高二化学选择性必修3第三章第三节第一课时醛(共82张PPT)
文档属性
| 名称 | 高二化学选择性必修3第三章第三节第一课时醛(共82张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 160.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 07:59:41 | ||
图片预览






文档简介
(共82张PPT)
高二年级 化学
醛
第三章 第二节
固体酒精
铜火锅
无色具有刺激性气味的液体,密度比水的小,沸点是20.8℃,易挥发,能跟水、乙醇等互溶。
该有机化合物的分子式为
C2H4O,我们如何确定它的结构呢?
【思考与交流】
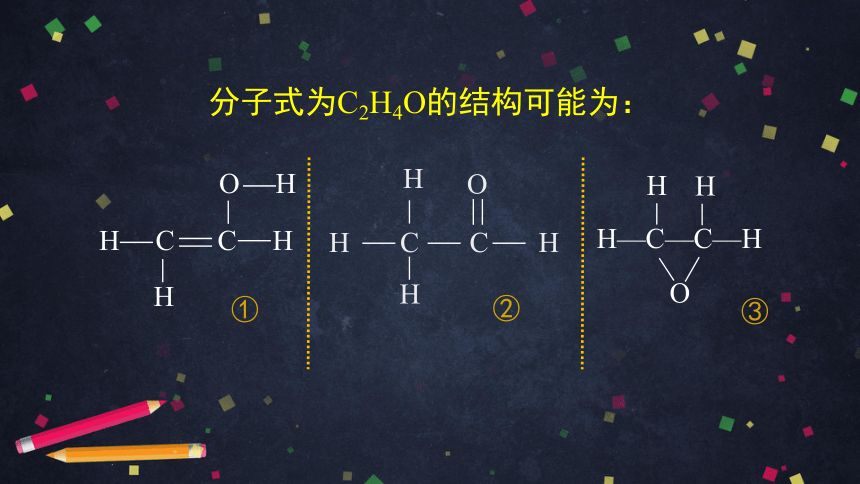
分子式为C2H4O的结构可能为:
H C C H
O H
H
H—C—C—H
H
H
O
H C C H
H
H
O
①
②
③
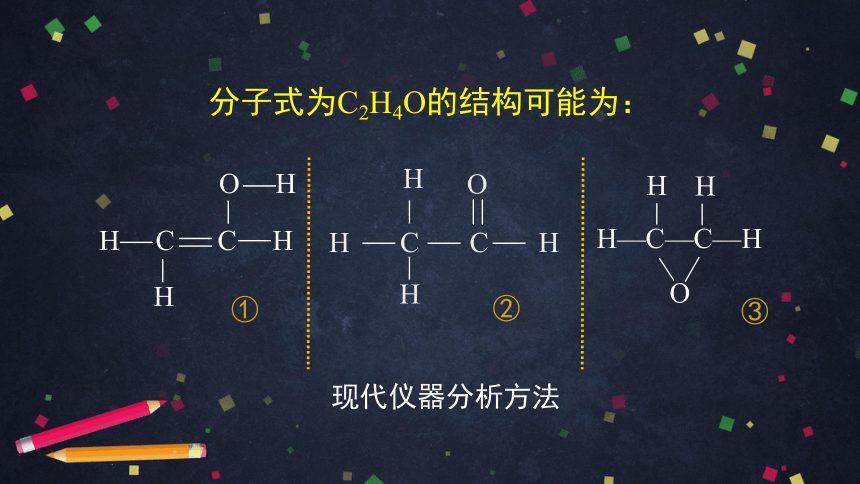
分子式为C2H4O的结构可能为:
H C C H
O H
H
H—C—C—H
H
H
O
H C C H
H
H
O
①
②
③
现代仪器分析方法
分子式为C2H4O的结构可能为:
H C C H
O H
H
H—C—C—H
H
H
O
H C C H
H
H
O
①
②
③
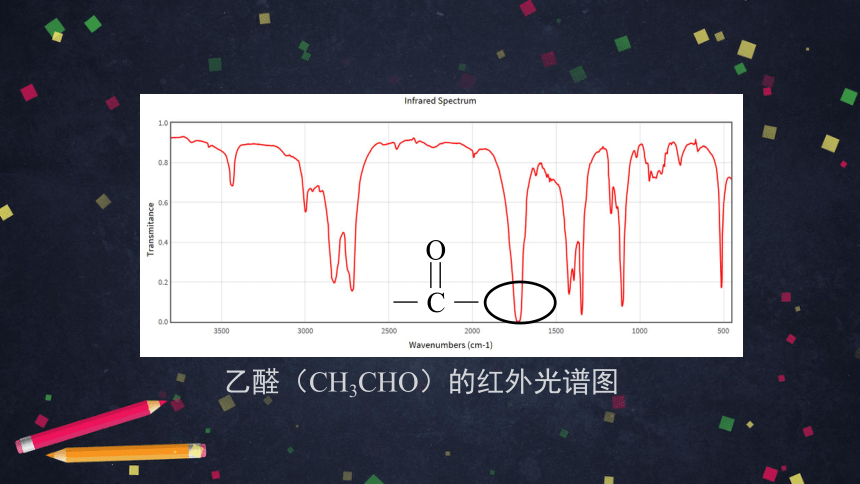
醛基
碳碳双键 羟基
醚键
该有机化合物的红外光谱图
乙醛(CH3CHO)的红外光谱图
C
O
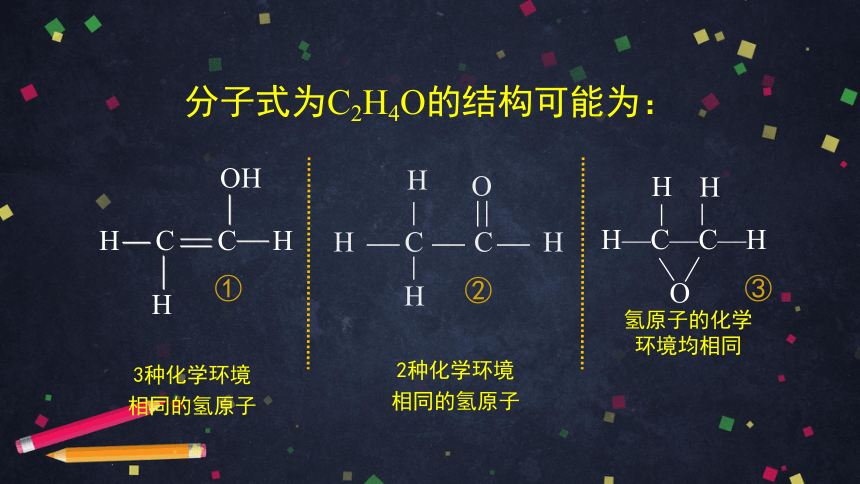
分子式为C2H4O的结构可能为:
H C C H
OH
H
H—C—C—H
H
H
O
H C C H
H
H
O
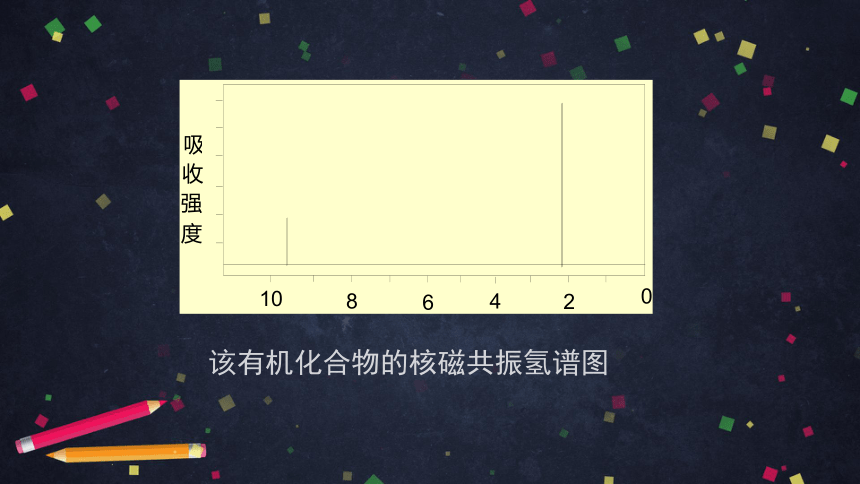
2种化学环境
相同的氢原子
3种化学环境
相同的氢原子
氢原子的化学
环境均相同
①
②
③
该有机化合物的核磁共振氢谱图
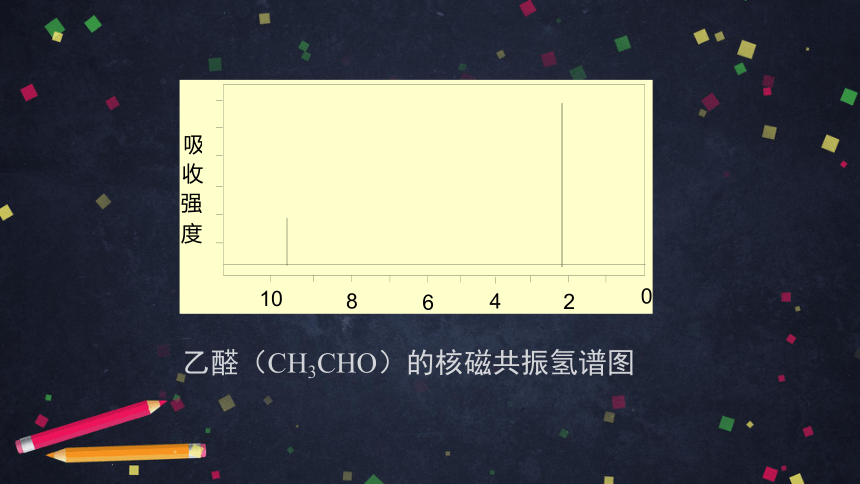
乙醛(CH3CHO)的核磁共振氢谱图
一、乙醛
1. 乙醛的组成和结构
分子式:
结构式:
结构简式:
C2H4O
CH3CHO
H C C H
H
H
O
官能团:
CHO
C H
O
球棍模型
比例模型
1. 乙醛的组成和结构
【思考与交流】
结合之前所学内容,根据乙醛的结构式分析乙醛可能具有的化学性质。
结构式:
2.乙醛的化学性质
H C C H
H
H
O
结构式:
2.乙醛的化学性质
H C C H
H
H
O
碳氧双键
碳氢单键
均为极性共价键
结构式:
2.乙醛的化学性质
H C C H
H
H
O
碳氧双键
碳氢单键
均为极性共价键
δ+
δ-
结构式:
2.乙醛的化学性质
H C C H
H
H
O
结构式:
2.乙醛的化学性质
H C C H
H
H
O
加成反应
H H
+
Ni
乙醛蒸气和氢气的混合气通过热的镍催化剂,可以发生加成反应。
△
H C C H
H
H
O
H C C H
H
H
O
H
H
H H
+
Ni
△
H C C H
H
H
O
H C C H
H
H
O
H
H
还原反应
结构式:
2.乙醛的化学性质
H C C H
H
H
O
(1)能发生加成反应
结构式:
2.乙醛的化学性质
H C C H
H
H
O
(1)能发生加成反应
重铬酸钾酸性溶液
加入乙醇
重铬酸钾酸性溶液
加入乙醇
CH3CH2OH CH3CHO CH3COOH
氧化
氧化
乙醛具有还原性
重铬酸钾酸性溶液
加入乙醛
重铬酸钾酸性溶液
加入乙醛
Cr3+
CH3CHO CH3COOH
重铬酸钾
酸性溶液
H C C H
H
H
O
H C C O H
H
H
O
对比乙醛和乙酸的结构,有什么变化?
工业上如果以乙醛为原料,无机原料任选制备乙酸,选择什么氧化剂更合适呢?
氧化剂:O2
工业上如果以乙醛为原料,无机原料任选制备乙酸,选择什么氧化剂更合适呢?
2CH3 C H
O
2CH3 C OH
O
+ O2
催化剂
△
工业上,在一定温度、催化剂存在的条件下,氧气可以将乙醛氧化为乙酸。
工业制镜
实验1:乙醛与银氨溶液反应
银氨溶液的制取
向2 mL 2% AgNO3溶液中,边振荡试管边逐滴滴加2%稀氨水。
① AgNO3 + NH3·H2O AgOH + NH4NO3
② AgOH + 2NH3·H2O Ag(NH3)2OH + 2H2O
氢氧化二氨合银
实验现象:
有光亮的银镜生成
反应条件:
水浴加热
Ag(NH3)2OH Ag
CH3CHO ?
+1
0
被还原
被氧化
Ag(NH3)2OH Ag
CH3CHO
+1
0
被还原
被氧化
CH3COONH4
△
CH3CHO + 2 Ag(NH3)2OH
CH3COONH4 + 2 Ag ↓ +
3 NH3 + H2O
反应名称:银镜反应
反应类型:氧化反应
应用: 检验醛基
实验2:乙醛与新制氢氧化铜反应
实验现象:
有砖红色沉淀生成
反应条件:
加热
+2
+1
被还原
被氧化
Cu(OH)2 Cu2O
CH3CHO
?
+2
+1
被还原
被氧化
CH3COONa
Cu(OH)2 Cu2O
CH3CHO
CH3CHO + 2 Cu(OH)2 + NaOH
CH3COONa + Cu2O ↓
△
+ 3H2O
反应类型:氧化反应
应用: 检验醛基
2.乙醛的化学性质
H C C H
H
H
O
H C C O H
H
H
O
H C C O
H
H
O
氧化剂
碱性环境氧化剂
酸化
(2)具有还原性,能发生氧化反应
2.乙醛的化学性质
【总结】
H C C H
H
H
O
d
+
d
-
2.乙醛的化学性质
【总结】
H C C H
H
H
O
加成反应
(与H2)
氧化反应
(KMnO4酸性溶液)
(K2Cr2O7酸性溶液)
(O2,催化剂)
(银氨溶液)
(新制氢氧化铜)
d
+
d
-
杏仁含苯甲醛
C H
O
桂皮含肉桂醛
CH CH CHO
某些动物标本保存在稀释后的福尔马林中,福尔马林是35%~40%的甲醛(HCHO)水溶液。
CHO
视黄醛
HCHO
CHO
CH CH CHO
C H
O
二、醛
由烃基(或氢原子)与醛基相连而构成的化合物。简写为RCHO。
1.概念
二、醛
由烃基(或氢原子)与醛基相连而构成的化合物。简写为RCHO。
1.概念
官能团:
醛基
CHO
C H
O
CnH2n+1CHO
(n≥0)
二、醛
2.饱和一元醛的通式
3.命名规则
(1)选取分子中连有醛基的最长碳链作为主链,按照
主链所含碳原子数称为“某醛”。
(2)从醛基开始给主链碳原子编号。
(3)在“某醛”名称之前加上取代基的位次号和名称。
二、醛
CH3 C CH2 CHO
CH3
CH3
【应用练习】
CH3 C CH2 CHO
CH3
CH3
【应用练习】
3,3-二甲基丁醛
4.醛的化学性质
R C C H
H
H
O
d
+
d
-
加成反应
(与H2)
氧化反应
(KMnO4酸性溶液)
(K2Cr2O7酸性溶液)
(O2,催化剂)
(银氨溶液)
(新制氢氧化铜)
甲醛是最简单的醛,是无色有强烈刺激性气味的气体,易溶于水。甲醛的水溶液具有杀菌和防腐
性能,可用于消毒和制作生物标本。还可
用于制备酚醛树脂和脲醛树脂。
右图为甲醛的球棍模型,为四原子共
面结构。
【应用练习】
请书写甲醛与新制氢氧化铜反应的化学方程式。
H C H
O
H C H
O
氧化反应
请书写甲醛与新制氢氧化铜反应的化学方程式。
甲醛的氧化反应
H C H
O
H C O H
O
H O C O
O
H
HCHO + 2Cu(OH)2 + NaOH
HCOONa + Cu2O ↓ + 3H2O
△
HCHO + 4Cu(OH)2 + 2NaOH
Na2CO3 + 2Cu2O ↓ + 6H2O
△
少量新制氢氧化铜:
足量新制氢氧化铜:
【拓展提高】
已知:
乙醛能在催化剂的作用下,与氢氰酸( HCN)发生加成反应,在分子中引入氰基,写出该反应的化学方程式。
H CN
乙醛与氢氰酸( HCN)反应
d
-
d
+
d
-
d
+
H C C H
H
H
O
+
H CN
H C C H
H
H
O
+
H C C H
H
H
O
H
CN
催化剂
乙醛与氢氰酸( HCN)反应
【拓展提高】
三氯乙醛是重要的有机合成中间体,可以合成农药和医药以及生产有机原料。如可以用于合成农药敌敌畏,合成药物氯霉素,合成有机溶剂氯仿等。
以乙醛和氯气为原料,在催化剂的作用下反应,可以生产三氯乙醛,同时生成氯化氢。
结合文献信息,书写乙醛与氯气生产三氯乙醛的化学方程式。
3 Cl2
+
催化剂
H C C H
H
H
O
Cl C C H
Cl
Cl
O
+ 3 HCl
【拓展练习】
结合下列已知信息,以乙醛和苯甲醛(其它无机试剂任选)为原料,合成肉桂醛。
+
催化剂
CH3 C H
O
CH3 CH CH2 C H
OH
O
②
CH3 C H
O
已知:
①
肉桂醛结构
CH CH CHO
CH3 C H
O
+
催化剂
CH2 C H
O
CH3 CH CH2 C H
OH
O
H
①
肉桂醛的合成步骤一
CH2 C H
O
H
+
催化剂
CH
OH
CH2 C H
O
C H
O
催化剂
△
H2O +
肉桂醛的合成步骤二
CH
OH
CH2 C H
O
CH CH CHO
如何分析题目信息——陌生化学反应?
【总结反思】
如何分析题目信息——陌生化学反应?
关键:对比反应物、产物的结构。
【总结反思】
如何分析题目信息——陌生化学反应?
关键:对比反应物、产物的结构。
找出产物新产生的官能团
找出产物和反应物相同的结构片段
找出反应物的断键位置
将断键后的基团重新成键生成产物
【总结反思】
如何分析题目信息——陌生化学反应?
【总结反思】
陌生的反应
熟悉的官能团
熟悉的断键、成键方式
熟悉的反应类型
【总结反思】
R C C H
H
H
O
从结构角度分析有机化合物化学性质的思路?
先关注官能团
再分析官能团
内部的化学键
关注官能团相邻基团
确定反应物
活性部位
(碳原子的饱和性、键的极性)
【总结反思】
反应物
反应类型
试剂
生成物
条件
反应现象
取代反应
加成反应
消去反应
氧化反应
还原反应
认识有机反应的角度
高二年级 化学
醛
第三章 第二节
固体酒精
铜火锅
无色具有刺激性气味的液体,密度比水的小,沸点是20.8℃,易挥发,能跟水、乙醇等互溶。
该有机化合物的分子式为
C2H4O,我们如何确定它的结构呢?
【思考与交流】
分子式为C2H4O的结构可能为:
H C C H
O H
H
H—C—C—H
H
H
O
H C C H
H
H
O
①
②
③
分子式为C2H4O的结构可能为:
H C C H
O H
H
H—C—C—H
H
H
O
H C C H
H
H
O
①
②
③
现代仪器分析方法
分子式为C2H4O的结构可能为:
H C C H
O H
H
H—C—C—H
H
H
O
H C C H
H
H
O
①
②
③
醛基
碳碳双键 羟基
醚键
该有机化合物的红外光谱图
乙醛(CH3CHO)的红外光谱图
C
O
分子式为C2H4O的结构可能为:
H C C H
OH
H
H—C—C—H
H
H
O
H C C H
H
H
O
2种化学环境
相同的氢原子
3种化学环境
相同的氢原子
氢原子的化学
环境均相同
①
②
③
该有机化合物的核磁共振氢谱图
乙醛(CH3CHO)的核磁共振氢谱图
一、乙醛
1. 乙醛的组成和结构
分子式:
结构式:
结构简式:
C2H4O
CH3CHO
H C C H
H
H
O
官能团:
CHO
C H
O
球棍模型
比例模型
1. 乙醛的组成和结构
【思考与交流】
结合之前所学内容,根据乙醛的结构式分析乙醛可能具有的化学性质。
结构式:
2.乙醛的化学性质
H C C H
H
H
O
结构式:
2.乙醛的化学性质
H C C H
H
H
O
碳氧双键
碳氢单键
均为极性共价键
结构式:
2.乙醛的化学性质
H C C H
H
H
O
碳氧双键
碳氢单键
均为极性共价键
δ+
δ-
结构式:
2.乙醛的化学性质
H C C H
H
H
O
结构式:
2.乙醛的化学性质
H C C H
H
H
O
加成反应
H H
+
Ni
乙醛蒸气和氢气的混合气通过热的镍催化剂,可以发生加成反应。
△
H C C H
H
H
O
H C C H
H
H
O
H
H
H H
+
Ni
△
H C C H
H
H
O
H C C H
H
H
O
H
H
还原反应
结构式:
2.乙醛的化学性质
H C C H
H
H
O
(1)能发生加成反应
结构式:
2.乙醛的化学性质
H C C H
H
H
O
(1)能发生加成反应
重铬酸钾酸性溶液
加入乙醇
重铬酸钾酸性溶液
加入乙醇
CH3CH2OH CH3CHO CH3COOH
氧化
氧化
乙醛具有还原性
重铬酸钾酸性溶液
加入乙醛
重铬酸钾酸性溶液
加入乙醛
Cr3+
CH3CHO CH3COOH
重铬酸钾
酸性溶液
H C C H
H
H
O
H C C O H
H
H
O
对比乙醛和乙酸的结构,有什么变化?
工业上如果以乙醛为原料,无机原料任选制备乙酸,选择什么氧化剂更合适呢?
氧化剂:O2
工业上如果以乙醛为原料,无机原料任选制备乙酸,选择什么氧化剂更合适呢?
2CH3 C H
O
2CH3 C OH
O
+ O2
催化剂
△
工业上,在一定温度、催化剂存在的条件下,氧气可以将乙醛氧化为乙酸。
工业制镜
实验1:乙醛与银氨溶液反应
银氨溶液的制取
向2 mL 2% AgNO3溶液中,边振荡试管边逐滴滴加2%稀氨水。
① AgNO3 + NH3·H2O AgOH + NH4NO3
② AgOH + 2NH3·H2O Ag(NH3)2OH + 2H2O
氢氧化二氨合银
实验现象:
有光亮的银镜生成
反应条件:
水浴加热
Ag(NH3)2OH Ag
CH3CHO ?
+1
0
被还原
被氧化
Ag(NH3)2OH Ag
CH3CHO
+1
0
被还原
被氧化
CH3COONH4
△
CH3CHO + 2 Ag(NH3)2OH
CH3COONH4 + 2 Ag ↓ +
3 NH3 + H2O
反应名称:银镜反应
反应类型:氧化反应
应用: 检验醛基
实验2:乙醛与新制氢氧化铜反应
实验现象:
有砖红色沉淀生成
反应条件:
加热
+2
+1
被还原
被氧化
Cu(OH)2 Cu2O
CH3CHO
?
+2
+1
被还原
被氧化
CH3COONa
Cu(OH)2 Cu2O
CH3CHO
CH3CHO + 2 Cu(OH)2 + NaOH
CH3COONa + Cu2O ↓
△
+ 3H2O
反应类型:氧化反应
应用: 检验醛基
2.乙醛的化学性质
H C C H
H
H
O
H C C O H
H
H
O
H C C O
H
H
O
氧化剂
碱性环境氧化剂
酸化
(2)具有还原性,能发生氧化反应
2.乙醛的化学性质
【总结】
H C C H
H
H
O
d
+
d
-
2.乙醛的化学性质
【总结】
H C C H
H
H
O
加成反应
(与H2)
氧化反应
(KMnO4酸性溶液)
(K2Cr2O7酸性溶液)
(O2,催化剂)
(银氨溶液)
(新制氢氧化铜)
d
+
d
-
杏仁含苯甲醛
C H
O
桂皮含肉桂醛
CH CH CHO
某些动物标本保存在稀释后的福尔马林中,福尔马林是35%~40%的甲醛(HCHO)水溶液。
CHO
视黄醛
HCHO
CHO
CH CH CHO
C H
O
二、醛
由烃基(或氢原子)与醛基相连而构成的化合物。简写为RCHO。
1.概念
二、醛
由烃基(或氢原子)与醛基相连而构成的化合物。简写为RCHO。
1.概念
官能团:
醛基
CHO
C H
O
CnH2n+1CHO
(n≥0)
二、醛
2.饱和一元醛的通式
3.命名规则
(1)选取分子中连有醛基的最长碳链作为主链,按照
主链所含碳原子数称为“某醛”。
(2)从醛基开始给主链碳原子编号。
(3)在“某醛”名称之前加上取代基的位次号和名称。
二、醛
CH3 C CH2 CHO
CH3
CH3
【应用练习】
CH3 C CH2 CHO
CH3
CH3
【应用练习】
3,3-二甲基丁醛
4.醛的化学性质
R C C H
H
H
O
d
+
d
-
加成反应
(与H2)
氧化反应
(KMnO4酸性溶液)
(K2Cr2O7酸性溶液)
(O2,催化剂)
(银氨溶液)
(新制氢氧化铜)
甲醛是最简单的醛,是无色有强烈刺激性气味的气体,易溶于水。甲醛的水溶液具有杀菌和防腐
性能,可用于消毒和制作生物标本。还可
用于制备酚醛树脂和脲醛树脂。
右图为甲醛的球棍模型,为四原子共
面结构。
【应用练习】
请书写甲醛与新制氢氧化铜反应的化学方程式。
H C H
O
H C H
O
氧化反应
请书写甲醛与新制氢氧化铜反应的化学方程式。
甲醛的氧化反应
H C H
O
H C O H
O
H O C O
O
H
HCHO + 2Cu(OH)2 + NaOH
HCOONa + Cu2O ↓ + 3H2O
△
HCHO + 4Cu(OH)2 + 2NaOH
Na2CO3 + 2Cu2O ↓ + 6H2O
△
少量新制氢氧化铜:
足量新制氢氧化铜:
【拓展提高】
已知:
乙醛能在催化剂的作用下,与氢氰酸( HCN)发生加成反应,在分子中引入氰基,写出该反应的化学方程式。
H CN
乙醛与氢氰酸( HCN)反应
d
-
d
+
d
-
d
+
H C C H
H
H
O
+
H CN
H C C H
H
H
O
+
H C C H
H
H
O
H
CN
催化剂
乙醛与氢氰酸( HCN)反应
【拓展提高】
三氯乙醛是重要的有机合成中间体,可以合成农药和医药以及生产有机原料。如可以用于合成农药敌敌畏,合成药物氯霉素,合成有机溶剂氯仿等。
以乙醛和氯气为原料,在催化剂的作用下反应,可以生产三氯乙醛,同时生成氯化氢。
结合文献信息,书写乙醛与氯气生产三氯乙醛的化学方程式。
3 Cl2
+
催化剂
H C C H
H
H
O
Cl C C H
Cl
Cl
O
+ 3 HCl
【拓展练习】
结合下列已知信息,以乙醛和苯甲醛(其它无机试剂任选)为原料,合成肉桂醛。
+
催化剂
CH3 C H
O
CH3 CH CH2 C H
OH
O
②
CH3 C H
O
已知:
①
肉桂醛结构
CH CH CHO
CH3 C H
O
+
催化剂
CH2 C H
O
CH3 CH CH2 C H
OH
O
H
①
肉桂醛的合成步骤一
CH2 C H
O
H
+
催化剂
CH
OH
CH2 C H
O
C H
O
催化剂
△
H2O +
肉桂醛的合成步骤二
CH
OH
CH2 C H
O
CH CH CHO
如何分析题目信息——陌生化学反应?
【总结反思】
如何分析题目信息——陌生化学反应?
关键:对比反应物、产物的结构。
【总结反思】
如何分析题目信息——陌生化学反应?
关键:对比反应物、产物的结构。
找出产物新产生的官能团
找出产物和反应物相同的结构片段
找出反应物的断键位置
将断键后的基团重新成键生成产物
【总结反思】
如何分析题目信息——陌生化学反应?
【总结反思】
陌生的反应
熟悉的官能团
熟悉的断键、成键方式
熟悉的反应类型
【总结反思】
R C C H
H
H
O
从结构角度分析有机化合物化学性质的思路?
先关注官能团
再分析官能团
内部的化学键
关注官能团相邻基团
确定反应物
活性部位
(碳原子的饱和性、键的极性)
【总结反思】
反应物
反应类型
试剂
生成物
条件
反应现象
取代反应
加成反应
消去反应
氧化反应
还原反应
认识有机反应的角度
