高二化学选择性必修3第三章第四节羧酸(共79张PPT)
文档属性
| 名称 | 高二化学选择性必修3第三章第四节羧酸(共79张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 47.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 08:00:57 | ||
图片预览











文档简介
(共79张PPT)
第三章 第三节
羧酸 酯
高二年级 化学
一、羧酸
乙酸
柠檬酸
乳酸
羧酸在自然界和日常生活中广泛存在
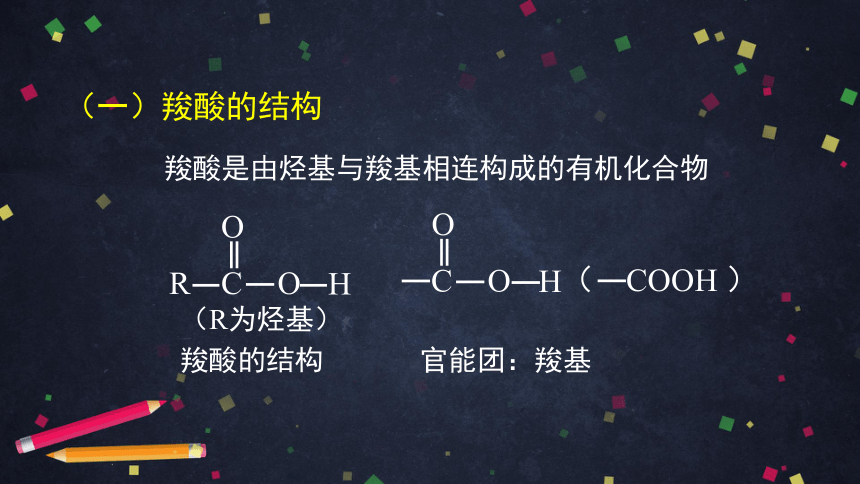
(一)羧酸的结构
羧酸是由烃基与羧基相连构成的有机化合物
R
H
O
C
O
( COOH )
官能团:羧基
羧酸的结构
H
O
C
O
(R为烃基)
羧酸
脂肪酸
芳香酸
(如乙酸、硬脂酸C17H35COOH)
(如苯甲酸C6H5COOH)
1.根据与羧基( COOH)相连的烃基的不同分类
(二)羧酸的分类
羧酸
一元羧酸
二元羧酸
多元羧酸
(如油酸C17H33COOH )
(如乙二酸HOOC-COOH)
2.根据羧酸分子中羧基的数目分类
(三)乙酸(CH3COOH)的物理性质
乙酸是食醋中的有效成分
(三)乙酸(CH3COOH)的物理性质
强烈刺激性气味的液体
易挥发
易溶于水和乙醇
温度低于熔点(16.6℃),凝结似冰一样的晶体(纯净的乙酸又称为冰醋酸)
乙酸是食醋中的有效成分
(四)乙酸(CH3COOH)的化学性质
(四)乙酸(CH3COOH)的化学性质
1.乙酸具有酸性
【科学探究】
乙酸、碳酸和苯酚的酸性强弱比较
乙酸、碳酸和苯酚的酸性强弱比较
【科学探究】
预测 酸性:乙酸>碳酸>苯酚
提供药品:碳酸钠固体、饱和碳酸氢钠溶液、苯酚钠溶液、
乙酸溶液
实验验证
提供仪器:锥形瓶、分液漏斗、洗气瓶、试管、导管、
橡胶管
设计一次性完成的实验装置
可能的实验方案
乙酸易挥发
该方案不够严谨
修改的实验方案
饱和碳酸氢钠溶液除去挥发出的乙酸
资料
实验证据
实验结论
酸性:乙酸>碳酸>苯酚
试管中:苯酚钠溶液变浑浊 酸性:碳酸>苯酚
锥形瓶中:产生气泡 酸性:乙酸>碳酸
(已确认除去了挥发出的乙酸)
小结 如何解释乙酸具有酸性?
C
H
H
H
H
O
C
O
乙酸的结构式
关注
官能团
小结 如何解释乙酸具有酸性?
C
H
H
H
H
O
C
O
乙酸的结构式
C
H
H
H
H
O
C
O
断裂,解离出H+
2.乙酸的酯化反应
CH3
O
C
O
CH2CH3
2.乙酸的酯化反应
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
△
浓硫酸
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
推测反应物中化学键可能的断键位置
△
浓硫酸
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
可能1
△
浓硫酸
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
可能2
△
浓硫酸
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
如何设计实验验证?
△
浓硫酸
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
如何设计实验验证?
断键方式不同,某些原子可能会存在于不同的产物中
△
浓硫酸
资料
同位素示踪法
将物质中的普通氧原子替换成18O,制备出含有18O的标记化合物,可用核探测器随时追踪它的位置。
实验方案1
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
△
浓硫酸
实验方案1
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
18
该实验方案不合理
△
浓硫酸
实验方案2
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
△
浓硫酸
实验方案2
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
18
△
浓硫酸
实验方案2
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
18
该实验方案合理
△
浓硫酸
实验方案3
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
△
浓硫酸
实验方案3
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
△
浓硫酸
H2O
+
+
18
18
实验方案3
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
18
该实验方案合理
△
浓硫酸
实验事实
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
科学家选择标记乙醇分子中的氧原子
18
△
浓硫酸
实验结论
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
乙酸分子中羧基中的C O键断裂
乙醇分子中羟基中的O H键断裂
△
浓硫酸
(五)总结 羧酸的化学性质
羧酸的化学性质与乙酸相似,主要取决于羧基官能团
(五)总结 羧酸的化学性质
R
H
O
C
O
具有酸性
羧酸的化学性质与乙酸相似,主要取决于羧基官能团
(五)总结 羧酸的化学性质
R
H
O
C
O
具有酸性
R
H
O
C
O
易被取代(如酯化反应)
羧酸的化学性质与乙酸相似,主要取决于羧基官能团
R
H
O
C
O
具有酸性
R
H
O
C
O
易被取代(如酯化反应)
结构
性质
二、酯
戊酸戊酯
丁酸乙酯
乙酸异戊酯
日常生活中饮料、糖果和糕点常使用酯类香料
酯是羧酸分子中的 OH被 OR′取代后的产物,简写为RCOOR′(R与R′可以同,也可以不同)
(一)酯的结构特点
官能团:酯基
酯的结构
(R、R′为烃基)
根据生成酯的酸和醇的名称命名酯,称为“某酸某酯”。
R
H
O
C
O
H
O
R′
R
O
C
O
R′
H2O
+
+
△
浓硫酸
酯的命名
(二)酯的化学性质
酯的重要化学性质之一是可以发生水解反应
请设计实验,探讨乙酸乙酯在中性、酸性和碱性溶液中的水解速率。
思考下列问题:
(1)该实验涉及哪些变量,如何控制?
(2)如何判断水解速率的快慢?
【科学探究】
可以通过观察乙酸乙酯层消失的时间差异,来判断乙酸乙酯在不同条件下的水解速率的差别。
方法支持
经染色后的乙酸乙酯
1.向试管1内加入5 mL 蒸馏水,再加2 mL乙酸乙酯,振荡混匀
2.向试管2内加入5 mL 稀H2SO4,再加2 mL乙酸乙酯,振荡混匀
3.向试管3内加入5 mL 稀NaOH溶液,再加2 mL乙酸乙酯,振荡
混匀
4.将3支试管同时放入相同温度的热水浴中,约5 min,观察乙酸
乙酯层变化情况
实验方案
(乙酸乙酯经染色处理,染料不影响乙酸乙酯的水解反应)
研究乙酸乙酯在不同酸碱性溶液中的水解速率
实验现象
5 min后
中性溶液
碱性溶液
酸性溶液
相同温度下,乙酸乙酯的水解速率:
实验结论
碱性溶液中的 > 酸性溶液中的 > 中性溶液中的
请设计实验,探讨乙酸乙酯在不同温度下的水解速率。
【科学探究】
实验方案
5 min后
研究不同温度下乙酸乙酯的水解速率
观察乙酸乙酯层
高度的变化
5 mL稀NaOH溶液
2 mL乙酸乙酯(染色)
热水、常温对比
实验结论
碱性条件下,乙酸乙酯的水解速率:
温度较高时的 > 温度较低时的
5 min后
乙酸乙酯水解反应的化学方程式:
乙酸乙酯水解反应的化学方程式:
CH3
O
C
O
CH2CH3
△
稀硫酸
H2O
+
CH3
O
C
OH
+
HO-CH2CH3
CH3
O
C
O
CH2CH3
+
NaOH
△
CH3
O
C
ONa
+
HO-CH2CH3
R
H
O
C
O
H
O
R′
R
O
C
O
R′
H2O
+
+
△
稀硫酸
酯水解反应中化学键的断裂位置
R
Na
O
C
O
H
O
R′
R
O
C
O
R′
+
+
NaOH
△
三、巩固提升
【应用1】
乳酸是生活中常见的羧酸,结构简式如下:
乳酸分子中含有的官能团是什么,可发生哪些反应?
CH3 CH
OH
COOH
乳酸分子中既含有羧基,也含有羟基
CH3 CH
OH
COOH
乳酸分子中既含有羧基,也含有羟基
CH3 CH
OH
COOH
OH:与Na反应、氧化反应、消去反应、取代反应、与酸发生酯
化反应等
乳酸分子中既含有羧基,也含有羟基
COOH:与碱中和、与醇发生酯化反应等
CH3 CH
OH
COOH
OH:与Na反应、氧化反应、消去反应、取代反应、与酸发生酯
化反应等
乳酸分子中既含有羧基,也含有羟基
CH3 CH
OH
COOH
乳酸分子自身能发生酯化反应吗?
写出2分子的乳酸发生酯化反应的化学方程式。
HO CH
CH3
COOH
+
HO CH
CH3
C O
CH
CH3
COOH
+
H2O
可能1
HO CH
CH3
COOH
O
△
浓硫酸
可能1
HO CH
CH3
COOH
+
HO CH
CH3
C O
CH
CH3
COOH
+
H2O
HO CH
CH3
COOH
O
△
浓硫酸
可能2
+
O
H3C
CH3
O
+
2H2O
O
O
HO CH
CH3
COOH
HO CH
CH3
COOH
△
浓硫酸
HO CH
CH3
COOH
+
HO CH
CH3
COOH
多分子乳酸酯化,产物是什么
HO CH
CH3
COOH
……
+
……
酯化反应
酯化反应
CH
CH3
C
O
O
CH
CH3
C
O
O
CH
CH3
C
O
O
……
……
n 个乳酸分子进行酯化反应,产物是什么
聚乳酸
CH
CH3
C
O
O
CH
CH3
C
O
O
CH
CH3
C
O
O
……
……
聚乳酸
【应用2】
阿司匹林是一种经典的解热镇痛药,结构简式如下:
写出阿司匹林在酸性环境中水解的化学方程式。
COOH
O
C
CH3
O
COOH
O
C
CH3
O
COOH
O
C
CH3
O
+ H2O
+ CH3COOH
COOH
OH
H+
四、课堂练习
【课堂练习】
将CH3COOH和H18O-C2H5混合发生酯化反应,已知酯化反应是可逆反应,反应达到平衡后,下列说法正确的是( )
A.18O存在于所有物质中
B.18O存在于乙醇和乙酸乙酯中
C.18O存在于乙醇和水中
D.有的乙醇分子可能不含18O
【课堂练习】
B
A.18O存在于所有物质中
B.18O存在于乙醇和乙酸乙酯中
C.18O存在于乙醇和水中
D.有的乙醇分子可能不含18O
将CH3COOH和H18O-C2H5混合发生酯化反应,已知酯化反应是可逆反应,反应达到平衡后,下列说法正确的是( )
绿原酸的结构简式如下,下列关于绿原酸的说法不正确的是( )
【课堂练习】
A. 分子式为C16H18O9
B. 能与Na2CO3反应
C. 能发生消去反应
D. 0.1mol 绿原酸最多与0.8 mol NaOH反应
绿原酸的结构简式如下,下列关于绿原酸的说法不正确的是( )
【课堂练习】
A. 分子式为C16H18O9
B. 能与Na2CO3反应
C. 能发生消去反应
D. 0.1mol 绿原酸最多与0.8 mol NaOH反应
正确
绿原酸的结构简式如下,下列关于绿原酸的说法不正确的是( )
【课堂练习】
A. 分子式为C16H18O9
B. 能与Na2CO3反应
C. 能发生消去反应
D. 0.1mol 绿原酸最多与0.8 mol NaOH反应
正确
绿原酸的结构简式如下,下列关于绿原酸的说法不正确的是( )
【课堂练习】
A. 分子式为C16H18O9
B. 能与Na2CO3反应
C. 能发生消去反应
D. 0.1mol 绿原酸最多与0.8 mol NaOH反应
正确
绿原酸的结构简式如下,下列关于绿原酸的说法不正确的是( )
【课堂练习】
A. 分子式为C16H18O9
B. 能与Na2CO3反应
C. 能发生消去反应
D. 0.1mol 绿原酸最多与0.8 mol NaOH反应
不正确
D
第三章 第三节
羧酸 酯
高二年级 化学
一、羧酸
乙酸
柠檬酸
乳酸
羧酸在自然界和日常生活中广泛存在
(一)羧酸的结构
羧酸是由烃基与羧基相连构成的有机化合物
R
H
O
C
O
( COOH )
官能团:羧基
羧酸的结构
H
O
C
O
(R为烃基)
羧酸
脂肪酸
芳香酸
(如乙酸、硬脂酸C17H35COOH)
(如苯甲酸C6H5COOH)
1.根据与羧基( COOH)相连的烃基的不同分类
(二)羧酸的分类
羧酸
一元羧酸
二元羧酸
多元羧酸
(如油酸C17H33COOH )
(如乙二酸HOOC-COOH)
2.根据羧酸分子中羧基的数目分类
(三)乙酸(CH3COOH)的物理性质
乙酸是食醋中的有效成分
(三)乙酸(CH3COOH)的物理性质
强烈刺激性气味的液体
易挥发
易溶于水和乙醇
温度低于熔点(16.6℃),凝结似冰一样的晶体(纯净的乙酸又称为冰醋酸)
乙酸是食醋中的有效成分
(四)乙酸(CH3COOH)的化学性质
(四)乙酸(CH3COOH)的化学性质
1.乙酸具有酸性
【科学探究】
乙酸、碳酸和苯酚的酸性强弱比较
乙酸、碳酸和苯酚的酸性强弱比较
【科学探究】
预测 酸性:乙酸>碳酸>苯酚
提供药品:碳酸钠固体、饱和碳酸氢钠溶液、苯酚钠溶液、
乙酸溶液
实验验证
提供仪器:锥形瓶、分液漏斗、洗气瓶、试管、导管、
橡胶管
设计一次性完成的实验装置
可能的实验方案
乙酸易挥发
该方案不够严谨
修改的实验方案
饱和碳酸氢钠溶液除去挥发出的乙酸
资料
实验证据
实验结论
酸性:乙酸>碳酸>苯酚
试管中:苯酚钠溶液变浑浊 酸性:碳酸>苯酚
锥形瓶中:产生气泡 酸性:乙酸>碳酸
(已确认除去了挥发出的乙酸)
小结 如何解释乙酸具有酸性?
C
H
H
H
H
O
C
O
乙酸的结构式
关注
官能团
小结 如何解释乙酸具有酸性?
C
H
H
H
H
O
C
O
乙酸的结构式
C
H
H
H
H
O
C
O
断裂,解离出H+
2.乙酸的酯化反应
CH3
O
C
O
CH2CH3
2.乙酸的酯化反应
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
△
浓硫酸
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
推测反应物中化学键可能的断键位置
△
浓硫酸
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
可能1
△
浓硫酸
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
可能2
△
浓硫酸
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
如何设计实验验证?
△
浓硫酸
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
如何设计实验验证?
断键方式不同,某些原子可能会存在于不同的产物中
△
浓硫酸
资料
同位素示踪法
将物质中的普通氧原子替换成18O,制备出含有18O的标记化合物,可用核探测器随时追踪它的位置。
实验方案1
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
△
浓硫酸
实验方案1
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
18
该实验方案不合理
△
浓硫酸
实验方案2
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
△
浓硫酸
实验方案2
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
18
△
浓硫酸
实验方案2
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
18
该实验方案合理
△
浓硫酸
实验方案3
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
△
浓硫酸
实验方案3
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
△
浓硫酸
H2O
+
+
18
18
实验方案3
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
18
该实验方案合理
△
浓硫酸
实验事实
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
18
科学家选择标记乙醇分子中的氧原子
18
△
浓硫酸
实验结论
CH3
H
O
C
O
H
O
CH2CH3
CH3
O
C
O
CH2CH3
H2O
+
+
乙酸分子中羧基中的C O键断裂
乙醇分子中羟基中的O H键断裂
△
浓硫酸
(五)总结 羧酸的化学性质
羧酸的化学性质与乙酸相似,主要取决于羧基官能团
(五)总结 羧酸的化学性质
R
H
O
C
O
具有酸性
羧酸的化学性质与乙酸相似,主要取决于羧基官能团
(五)总结 羧酸的化学性质
R
H
O
C
O
具有酸性
R
H
O
C
O
易被取代(如酯化反应)
羧酸的化学性质与乙酸相似,主要取决于羧基官能团
R
H
O
C
O
具有酸性
R
H
O
C
O
易被取代(如酯化反应)
结构
性质
二、酯
戊酸戊酯
丁酸乙酯
乙酸异戊酯
日常生活中饮料、糖果和糕点常使用酯类香料
酯是羧酸分子中的 OH被 OR′取代后的产物,简写为RCOOR′(R与R′可以同,也可以不同)
(一)酯的结构特点
官能团:酯基
酯的结构
(R、R′为烃基)
根据生成酯的酸和醇的名称命名酯,称为“某酸某酯”。
R
H
O
C
O
H
O
R′
R
O
C
O
R′
H2O
+
+
△
浓硫酸
酯的命名
(二)酯的化学性质
酯的重要化学性质之一是可以发生水解反应
请设计实验,探讨乙酸乙酯在中性、酸性和碱性溶液中的水解速率。
思考下列问题:
(1)该实验涉及哪些变量,如何控制?
(2)如何判断水解速率的快慢?
【科学探究】
可以通过观察乙酸乙酯层消失的时间差异,来判断乙酸乙酯在不同条件下的水解速率的差别。
方法支持
经染色后的乙酸乙酯
1.向试管1内加入5 mL 蒸馏水,再加2 mL乙酸乙酯,振荡混匀
2.向试管2内加入5 mL 稀H2SO4,再加2 mL乙酸乙酯,振荡混匀
3.向试管3内加入5 mL 稀NaOH溶液,再加2 mL乙酸乙酯,振荡
混匀
4.将3支试管同时放入相同温度的热水浴中,约5 min,观察乙酸
乙酯层变化情况
实验方案
(乙酸乙酯经染色处理,染料不影响乙酸乙酯的水解反应)
研究乙酸乙酯在不同酸碱性溶液中的水解速率
实验现象
5 min后
中性溶液
碱性溶液
酸性溶液
相同温度下,乙酸乙酯的水解速率:
实验结论
碱性溶液中的 > 酸性溶液中的 > 中性溶液中的
请设计实验,探讨乙酸乙酯在不同温度下的水解速率。
【科学探究】
实验方案
5 min后
研究不同温度下乙酸乙酯的水解速率
观察乙酸乙酯层
高度的变化
5 mL稀NaOH溶液
2 mL乙酸乙酯(染色)
热水、常温对比
实验结论
碱性条件下,乙酸乙酯的水解速率:
温度较高时的 > 温度较低时的
5 min后
乙酸乙酯水解反应的化学方程式:
乙酸乙酯水解反应的化学方程式:
CH3
O
C
O
CH2CH3
△
稀硫酸
H2O
+
CH3
O
C
OH
+
HO-CH2CH3
CH3
O
C
O
CH2CH3
+
NaOH
△
CH3
O
C
ONa
+
HO-CH2CH3
R
H
O
C
O
H
O
R′
R
O
C
O
R′
H2O
+
+
△
稀硫酸
酯水解反应中化学键的断裂位置
R
Na
O
C
O
H
O
R′
R
O
C
O
R′
+
+
NaOH
△
三、巩固提升
【应用1】
乳酸是生活中常见的羧酸,结构简式如下:
乳酸分子中含有的官能团是什么,可发生哪些反应?
CH3 CH
OH
COOH
乳酸分子中既含有羧基,也含有羟基
CH3 CH
OH
COOH
乳酸分子中既含有羧基,也含有羟基
CH3 CH
OH
COOH
OH:与Na反应、氧化反应、消去反应、取代反应、与酸发生酯
化反应等
乳酸分子中既含有羧基,也含有羟基
COOH:与碱中和、与醇发生酯化反应等
CH3 CH
OH
COOH
OH:与Na反应、氧化反应、消去反应、取代反应、与酸发生酯
化反应等
乳酸分子中既含有羧基,也含有羟基
CH3 CH
OH
COOH
乳酸分子自身能发生酯化反应吗?
写出2分子的乳酸发生酯化反应的化学方程式。
HO CH
CH3
COOH
+
HO CH
CH3
C O
CH
CH3
COOH
+
H2O
可能1
HO CH
CH3
COOH
O
△
浓硫酸
可能1
HO CH
CH3
COOH
+
HO CH
CH3
C O
CH
CH3
COOH
+
H2O
HO CH
CH3
COOH
O
△
浓硫酸
可能2
+
O
H3C
CH3
O
+
2H2O
O
O
HO CH
CH3
COOH
HO CH
CH3
COOH
△
浓硫酸
HO CH
CH3
COOH
+
HO CH
CH3
COOH
多分子乳酸酯化,产物是什么
HO CH
CH3
COOH
……
+
……
酯化反应
酯化反应
CH
CH3
C
O
O
CH
CH3
C
O
O
CH
CH3
C
O
O
……
……
n 个乳酸分子进行酯化反应,产物是什么
聚乳酸
CH
CH3
C
O
O
CH
CH3
C
O
O
CH
CH3
C
O
O
……
……
聚乳酸
【应用2】
阿司匹林是一种经典的解热镇痛药,结构简式如下:
写出阿司匹林在酸性环境中水解的化学方程式。
COOH
O
C
CH3
O
COOH
O
C
CH3
O
COOH
O
C
CH3
O
+ H2O
+ CH3COOH
COOH
OH
H+
四、课堂练习
【课堂练习】
将CH3COOH和H18O-C2H5混合发生酯化反应,已知酯化反应是可逆反应,反应达到平衡后,下列说法正确的是( )
A.18O存在于所有物质中
B.18O存在于乙醇和乙酸乙酯中
C.18O存在于乙醇和水中
D.有的乙醇分子可能不含18O
【课堂练习】
B
A.18O存在于所有物质中
B.18O存在于乙醇和乙酸乙酯中
C.18O存在于乙醇和水中
D.有的乙醇分子可能不含18O
将CH3COOH和H18O-C2H5混合发生酯化反应,已知酯化反应是可逆反应,反应达到平衡后,下列说法正确的是( )
绿原酸的结构简式如下,下列关于绿原酸的说法不正确的是( )
【课堂练习】
A. 分子式为C16H18O9
B. 能与Na2CO3反应
C. 能发生消去反应
D. 0.1mol 绿原酸最多与0.8 mol NaOH反应
绿原酸的结构简式如下,下列关于绿原酸的说法不正确的是( )
【课堂练习】
A. 分子式为C16H18O9
B. 能与Na2CO3反应
C. 能发生消去反应
D. 0.1mol 绿原酸最多与0.8 mol NaOH反应
正确
绿原酸的结构简式如下,下列关于绿原酸的说法不正确的是( )
【课堂练习】
A. 分子式为C16H18O9
B. 能与Na2CO3反应
C. 能发生消去反应
D. 0.1mol 绿原酸最多与0.8 mol NaOH反应
正确
绿原酸的结构简式如下,下列关于绿原酸的说法不正确的是( )
【课堂练习】
A. 分子式为C16H18O9
B. 能与Na2CO3反应
C. 能发生消去反应
D. 0.1mol 绿原酸最多与0.8 mol NaOH反应
正确
绿原酸的结构简式如下,下列关于绿原酸的说法不正确的是( )
【课堂练习】
A. 分子式为C16H18O9
B. 能与Na2CO3反应
C. 能发生消去反应
D. 0.1mol 绿原酸最多与0.8 mol NaOH反应
不正确
D
