0高二化学选择性必修3第三章第五节有机合成(共77张PPT)
文档属性
| 名称 | 0高二化学选择性必修3第三章第五节有机合成(共77张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 00:00:00 | ||
图片预览







文档简介
(共77张PPT)
第三章 第五节 有机合成(2)
高二年级 化学
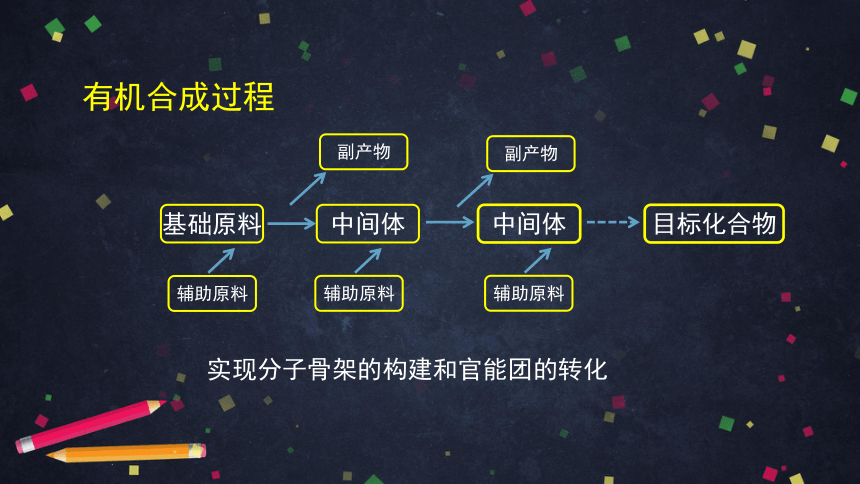
有机合成过程
基础原料
中间体
中间体
目标化合物
辅助原料
辅助原料
辅助原料
副产物
副产物
实现分子骨架的构建和官能团的转化
2001年诺贝尔化学奖得主提出有机合成的两大任务:
实现有价值的已知有机化合物的高效率生产
创造新的有价值的物质和材料
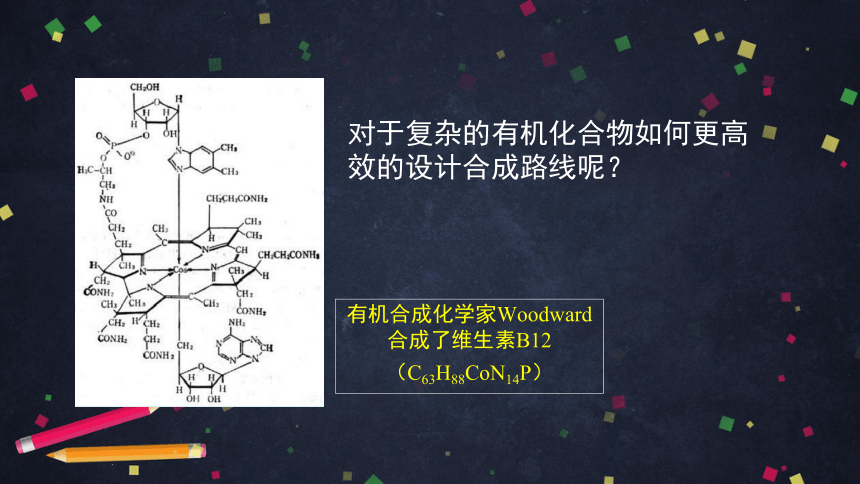
对于复杂的有机化合物如何更高效的设计合成路线呢?
有机合成化学家Woodward
合成了维生素B12
(C63H88CoN14P)
逆合成理论创建者:科里教授
科里(Elias James Corey),1928年出生,美国化学学家,哈佛大学教授。他于1967年提出了 “逆合成分析原理”,使有机合成路线设计成为有严格思维逻辑的科学,并开创了计算机辅助有机合成设计的新纪元。1990年获得诺贝尔化学奖。
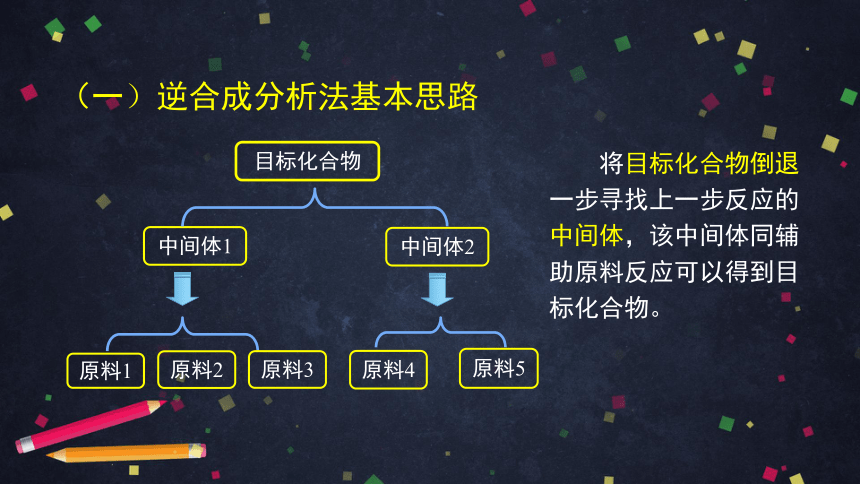
(一)逆合成分析法基本思路
目标化合物
中间体1
中间体2
原料1
原料2
原料4
原料5
原料3
将目标化合物倒退一步寻找上一步反应的中间体,该中间体同辅助原料反应可以得到目标化合物。
有机合成基本原料
来自天然资源,煤、石油、天然气或农副产品等,如甲烷、乙烷、丙烷、乙烯、乙炔、苯、甲苯等。
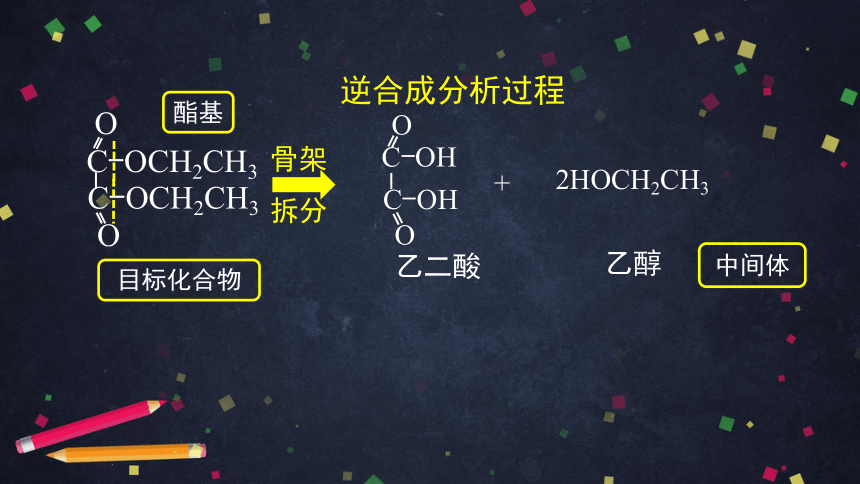
乙二酸二乙酯是医药工业中重要的中间体,尝试用逆 合成分析法分析其合成路线。
乙二酸二乙酯的结构简式
C-OCH2CH3
C-OCH2CH3
O
O
目标化合物
逆合成分析过程
请你观察目标化合物的分子结构的特点。
往前倒推一步,合成它的中间体可能是什么。
C-OCH2CH3
C-OCH2CH3
O
O
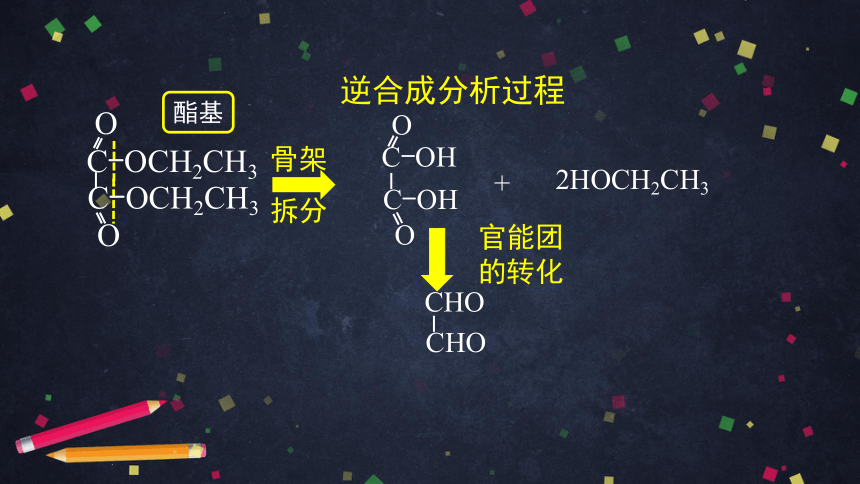
逆合成分析过程
目标化合物
酯基
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
目标化合物
酯基
乙二酸
乙醇
+
2HOCH2CH3
中间体
骨架
拆分
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
酯基
+
2HOCH2CH3
CHO
CHO
官能团的转化
骨架
拆分
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
酯基
+
2HOCH2CH3
骨架
拆分
CHO
CHO
官能团的转化
CH2OH
CH2OH
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
酯基
+
2HOCH2CH3
骨架
拆分
CHO
CHO
官能团的转化
CH2OH
CH2OH
CH2Br
CH2Br
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
酯基
+
2HOCH2CH3
骨架
拆分
CHO
CHO
官能团的转化
CH2OH
CH2OH
CH2Br
CH2Br
CH2
CH2
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
酯基
+
2HOCH2CH3
骨架
拆分
HOCH2CH3
BrCH2CH3
CH2= CH2
路径1
官能团的转化
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
常见重要官能团间的转化关系
逆合成分析过程
酯基
+
2HOCH2CH3
骨架
拆分
HOCH2CH3
BrCH2CH3
CH2= CH2
路径1
路径2
CH2= CH2
官能团的转化
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
酯基
+
2HOCH2CH3
骨架
拆分
HOCH2CH3
BrCH2CH3
CH2= CH2
路径1
路径2
CH2= CH2
官能团的转化
步骤更短
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
+
2HOCH2CH3
骨架
拆分
官能团的转化
CH2Br
CH2Br
CH2
CH2
CH2
CH2
酯基
C-OH
C-OH
O
O
CH2OH
CH2OH
CHO
CHO
C-OCH2CH3
C-OCH2CH3
O
O
正向梳理合成路线
增长碳链
官能团的转化
CH2Br
CH2Br
CH2
CH2
CH2
CH2
酯基
C-OH
C-OH
O
O
CHO
CHO
CH2OH
CH2OH
+
2HOCH2CH3
C-OCH2CH3
C-OCH2CH3
O
O
写出合成过程中反应的化学方程式
CH2=CH2
CH2=CH2 + H2O
CH3CH2OH
催化剂
CH2=CH2
+ Br2
CH2 CH2
Br Br
加成反应
加成反应
官能团的转化
水解反应
加成反应
CH2 CH2
加成反应
Br Br
+ 2NaOH
+ 2NaBr
CH2 CH2
OH OH
+ Br2
CH2=CH2
+ Br2
CH2 CH2
Br Br
CH2=CH2 + H2O
CH3CH2OH
催化剂
官能团的转化
H C C H
O
催化剂
+ O2
+ O2
2H2O +
Cu
氧化反应
官能团的转化
O
O
C C OH
O
HO
H C C H
O
O
OH OH
CH2 CH2
+ 2CH3CH2OH
浓硫酸
+ 2H2O
酯化反应
引入酯基,增长碳链
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
以乙烯为唯一的有机原料(无机试剂及催化剂可以任选),根据以下信息设计合成二丙酸乙二醇酯的路线。
资料:R-Cl + NaCN
R-CN + NaCl
R-CN + H2O + HCl
RCOOH + NH4Cl
CH3-CH2-C-O-CH2-CH2-O-C-CH2-CH3
O
O
二丙酸乙二醇酯
(-CN 氰基)
逆合成分析
观察目标分子
CH3-CH2-C-O-CH2-CH2-O-C-CH2-CH3
O
O
逆合成分析
观察目标分子
HOCH2CH2OH
CH3CH2COOH
逆向分析
CH3-CH2-C-O-CH2-CH2-O-C-CH2-CH3
O
O
逆合成分析
观察目标分子
对比分子骨架
官能团
CH3CH2COOH
BrCH2 CH2Br
HOCH2CH2OH
逆向分析
CH3-CH2-C-O-CH2-CH2-O-C-CH2-CH3
O
O
逆合成分析
观察目标分子
CH3CH2COOH
BrCH2 CH2Br
CH2=CH2
HOCH2CH2OH
逆向分析
对比分子骨架
官能团
CH3-CH2-C-O-CH2-CH2-O-C-CH2-CH3
O
O
逆合成分析
观察目标分子
CH3CH2COOH
BrCH2 CH2Br
CH2=CH2
需增长碳链转化官能团
逆向分析
对比分子骨架
官能团
CH3-CH2-C-O-CH2-CH2-O-C-CH2-CH3
O
O
HOCH2CH2OH
CH3CH2COOH
CH2=CH2
需增长碳链转化官能团
资料:R-Cl + NaCN
R-CN + NaCl
R-CN + H2O + HCl
RCOOH + NH4Cl
增长碳链
引入羧基
对比分子骨架
官能团
(-CN 氰基)
CH3CH2COOH
CH2=CH2
资料:R-Cl + NaCN
R-CN + NaCl
R-CN + H2O + HCl
RCOOH + NH4Cl
增长碳链
引入羧基
CH3CH2CN
丙腈
对比分子骨架
官能团
(-CN 氰基)
CH3CH2COOH
CH2=CH2
资料:R-Cl + NaCN
R-CN + NaCl
R-CN + H2O + HCl
RCOOH + NH4Cl
增长碳链
引入羧基
CH3CH2CN
CH3CH2Cl
丙腈
对比分子骨架
官能团
(-CN 氰基)
正向梳理,写出合成路线
CH2OH
CH2OH
CH2Br
CH2Br
CH2
CH2
Br2
NaOH
水溶液
转化官能团
正向梳理,写出合成路线
CH2OH
CH2OH
CH2Br
CH2Br
CH2
CH2
Br2
NaOH
水溶液
CH3CH2COOH
CH3CH2CN
CH3CH2Cl
CH2
CH2
HCl
催化剂
NaCN
H2O
HCl
增长碳链
转化官能团
转化官能团
正向梳理,写出合成路线
CH2OH
CH2OH
CH2Br
CH2Br
CH2
CH2
Br2
NaOH
水溶液
CH3CH2COOH
CH3CH2CN
CH3CH2Cl
CH2
CH2
HCl
催化剂
NaCN
H2O
HCl
浓硫酸
CH3-CH2-C-O-CH2-CH2-O-C-CH2-CH3
O
O
请同学们思考用逆合成分析法设计合成路线的基本步骤以及要素。
(二)逆合成分析法思路小结
分子骨架特征,
官能团种类、位置
寻断键处
观察目标化合物的分子结构
(二)逆合成分析法思路小结
逆推至原料
分子骨架的构建和
官能团的转化
应用有机化合物的转化及新信息
(二)逆合成分析法思路小结
分子骨架特征,
官能团种类、位置
观察目标化合物的分子结构
寻断键处
酯基
+
2HOCH2CH3
骨架
拆分
HOCH2CH3
BrCH2CH3
CH2= CH2
路径1
路径2
CH2= CH2
官能团的转化
步骤更短
C-OH
C-OH
O
O
多种路径时进行优选
C-OCH2CH3
C-OCH2CH3
O
O
血管紧张素抑制剂--卡托普利的合成路线
A
B
C
93.0%
81.7%
85.6%
90.0%
CH2=C
CH3
COOH
2-甲基丙烯酸
HOOC
HSCH2CHCON
CH3
卡托普利
箭头上标注了各步反应的产率
血管紧张素抑制剂--卡托普利的合成路线
A
B
C
93.0%
81.7%
85.6%
90.0%
CH2=C
CH3
COOH
2-甲基丙烯酸
HOOC
HSCH2CHCON
CH3
总产率= 1×93.0%×81.7%×90.0%×85.6% = 58.54%
卡托普利
箭头上标注了各步反应的产率
血管紧张素抑制剂--卡托普利的合成路线
A
B
C
93.0%
81.7%
85.6%
90.0%
CH2=C
CH3
COOH
2-甲基丙烯酸
HOOC
HSCH2CHCON
CH3
总产率= 1×93.0%×81.7%×90.0%×85.6% = 58.54%
卡托普利
合成步骤越多,总转化率越低
逆推至原料
分子骨架的构建和
官能团的转化
应用有机化合物的转化及新信息
(二)逆合成分析法思路小结
分子骨架特征,
官能团种类、位置
观察目标化合物的分子结构
寻断键处
优化合成路线
依据“绿色化学”
“绿色化学”合成原则
原料:易得廉价,低毒性,低污染
反应:条件温和,操作安全,产率高
路线:科学高效,步骤少
练习:阿司匹林能镇痛、解热。缓释阿司匹林由于其分子结构特点(如下图)可使药物在体内以一定浓度连续缓慢释放。请利用逆合成分析法,分析其合成路线。
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
CH2 C
CH3
C OCH2CH2O C
O
n
O-C-CH3
O
观察目标物分子结构特征
练习:阿司匹林能镇痛、解热。缓释阿司匹林由于其分子结构特点(如下图)可使药物在体内以一定浓度连续缓慢释放。请利用逆合成分析法,分析其合成路线。
O
练习:阿司匹林能镇痛、解热。缓释阿司匹林由于其分子结构特点(如下图)可使药物在体内以一定浓度连续缓慢释放。请利用逆合成分析法,分析其合成路线。
CH2 C
CH3
C OCH2CH2O C
O
n
O-C-CH3
O
CH2 C
CH3
C OCH2CH2O C
O
分子骨架特征
官能团种类位置
O
练习:阿司匹林能镇痛、解热。缓释阿司匹林由于其分子结构特点(如下图)可使药物在体内以一定浓度连续缓慢释放。请利用逆合成分析法,分析其合成路线。
CH2 C
CH3
C OCH2CH2O C
O
n
O-C-CH3
O
CH2 C
CH3
C OCH2CH2O C
O
O
分子骨架特征
官能团种类位置
加聚反应
CH2 CH2
n
n CH2 = CH2
催化剂
聚乙烯
O-C-CH3
O
路径1
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
路径1
CH2 C
CH3
C OCH2CH2O C
O
O
O-C-CH3
O
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
路径1
CH2 C
CH3
C OCH2CH2O C
O
O
O-C-CH3
O
CH2 C
CH3
C OCH2CH2O C
O
O
n
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
路径1
CH2 C
CH3
C OCH2CH2O C
O
O-C-CH3
O
CH2=CCOOH
CH3
HOCH2CH2OH
OH
COOH
①
②
③
②
①
③
CH3COOH
④
④
水杨酸
2-甲基丙烯酸
O
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
路径2
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
HOCH2CH2OH
②乙二醇
①聚甲基丙烯酸
③乙酰水杨酸
路径2
CH2 C
CH3
COOH
n
OCCH3
COOH
O
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
HOCH2CH2OH
②乙二醇
①聚甲基丙烯酸
③乙酰水杨酸
路径2
CH2 C
CH3
COOH
n
OCCH3
COOH
O
实际生产中,常常将阿司匹林(乙酰水杨酸)借助乙二醇嫁接到聚甲基丙烯酸上,然后缓慢水解释放出乙酰水杨酸在人体内发挥长效。
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
①聚甲基丙烯酸
路径2
CH2 C
CH3
COOH
n
CH2=CCOOH
CH3
2-甲基丙烯酸
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
HOCH2CH2OH
②乙二醇
①聚甲基丙烯酸
③乙酰水杨酸
路径2
CH2 C
CH3
COOH
n
OCCH3
COOH
O
O-C-CH3
O
③乙酰水杨酸
路径2
实际生产中,采用水杨酸为原料与乙酸酐发生取代反应来构建碳骨架和引入酯基。该反应更易发生,产率更高。
OCCH3
COOH
O
OH
COOH
CH3C
O
O
CH3C
O
水杨酸
+
乙酸酐
CH2 C
CH3
C OCH2CH2O C
O
O
n
OCCH3
COOH
O
OH
COOH
乙酸酐
CH2OH
CH2OH
CH2Br
CH2Br
CH2
CH2
Br2
NaOH
水溶液
CH2=CCOOH
CH3
CH2 C
CH3
COOH
n
催化剂
水杨酸
乙酰水杨酸
2-甲基丙烯酸
练习:对氨基水杨酸钠,适用于结核分枝杆菌所致的肺及肺外结核病。现用甲苯为原料,制备对氨基水杨酸。尝试分析其合成路线。
对氨基水杨酸
已知:
苯胺易被氧化
原料
目标分子
对比分子骨架
与官能团
原料
目标分子
需引入官能团:
–NH2 , –OH, –COOH
对比分子骨架
与官能团
练习:对氨基水杨酸钠,适用于结核分枝杆菌所致的肺及肺外结核病。现用甲苯为原料,制备对氨基水杨酸。尝试分析其合成路线。
对氨基水杨酸
已知:
苯胺易被氧化
原料
目标分子
对比碳骨架
与官能团
需引入官能团:
–NH2 , –OH, –COOH
需引入官能团:
–NO2 , –Br, –COOH
根据信息将下列合成路线补充完整:
浓硫酸
浓硝酸
A
B
根据信息将下列合成路线补充完整:
浓硫酸
浓硝酸
A
B
Br2
催化剂
根据信息将下列合成路线补充完整:
浓硫酸
浓硝酸
A
B
Br2
催化剂
路径1
一定条件
Fe, HCl,H2O
KMnO4, H+
根据信息将下列合成路线补充完整:
浓硫酸
浓硝酸
A
B
Br2
催化剂
路径1
一定条件
Fe, HCl,H2O
KMnO4, H+
苯胺易被氧化
信息:
与苯环直接相连的羟基易被氧化
根据信息将下列合成路线补充完整:
浓硫酸
浓硝酸
A
B
Br2
催化剂
路径1
一定条件
Fe, HCl,H2O
KMnO4, H+
苯胺易被氧化
信息:
会被强氧化剂破坏
与苯环直接相连的羟基易被氧化
根据信息将下列合成路线补充完整:
浓硫酸
浓硝酸
Br2
催化剂
KMnO4, H+
Fe, HCl,
H2O
一定条件
路径2
根据信息将下列合成路线补充完整:
浓硫酸
浓硝酸
Br2
催化剂
KMnO4, H+
Fe, HCl,
H2O
一定条件
启示:要依据官能团性质按一定的反应顺序和规律转化官能团,
关注反应条件对其它存在官能团的影响。
逆推至原料
分子骨架的构建和
官能团的转化
应用有机化合物的转化及新信息
逆合成分析法思路小结
分子骨架特征,
官能团种类、位置
观察目标化合物的分子结构
寻断键处
优化合成路线
依据“绿色化学”
思考题
请同学们尝试用逆合成分析法分析设计由1,3-丁二烯为有机原料制备2-氯-1,3-丁二烯的合成路线。(无机试剂任选)
2-氯-1,3-丁二烯( )是制备氯丁橡胶的原料,它只比1,3-丁二烯( )多了一个氯原子。但由于双键上的氢原子很难发生取代反应,不能通过1,3-丁二烯直接与氯气反应制得。
第三章 第五节 有机合成(2)
高二年级 化学
有机合成过程
基础原料
中间体
中间体
目标化合物
辅助原料
辅助原料
辅助原料
副产物
副产物
实现分子骨架的构建和官能团的转化
2001年诺贝尔化学奖得主提出有机合成的两大任务:
实现有价值的已知有机化合物的高效率生产
创造新的有价值的物质和材料
对于复杂的有机化合物如何更高效的设计合成路线呢?
有机合成化学家Woodward
合成了维生素B12
(C63H88CoN14P)
逆合成理论创建者:科里教授
科里(Elias James Corey),1928年出生,美国化学学家,哈佛大学教授。他于1967年提出了 “逆合成分析原理”,使有机合成路线设计成为有严格思维逻辑的科学,并开创了计算机辅助有机合成设计的新纪元。1990年获得诺贝尔化学奖。
(一)逆合成分析法基本思路
目标化合物
中间体1
中间体2
原料1
原料2
原料4
原料5
原料3
将目标化合物倒退一步寻找上一步反应的中间体,该中间体同辅助原料反应可以得到目标化合物。
有机合成基本原料
来自天然资源,煤、石油、天然气或农副产品等,如甲烷、乙烷、丙烷、乙烯、乙炔、苯、甲苯等。
乙二酸二乙酯是医药工业中重要的中间体,尝试用逆 合成分析法分析其合成路线。
乙二酸二乙酯的结构简式
C-OCH2CH3
C-OCH2CH3
O
O
目标化合物
逆合成分析过程
请你观察目标化合物的分子结构的特点。
往前倒推一步,合成它的中间体可能是什么。
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
目标化合物
酯基
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
目标化合物
酯基
乙二酸
乙醇
+
2HOCH2CH3
中间体
骨架
拆分
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
酯基
+
2HOCH2CH3
CHO
CHO
官能团的转化
骨架
拆分
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
酯基
+
2HOCH2CH3
骨架
拆分
CHO
CHO
官能团的转化
CH2OH
CH2OH
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
酯基
+
2HOCH2CH3
骨架
拆分
CHO
CHO
官能团的转化
CH2OH
CH2OH
CH2Br
CH2Br
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
酯基
+
2HOCH2CH3
骨架
拆分
CHO
CHO
官能团的转化
CH2OH
CH2OH
CH2Br
CH2Br
CH2
CH2
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
酯基
+
2HOCH2CH3
骨架
拆分
HOCH2CH3
BrCH2CH3
CH2= CH2
路径1
官能团的转化
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
常见重要官能团间的转化关系
逆合成分析过程
酯基
+
2HOCH2CH3
骨架
拆分
HOCH2CH3
BrCH2CH3
CH2= CH2
路径1
路径2
CH2= CH2
官能团的转化
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
酯基
+
2HOCH2CH3
骨架
拆分
HOCH2CH3
BrCH2CH3
CH2= CH2
路径1
路径2
CH2= CH2
官能团的转化
步骤更短
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
逆合成分析过程
+
2HOCH2CH3
骨架
拆分
官能团的转化
CH2Br
CH2Br
CH2
CH2
CH2
CH2
酯基
C-OH
C-OH
O
O
CH2OH
CH2OH
CHO
CHO
C-OCH2CH3
C-OCH2CH3
O
O
正向梳理合成路线
增长碳链
官能团的转化
CH2Br
CH2Br
CH2
CH2
CH2
CH2
酯基
C-OH
C-OH
O
O
CHO
CHO
CH2OH
CH2OH
+
2HOCH2CH3
C-OCH2CH3
C-OCH2CH3
O
O
写出合成过程中反应的化学方程式
CH2=CH2
CH2=CH2 + H2O
CH3CH2OH
催化剂
CH2=CH2
+ Br2
CH2 CH2
Br Br
加成反应
加成反应
官能团的转化
水解反应
加成反应
CH2 CH2
加成反应
Br Br
+ 2NaOH
+ 2NaBr
CH2 CH2
OH OH
+ Br2
CH2=CH2
+ Br2
CH2 CH2
Br Br
CH2=CH2 + H2O
CH3CH2OH
催化剂
官能团的转化
H C C H
O
催化剂
+ O2
+ O2
2H2O +
Cu
氧化反应
官能团的转化
O
O
C C OH
O
HO
H C C H
O
O
OH OH
CH2 CH2
+ 2CH3CH2OH
浓硫酸
+ 2H2O
酯化反应
引入酯基,增长碳链
C-OH
C-OH
O
O
C-OCH2CH3
C-OCH2CH3
O
O
以乙烯为唯一的有机原料(无机试剂及催化剂可以任选),根据以下信息设计合成二丙酸乙二醇酯的路线。
资料:R-Cl + NaCN
R-CN + NaCl
R-CN + H2O + HCl
RCOOH + NH4Cl
CH3-CH2-C-O-CH2-CH2-O-C-CH2-CH3
O
O
二丙酸乙二醇酯
(-CN 氰基)
逆合成分析
观察目标分子
CH3-CH2-C-O-CH2-CH2-O-C-CH2-CH3
O
O
逆合成分析
观察目标分子
HOCH2CH2OH
CH3CH2COOH
逆向分析
CH3-CH2-C-O-CH2-CH2-O-C-CH2-CH3
O
O
逆合成分析
观察目标分子
对比分子骨架
官能团
CH3CH2COOH
BrCH2 CH2Br
HOCH2CH2OH
逆向分析
CH3-CH2-C-O-CH2-CH2-O-C-CH2-CH3
O
O
逆合成分析
观察目标分子
CH3CH2COOH
BrCH2 CH2Br
CH2=CH2
HOCH2CH2OH
逆向分析
对比分子骨架
官能团
CH3-CH2-C-O-CH2-CH2-O-C-CH2-CH3
O
O
逆合成分析
观察目标分子
CH3CH2COOH
BrCH2 CH2Br
CH2=CH2
需增长碳链转化官能团
逆向分析
对比分子骨架
官能团
CH3-CH2-C-O-CH2-CH2-O-C-CH2-CH3
O
O
HOCH2CH2OH
CH3CH2COOH
CH2=CH2
需增长碳链转化官能团
资料:R-Cl + NaCN
R-CN + NaCl
R-CN + H2O + HCl
RCOOH + NH4Cl
增长碳链
引入羧基
对比分子骨架
官能团
(-CN 氰基)
CH3CH2COOH
CH2=CH2
资料:R-Cl + NaCN
R-CN + NaCl
R-CN + H2O + HCl
RCOOH + NH4Cl
增长碳链
引入羧基
CH3CH2CN
丙腈
对比分子骨架
官能团
(-CN 氰基)
CH3CH2COOH
CH2=CH2
资料:R-Cl + NaCN
R-CN + NaCl
R-CN + H2O + HCl
RCOOH + NH4Cl
增长碳链
引入羧基
CH3CH2CN
CH3CH2Cl
丙腈
对比分子骨架
官能团
(-CN 氰基)
正向梳理,写出合成路线
CH2OH
CH2OH
CH2Br
CH2Br
CH2
CH2
Br2
NaOH
水溶液
转化官能团
正向梳理,写出合成路线
CH2OH
CH2OH
CH2Br
CH2Br
CH2
CH2
Br2
NaOH
水溶液
CH3CH2COOH
CH3CH2CN
CH3CH2Cl
CH2
CH2
HCl
催化剂
NaCN
H2O
HCl
增长碳链
转化官能团
转化官能团
正向梳理,写出合成路线
CH2OH
CH2OH
CH2Br
CH2Br
CH2
CH2
Br2
NaOH
水溶液
CH3CH2COOH
CH3CH2CN
CH3CH2Cl
CH2
CH2
HCl
催化剂
NaCN
H2O
HCl
浓硫酸
CH3-CH2-C-O-CH2-CH2-O-C-CH2-CH3
O
O
请同学们思考用逆合成分析法设计合成路线的基本步骤以及要素。
(二)逆合成分析法思路小结
分子骨架特征,
官能团种类、位置
寻断键处
观察目标化合物的分子结构
(二)逆合成分析法思路小结
逆推至原料
分子骨架的构建和
官能团的转化
应用有机化合物的转化及新信息
(二)逆合成分析法思路小结
分子骨架特征,
官能团种类、位置
观察目标化合物的分子结构
寻断键处
酯基
+
2HOCH2CH3
骨架
拆分
HOCH2CH3
BrCH2CH3
CH2= CH2
路径1
路径2
CH2= CH2
官能团的转化
步骤更短
C-OH
C-OH
O
O
多种路径时进行优选
C-OCH2CH3
C-OCH2CH3
O
O
血管紧张素抑制剂--卡托普利的合成路线
A
B
C
93.0%
81.7%
85.6%
90.0%
CH2=C
CH3
COOH
2-甲基丙烯酸
HOOC
HSCH2CHCON
CH3
卡托普利
箭头上标注了各步反应的产率
血管紧张素抑制剂--卡托普利的合成路线
A
B
C
93.0%
81.7%
85.6%
90.0%
CH2=C
CH3
COOH
2-甲基丙烯酸
HOOC
HSCH2CHCON
CH3
总产率= 1×93.0%×81.7%×90.0%×85.6% = 58.54%
卡托普利
箭头上标注了各步反应的产率
血管紧张素抑制剂--卡托普利的合成路线
A
B
C
93.0%
81.7%
85.6%
90.0%
CH2=C
CH3
COOH
2-甲基丙烯酸
HOOC
HSCH2CHCON
CH3
总产率= 1×93.0%×81.7%×90.0%×85.6% = 58.54%
卡托普利
合成步骤越多,总转化率越低
逆推至原料
分子骨架的构建和
官能团的转化
应用有机化合物的转化及新信息
(二)逆合成分析法思路小结
分子骨架特征,
官能团种类、位置
观察目标化合物的分子结构
寻断键处
优化合成路线
依据“绿色化学”
“绿色化学”合成原则
原料:易得廉价,低毒性,低污染
反应:条件温和,操作安全,产率高
路线:科学高效,步骤少
练习:阿司匹林能镇痛、解热。缓释阿司匹林由于其分子结构特点(如下图)可使药物在体内以一定浓度连续缓慢释放。请利用逆合成分析法,分析其合成路线。
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
CH2 C
CH3
C OCH2CH2O C
O
n
O-C-CH3
O
观察目标物分子结构特征
练习:阿司匹林能镇痛、解热。缓释阿司匹林由于其分子结构特点(如下图)可使药物在体内以一定浓度连续缓慢释放。请利用逆合成分析法,分析其合成路线。
O
练习:阿司匹林能镇痛、解热。缓释阿司匹林由于其分子结构特点(如下图)可使药物在体内以一定浓度连续缓慢释放。请利用逆合成分析法,分析其合成路线。
CH2 C
CH3
C OCH2CH2O C
O
n
O-C-CH3
O
CH2 C
CH3
C OCH2CH2O C
O
分子骨架特征
官能团种类位置
O
练习:阿司匹林能镇痛、解热。缓释阿司匹林由于其分子结构特点(如下图)可使药物在体内以一定浓度连续缓慢释放。请利用逆合成分析法,分析其合成路线。
CH2 C
CH3
C OCH2CH2O C
O
n
O-C-CH3
O
CH2 C
CH3
C OCH2CH2O C
O
O
分子骨架特征
官能团种类位置
加聚反应
CH2 CH2
n
n CH2 = CH2
催化剂
聚乙烯
O-C-CH3
O
路径1
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
路径1
CH2 C
CH3
C OCH2CH2O C
O
O
O-C-CH3
O
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
路径1
CH2 C
CH3
C OCH2CH2O C
O
O
O-C-CH3
O
CH2 C
CH3
C OCH2CH2O C
O
O
n
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
路径1
CH2 C
CH3
C OCH2CH2O C
O
O-C-CH3
O
CH2=CCOOH
CH3
HOCH2CH2OH
OH
COOH
①
②
③
②
①
③
CH3COOH
④
④
水杨酸
2-甲基丙烯酸
O
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
路径2
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
HOCH2CH2OH
②乙二醇
①聚甲基丙烯酸
③乙酰水杨酸
路径2
CH2 C
CH3
COOH
n
OCCH3
COOH
O
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
HOCH2CH2OH
②乙二醇
①聚甲基丙烯酸
③乙酰水杨酸
路径2
CH2 C
CH3
COOH
n
OCCH3
COOH
O
实际生产中,常常将阿司匹林(乙酰水杨酸)借助乙二醇嫁接到聚甲基丙烯酸上,然后缓慢水解释放出乙酰水杨酸在人体内发挥长效。
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
①聚甲基丙烯酸
路径2
CH2 C
CH3
COOH
n
CH2=CCOOH
CH3
2-甲基丙烯酸
CH2 C
CH3
C OCH2CH2O C
O
O
n
O-C-CH3
O
HOCH2CH2OH
②乙二醇
①聚甲基丙烯酸
③乙酰水杨酸
路径2
CH2 C
CH3
COOH
n
OCCH3
COOH
O
O-C-CH3
O
③乙酰水杨酸
路径2
实际生产中,采用水杨酸为原料与乙酸酐发生取代反应来构建碳骨架和引入酯基。该反应更易发生,产率更高。
OCCH3
COOH
O
OH
COOH
CH3C
O
O
CH3C
O
水杨酸
+
乙酸酐
CH2 C
CH3
C OCH2CH2O C
O
O
n
OCCH3
COOH
O
OH
COOH
乙酸酐
CH2OH
CH2OH
CH2Br
CH2Br
CH2
CH2
Br2
NaOH
水溶液
CH2=CCOOH
CH3
CH2 C
CH3
COOH
n
催化剂
水杨酸
乙酰水杨酸
2-甲基丙烯酸
练习:对氨基水杨酸钠,适用于结核分枝杆菌所致的肺及肺外结核病。现用甲苯为原料,制备对氨基水杨酸。尝试分析其合成路线。
对氨基水杨酸
已知:
苯胺易被氧化
原料
目标分子
对比分子骨架
与官能团
原料
目标分子
需引入官能团:
–NH2 , –OH, –COOH
对比分子骨架
与官能团
练习:对氨基水杨酸钠,适用于结核分枝杆菌所致的肺及肺外结核病。现用甲苯为原料,制备对氨基水杨酸。尝试分析其合成路线。
对氨基水杨酸
已知:
苯胺易被氧化
原料
目标分子
对比碳骨架
与官能团
需引入官能团:
–NH2 , –OH, –COOH
需引入官能团:
–NO2 , –Br, –COOH
根据信息将下列合成路线补充完整:
浓硫酸
浓硝酸
A
B
根据信息将下列合成路线补充完整:
浓硫酸
浓硝酸
A
B
Br2
催化剂
根据信息将下列合成路线补充完整:
浓硫酸
浓硝酸
A
B
Br2
催化剂
路径1
一定条件
Fe, HCl,H2O
KMnO4, H+
根据信息将下列合成路线补充完整:
浓硫酸
浓硝酸
A
B
Br2
催化剂
路径1
一定条件
Fe, HCl,H2O
KMnO4, H+
苯胺易被氧化
信息:
与苯环直接相连的羟基易被氧化
根据信息将下列合成路线补充完整:
浓硫酸
浓硝酸
A
B
Br2
催化剂
路径1
一定条件
Fe, HCl,H2O
KMnO4, H+
苯胺易被氧化
信息:
会被强氧化剂破坏
与苯环直接相连的羟基易被氧化
根据信息将下列合成路线补充完整:
浓硫酸
浓硝酸
Br2
催化剂
KMnO4, H+
Fe, HCl,
H2O
一定条件
路径2
根据信息将下列合成路线补充完整:
浓硫酸
浓硝酸
Br2
催化剂
KMnO4, H+
Fe, HCl,
H2O
一定条件
启示:要依据官能团性质按一定的反应顺序和规律转化官能团,
关注反应条件对其它存在官能团的影响。
逆推至原料
分子骨架的构建和
官能团的转化
应用有机化合物的转化及新信息
逆合成分析法思路小结
分子骨架特征,
官能团种类、位置
观察目标化合物的分子结构
寻断键处
优化合成路线
依据“绿色化学”
思考题
请同学们尝试用逆合成分析法分析设计由1,3-丁二烯为有机原料制备2-氯-1,3-丁二烯的合成路线。(无机试剂任选)
2-氯-1,3-丁二烯( )是制备氯丁橡胶的原料,它只比1,3-丁二烯( )多了一个氯原子。但由于双键上的氢原子很难发生取代反应,不能通过1,3-丁二烯直接与氯气反应制得。
