化学人教版(2019)选择性必修1 2.1.3 活化能(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.1.3 活化能(共23张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 962.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 08:49:24 | ||
图片预览



文档简介
(共23张PPT)
第二章 化学反应速率与化学平衡
第一节 化学反应速率
活化能
思考与交流:
活化能与简单碰撞理论
2.旧键断裂和新键形成又是如何发生的呢?
1.化学反应是如何发生的?请结合我们学过的化学键知识来解释化学反应的本质?
反应物中旧化学键的断裂
生成物中新化学键的形成
你知道吗?
物质 条件 碰撞次数
H2、O2 常温、常压 2.35×1010 次/秒
任何分子间的碰撞次数都是非常巨大的,通常情况下, 当气体的浓度为1mol/L时,在每立方厘米、每秒内反应物分子的碰撞可达到1028。
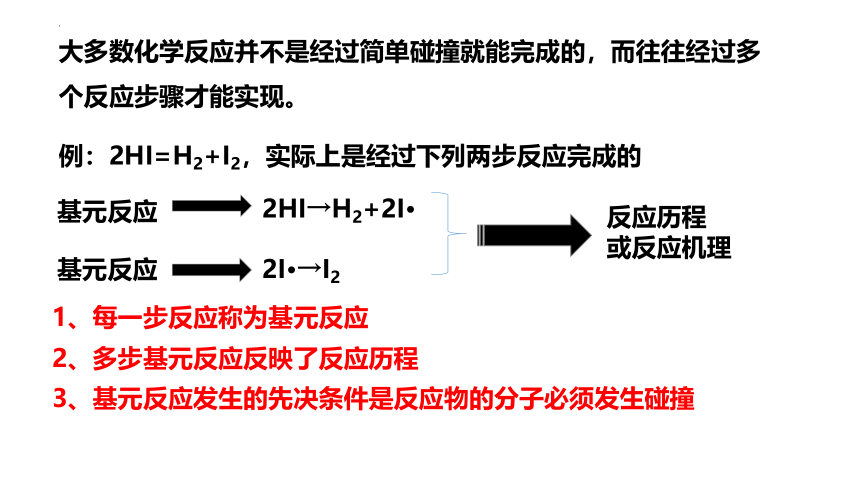
大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。
2HI→H2+2I
2I →I2
例:2HI=H2+I2,实际上是经过下列两步反应完成的
基元反应
基元反应
1、每一步反应称为基元反应
2、多步基元反应反映了反应历程
3、基元反应发生的先决条件是反应物的分子必须发生碰撞
反应历程
或反应机理
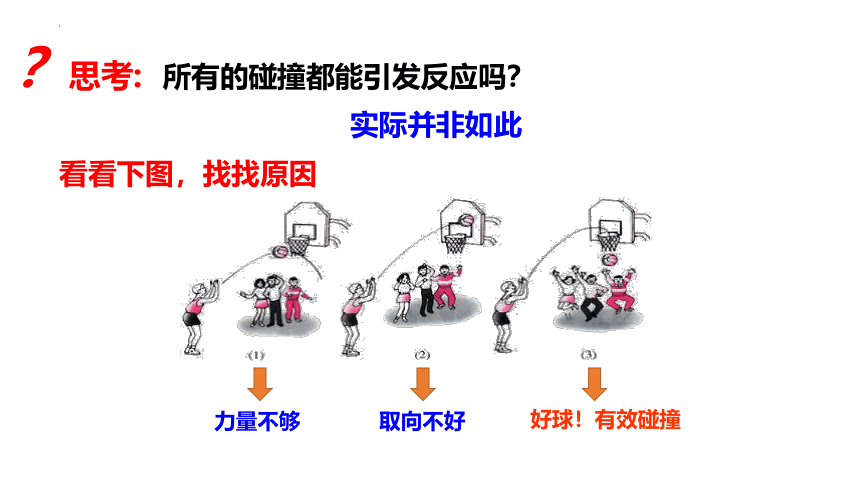
所有的碰撞都能引发反应吗?
?思考:
实际并非如此
看看下图,找找原因
力量不够
取向不好
好球!有效碰撞
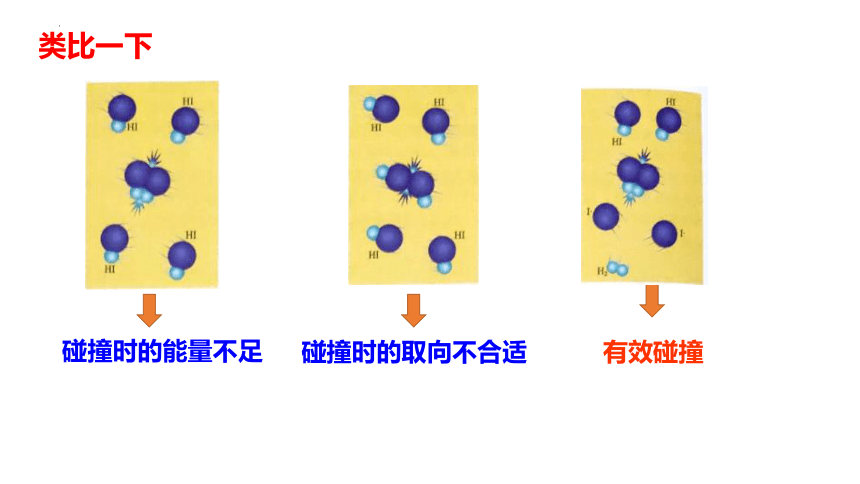
类比一下
碰撞时的取向不合适
有效碰撞
碰撞时的能量不足
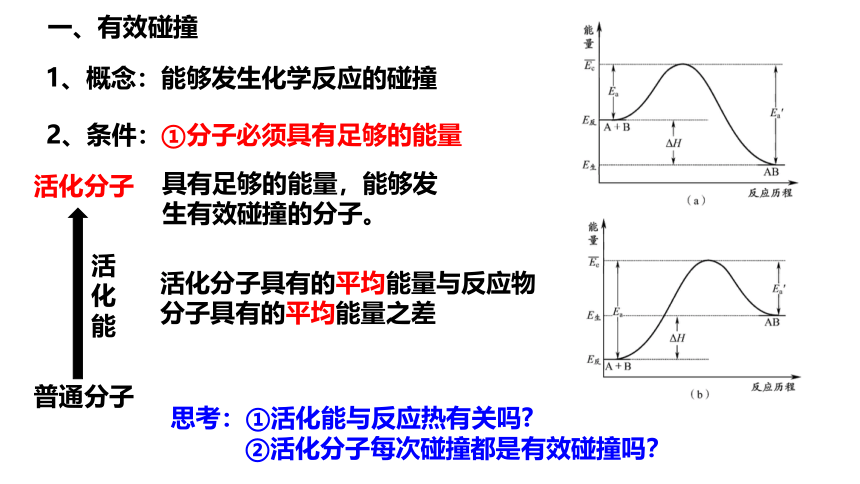
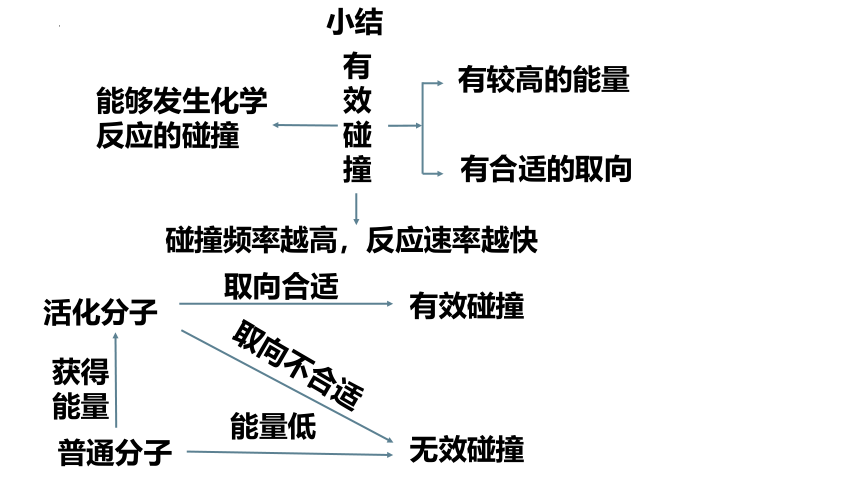
一、有效碰撞
1、概念:能够发生化学反应的碰撞
2、条件:
①分子必须具有足够的能量
活化分子具有的平均能量与反应物分子具有的平均能量之差
活化分子
具有足够的能量,能够发生有效碰撞的分子。
普通分子
活
化
能
思考:①活化能与反应热有关吗
②活化分子每次碰撞都是有效碰撞吗?
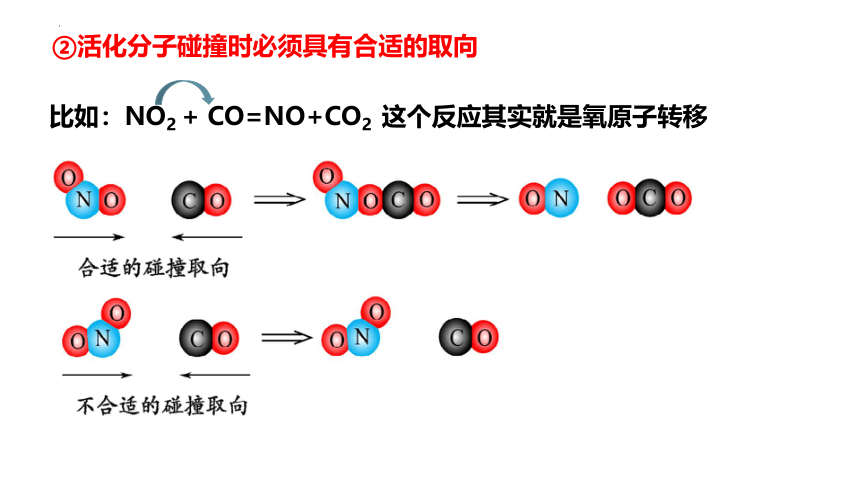
比如:NO2 + CO=NO+CO2 这个反应其实就是氧原子转移
②活化分子碰撞时必须具有合适的取向
有
效
碰
撞
能够发生化学反应的碰撞
有较高的能量
有合适的取向
碰撞频率越高,反应速率越快
普通分子
无效碰撞
能量低
活化分子
有效碰撞
取向不合适
获得
能量
取向合适
小结
一个反应要发生一般要经历哪些过程?
动脑时间
普通
分子
得到
能量
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
释放
能量
活化能
练习:下列说法正确的是
A、一定条件下,增大反应物的量会加快化学反应速率。
B、增大压强,肯定会加快化学反应速率。
C、活化分子间所发生的碰撞为有效碰撞。
D、能够发生有效碰撞的分子叫活化分子。
√
练习.下列说法不正确的是( )
A.能量较高、有可能发生有效碰撞的分子称为活化分子
B.活化分子的平均能量与所有分子的平均能量之差称为活化能
C.催化剂能参与反应,可降低原反应所需活化能
D.非活化分子也有可能发生有效碰撞
D
二、活化分子、有效碰撞与反应速率的关系
1、浓度对反应速率的影响
浓度增大
单位体积内分子总数↑
活化分子数↑
活化分子百分数不变
单位时间内有效碰撞次数↑
v↑
普通分子
活化分子
2、压强对反应速率的影响
有气体参加的反应
①范围
②方法
压强问题
浓度问题
思考:请用有效碰撞理论解释压强对反应速率的影响。
I、恒温,缩小体积
反应物物质的量不变
浓度c↑
体积减小
压强增大
单位体积内分子总数↑
活化分子数↑
活化分子百分数不变
单位时间内有效碰撞次数↑
v↑
II、恒温,体积不变(恒温恒容)条件下,充入反应气体
充入反应气
恒温恒容充反应气
体积不变
浓度c变↑
反应物物质的量变大
单位体积内分子总数↑
活化分子数↑
活化分子百分数不变
单位时间内有效碰撞次数↑
v↑
III、恒温,体积不变(恒温恒容)条件下,充入惰性气体
充入惰气
恒温恒容冲入惰气
体积不变
浓度c不变
反应物物质的量不变
反应速率v不变
惰性气体
普通分子
活化分子
Ⅳ、恒温,体积可变(恒温恒压)条件下,充入惰性气体
充入惰气
恒温恒压充惰性气体
体积变大
浓度c变↓
反应物物质的量不变
惰性气体
普通分子
活化分子
单位体积内分子总数不变
活化分子数不变
活化分子百分数变小
单位时间内有效碰撞次数↓
v↓
升高温度
单位体积内分子总数不变,
活化分子数↑
活化分子百分数↑
单位时间内有效碰撞次数↑
v↑
3、温度对反应速率的影响
升高温度
分子运动加快,碰撞频率提高
催化剂可以改变反应历程,降低反应的活化能,但不能改变反应的热效应。
4、催化剂对反应速率的影响
加催化剂
单位体积内分子总数不变,
活化分子数↑
活化分子百分数↑
单位时间内有效碰撞次数↑
v↑
降低活化能
练习:
1.增大反应物的浓度使反应速率加快的主要原因( )
2.对于气体参与体系增大压强使反应速率加快的主要
原因是( )
3.升高温度使反应速率加快的主要原因是( )
4.使用催化剂使反应速率加快的主要原因是( )
A.活化分子百分数不变,但提高单位体积内活化分子的总数
B.增大分子的运动速率而使有效碰撞增加
C.升高反应物分子的能量,使活化分子的百分数增加
D.降低反应所需的能量,使活化分子百分数增加
A
A
C
D
练习:下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大浓度 B、增大压强
C、升高温度 D、使用催化剂
D
【2014·全国高考真题】已知分解1mol H2O2 放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2+I-→H2O+IO- 慢,
H2O2+IO-→H2O+O2+I- 快;
下列有关反应的说法正确的是( )A.反应的速率与I-的浓度有关 B.IO-也是该反应的催化剂C.反应活化能等于98kJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
A
外界因素 活化能 分子总数 活化分子总数 活化分子百分数 单位体积活化分子百分数 有效碰撞次数 反应速率
增大浓度
压缩体积
升高温度
加催化剂
小结:影响化学反应速率的外因
不变 增多 增多 不变 增多 增多 加快
不变 不变 不变 不变 增多 增多 加快
不变 不变 增多 增多 增多 增多 加快
降低 不变 增多 增多 增多 增多 加快
第二章 化学反应速率与化学平衡
第一节 化学反应速率
活化能
思考与交流:
活化能与简单碰撞理论
2.旧键断裂和新键形成又是如何发生的呢?
1.化学反应是如何发生的?请结合我们学过的化学键知识来解释化学反应的本质?
反应物中旧化学键的断裂
生成物中新化学键的形成
你知道吗?
物质 条件 碰撞次数
H2、O2 常温、常压 2.35×1010 次/秒
任何分子间的碰撞次数都是非常巨大的,通常情况下, 当气体的浓度为1mol/L时,在每立方厘米、每秒内反应物分子的碰撞可达到1028。
大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。
2HI→H2+2I
2I →I2
例:2HI=H2+I2,实际上是经过下列两步反应完成的
基元反应
基元反应
1、每一步反应称为基元反应
2、多步基元反应反映了反应历程
3、基元反应发生的先决条件是反应物的分子必须发生碰撞
反应历程
或反应机理
所有的碰撞都能引发反应吗?
?思考:
实际并非如此
看看下图,找找原因
力量不够
取向不好
好球!有效碰撞
类比一下
碰撞时的取向不合适
有效碰撞
碰撞时的能量不足
一、有效碰撞
1、概念:能够发生化学反应的碰撞
2、条件:
①分子必须具有足够的能量
活化分子具有的平均能量与反应物分子具有的平均能量之差
活化分子
具有足够的能量,能够发生有效碰撞的分子。
普通分子
活
化
能
思考:①活化能与反应热有关吗
②活化分子每次碰撞都是有效碰撞吗?
比如:NO2 + CO=NO+CO2 这个反应其实就是氧原子转移
②活化分子碰撞时必须具有合适的取向
有
效
碰
撞
能够发生化学反应的碰撞
有较高的能量
有合适的取向
碰撞频率越高,反应速率越快
普通分子
无效碰撞
能量低
活化分子
有效碰撞
取向不合适
获得
能量
取向合适
小结
一个反应要发生一般要经历哪些过程?
动脑时间
普通
分子
得到
能量
活化
分子
合理
取向的
碰撞
有效
碰撞
新物质
释放
能量
活化能
练习:下列说法正确的是
A、一定条件下,增大反应物的量会加快化学反应速率。
B、增大压强,肯定会加快化学反应速率。
C、活化分子间所发生的碰撞为有效碰撞。
D、能够发生有效碰撞的分子叫活化分子。
√
练习.下列说法不正确的是( )
A.能量较高、有可能发生有效碰撞的分子称为活化分子
B.活化分子的平均能量与所有分子的平均能量之差称为活化能
C.催化剂能参与反应,可降低原反应所需活化能
D.非活化分子也有可能发生有效碰撞
D
二、活化分子、有效碰撞与反应速率的关系
1、浓度对反应速率的影响
浓度增大
单位体积内分子总数↑
活化分子数↑
活化分子百分数不变
单位时间内有效碰撞次数↑
v↑
普通分子
活化分子
2、压强对反应速率的影响
有气体参加的反应
①范围
②方法
压强问题
浓度问题
思考:请用有效碰撞理论解释压强对反应速率的影响。
I、恒温,缩小体积
反应物物质的量不变
浓度c↑
体积减小
压强增大
单位体积内分子总数↑
活化分子数↑
活化分子百分数不变
单位时间内有效碰撞次数↑
v↑
II、恒温,体积不变(恒温恒容)条件下,充入反应气体
充入反应气
恒温恒容充反应气
体积不变
浓度c变↑
反应物物质的量变大
单位体积内分子总数↑
活化分子数↑
活化分子百分数不变
单位时间内有效碰撞次数↑
v↑
III、恒温,体积不变(恒温恒容)条件下,充入惰性气体
充入惰气
恒温恒容冲入惰气
体积不变
浓度c不变
反应物物质的量不变
反应速率v不变
惰性气体
普通分子
活化分子
Ⅳ、恒温,体积可变(恒温恒压)条件下,充入惰性气体
充入惰气
恒温恒压充惰性气体
体积变大
浓度c变↓
反应物物质的量不变
惰性气体
普通分子
活化分子
单位体积内分子总数不变
活化分子数不变
活化分子百分数变小
单位时间内有效碰撞次数↓
v↓
升高温度
单位体积内分子总数不变,
活化分子数↑
活化分子百分数↑
单位时间内有效碰撞次数↑
v↑
3、温度对反应速率的影响
升高温度
分子运动加快,碰撞频率提高
催化剂可以改变反应历程,降低反应的活化能,但不能改变反应的热效应。
4、催化剂对反应速率的影响
加催化剂
单位体积内分子总数不变,
活化分子数↑
活化分子百分数↑
单位时间内有效碰撞次数↑
v↑
降低活化能
练习:
1.增大反应物的浓度使反应速率加快的主要原因( )
2.对于气体参与体系增大压强使反应速率加快的主要
原因是( )
3.升高温度使反应速率加快的主要原因是( )
4.使用催化剂使反应速率加快的主要原因是( )
A.活化分子百分数不变,但提高单位体积内活化分子的总数
B.增大分子的运动速率而使有效碰撞增加
C.升高反应物分子的能量,使活化分子的百分数增加
D.降低反应所需的能量,使活化分子百分数增加
A
A
C
D
练习:下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大浓度 B、增大压强
C、升高温度 D、使用催化剂
D
【2014·全国高考真题】已知分解1mol H2O2 放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2+I-→H2O+IO- 慢,
H2O2+IO-→H2O+O2+I- 快;
下列有关反应的说法正确的是( )A.反应的速率与I-的浓度有关 B.IO-也是该反应的催化剂C.反应活化能等于98kJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
A
外界因素 活化能 分子总数 活化分子总数 活化分子百分数 单位体积活化分子百分数 有效碰撞次数 反应速率
增大浓度
压缩体积
升高温度
加催化剂
小结:影响化学反应速率的外因
不变 增多 增多 不变 增多 增多 加快
不变 不变 不变 不变 增多 增多 加快
不变 不变 增多 增多 增多 增多 加快
降低 不变 增多 增多 增多 增多 加快
