2012-2013化学苏教版选修3学习方略课件:专题3 阶段复习课
文档属性
| 名称 | 2012-2013化学苏教版选修3学习方略课件:专题3 阶段复习课 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-03-27 22:13:41 | ||
图片预览








文档简介
课件61张PPT。专题3 阶段复习课 一、共价键和分子间作用力
1.共价键
(1)本质:原子之间形成的共用电子对。
(2)特征:共价键具有方向性和饱和性。
(3)类型。①σ键以形成化学键的两原子核的连线为轴作旋转操
作,共价键电子云的图形不变,这种特征称为
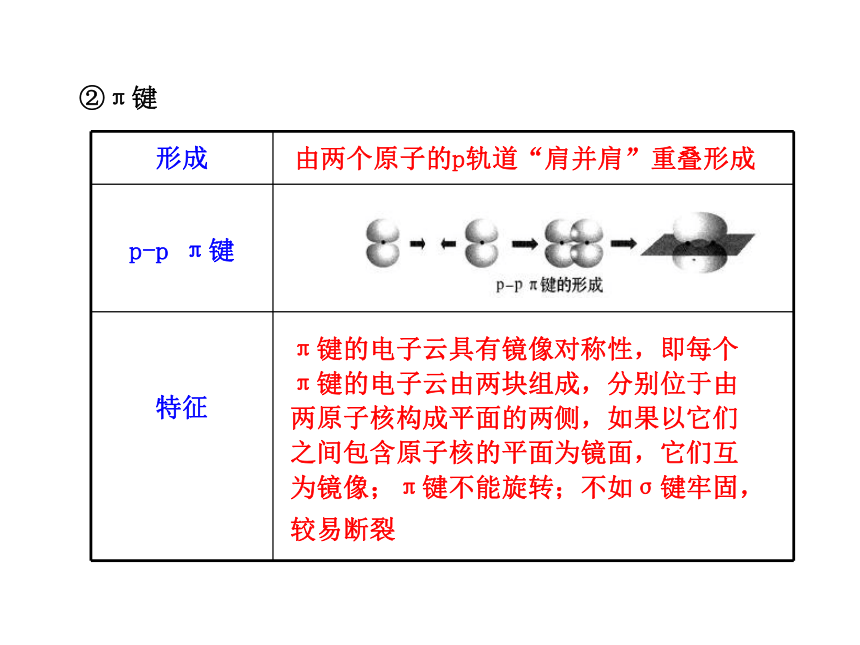
轴对称。σ键的强度大 成键原子的s轨道或p轨道“头碰头”重叠而形成②π键 由两个原子的p轨道“肩并肩”重叠形成π键的电子云具有镜像对称性,即每个
π键的电子云由两块组成,分别位于由
两原子核构成平面的两侧,如果以它们
之间包含原子核的平面为镜面,它们互
为镜像;π键不能旋转;不如σ键牢固,
较易断裂 (4)存在。
共价单键——σ键(如H—Cl、H—H、Cl—Cl等)
共价双键——1个σ键、1个π键(C=C双键、C=O双键)
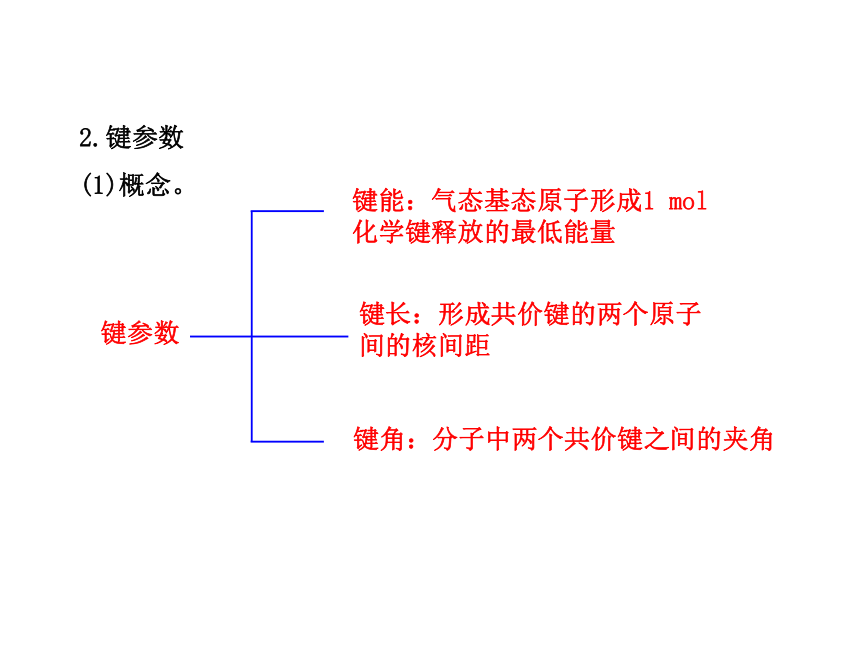
共价三键——1个σ键、2个π键(C C三键、N N三键)2.键参数
(1)概念。键参数键能:气态基态原子形成1 mol
化学键释放的最低能量键长:形成共价键的两个原子
间的核间距键角:分子中两个共价键之间的夹角(2)键参数对分子性质的影响。
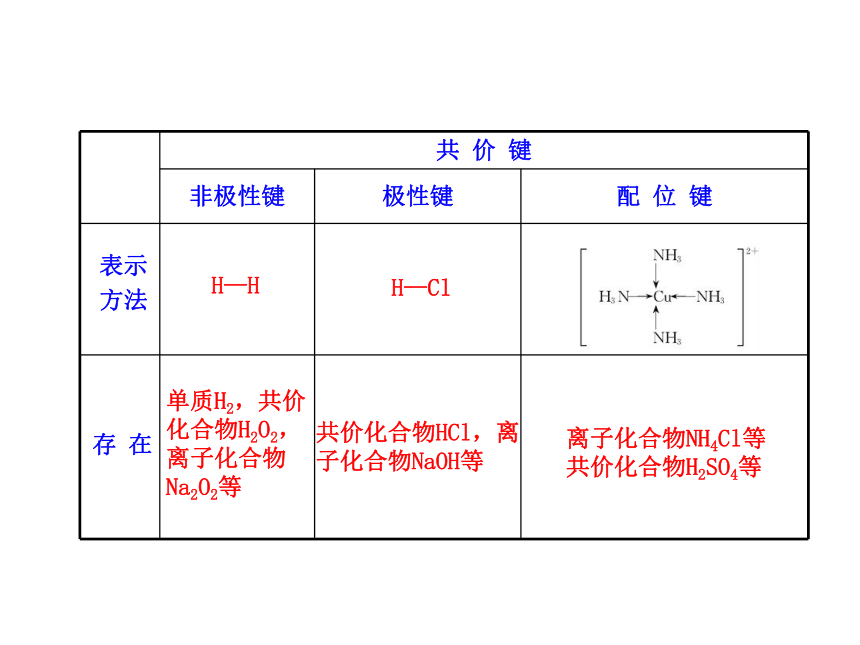
键能越大,键长越短,分子越稳定。3.配位键与极性键、非极性键的比较本 质成键
条件
(元素
种类)特 征相邻原子间通过共用电子对(电子云的重叠)所形成的相互作用 成键原子得、
失电子能力
相同(同种非
金属) 成键原子得、失
电子能力差别较
小(一般指不同种
非金属)成键原子一方有孤电子对
(配位体),另一方有空轨
道(中心离子)有方向性和饱和性表示
方法存 在H—H H—Cl单质H2,共价
化合物H2O2,
离子化合物
Na2O2等 共价化合物HCl,离
子化合物NaOH等 离子化合物NH4Cl等
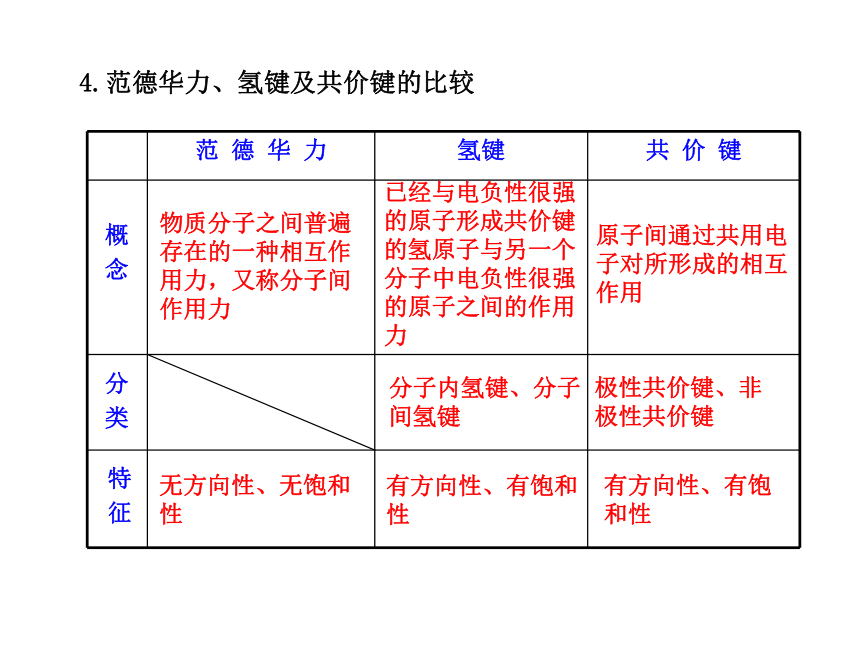
共价化合物H2SO4等4.范德华力、氢键及共价键的比较 概
念物质分子之间普遍
存在的一种相互作
用力,又称分子间
作用力 已经与电负性很强
的原子形成共价键
的氢原子与另一个
分子中电负性很强
的原子之间的作用
力 原子间通过共用电
子对所形成的相互
作用 分
类 分子内氢键、分子
间氢键极性共价键、非
极性共价键 特
征无方向性、无饱和
性有方向性、有饱和
性 有方向性、有饱
和性 作用
微粒分子或原子(稀有气
体) 氢原子、电负
性很强的原子原 子强度
比较共价键>氢键>范德华力影响
强度
的因
素①随着分子极性和相
对分子质量的增大而
增大
②组成和结构相似的
物质,相对分子质量
越大,分子间作用力
越大 A—H……B—,
A、B的电负
性越大,B原
子的半径越小,
作用力越大 成键原子半
径越小,键
长越短,键
能越大,共
价键越稳定对物质性
质的影响①影响物质的熔沸
点、溶解度等物理
性质
②组成和结构相似
的物质,随相对分
子质量的增大,物
质的熔沸点升高,
如F2CF4存在,使物质
的熔沸点升
高,在水中的
溶解度增大,
如熔沸点:
H2O>H2S,
HF>HCl,
NH3>PH3①影响分子的
稳定性
②共价键键能
越大,分子稳
定性越强 二、晶体
1.金属晶体
(1)“金属键理论”解释金属的性质。
①延展性:当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但排列方式不变,金属原子与自由电子形成的化学键没有被破坏,所以金属有良好的延展性。
②导电性:在外加电场的作用下,金属晶体中的电子做定向移动而形成电流,呈现良好的导电性。
③导热性:电子在运动时经常与金属原子碰撞,从而引起两者能量的交换。金
属
晶
体简单立
方堆积体心立
方堆积六方最
密堆积 面心立方
最密堆积典型代表Po,空间利
用率52%,配位数为6典型代表Na、K、Fe,
空间利用率68%,配位
数为8 典型代表Mg、Zn、Ti,
空间利用率74%,配位
数为12 典型代表Cu、Ag、
Au,空间利用率74%,
配位数为12 (2)金属晶体的原子堆积模型。2.离子晶体
(1)决定晶体结构的因素。(2)典型离子晶体的结构特点。(3)晶格能。
(4)性质。
熔、沸点较高,硬度较大,难溶于有机溶剂。定义 分子间通过分子间
作用力结合形成的
晶体 相邻原子间以共价键
结合而形成的具有空
间立体网状结构的晶
体 组成微粒 分 子原 子 物质类别多数的非金属单质
和共价化合物等金刚石、晶体硅、碳
化硅、二氧化硅等少
数非金属单质及共价
化合物等 微粒间
的作用力 分子间作用力(氢键、
范德华力)共价键(极性键、非
极性键) 3.原子晶体与分子晶体的比较熔化时需克
服的作用力较弱的分子间作用力很强的共价键 物
理
性
质熔、沸点较低 很高硬 度较小很大导电性固态和熔化时都不导电,
但某些分子晶体溶于水能
导电,如HCl固态和熔化时都不
导电 溶解性相似相溶难溶于一般溶剂决定熔、沸点
高低的因素分子间作用力的强弱共价键的强弱4.常见晶胞分析
(1)干冰。
①每个晶胞中有4个CO2分子,12个原子。
②每个CO2分子周围等距离紧邻的CO2分子有12个。(2)冰。
①水分子之间的作用力有范德华力,但主要作用力是氢键。
②由于氢键的存在迫使在四面体中心的每个水分子与四面体顶点的4个相邻的水分子相互吸引。(3)金刚石。
①在晶体中每个碳原子以4个共价单键对称地与相邻的4个碳原子相结合,形成正四面体结构。
②晶体中C—C—C夹角为109.5°,碳原子采取了sp3杂化。
③最小环上有6个碳原子。
④晶体中C原子个数与C—C键数之比为1∶(4× )=1∶2。(4)二氧化硅。
①在晶体中每个硅原子和4个氧原子形成4个共价键;每个氧原子与2个硅原子相结合。故SiO2晶体中硅原子与氧原子按1∶2的比例组成。
②最小环上有12个原子。5.晶胞中粒子数目的计算方法①′②′③′④′⑤′⑥′⑦′④′⑤′⑨′⑧′?′⑤⑩′?′?′⑤′① ②③④⑤⑥⑦⑧⑦⑩??⑨????【备选答案】
①共用电子对 ②方向性 ③饱和性 ④头碰头
⑤肩并肩 ⑥σ ⑦稳定 ⑧A→B ⑨金属离子 ⑩金属离子、自由电子 ?无饱和性、无方向性 ?越强
?阴、阳离子 ①′原子 ②′共价键
③′越短 ④′越大 ⑤′越高 ⑥′分子
⑦′范德华力 ⑧′离子键 ⑨′阳离子和阴离子
⑩′金属阳离子和自由电子 ? ′金属键 ? ′越小【热点一】 判断晶体类型的方法
1.依据组成晶体的微粒和微粒间的作用判断
形成离子晶体的微粒是阴、阳离子,微粒间的作用是离子键;形成原子晶体的微粒是原子,微粒间的作用是共价键;形成分子晶体的微粒是分子,微粒间的作用为分子间作用力;形成金属晶体的微粒是金属阳离子和自由电子,微粒间的作用是金属键。2.依据物质的分类判断
活泼金属氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体。大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)是分子晶体。常见的原子晶体单质有金刚石、晶体硅、晶体硼等;常见的原子晶体化合物有碳化硅、二氧化硅等。金属单质(除汞外)与合金是金属晶体。3.依据晶体的熔点判断
离子晶体的熔点较高,一般在数百至1 000 ℃以上。原子晶体熔点高,一般在1 000 ℃至几千度。分子晶体熔点较低,一般在数百度以下至很低温度。金属晶体多数熔点高,但也有相当低的。
4.依据导电性判断
离子晶体水溶液及熔化时能导电。原子晶体一般为非导体。分子晶体为非导体。而分子晶体中的电解质(主要是酸和强非金属氢化物)溶于水,使分子内的化学键断裂形成自由离子也能导电。金属晶体是电的良导体。5.依据硬度和机械性能判断
离子晶体硬度较大或略硬而脆。原子晶体硬度大。分子晶体硬度小且较脆。金属晶体多数硬度大。但也有较小的,且具有延展性。【典例1】下列关于金属铯和氯化铯的说法中,正确的是
( )
A.熔化时克服的化学键类型相同
B.氯离子和铯离子的L层的电子能量一定相同
C.氯化铯是离子化合物,一定不会有单个的CsCl分子存在
D.金属铯和氯化铯晶体中均含有铯离子
【解析】选D。本题考查晶体的结构和性质。熔化时金属铯克服的是金属键,氯化铯克服的是离子键,A错;Cl-与Cs+的核电荷数不同,L层的电子能量不同,B错;当氯化铯为气态时,可存在单个的CsCl分子,C错。【典例2】三聚氰胺是一种白色粉末状固体,微溶于水,易溶于甲醇、甲醛等有机溶剂,熔点为345 ℃,若快速加热至
300 ℃可升华。据此判断三聚氰胺属于( )
A.分子晶体 B.原子晶体
C.离子晶体 D.金属晶体
【解析】选A。熔点低、易升华是分子晶体的特征。【热点二】 晶体熔沸点比较规律
1.在相同条件下,呈不同状态的物质的熔、沸点规律是:固体>液体>气体。
例如:NaBr(固)>Br2>HBr(气)。2.不同类型晶体的比较规律
一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶
体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的强弱差别较大,因而金属晶体熔、沸点有的很高
(如W),有的很低(如Hg)。3.同种类型晶体的比较规律
(1)原子晶体:熔、沸点的高低取决于共价键的键长和键能,键长越短,键能越大,共价键越稳定,物质熔、沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C碳化硅>晶体硅。
(2)离子晶体:熔、沸点的高低,取决于离子键的强弱。一般来说,离子半径越小,离子所带电荷越多,离子键就越强,熔、沸点就越高,反之越低。
例如:MgO>CaO,NaF>NaCl>NaBr>NaI,CaO>KCl。(3)金属晶体:金属晶体中金属阳离子所带电荷越多,半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔、沸点越高,反之越低。如:Na<Mg<Al,Li>Na>K。
合金的熔、沸点一般说比它各组分纯金属的熔沸点低。如铝硅合金<纯铝(或纯硅)。
(4)分子晶体:熔、沸点的高低,取决于分子间作用力的大小。分子晶体分子间作用力越大物质的熔沸点越高,反之越低。(含有氢键的分子晶体,熔沸点反常的高)
如:H2O>H2Te>H2Se>H2S,C2H5OH>CH3—O—CH3。 ①组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。
如:CH4<SiH4<GeH4<SnH4。
②组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高。
如熔沸点CO>N2,CH3OH>CH3—CH3。
③在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。
如:C17H35COOH >C17H33COOH;
硬脂酸 油酸④烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔沸点升高。
如:C2H6>CH4,C2H5Cl>CH3Cl,CH3COOH>HCOOH。
⑤同分异构体:链烃及其衍生物的同分异构体随着支链增多,熔沸点降低。
如:CH3(CH2)3CH3>CH3CH2CH(CH3)2>(CH3)4C。
芳香烃的异构体有两个取代基时,熔点按对、邻、间位降低。(沸点按邻、间、对位降低)【典例3】碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是( )
A.①③② B.②③①
C.③①② D.②①③【解析】选A。由于题给的三种物质都属于原子晶体,而且结构相似都是正四面体形的空间网状结构,所以晶体的熔点由微粒间的共价键强弱决定,这里共价键强弱主要由键长决定,可近似地看作是成键原子的半径之和,由于硅的原子半径大于碳原子,所以键的强弱顺序为C—C>C—Si> Si—Si,熔点由高到低的顺序为金刚石>碳化硅>晶体硅。【典例4】现有几组物质的熔点(℃)数据:据此回答下列问题:
(1)A组属于_______晶体,其熔化时克服的微粒间的作用力是_________。
(2)B组晶体共同的物理性质是_________(填序号)。
①有金属光泽 ②导电性
③导热性 ④延展性
(3)C组中HF熔点反常是由于_________________________。(4)D组晶体可能具有的性质是___________(填序号)。
①硬度小 ②水溶液能导电
③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为:NaCl>KCl>RbCl>CsCl,其原因为_____________________________________
_________________________________________________。【解析】通过读取表格中数据先判断出晶体的类型及晶体的性质,应用氢键解释HF的熔点反常的原因,利用晶格能的大小解释离子晶体熔点高低的原因。
答案:(1)原子 共价键 (2)①②③④
(3)HF分子间能形成氢键,其熔化时需要消耗的能量更多(只要答出HF分子间能形成氢键即可)
(4)②④
(5)D组晶体都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高【热点三】 晶体中粒子数的计算
“均摊法”的基本思想是:晶胞中任意位置上的一个粒子被n个晶胞共用,那么每个晶胞对这个原子分得的份额就是
。1.立方晶胞
(1)每个顶点上的粒子被8个晶胞共用,每个粒子只有 属
于该晶胞。
(2)每条棱上的粒子被4个晶胞共用,每个粒子只有 属于
该晶胞。
(3)每个面心上的粒子被2个晶胞共用,每个粒子只有 属
于该晶胞。
(4)晶胞内的粒子完全属于该晶胞。2.六方晶胞
(1)每个顶点上的粒子被6个晶胞共用。
(2)每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被3个晶胞共用。
(3)每个面心上的粒子被2个晶胞共用。
(4)晶胞内的粒子完全属于该晶胞。3.三棱晶胞
(1)每个顶点上的粒子被12个晶胞共用。
(2)每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被6个晶胞共用。
(3)每个面心上的粒子被2个晶胞共用。
(4)晶胞内的粒子完全属于该晶胞。【典例5】下图为四种离子晶体的空间结构,若以M代表阳离子,N代表阴离子,试写出A、B、C、D的化学式。【解析】题中所给空间结构都可以看成该晶体结构中最小的结构重复单元,四种晶体的晶胞均为立方晶胞。
A:平均含阳离子数目为 ×4= ,阴离子为 ×4= ,阳离子与阴离子个数比为1∶1,故A的化学式为MN。
B:平均含阳离子数目为 ×8+1=2,阴离子为 ×6=3,阳离子与阴离子个数比为2∶3,故B的化学式为M2N3。
C:平均含阳离子数目为 ×4= ,阴离子为1,阳离子与阴离子个数比为1∶2,故C的化学式为MN2。
D:平均含阳离子数目为 ×8=1,阴离子为1,阳离子与阴离子个数比为1∶1,故D的化学式为MN。
答案:A:MN B:M2N3 C:MN2 D:MN【典例6】某离子晶体晶胞的结构如图所示。
X( )位于立方体顶点,Y( )位于立方体中心。试分析:
(1)晶体的化学式为____________________。
(2)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是___
__________。【解析】(1)采用均摊法,X的个数=4×1/8=1/2,Y在立方体内,个数是1个。X与Y的个数比是1∶2。
(2)若将4个X连接,构成1个正四面体,Y位于正四面体的中心,可联系CH4的键角,知∠XYX=109.5°。
答案:(1)XY2或Y2X (2)109.5°
1.共价键
(1)本质:原子之间形成的共用电子对。
(2)特征:共价键具有方向性和饱和性。
(3)类型。①σ键以形成化学键的两原子核的连线为轴作旋转操
作,共价键电子云的图形不变,这种特征称为
轴对称。σ键的强度大 成键原子的s轨道或p轨道“头碰头”重叠而形成②π键 由两个原子的p轨道“肩并肩”重叠形成π键的电子云具有镜像对称性,即每个
π键的电子云由两块组成,分别位于由
两原子核构成平面的两侧,如果以它们
之间包含原子核的平面为镜面,它们互
为镜像;π键不能旋转;不如σ键牢固,
较易断裂 (4)存在。
共价单键——σ键(如H—Cl、H—H、Cl—Cl等)
共价双键——1个σ键、1个π键(C=C双键、C=O双键)
共价三键——1个σ键、2个π键(C C三键、N N三键)2.键参数
(1)概念。键参数键能:气态基态原子形成1 mol
化学键释放的最低能量键长:形成共价键的两个原子
间的核间距键角:分子中两个共价键之间的夹角(2)键参数对分子性质的影响。
键能越大,键长越短,分子越稳定。3.配位键与极性键、非极性键的比较本 质成键
条件
(元素
种类)特 征相邻原子间通过共用电子对(电子云的重叠)所形成的相互作用 成键原子得、
失电子能力
相同(同种非
金属) 成键原子得、失
电子能力差别较
小(一般指不同种
非金属)成键原子一方有孤电子对
(配位体),另一方有空轨
道(中心离子)有方向性和饱和性表示
方法存 在H—H H—Cl单质H2,共价
化合物H2O2,
离子化合物
Na2O2等 共价化合物HCl,离
子化合物NaOH等 离子化合物NH4Cl等
共价化合物H2SO4等4.范德华力、氢键及共价键的比较 概
念物质分子之间普遍
存在的一种相互作
用力,又称分子间
作用力 已经与电负性很强
的原子形成共价键
的氢原子与另一个
分子中电负性很强
的原子之间的作用
力 原子间通过共用电
子对所形成的相互
作用 分
类 分子内氢键、分子
间氢键极性共价键、非
极性共价键 特
征无方向性、无饱和
性有方向性、有饱和
性 有方向性、有饱
和性 作用
微粒分子或原子(稀有气
体) 氢原子、电负
性很强的原子原 子强度
比较共价键>氢键>范德华力影响
强度
的因
素①随着分子极性和相
对分子质量的增大而
增大
②组成和结构相似的
物质,相对分子质量
越大,分子间作用力
越大 A—H……B—,
A、B的电负
性越大,B原
子的半径越小,
作用力越大 成键原子半
径越小,键
长越短,键
能越大,共
价键越稳定对物质性
质的影响①影响物质的熔沸
点、溶解度等物理
性质
②组成和结构相似
的物质,随相对分
子质量的增大,物
质的熔沸点升高,
如F2
的熔沸点升
高,在水中的
溶解度增大,
如熔沸点:
H2O>H2S,
HF>HCl,
NH3>PH3①影响分子的
稳定性
②共价键键能
越大,分子稳
定性越强 二、晶体
1.金属晶体
(1)“金属键理论”解释金属的性质。
①延展性:当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但排列方式不变,金属原子与自由电子形成的化学键没有被破坏,所以金属有良好的延展性。
②导电性:在外加电场的作用下,金属晶体中的电子做定向移动而形成电流,呈现良好的导电性。
③导热性:电子在运动时经常与金属原子碰撞,从而引起两者能量的交换。金
属
晶
体简单立
方堆积体心立
方堆积六方最
密堆积 面心立方
最密堆积典型代表Po,空间利
用率52%,配位数为6典型代表Na、K、Fe,
空间利用率68%,配位
数为8 典型代表Mg、Zn、Ti,
空间利用率74%,配位
数为12 典型代表Cu、Ag、
Au,空间利用率74%,
配位数为12 (2)金属晶体的原子堆积模型。2.离子晶体
(1)决定晶体结构的因素。(2)典型离子晶体的结构特点。(3)晶格能。
(4)性质。
熔、沸点较高,硬度较大,难溶于有机溶剂。定义 分子间通过分子间
作用力结合形成的
晶体 相邻原子间以共价键
结合而形成的具有空
间立体网状结构的晶
体 组成微粒 分 子原 子 物质类别多数的非金属单质
和共价化合物等金刚石、晶体硅、碳
化硅、二氧化硅等少
数非金属单质及共价
化合物等 微粒间
的作用力 分子间作用力(氢键、
范德华力)共价键(极性键、非
极性键) 3.原子晶体与分子晶体的比较熔化时需克
服的作用力较弱的分子间作用力很强的共价键 物
理
性
质熔、沸点较低 很高硬 度较小很大导电性固态和熔化时都不导电,
但某些分子晶体溶于水能
导电,如HCl固态和熔化时都不
导电 溶解性相似相溶难溶于一般溶剂决定熔、沸点
高低的因素分子间作用力的强弱共价键的强弱4.常见晶胞分析
(1)干冰。
①每个晶胞中有4个CO2分子,12个原子。
②每个CO2分子周围等距离紧邻的CO2分子有12个。(2)冰。
①水分子之间的作用力有范德华力,但主要作用力是氢键。
②由于氢键的存在迫使在四面体中心的每个水分子与四面体顶点的4个相邻的水分子相互吸引。(3)金刚石。
①在晶体中每个碳原子以4个共价单键对称地与相邻的4个碳原子相结合,形成正四面体结构。
②晶体中C—C—C夹角为109.5°,碳原子采取了sp3杂化。
③最小环上有6个碳原子。
④晶体中C原子个数与C—C键数之比为1∶(4× )=1∶2。(4)二氧化硅。
①在晶体中每个硅原子和4个氧原子形成4个共价键;每个氧原子与2个硅原子相结合。故SiO2晶体中硅原子与氧原子按1∶2的比例组成。
②最小环上有12个原子。5.晶胞中粒子数目的计算方法①′②′③′④′⑤′⑥′⑦′④′⑤′⑨′⑧′?′⑤⑩′?′?′⑤′① ②③④⑤⑥⑦⑧⑦⑩??⑨????【备选答案】
①共用电子对 ②方向性 ③饱和性 ④头碰头
⑤肩并肩 ⑥σ ⑦稳定 ⑧A→B ⑨金属离子 ⑩金属离子、自由电子 ?无饱和性、无方向性 ?越强
?阴、阳离子 ①′原子 ②′共价键
③′越短 ④′越大 ⑤′越高 ⑥′分子
⑦′范德华力 ⑧′离子键 ⑨′阳离子和阴离子
⑩′金属阳离子和自由电子 ? ′金属键 ? ′越小【热点一】 判断晶体类型的方法
1.依据组成晶体的微粒和微粒间的作用判断
形成离子晶体的微粒是阴、阳离子,微粒间的作用是离子键;形成原子晶体的微粒是原子,微粒间的作用是共价键;形成分子晶体的微粒是分子,微粒间的作用为分子间作用力;形成金属晶体的微粒是金属阳离子和自由电子,微粒间的作用是金属键。2.依据物质的分类判断
活泼金属氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体。大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)是分子晶体。常见的原子晶体单质有金刚石、晶体硅、晶体硼等;常见的原子晶体化合物有碳化硅、二氧化硅等。金属单质(除汞外)与合金是金属晶体。3.依据晶体的熔点判断
离子晶体的熔点较高,一般在数百至1 000 ℃以上。原子晶体熔点高,一般在1 000 ℃至几千度。分子晶体熔点较低,一般在数百度以下至很低温度。金属晶体多数熔点高,但也有相当低的。
4.依据导电性判断
离子晶体水溶液及熔化时能导电。原子晶体一般为非导体。分子晶体为非导体。而分子晶体中的电解质(主要是酸和强非金属氢化物)溶于水,使分子内的化学键断裂形成自由离子也能导电。金属晶体是电的良导体。5.依据硬度和机械性能判断
离子晶体硬度较大或略硬而脆。原子晶体硬度大。分子晶体硬度小且较脆。金属晶体多数硬度大。但也有较小的,且具有延展性。【典例1】下列关于金属铯和氯化铯的说法中,正确的是
( )
A.熔化时克服的化学键类型相同
B.氯离子和铯离子的L层的电子能量一定相同
C.氯化铯是离子化合物,一定不会有单个的CsCl分子存在
D.金属铯和氯化铯晶体中均含有铯离子
【解析】选D。本题考查晶体的结构和性质。熔化时金属铯克服的是金属键,氯化铯克服的是离子键,A错;Cl-与Cs+的核电荷数不同,L层的电子能量不同,B错;当氯化铯为气态时,可存在单个的CsCl分子,C错。【典例2】三聚氰胺是一种白色粉末状固体,微溶于水,易溶于甲醇、甲醛等有机溶剂,熔点为345 ℃,若快速加热至
300 ℃可升华。据此判断三聚氰胺属于( )
A.分子晶体 B.原子晶体
C.离子晶体 D.金属晶体
【解析】选A。熔点低、易升华是分子晶体的特征。【热点二】 晶体熔沸点比较规律
1.在相同条件下,呈不同状态的物质的熔、沸点规律是:固体>液体>气体。
例如:NaBr(固)>Br2>HBr(气)。2.不同类型晶体的比较规律
一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶
体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的强弱差别较大,因而金属晶体熔、沸点有的很高
(如W),有的很低(如Hg)。3.同种类型晶体的比较规律
(1)原子晶体:熔、沸点的高低取决于共价键的键长和键能,键长越短,键能越大,共价键越稳定,物质熔、沸点越高,反之越低。如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C
(2)离子晶体:熔、沸点的高低,取决于离子键的强弱。一般来说,离子半径越小,离子所带电荷越多,离子键就越强,熔、沸点就越高,反之越低。
例如:MgO>CaO,NaF>NaCl>NaBr>NaI,CaO>KCl。(3)金属晶体:金属晶体中金属阳离子所带电荷越多,半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔、沸点越高,反之越低。如:Na<Mg<Al,Li>Na>K。
合金的熔、沸点一般说比它各组分纯金属的熔沸点低。如铝硅合金<纯铝(或纯硅)。
(4)分子晶体:熔、沸点的高低,取决于分子间作用力的大小。分子晶体分子间作用力越大物质的熔沸点越高,反之越低。(含有氢键的分子晶体,熔沸点反常的高)
如:H2O>H2Te>H2Se>H2S,C2H5OH>CH3—O—CH3。 ①组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。
如:CH4<SiH4<GeH4<SnH4。
②组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高。
如熔沸点CO>N2,CH3OH>CH3—CH3。
③在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。
如:C17H35COOH >C17H33COOH;
硬脂酸 油酸④烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔沸点升高。
如:C2H6>CH4,C2H5Cl>CH3Cl,CH3COOH>HCOOH。
⑤同分异构体:链烃及其衍生物的同分异构体随着支链增多,熔沸点降低。
如:CH3(CH2)3CH3>CH3CH2CH(CH3)2>(CH3)4C。
芳香烃的异构体有两个取代基时,熔点按对、邻、间位降低。(沸点按邻、间、对位降低)【典例3】碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是( )
A.①③② B.②③①
C.③①② D.②①③【解析】选A。由于题给的三种物质都属于原子晶体,而且结构相似都是正四面体形的空间网状结构,所以晶体的熔点由微粒间的共价键强弱决定,这里共价键强弱主要由键长决定,可近似地看作是成键原子的半径之和,由于硅的原子半径大于碳原子,所以键的强弱顺序为C—C>C—Si> Si—Si,熔点由高到低的顺序为金刚石>碳化硅>晶体硅。【典例4】现有几组物质的熔点(℃)数据:据此回答下列问题:
(1)A组属于_______晶体,其熔化时克服的微粒间的作用力是_________。
(2)B组晶体共同的物理性质是_________(填序号)。
①有金属光泽 ②导电性
③导热性 ④延展性
(3)C组中HF熔点反常是由于_________________________。(4)D组晶体可能具有的性质是___________(填序号)。
①硬度小 ②水溶液能导电
③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为:NaCl>KCl>RbCl>CsCl,其原因为_____________________________________
_________________________________________________。【解析】通过读取表格中数据先判断出晶体的类型及晶体的性质,应用氢键解释HF的熔点反常的原因,利用晶格能的大小解释离子晶体熔点高低的原因。
答案:(1)原子 共价键 (2)①②③④
(3)HF分子间能形成氢键,其熔化时需要消耗的能量更多(只要答出HF分子间能形成氢键即可)
(4)②④
(5)D组晶体都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高【热点三】 晶体中粒子数的计算
“均摊法”的基本思想是:晶胞中任意位置上的一个粒子被n个晶胞共用,那么每个晶胞对这个原子分得的份额就是
。1.立方晶胞
(1)每个顶点上的粒子被8个晶胞共用,每个粒子只有 属
于该晶胞。
(2)每条棱上的粒子被4个晶胞共用,每个粒子只有 属于
该晶胞。
(3)每个面心上的粒子被2个晶胞共用,每个粒子只有 属
于该晶胞。
(4)晶胞内的粒子完全属于该晶胞。2.六方晶胞
(1)每个顶点上的粒子被6个晶胞共用。
(2)每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被3个晶胞共用。
(3)每个面心上的粒子被2个晶胞共用。
(4)晶胞内的粒子完全属于该晶胞。3.三棱晶胞
(1)每个顶点上的粒子被12个晶胞共用。
(2)每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被6个晶胞共用。
(3)每个面心上的粒子被2个晶胞共用。
(4)晶胞内的粒子完全属于该晶胞。【典例5】下图为四种离子晶体的空间结构,若以M代表阳离子,N代表阴离子,试写出A、B、C、D的化学式。【解析】题中所给空间结构都可以看成该晶体结构中最小的结构重复单元,四种晶体的晶胞均为立方晶胞。
A:平均含阳离子数目为 ×4= ,阴离子为 ×4= ,阳离子与阴离子个数比为1∶1,故A的化学式为MN。
B:平均含阳离子数目为 ×8+1=2,阴离子为 ×6=3,阳离子与阴离子个数比为2∶3,故B的化学式为M2N3。
C:平均含阳离子数目为 ×4= ,阴离子为1,阳离子与阴离子个数比为1∶2,故C的化学式为MN2。
D:平均含阳离子数目为 ×8=1,阴离子为1,阳离子与阴离子个数比为1∶1,故D的化学式为MN。
答案:A:MN B:M2N3 C:MN2 D:MN【典例6】某离子晶体晶胞的结构如图所示。
X( )位于立方体顶点,Y( )位于立方体中心。试分析:
(1)晶体的化学式为____________________。
(2)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是___
__________。【解析】(1)采用均摊法,X的个数=4×1/8=1/2,Y在立方体内,个数是1个。X与Y的个数比是1∶2。
(2)若将4个X连接,构成1个正四面体,Y位于正四面体的中心,可联系CH4的键角,知∠XYX=109.5°。
答案:(1)XY2或Y2X (2)109.5°
