2012-2013化学苏教版选修3学习方略课件:专题4 阶段复习课
文档属性
| 名称 | 2012-2013化学苏教版选修3学习方略课件:专题4 阶段复习课 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-03-27 22:04:18 | ||
图片预览






文档简介
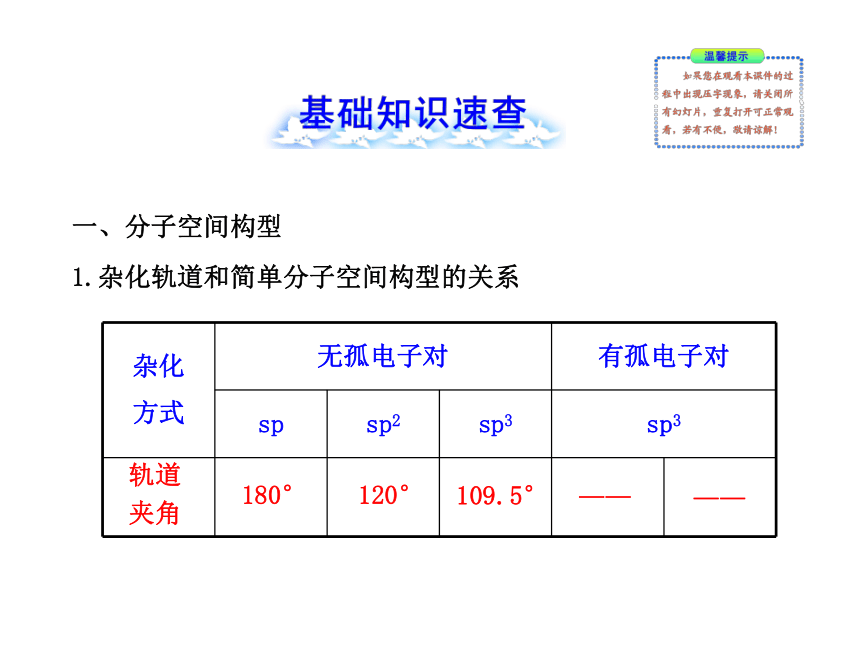
课件33张PPT。专题4 阶段复习课一、分子空间构型
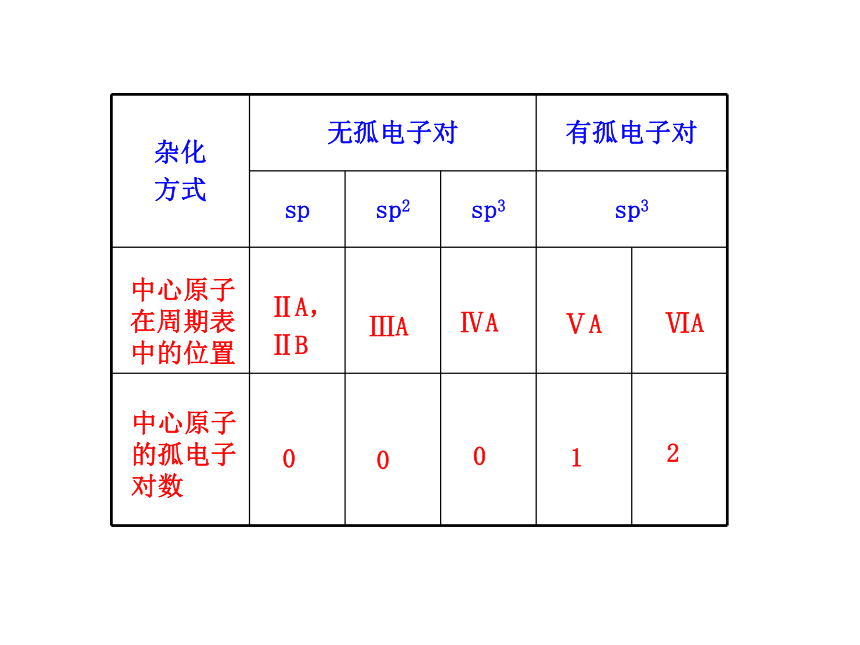
1.杂化轨道和简单分子空间构型的关系轨道
夹角180°120°109.5°————中心原子在周期表中的位置ⅡA,
ⅡBⅢAⅣAⅤAⅥA中心原子的孤电子对数00012分子立
体结构直线形平面三
角形正四面
体型三角
锥型V形实例BeCl2 ,
HgCl2BF3CH4 ,
SiCl4NH3 ,
PH3H2O ,
H2S2.确定杂化方式的两种简单方法
方法一:杂化轨道用来形成σ键和容纳孤电子对,所以有公式:
杂化轨道数=中心原子的孤电子对的对数+中心原子的σ键个数。
方法二:杂化轨道数=1/2(中心原子的价电子数+配位原子的成键电子数±电荷数)。说明:(1)当上述公式中电荷数为正值时取“-”,电荷数为负值时取“+”。
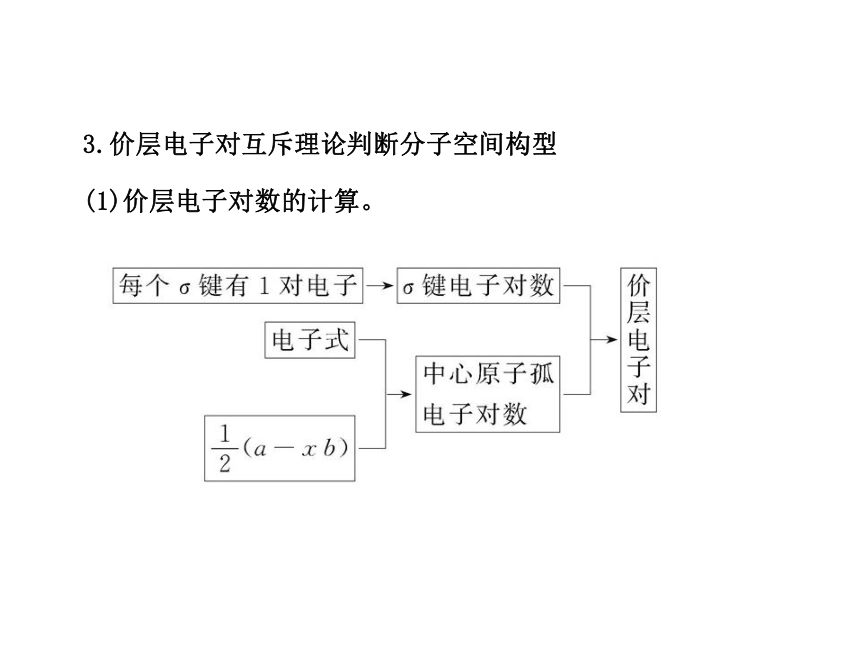
(2)当配位原子为氧原子或硫原子时,成键电子数为零。3.价层电子对互斥理论判断分子空间构型
(1)价层电子对数的计算。其中,①a表示中心原子的价电子数,a.对于主族元素,a=最外层电子数;b.对于阳离子,a=价电子数-离子电荷数;
c.对于阴离子,a=价电子数+|离子电荷数|。
②x表示与中心原子结合的原子数。
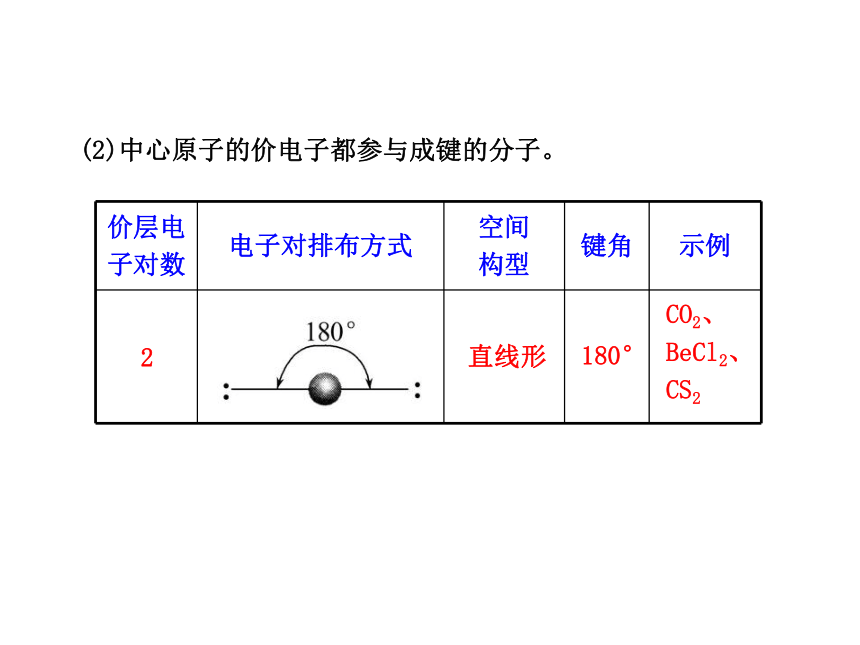
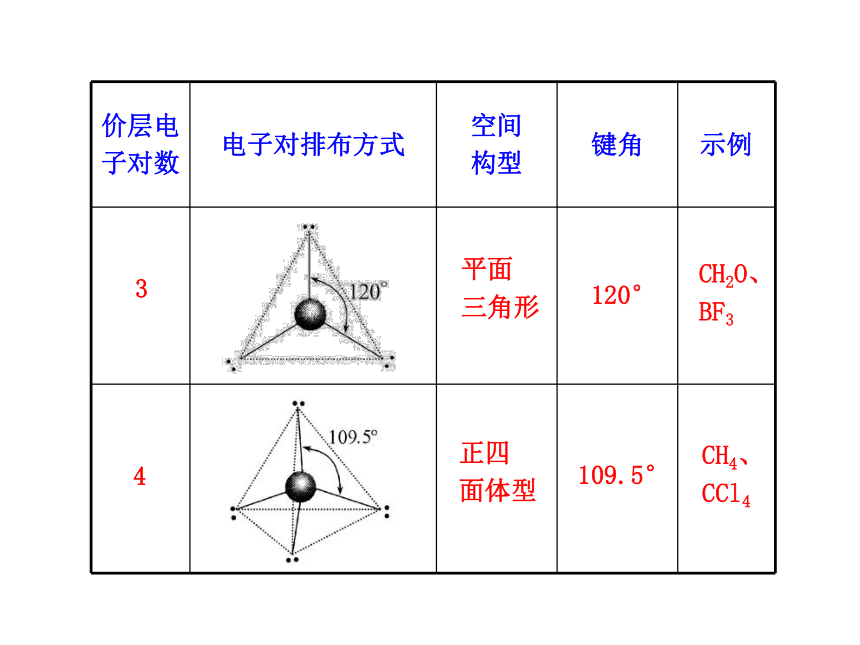
③b表示与中心原子结合的原子最多能接受的电子数,氢为1,其他原子=8-该原子的价电子数。(2)中心原子的价电子都参与成键的分子。 2直线形180°CO2、
BeCl2、
CS2 34平面
三角形120°CH2O、
BF3正四
面体型109.5°CH4、
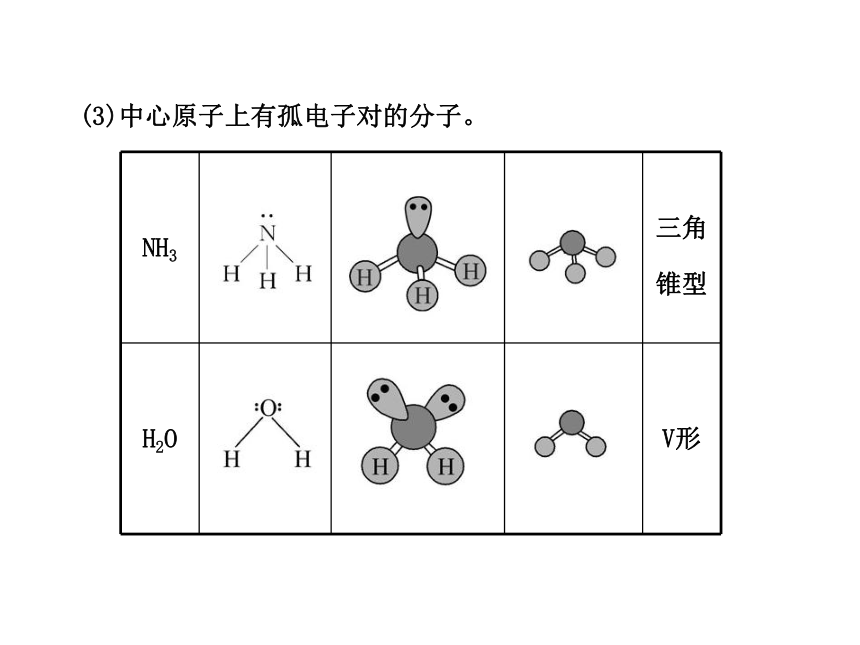
CCl4(3)中心原子上有孤电子对的分子。4.确定中心原子中价层电子对数的另一种方法
(1)确定中心原子价层电子对数。
①中心原子的价层电子对数=
中心原子的价电子数+配位原子提供的价电子数
当出现单电子时,单电子算一对,如 ≈5。
②作为配体,H提供1个电子,卤素原子提供1个电子。
③氧族元素原子作配位原子时,不提供电子,但氧族元素原子作中心原子时,价电子数为6。2__________________________________________92__。④负离子的价电子数=中心原子的价电子数+|所带负电荷数|。
正离子的价电子数=中心原子的价电子数-|所带正电荷数|。
例如:NO3-中N的价层电子对数= (5+1)=3;
NO2+中N的价层电子对数= (5-1)=2;
NH4+中N的价层电子对数= (5+4-1)=4。 (2)确定成键电子对和孤电子对的数目,并以此确定中心原子
价电子构型和分子的空间构型。例如CO2中C的价层电子对数
= =2,CO2中两个配位原子(O原子)通过2对电子与中心原子
C连接,所以CO2中无孤电子对,即CO2中中心原子的价电子构
型为直线形,分子也为直线形,即O=C=O。 5.价层电子对互斥理论、杂化轨道理论与分子空间构型的关系二、极性分子和非极性分子三、配合物 分子空间构型的判断方法
1.价层电子对互斥模型与分子构型
价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤电子对。当中心原子无孤电子对时,两者的构型一致;当中心原子有孤电子对时,两者的构型不一致。见表:电子
对数 成键电
子对数 孤电
子对数 电子对的
空间构型 分子的空
间构型 实例 直线形直线形三角形平面三角形 V形 BeCl2 BF3 SnBr2 23203012四面体型正四面体型三角锥型 NH3 V形 H2O 电子
对数 成键电
子对数 孤电
子对数 电子对的
空间构型 分子的空
间构型 实例 CH4 44320122.杂化轨道类型与分子构型
当原子成键时,原子的价层原子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间形状不同。对于ABm型分子,中心原子轨道杂化方式相同,但孤电子对数不同,分子构型也不同。见下表:实例 分子构型 孤电
子对数 分子
类型 中心原子轨
道杂化类型 AB4 AB2 AB3 直线形V形 V形 三角锥型 正四面体型平面三角形 sp3 sp sp2 sp3 sp2 sp3 BeCl2 SO2 BF3 NH3 CH4 H2O 022010【典例1】(2012·苏州高二检测)氨气分子空间构型是三角锥型,而甲烷是正四面体型,这是因为( )
A.两种分子的中心原子的杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道C.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥
作用较强
D.氨气分子是极性分子而甲烷是非极性分子
【解析】选C。NH3和CH4的中心原子都是sp3杂化,故A、B错误,
分子的空间构型跟分子的极性无关,故D错误。【典例2】有关原子杂化的说法正确的是( )
A.空间构型是正四面体的分子,中心原子都是以sp3杂化
B.苯分子中的碳原子以sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.乙烯分子的碳原子以sp2 杂化,其中, C-H之间是sp2形成的σ键,C-C之间除了以sp2 杂化轨道形成σ键外,未参与杂化的2p轨道形成π键
D.只要分子的中心原子的杂化类型相同,分子的键角就一定相同【解析】选C。A项,比如白磷分子虽然为正四面体型,但却不参与杂化;B项苯分子中的碳原子以sp2杂化,碳原子之间以sp2杂化轨道形成σ键,每个原子上的未杂化的2p轨道重叠形成π键;分子的中心原子的杂化类型相同,比如都是以sp3杂化的分子,由于中心原子上的孤电子对不同,对杂化轨道的排斥能力不同导致分子的键角不同。 键的极性与分子极性的关系
分子的极性由共价键的极性和分子的立体构型共同决定。
(1)只含非极性键的分子都是非极性分子。
单质分子即属此类,如H2、O2、P4、C60等。
(2)以极性键结合而形成的异核双原子分子都是极性分子。
即A-B型分子,如HCl、CO等均为极性分子。(3)以极性键结合而形成的多原子分子。
空间构型为中心对称的分子是非极性分子。
空间构型为非中心对称的分子是极性分子。
(4)共价键的极性与分子极性的关系可总结如下:【典例3】下列叙述中不正确的是( )
A.卤化氢分子中,由于H-X键为极性键,故HX分子也为极性分子
B.以极性键结合的分子不一定是极性分子
C.判断A2B或AB2型分子是极性分子必须具有极性键且分子不对称
D.非极性分子中,各原子间都应以非极性键结合【解析】选D。对于双原子分子,H-X一定为极性键,分子内正、负电荷重心不相重合,故为极性分子。以极性键结合的多原子分子不一定是极性分子,也可能是非极性分子,如CO2分子中,两个C=O键(极性键)是对称排列的,两键的极性互相抵消,所以CO2是非极性分子。A2B型如H2O、H2S等,AB2型如CO2、CS2等,判断其是否是极性分子的根据是必有极性键,且电荷分布不对称。CO2、CS2等多原子分子,其电荷分布对称,这样的非极性分子中可以含有极性键。故选D。
1.杂化轨道和简单分子空间构型的关系轨道
夹角180°120°109.5°————中心原子在周期表中的位置ⅡA,
ⅡBⅢAⅣAⅤAⅥA中心原子的孤电子对数00012分子立
体结构直线形平面三
角形正四面
体型三角
锥型V形实例BeCl2 ,
HgCl2BF3CH4 ,
SiCl4NH3 ,
PH3H2O ,
H2S2.确定杂化方式的两种简单方法
方法一:杂化轨道用来形成σ键和容纳孤电子对,所以有公式:
杂化轨道数=中心原子的孤电子对的对数+中心原子的σ键个数。
方法二:杂化轨道数=1/2(中心原子的价电子数+配位原子的成键电子数±电荷数)。说明:(1)当上述公式中电荷数为正值时取“-”,电荷数为负值时取“+”。
(2)当配位原子为氧原子或硫原子时,成键电子数为零。3.价层电子对互斥理论判断分子空间构型
(1)价层电子对数的计算。其中,①a表示中心原子的价电子数,a.对于主族元素,a=最外层电子数;b.对于阳离子,a=价电子数-离子电荷数;
c.对于阴离子,a=价电子数+|离子电荷数|。
②x表示与中心原子结合的原子数。
③b表示与中心原子结合的原子最多能接受的电子数,氢为1,其他原子=8-该原子的价电子数。(2)中心原子的价电子都参与成键的分子。 2直线形180°CO2、
BeCl2、
CS2 34平面
三角形120°CH2O、
BF3正四
面体型109.5°CH4、
CCl4(3)中心原子上有孤电子对的分子。4.确定中心原子中价层电子对数的另一种方法
(1)确定中心原子价层电子对数。
①中心原子的价层电子对数=
中心原子的价电子数+配位原子提供的价电子数
当出现单电子时,单电子算一对,如 ≈5。
②作为配体,H提供1个电子,卤素原子提供1个电子。
③氧族元素原子作配位原子时,不提供电子,但氧族元素原子作中心原子时,价电子数为6。2__________________________________________92__。④负离子的价电子数=中心原子的价电子数+|所带负电荷数|。
正离子的价电子数=中心原子的价电子数-|所带正电荷数|。
例如:NO3-中N的价层电子对数= (5+1)=3;
NO2+中N的价层电子对数= (5-1)=2;
NH4+中N的价层电子对数= (5+4-1)=4。 (2)确定成键电子对和孤电子对的数目,并以此确定中心原子
价电子构型和分子的空间构型。例如CO2中C的价层电子对数
= =2,CO2中两个配位原子(O原子)通过2对电子与中心原子
C连接,所以CO2中无孤电子对,即CO2中中心原子的价电子构
型为直线形,分子也为直线形,即O=C=O。 5.价层电子对互斥理论、杂化轨道理论与分子空间构型的关系二、极性分子和非极性分子三、配合物 分子空间构型的判断方法
1.价层电子对互斥模型与分子构型
价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤电子对。当中心原子无孤电子对时,两者的构型一致;当中心原子有孤电子对时,两者的构型不一致。见表:电子
对数 成键电
子对数 孤电
子对数 电子对的
空间构型 分子的空
间构型 实例 直线形直线形三角形平面三角形 V形 BeCl2 BF3 SnBr2 23203012四面体型正四面体型三角锥型 NH3 V形 H2O 电子
对数 成键电
子对数 孤电
子对数 电子对的
空间构型 分子的空
间构型 实例 CH4 44320122.杂化轨道类型与分子构型
当原子成键时,原子的价层原子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间形状不同。对于ABm型分子,中心原子轨道杂化方式相同,但孤电子对数不同,分子构型也不同。见下表:实例 分子构型 孤电
子对数 分子
类型 中心原子轨
道杂化类型 AB4 AB2 AB3 直线形V形 V形 三角锥型 正四面体型平面三角形 sp3 sp sp2 sp3 sp2 sp3 BeCl2 SO2 BF3 NH3 CH4 H2O 022010【典例1】(2012·苏州高二检测)氨气分子空间构型是三角锥型,而甲烷是正四面体型,这是因为( )
A.两种分子的中心原子的杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道C.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥
作用较强
D.氨气分子是极性分子而甲烷是非极性分子
【解析】选C。NH3和CH4的中心原子都是sp3杂化,故A、B错误,
分子的空间构型跟分子的极性无关,故D错误。【典例2】有关原子杂化的说法正确的是( )
A.空间构型是正四面体的分子,中心原子都是以sp3杂化
B.苯分子中的碳原子以sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.乙烯分子的碳原子以sp2 杂化,其中, C-H之间是sp2形成的σ键,C-C之间除了以sp2 杂化轨道形成σ键外,未参与杂化的2p轨道形成π键
D.只要分子的中心原子的杂化类型相同,分子的键角就一定相同【解析】选C。A项,比如白磷分子虽然为正四面体型,但却不参与杂化;B项苯分子中的碳原子以sp2杂化,碳原子之间以sp2杂化轨道形成σ键,每个原子上的未杂化的2p轨道重叠形成π键;分子的中心原子的杂化类型相同,比如都是以sp3杂化的分子,由于中心原子上的孤电子对不同,对杂化轨道的排斥能力不同导致分子的键角不同。 键的极性与分子极性的关系
分子的极性由共价键的极性和分子的立体构型共同决定。
(1)只含非极性键的分子都是非极性分子。
单质分子即属此类,如H2、O2、P4、C60等。
(2)以极性键结合而形成的异核双原子分子都是极性分子。
即A-B型分子,如HCl、CO等均为极性分子。(3)以极性键结合而形成的多原子分子。
空间构型为中心对称的分子是非极性分子。
空间构型为非中心对称的分子是极性分子。
(4)共价键的极性与分子极性的关系可总结如下:【典例3】下列叙述中不正确的是( )
A.卤化氢分子中,由于H-X键为极性键,故HX分子也为极性分子
B.以极性键结合的分子不一定是极性分子
C.判断A2B或AB2型分子是极性分子必须具有极性键且分子不对称
D.非极性分子中,各原子间都应以非极性键结合【解析】选D。对于双原子分子,H-X一定为极性键,分子内正、负电荷重心不相重合,故为极性分子。以极性键结合的多原子分子不一定是极性分子,也可能是非极性分子,如CO2分子中,两个C=O键(极性键)是对称排列的,两键的极性互相抵消,所以CO2是非极性分子。A2B型如H2O、H2S等,AB2型如CO2、CS2等,判断其是否是极性分子的根据是必有极性键,且电荷分布不对称。CO2、CS2等多原子分子,其电荷分布对称,这样的非极性分子中可以含有极性键。故选D。
