科粤版化学九年级下册:6.2金属的化学性质 习题(含解析)
文档属性
| 名称 | 科粤版化学九年级下册:6.2金属的化学性质 习题(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 230.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-20 00:00:00 | ||
图片预览

文档简介
6.2 金属的化学性质
一、单选题,共15小题
1.锌粉、铝粉、铁粉、镁粉的混合物3.8克与一定质量的稀硫酸恰好完全反应,将反应后的混合物蒸发水分得固体13.4克,则生成氢气的质量为( )
A.0.2克 B.9.6克 C.9.8克 D.0.18克
2.有X、Y、Z三种金属,把Y投入X(NO3)2溶液中,Y表面有X析出,溶液质量增大;把X投入Z(NO3)2溶液中,得到X(NO3)2,固体质量增大。下列判断错误的是( )
A.X、Y、Z可能依次是:Cu、Fe、Ag
B.元素的相对原子质量可能是:Z>Y>X
C.金属活动性顺序是:Y>X>Z
D.X、Y、Z可能依次是:Fe、Zn、Hg
3.现有等质量的X、Y两种金属(化合价都为+2价),分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如下图所示.下列说法中正确的是( )
A.生成氢气的质量:X<Y B.相对原子质量:X>Y
C.金属活动性:X>Y D.消耗硫酸的质量:X>Y
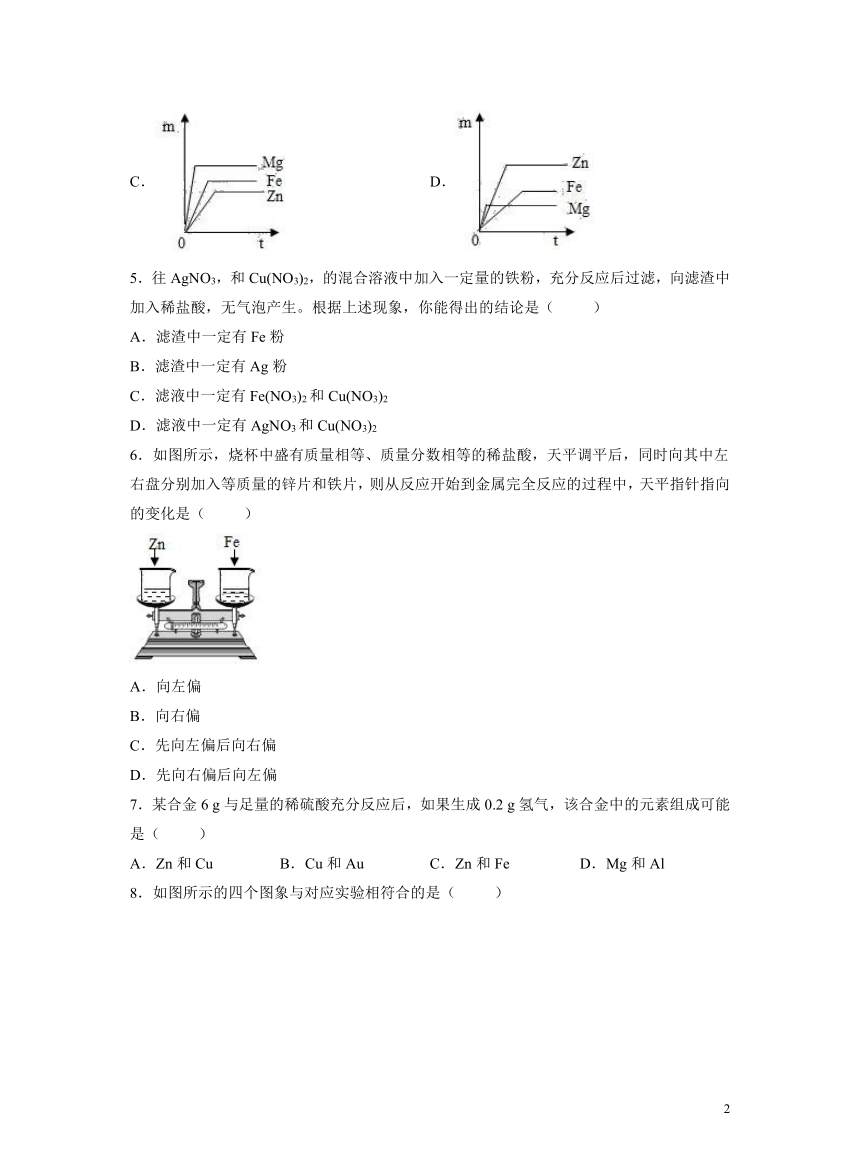
4.等质量的镁、锌、铁分别跟足量的稀硫酸在室温下起反应,图中能够正确反映产生氢气质量m与反应时间t关系的图象为( )
A. B.
C. D.
5.往AgNO3,和Cu(NO3)2,的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,你能得出的结论是( )
A.滤渣中一定有Fe粉
B.滤渣中一定有Ag粉
C.滤液中一定有Fe(NO3)2和Cu(NO3)2
D.滤液中一定有AgNO3和Cu(NO3)2
6.如图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中左右盘分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
A.向左偏
B.向右偏
C.先向左偏后向右偏
D.先向右偏后向左偏
7.某合金6 g与足量的稀硫酸充分反应后,如果生成0.2 g氢气,该合金中的元素组成可能是( )
A.Zn和Cu B.Cu和Au C.Zn和Fe D.Mg和Al
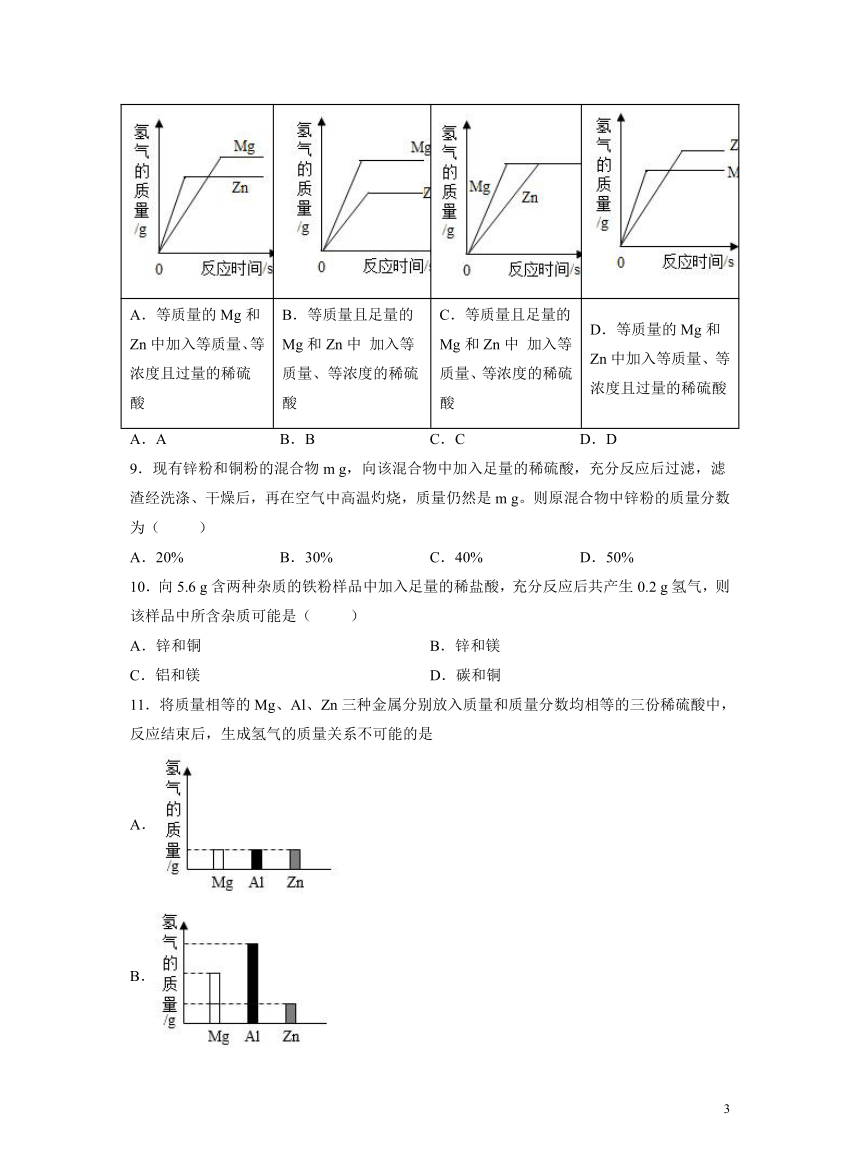
8.如图所示的四个图象与对应实验相符合的是( )
A.等质量的Mg和Zn中加入等质量、等浓度且过量的稀硫酸 B.等质量且足量的Mg和Zn中 加入等质量、等浓度的稀硫酸 C.等质量且足量的Mg和Zn中 加入等质量、等浓度的稀硫酸 D.等质量的Mg和Zn中加入等质量、等浓度且过量的稀硫酸
A.A B.B C.C D.D
9.现有锌粉和铜粉的混合物m g,向该混合物中加入足量的稀硫酸,充分反应后过滤,滤渣经洗涤、干燥后,再在空气中高温灼烧,质量仍然是m g。则原混合物中锌粉的质量分数为( )
A.20% B.30% C.40% D.50%
10.向5.6 g含两种杂质的铁粉样品中加入足量的稀盐酸,充分反应后共产生0.2 g氢气,则该样品中所含杂质可能是( )
A.锌和铜 B.锌和镁
C.铝和镁 D.碳和铜
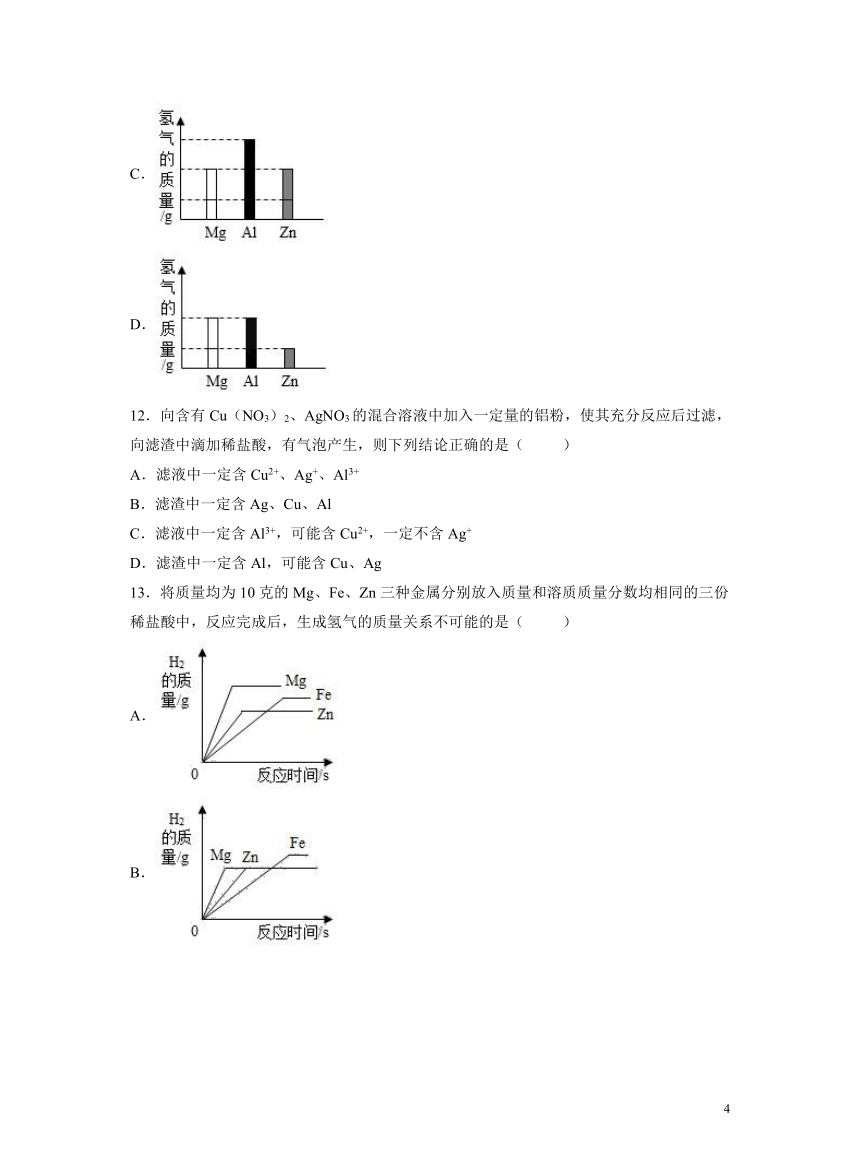
11.将质量相等的Mg、Al、Zn三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能的是
A.
B.
C.
D.
12.向含有Cu(NO3)2、AgNO3的混合溶液中加入一定量的铝粉,使其充分反应后过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是( )
A.滤液中一定含Cu2+、Ag+、Al3+
B.滤渣中一定含Ag、Cu、Al
C.滤液中一定含Al3+,可能含Cu2+,一定不含Ag+
D.滤渣中一定含Al,可能含Cu、Ag
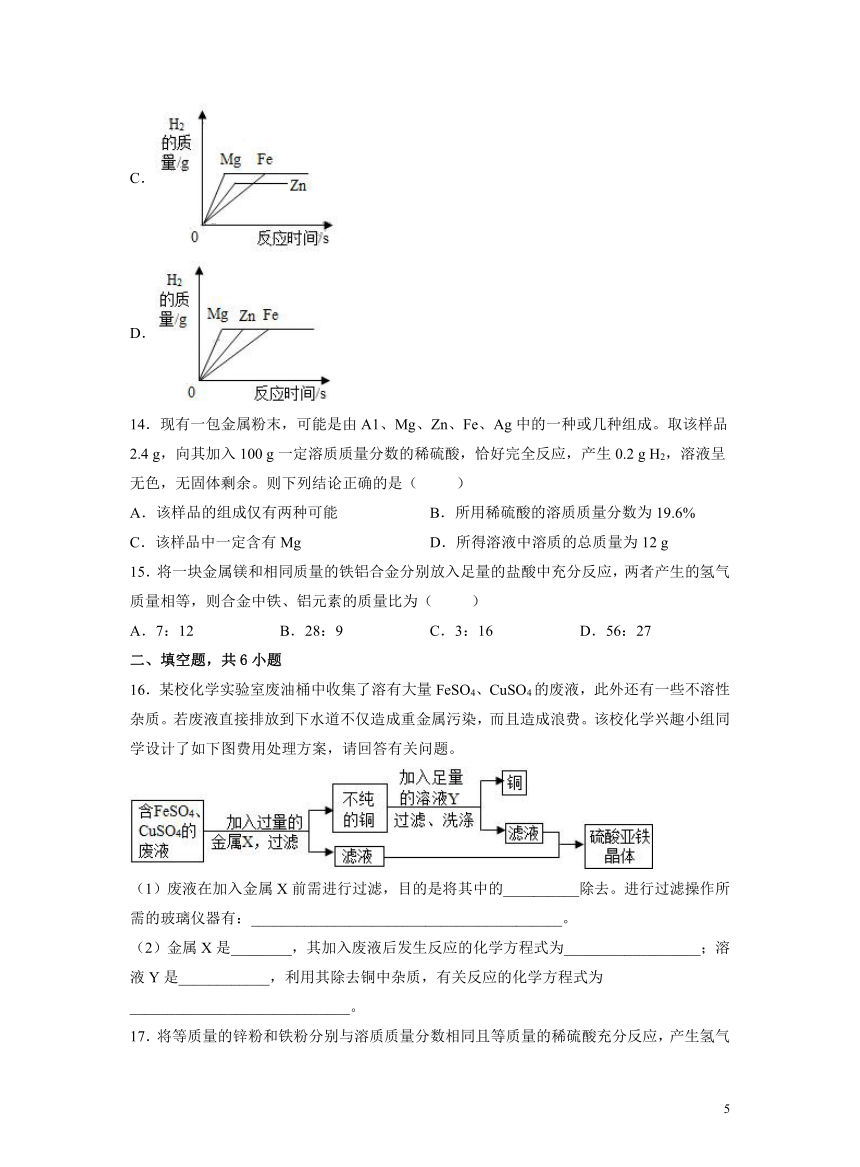
13.将质量均为10克的Mg、Fe、Zn三种金属分别放入质量和溶质质量分数均相同的三份稀盐酸中,反应完成后,生成氢气的质量关系不可能的是( )
A.
B.
C.
D.
14.现有一包金属粉末,可能是由A1、Mg、Zn、Fe、Ag中的一种或几种组成。取该样品2.4 g,向其加入100 g一定溶质质量分数的稀硫酸,恰好完全反应,产生0.2 g H2,溶液呈无色,无固体剩余。则下列结论正确的是( )
A.该样品的组成仅有两种可能 B.所用稀硫酸的溶质质量分数为19.6%
C.该样品中一定含有Mg D.所得溶液中溶质的总质量为12 g
15.将一块金属镁和相同质量的铁铝合金分别放入足量的盐酸中充分反应,两者产生的氢气质量相等,则合金中铁、铝元素的质量比为( )
A.7:12 B.28:9 C.3:16 D.56:27
二、填空题,共6小题
16.某校化学实验室废油桶中收集了溶有大量FeSO4、CuSO4的废液,此外还有一些不溶性杂质。若废液直接排放到下水道不仅造成重金属污染,而且造成浪费。该校化学兴趣小组同学设计了如下图费用处理方案,请回答有关问题。
(1)废液在加入金属X前需进行过滤,目的是将其中的__________除去。进行过滤操作所需的玻璃仪器有:_________________________________________。
(2)金属X是________,其加入废液后发生反应的化学方程式为__________________;溶液Y是____________,利用其除去铜中杂质,有关反应的化学方程式为_____________________________。
17.将等质量的锌粉和铁粉分别与溶质质量分数相同且等质量的稀硫酸充分反应,产生氢气的质量与时间的关系如图所示。请回答下列问题:
(1)表示锌粉与稀硫酸反应的曲线是: _______ (填 a 或 b)。
(2)对于曲线a表示的反应, ________ (填化学式)有剩余。
(3)若有一种金属剩余,则剩余的金属一定是_____ (填化学式)。
18.黄金是一种贵重金属。在人类漫长的历史中,素有“沙里淘金”、“真金不怕火炼”之说。这说明黄金在自然界中主要以_______形式存在,也说明黄金的化学性质在自然条件下非常_____。
19.等质量的Zn、Mg分别放入等质量等浓度(溶质质量分数)的稀硫酸中。若生成氢气相等,则一定没有剩余的是_______________,一定有剩余的是________________。
20.我国是世界上最早采用湿法冶金提取钢的国家,在汉代许多著作里有“石胆能化铁为铜”的记载,至宋代时湿法炼铜成为大量生产铜的重要要方法。湿法炼铜的原理是铁硫酸铜溶液反应。
(1)铁与硫酸铜反应的基本类型是________。
(2)实验室中用托盘天平称取5.6 g铁粉进行该实验,正确的操作是________(填序号)。
A.用镊子取用砝码
B.将铁粉直接放在托盘上称量
C.观察左、右托盘高度判断天平平衡
D.先将铁粉放在托盘上,再加砝码至天平平衡
(3)将5.6 g铁粉放入烧杯中,缓缓加入160 g硫酸铜溶液并搅拌,二者恰好完全反应,清计算该硫酸铜溶液中溶质质量的分数____________。
21.近年来,我国航空、航海、高铁等得到长足发展,跻身世界前列。大飞机C919试飞成功,标志着我国强国梦又迈出了一大步。大飞机使用的化学材料如甲图。请回答:
(1)钛合金属于__________(填“金属”或“合成”)材料。
(2)图乙是钛原子结构示意图,则x=_______;钛元素位于元素周期表第_______周期。
(3)建造航母也使用了钛合金,构成金属钛的粒子是________(填“原子”“分子”或“离子”),工业制取钛的反应为:,X的化学式为__________。
(4)利用新技术能将不锈钢加工成柔软的金属丝,用它和棉纤维一起编织成性能优良的劳保防护服,这是利用了不锈钢_________。
A.延展性 B.导热性 C.导电性
(5)早在春秋战国时期,我国就开始生产和使用铁器。以磁铁矿为原料炼铁的化学方程式为____________。
(6)为了探究航母材料中锌、铁、铜三种金属活动性强弱,下列选用的药品可行的是_________(填序号)。
A.Zn、FeSO4溶液、Cu
B.ZnSO4溶液、Cu、Fe
C.ZnSO4溶液、Fe、CuSO4溶液
D.FeSO4溶液、CuSO4溶液、Zn
(7)为探究铁和锌两种金属与酸反应的状况,将等质量的两种金属分别与等质量的溶质质量分数相同的稀硫酸反应,产生氢气的质量与反应时间的函数关系如下图所示。下列相关判断中,正确的是___________。
A.甲是铁,乙是锌
B.甲是锌,乙是铁
C.图1中金属乙与稀硫酸充分反应后,稀硫酸一定还有剩余
D.图2中金属甲与稀硫酸充分反应,金属甲可能有剩余
三、简答题,共2小题
22.在轮船的金属外壳上铆上一些锌片,专业人士说可以防止锈蚀,保护船体。有人说镀锌铁不容易生锈的原因是:表面镀上一层不活泼的金属锌作为保护膜,这种说法正确吗?
23.将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式________________________。图7是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是____________(填标号)。
参考答案
1.A
【解析】
根据反应前后元素质量不变,反应生成的13.4 g硫酸锌、硫酸铝、硫酸亚铁、硫酸镁混合物中含有硫酸根的质量=13.4 g-3.8 g=9.6 g;根据硫酸的化学式,其中氢元素与硫酸根的质量比=2:96=1:48,当硫酸中所含硫酸根的质量为9.6 g时,硫酸中H元素的质量=9.6 g×=0.2 g,即反应中产生的氢气质量为0.2 g。
故选A。
2.A
【解析】
A.金属活动性顺序是Y>X>Z,X、Y、Z可能依次是Cu、Fe、Ag,Y的相对原子质量大于X,而Fe的相对原子质量小于Cu,银的化合价为+1价,Z在硝酸盐中显+2价,故A不正确;
B.元素的相对原子质量是Y>X,Z>X,则元素的相对原子质量可能是Z>Y>X,故B正确;
C.金属活动性顺序是Y>X>Z,故C正确;
D.金属活动性顺序是Y>X>Z,X、Y、Z可能依次是:Fe、Zn、Hg,Zn的相对原子质量大于Fe,Hg的相对原子质量大于Fe,故D正确。故选A。
3.D
【解析】
【详解】
A.根据反应生成H2的质量与反应时间的关系图所示,在两种金属 完全反应后,放出H2的质量是 X>Y,正确;
B.X、Y金属的质量都相等(化合价都为+2 价),完全反应放出氢气的质量与金属的相对原子质量成反比,即产生氢气多的相对原子质量小;根据反应生成H2的质量与反应时间的关系图所示,在金属完全反应后,放出H2的质量是X>Y,因此可判断相对原子质量是Y>X,故说法错误;
C.根据反应生成H2的质量与反应时间的关系图所示,相同时间内Y放出氢气的 质量大于X,可判断金属活动性顺序是Y>X,故说法正确;
D.金属与酸的反应生成氢气时,氢气来源于酸中的氢元素,所以生成的氢气与消耗的酸的多少顺序一致,消耗硫酸的质量:X>Y,故说法正确。故选:D。
4.A
【解析】
在金属活动性顺序中,镁>锌>铁,与硫酸反应时镁的速率最快,在坐标中斜线最陡,铁的反应速率最慢,在坐标中斜线最平缓,观察图象,排除BC;等质量的镁,锌,铁,分别跟足量的稀硫酸在室温下起反应,则镁生成的氢气最多,锌生成的氢气最少,观察图象,排除D;故选:A。
5.B
【解析】
A.铁先和硝酸银反应生成银和硝酸亚铁,反应完全,多余的铁和硝酸铜反应生成铜和硝酸亚铁,向滤渣中加入稀盐酸,无气泡产生,说明加入的铁全部发生了反应,滤渣中一定没有Fe粉,故A不正确;
B.铁先和硝酸银反应生成银和硝酸亚铁,滤渣中一定有Ag粉,故B正确;
C.铁先和硝酸银反应生成银和硝酸亚铁,滤液中一定有Fe(NO3)2,向滤渣中加入稀盐酸,无气泡产生,说明加入的铁全部发生了反应,不能确定滤液中是否含有AgNO3、Cu(NO3)2,故C不正确;
D.向滤渣中加入稀盐酸,无气泡产生,说明加入的铁全部发生了反应,则一定有银被置换出来;由于铁粉为一定量,无法判断铁粉是否与AgNO3完全反应,也就无法进一步判断是否和混合溶液中的Cu(NO3)2发生了反应,不能确定滤液中是否含有AgNO3和Cu(NO3)2,故D不正确。故选B。
【点睛】
铁先和硝酸银反应生成银和硝酸亚铁,反应完全,多余的铁和硝酸铜反应生成铜和硝酸亚铁,向滤渣中加入稀盐酸,无气泡产生,说明加入的铁全部发生了反应。
6.D
【解析】
【分析】
先比较锌和铁的金属活动性,锌大于铁,因此锌与稀盐酸反应放出氢气的速率大于铁,从而质量的减少速率也大于铁,因此加入锌的烧杯质量减少较快,指针偏向铁的,即右偏;相同质量的锌和铁与稀盐酸反应,金属完全反应,铁放出的气体更多,因此反应结束后,指针向左偏。根据反应规律,指针先向右铁片烧杯中偏,反应结束后,偏向锌片烧杯,即向左偏移,故选D。
7.C
【解析】
A.由锌和稀硫酸反应产生氢气Zn+H2SO4=ZnSO4+H2↑的关系可知:6.5 g锌能产生0.2 g氢气,则6 g锌产生氢气小于0.2 g,铜不能产生氢气;则6g的锌和铜合金产生氢气小于
0.2 g;故选项错误;
B.铜和金都不能与稀硫酸反应产生氢气;故选项错误;
C.由锌和稀硫酸反应产生氢气Zn+H2SO4=ZnSO4+H2↑的关系可知:6.5 g锌能产生0.2 g氢气,则6 g锌产生氢气小于0.2 g,由铁和稀硫酸反应产生氢气Fe+H2SO4=FeSO4+H2↑的关系可知;5.6 g铁能产生0.2 g氢气,6.5 g铁能产生氢气大于0.2 g,则6 g的锌和铁合金可以产生0.2 g氢气;故选项正确;
D.由镁和稀硫酸反应产生氢气Mg+H2SO4=MgSO4+H2↑的关系可知:2.4 g镁能产0.2 g
氢气;6.5 g镁产生的氢气大于0.2 g,由铝和稀硫酸反应产生氢气2Al+3H2SO4=2Al2(SO4)3+3H2↑的关系可知:1.8 g铝能产生0.2 g氢气;6.0 g铝产生的氢气大于0.2 g;则6 g的镁和铝合金产生氢气质量大于0.2 g;故选项错误;
故选:C。
8.C
【解析】
A.镁的金属活动性比锌强,故镁的反应速率快,镁与稀硫酸反应:,锌与稀硫酸反应:,等质量的Mg和Zn中加入等质量、等浓度且过量的稀硫酸,镁的相对原子质量小于锌,最后镁产生的氢气质量大,图像中表示的是锌反应快,错误,不符合题意;
B.镁的金属活动性比锌强,故镁的反应速率快,等质量且足量的Mg和Zn中 加入等质量、等浓度的稀硫酸,最后生成氢气的质量一样大,不符合题意;
C.镁的金属活动性比锌强,故镁的反应速率快,等质量且足量的Mg和Zn中 加入等质量、等浓度的稀硫酸,最后生成氢气的质量一样大,符合题意;
D.镁的金属活动性比锌强,故镁的反应速率快,镁与稀硫酸反应:,锌与稀硫酸反应:,等质量的Mg和Zn中加入等质量、等浓度且过量的稀硫酸,镁的相对原子质量小于锌,最后镁产生的氢气质量大,不符合题意;
故选C。
9.A
【解析】
解:设锌的质量为,
铜在空气中高温灼烧,质量仍然是m g,说明锌的质量和反应的氧气质量相等,
则原混合物中锌粉的质量分数为:,
故选:A。
10.B
【解析】
碳、铜和盐酸不反应,而锌、铁、镁、铝与酸反应时,金属和氢气的质量关系如下:
同质量的四种金属,生成氢气的关系:铝>镁>铁>锌。故:
A.锌和铜混合物比同质量的铁生成氢气少,选项错误;
B.锌和镁混合物可能与同质量的铁生成氢气相同,选项正确;
C.铝和镁混合物比同质量的铁生成氢气多,选项错误;
D.碳和铜混合物不与酸生成氢气,选项错误。
故选B。
11.C
【解析】
A.如果金属都过量,则生成氢气质量决定于稀硫酸,由于是质量和溶质质量分数均相同的三份稀硫酸,因此生成氢气质量相等,该选项对应关系有可能,不符合题意;
B.如果稀硫酸过量,则生成氢气质量决定于金属质量,镁、铝、锌和稀硫酸反应的化学方程式及其质量关系:
由以上质量关系可知,相等质量的金属完全反应时,铝反应生成氢气质量最大,其次是镁,锌反应生成氢气质量最小,该选项对应关系有可能,不符合题意;
C.如果镁、锌反应生成氢气质量相等,则稀硫酸不足,对于铝来说,稀硫酸也是不足,因此生成氢气质量应该相等,该选项对应关系没有可能,符合题意;
D.当铝恰好和硫酸反应时,镁过量,锌不足,镁、铝和稀硫酸反应生成的氢气质量相等,锌和稀硫酸反应生成的氢气质量小于镁、铝和稀硫酸反应生成的氢气质量,该选项对应关系可能正确,不符合题意;
故选:C。
12.B
【解析】
A.铝是过量的,硝酸银、硝酸铜均完全反应,则滤液中一定含Al3+,无铜离子和银离子,故选项说法错误;
B.铝是过量的,滤渣中一定含Ag、Cu、Al,故选项说法正确;
C.铝是过量的,硝酸银、硝酸铜均完全反应,则滤液中一定含Al3+,一定不含Cu2+、Ag+,故选项说法错误;
D.铝是过量的,滤渣中一定含Ag、Cu、Al,故选项说法错误。
故选:B。
13.B
【解析】
A.等质量的Mg、Fe、Zn三种金属分别放入质量和溶质质量分数均相同的三份足量的稀盐酸中,产生的氢气的质量可用金属的化合价÷金属相对原子质量的比值进行比较,则有,由于它们的金属活动性顺序为Mg>Zn>Fe;分析图象可知,质量均为10克的Mg、Fe、Zn三种金属分别放入质量和溶质质量分数均相同的三份足量的稀盐酸中,产生氢气的质量与图象一致,故A正确;
B.分析图象可知,当10 gMg、10 gZn分别放入质量和溶质质量分数均相同的两份的稀盐酸中产生等质量氢气时,说明金属镁是过量的,而锌是恰好与酸完全反应或是过量,则10 gFe一定是过量的,产生的氢气应与10 gMg、Zn产生氢气相同,故B错误;
C.质量均为10克的Mg、Fe、Zn三种金属分别放入一定质量和溶质质量分数均相同的三份的稀盐酸中,当10 g铁与盐酸恰好完全反应时,根据A选项分析,10 g镁是过量的,则镁和铁产生的氢气质量相等,而10 g锌产生氢气的质量小于10 g镁和铁,与图象一致,故C正确;
D.等质量且足量的Mg、Fe、Zn三种金属分别放入一定质量和溶质质量分数均相同的三份的稀盐酸中,产生的氢气是相等的,则将质量均为10克且足量的Mg、Fe、Zn三种金属分别放入质量和溶质质量分数均相同的三份稀盐酸中,反应完成后,酸都被消耗,则生成氢气的质量相等,与图象一致,故D正确。
故选:B。
14.D
【解析】
A.金属粉末与稀硫酸反应,得到无色溶液,固体无剩余,说明粉末中一定不包括铁和银,通过上面计算可知,金属粉末可能组成为镁、铝和锌、铝、镁和锌,组成有三种可能,说法错误;
B.由质量守恒定律可知:生成的氢气中氢元素都来源于硫酸中的氢元素,生成0.2 g氢气,100 g一定溶质质量分数的稀硫酸中氢元素的质量=0.2 g,则硫酸溶液中硫酸的质量=,稀硫酸的溶质质量分数=,说法错误;
C.由A可知,该样品中不一定含有镁,说法错误;
D.反应后所得溶液中溶质的为金属硫酸盐,金属的质量=2.4 g,硫酸根的质量=,所得溶液中溶质的质量=9.6 g+2.4 g=12 g;
答案:D。
15.A
【解析】
由题目信息可知,假设金属镁的质量为x,产生的氢气质量为y,由反应方程式可得,并由此得到关系式: ,;
假设合金中,铁的质量为a,铝的质量为b,根据铁和铝与盐酸反应的方程式可以得出,铁与盐酸反应产生的氢气的质量为:,铝与盐酸反应产生的氢气的质量为:;
由于金属镁和合金的质量相等,则有:,且二者产生的氢气也相等,故可以得出以下关系式: ,化简可以得出:,;
所以合金中铁、铝元素的质量比为7∶12,故选择A。
16.不溶性杂质 漏斗、烧杯、玻璃棒 铁 CuSO4+Fe=FeSO4+Cu 稀硫酸 H2SO4+Fe=FeSO4+H2↑
【解析】
(1)过滤是将不溶性固体从溶液中分离出来的操作,组装过滤器需要的仪器有:铁架台、漏斗、滤纸、烧杯和玻璃棒,其中玻璃仪器为:漏斗、烧杯、玻璃棒.
(2)从图框中可以知道,向废液中加入过量的金属X得到了不纯的铜,根据题干要求及废水中的成分并结合最后得到物质为硫酸亚铁晶体,可以判断金属X为铁;铜排在氢后面,不与酸反应,而铁排在氢前面,与酸反应,因此为除去混在铜粉里的铁粉并且得到FeSO4溶液,把金属混合物放入足量的稀硫酸并过滤即可,故溶液Y为稀硫酸.
故答为:(1)不溶性杂质,漏斗、烧杯、玻璃棒;(2)铁,CuSO4+Fe=FeSO4+Cu,稀硫酸,H2SO4+Fe=FeSO4+H2↑.
17.a H2SO4 Fe
【解析】
试题分析:(1)通过观察产生氢气的质量与时间的关系图,可以看出a反应速率更快,从而说明金属a 的活动性更强,故表示锌粉与稀硫酸反应的曲线是:a
(2)由于曲线a 表示的是锌粉与稀硫酸反应的曲线,等质量的锌粉和铁粉,锌消耗的H2SO4质量更小,故对于锌来说,H2SO4有剩余
(3)根据反应:Zn + H2SO4 ===ZnSO4 + H2↑中Zn与H2SO4的质量关系为65:98,而反应:Fe + H2SO4 ===FeSO4 + H2↑中Fe与H2SO4的质量关系为56:98,故相同质量的H2SO4,消耗Zn的质量更多,故若有一种金属剩余,则剩余的金属一定是Fe。
考点:金属与酸反应的现象及有关计算
18.单质 稳定
【解析】
(1)沙里淘金是物理变化,说明沙子里黄金是以单质的形式存在;
(2)黄金在高温的条件下不与氧气反应,说明黄金的化学性质不活泼;
19.硫酸 镁
【解析】
【详解】
等质量的Zn、Mg分别放入等质量等浓度(溶质质量分数)的稀硫酸中。若生成氢气相等,则参加反应的硫酸的质量相等,参加反应的锌的质量大于镁的质量,分别放入等质量等浓度(溶质质量分数)的稀硫酸中的Zn、Mg质量相等,故镁一定有剩余,所以一定没有剩余的是硫酸。
20.置换反应; A 10%
【解析】
(1)铁与硫酸铜的反应产物是铜与硫酸亚铁,其方程式为:Fe+CuSO4═FeSO4+Cu,该反应的反应物、生成物均是一种单质与一种化合物,所以属于置换反应;(2)A.使用托盘天平称量时,用镊子取用砝码,防止污染砝码,正确;B.在托盘天平上称量药品时,要注意称量一般药品时,要在左、右盘上放相同质量的纸,如果称量易潮解、有腐蚀性的药品时,必须放到玻璃器皿中称量,否则会把托盘腐蚀,造成称量的误差,错误;C.观察分度盘的指针是否在中间判断天平平衡,不是观察左右托盘高度,错误;D.称取一定质量的铁粉,应先加砝码,再调节游码,然后再将铁粉放在托盘上,直至天平平衡,错误。故选A;
(3)设硫酸铜的质量为x,
Fe+CuSO4═FeSO4+Cu
56 160
5.6 g x
x=16 g
该硫酸铜溶液中溶质质量的分数=×100%=10%
21.金属 8 四 原子 SO3 A AC AC
【解析】
【分析】
金属材料包括纯金属和合金,四氧化三铁和一氧化碳高温生成铁和二氧化碳,锌和硫酸亚铁反应生成铁和硫酸锌,铁和硫酸铜反应生成硫酸锌和铜,锌和稀硫酸反应生成硫酸锌和氢气,铁和稀硫酸反应生成硫酸亚铁和氢气。
【详解】
(1)金属材料包括纯金属和合金,故钛合金属于金属材料。
(2)在原子中,质子数=核外电子数,由钛原子结构示意图,,则;钛原子核外有4个电子层,故钛元素位于元素周期表第四周期。
(3)金属是由原子构成的,故构成金属钛的粒子是原子,由质量守恒定律可知,反应前后原子种类和数目均相同,工业制取钛的反应为:,反应前有1个钛原子,4个氟原子,4个氢原子,2个硫原子,8个氧原子,反应后有4个氢原子,4个氟原子,1个钛原子,2个氧原子,还有2个硫原子,6个氧原子,X前面的化学计量数为2,故X的化学式为SO3。
(4)利用新技术能将不锈钢加工成柔软的金属丝,用它和棉纤维一起编织成性能优良的劳保防护服,这是利用了不锈钢延展性,故选A。
(5)以磁铁矿为原料炼铁的反应是四氧化三铁和一氧化碳高温生成铁和二氧化碳,故反应的化学方程式为。
(6)A.锌和硫酸亚铁反应生成铁和硫酸锌,则锌的金属活动性强于铁,铜和硫酸亚铁不反应,则铁的金属活动性强于铜,则三种金属的活动性顺序为锌、铁、铜,故A正确;
B.Cu、Fe均和ZnSO4溶液不反应,说明铜、铁的金属活动性弱于锌,不能比较铜、铁的金属活动,故B不正确;
C.铁和硫酸锌不反应,说明锌的金属活动性强于铁,铁和硫酸铜反应生成硫酸锌和铜,说明铁的金属活动性强于铜,则三种金属的活动性顺序为锌、铁、铜,故C正确;
D.锌和硫酸亚铁反应生成铁和硫酸锌,锌和硫酸铜反应生成硫酸锌和铜,说明锌的金属活动性强于铁、铜,不能比较铜、铁的金属活动,故D不正确。故选AC。
(7)A.在金属活动性顺序表中,锌的金属活动性强于铁,和稀硫酸反应速率较快,反应需要时间短,反应的关系式为,,65份的锌和稀硫酸反应生成2份的氢气,56份的铁和稀硫酸反应生成2份的氢气,等质量的两种金属,最终铁和稀硫酸反应生成的氢气多,因此甲是铁,乙是锌,故A正确;
B.锌的金属活动性强于铁,和稀硫酸反应速率较快,反应需要时间短,等质量的两种金属,最终铁和稀硫酸反应生成的氢气多,甲是铁,乙是锌,故B不正确;
C.图1中由生成氢气的质量可知,当锌完全反应后,铁还继续反应生成氢气,说明和锌反应的稀硫酸有剩余,故C正确;
D.图2中最终生成氢气质量相等,说明稀硫酸完全反应,铁一定有剩余,故D不正确。故选AC。
【点睛】
由质量守恒定律可知,反应前后原子种类和数目均相同,在金属活动性顺序表中,前面的金属和后面的金属的盐溶液反应,把其从盐溶液中置换出来。
22.这种说法不正确。根据金属活动性顺序表,锌比铁活泼,海水中先腐蚀锌片从而保护了铁制品。
【解析】
这种说法不正确。锌的活动性比铁强,在轮船的金属外壳上铆上一些锌片,根据金属活动性顺序表,锌比铁活泼,海水中先腐蚀锌片从而保护了铁制品。
23.Fe + 2HCl = FeCl2+H2↑ A、C
【解析】
根据金属的活动性顺序可知,铁与稀盐酸反应生成氯化亚铁和氢气,而铜与稀盐酸不反应;反应的方程式是:Fe+2HCl=FeCl2+H2↑;随着反应的进行,氢气的质量增加,当铁完全反应后,氢气的质量不再改变;随着铁的反应,金属混合物的质量不断减小,当铁完全反应后,剩余固体是铜,质量不再减小。所以AC正确。
试卷第2页,共18页
1
一、单选题,共15小题
1.锌粉、铝粉、铁粉、镁粉的混合物3.8克与一定质量的稀硫酸恰好完全反应,将反应后的混合物蒸发水分得固体13.4克,则生成氢气的质量为( )
A.0.2克 B.9.6克 C.9.8克 D.0.18克
2.有X、Y、Z三种金属,把Y投入X(NO3)2溶液中,Y表面有X析出,溶液质量增大;把X投入Z(NO3)2溶液中,得到X(NO3)2,固体质量增大。下列判断错误的是( )
A.X、Y、Z可能依次是:Cu、Fe、Ag
B.元素的相对原子质量可能是:Z>Y>X
C.金属活动性顺序是:Y>X>Z
D.X、Y、Z可能依次是:Fe、Zn、Hg
3.现有等质量的X、Y两种金属(化合价都为+2价),分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如下图所示.下列说法中正确的是( )
A.生成氢气的质量:X<Y B.相对原子质量:X>Y
C.金属活动性:X>Y D.消耗硫酸的质量:X>Y
4.等质量的镁、锌、铁分别跟足量的稀硫酸在室温下起反应,图中能够正确反映产生氢气质量m与反应时间t关系的图象为( )
A. B.
C. D.
5.往AgNO3,和Cu(NO3)2,的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,你能得出的结论是( )
A.滤渣中一定有Fe粉
B.滤渣中一定有Ag粉
C.滤液中一定有Fe(NO3)2和Cu(NO3)2
D.滤液中一定有AgNO3和Cu(NO3)2
6.如图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中左右盘分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
A.向左偏
B.向右偏
C.先向左偏后向右偏
D.先向右偏后向左偏
7.某合金6 g与足量的稀硫酸充分反应后,如果生成0.2 g氢气,该合金中的元素组成可能是( )
A.Zn和Cu B.Cu和Au C.Zn和Fe D.Mg和Al
8.如图所示的四个图象与对应实验相符合的是( )
A.等质量的Mg和Zn中加入等质量、等浓度且过量的稀硫酸 B.等质量且足量的Mg和Zn中 加入等质量、等浓度的稀硫酸 C.等质量且足量的Mg和Zn中 加入等质量、等浓度的稀硫酸 D.等质量的Mg和Zn中加入等质量、等浓度且过量的稀硫酸
A.A B.B C.C D.D
9.现有锌粉和铜粉的混合物m g,向该混合物中加入足量的稀硫酸,充分反应后过滤,滤渣经洗涤、干燥后,再在空气中高温灼烧,质量仍然是m g。则原混合物中锌粉的质量分数为( )
A.20% B.30% C.40% D.50%
10.向5.6 g含两种杂质的铁粉样品中加入足量的稀盐酸,充分反应后共产生0.2 g氢气,则该样品中所含杂质可能是( )
A.锌和铜 B.锌和镁
C.铝和镁 D.碳和铜
11.将质量相等的Mg、Al、Zn三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能的是
A.
B.
C.
D.
12.向含有Cu(NO3)2、AgNO3的混合溶液中加入一定量的铝粉,使其充分反应后过滤,向滤渣中滴加稀盐酸,有气泡产生,则下列结论正确的是( )
A.滤液中一定含Cu2+、Ag+、Al3+
B.滤渣中一定含Ag、Cu、Al
C.滤液中一定含Al3+,可能含Cu2+,一定不含Ag+
D.滤渣中一定含Al,可能含Cu、Ag
13.将质量均为10克的Mg、Fe、Zn三种金属分别放入质量和溶质质量分数均相同的三份稀盐酸中,反应完成后,生成氢气的质量关系不可能的是( )
A.
B.
C.
D.
14.现有一包金属粉末,可能是由A1、Mg、Zn、Fe、Ag中的一种或几种组成。取该样品2.4 g,向其加入100 g一定溶质质量分数的稀硫酸,恰好完全反应,产生0.2 g H2,溶液呈无色,无固体剩余。则下列结论正确的是( )
A.该样品的组成仅有两种可能 B.所用稀硫酸的溶质质量分数为19.6%
C.该样品中一定含有Mg D.所得溶液中溶质的总质量为12 g
15.将一块金属镁和相同质量的铁铝合金分别放入足量的盐酸中充分反应,两者产生的氢气质量相等,则合金中铁、铝元素的质量比为( )
A.7:12 B.28:9 C.3:16 D.56:27
二、填空题,共6小题
16.某校化学实验室废油桶中收集了溶有大量FeSO4、CuSO4的废液,此外还有一些不溶性杂质。若废液直接排放到下水道不仅造成重金属污染,而且造成浪费。该校化学兴趣小组同学设计了如下图费用处理方案,请回答有关问题。
(1)废液在加入金属X前需进行过滤,目的是将其中的__________除去。进行过滤操作所需的玻璃仪器有:_________________________________________。
(2)金属X是________,其加入废液后发生反应的化学方程式为__________________;溶液Y是____________,利用其除去铜中杂质,有关反应的化学方程式为_____________________________。
17.将等质量的锌粉和铁粉分别与溶质质量分数相同且等质量的稀硫酸充分反应,产生氢气的质量与时间的关系如图所示。请回答下列问题:
(1)表示锌粉与稀硫酸反应的曲线是: _______ (填 a 或 b)。
(2)对于曲线a表示的反应, ________ (填化学式)有剩余。
(3)若有一种金属剩余,则剩余的金属一定是_____ (填化学式)。
18.黄金是一种贵重金属。在人类漫长的历史中,素有“沙里淘金”、“真金不怕火炼”之说。这说明黄金在自然界中主要以_______形式存在,也说明黄金的化学性质在自然条件下非常_____。
19.等质量的Zn、Mg分别放入等质量等浓度(溶质质量分数)的稀硫酸中。若生成氢气相等,则一定没有剩余的是_______________,一定有剩余的是________________。
20.我国是世界上最早采用湿法冶金提取钢的国家,在汉代许多著作里有“石胆能化铁为铜”的记载,至宋代时湿法炼铜成为大量生产铜的重要要方法。湿法炼铜的原理是铁硫酸铜溶液反应。
(1)铁与硫酸铜反应的基本类型是________。
(2)实验室中用托盘天平称取5.6 g铁粉进行该实验,正确的操作是________(填序号)。
A.用镊子取用砝码
B.将铁粉直接放在托盘上称量
C.观察左、右托盘高度判断天平平衡
D.先将铁粉放在托盘上,再加砝码至天平平衡
(3)将5.6 g铁粉放入烧杯中,缓缓加入160 g硫酸铜溶液并搅拌,二者恰好完全反应,清计算该硫酸铜溶液中溶质质量的分数____________。
21.近年来,我国航空、航海、高铁等得到长足发展,跻身世界前列。大飞机C919试飞成功,标志着我国强国梦又迈出了一大步。大飞机使用的化学材料如甲图。请回答:
(1)钛合金属于__________(填“金属”或“合成”)材料。
(2)图乙是钛原子结构示意图,则x=_______;钛元素位于元素周期表第_______周期。
(3)建造航母也使用了钛合金,构成金属钛的粒子是________(填“原子”“分子”或“离子”),工业制取钛的反应为:,X的化学式为__________。
(4)利用新技术能将不锈钢加工成柔软的金属丝,用它和棉纤维一起编织成性能优良的劳保防护服,这是利用了不锈钢_________。
A.延展性 B.导热性 C.导电性
(5)早在春秋战国时期,我国就开始生产和使用铁器。以磁铁矿为原料炼铁的化学方程式为____________。
(6)为了探究航母材料中锌、铁、铜三种金属活动性强弱,下列选用的药品可行的是_________(填序号)。
A.Zn、FeSO4溶液、Cu
B.ZnSO4溶液、Cu、Fe
C.ZnSO4溶液、Fe、CuSO4溶液
D.FeSO4溶液、CuSO4溶液、Zn
(7)为探究铁和锌两种金属与酸反应的状况,将等质量的两种金属分别与等质量的溶质质量分数相同的稀硫酸反应,产生氢气的质量与反应时间的函数关系如下图所示。下列相关判断中,正确的是___________。
A.甲是铁,乙是锌
B.甲是锌,乙是铁
C.图1中金属乙与稀硫酸充分反应后,稀硫酸一定还有剩余
D.图2中金属甲与稀硫酸充分反应,金属甲可能有剩余
三、简答题,共2小题
22.在轮船的金属外壳上铆上一些锌片,专业人士说可以防止锈蚀,保护船体。有人说镀锌铁不容易生锈的原因是:表面镀上一层不活泼的金属锌作为保护膜,这种说法正确吗?
23.将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式________________________。图7是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是____________(填标号)。
参考答案
1.A
【解析】
根据反应前后元素质量不变,反应生成的13.4 g硫酸锌、硫酸铝、硫酸亚铁、硫酸镁混合物中含有硫酸根的质量=13.4 g-3.8 g=9.6 g;根据硫酸的化学式,其中氢元素与硫酸根的质量比=2:96=1:48,当硫酸中所含硫酸根的质量为9.6 g时,硫酸中H元素的质量=9.6 g×=0.2 g,即反应中产生的氢气质量为0.2 g。
故选A。
2.A
【解析】
A.金属活动性顺序是Y>X>Z,X、Y、Z可能依次是Cu、Fe、Ag,Y的相对原子质量大于X,而Fe的相对原子质量小于Cu,银的化合价为+1价,Z在硝酸盐中显+2价,故A不正确;
B.元素的相对原子质量是Y>X,Z>X,则元素的相对原子质量可能是Z>Y>X,故B正确;
C.金属活动性顺序是Y>X>Z,故C正确;
D.金属活动性顺序是Y>X>Z,X、Y、Z可能依次是:Fe、Zn、Hg,Zn的相对原子质量大于Fe,Hg的相对原子质量大于Fe,故D正确。故选A。
3.D
【解析】
【详解】
A.根据反应生成H2的质量与反应时间的关系图所示,在两种金属 完全反应后,放出H2的质量是 X>Y,正确;
B.X、Y金属的质量都相等(化合价都为+2 价),完全反应放出氢气的质量与金属的相对原子质量成反比,即产生氢气多的相对原子质量小;根据反应生成H2的质量与反应时间的关系图所示,在金属完全反应后,放出H2的质量是X>Y,因此可判断相对原子质量是Y>X,故说法错误;
C.根据反应生成H2的质量与反应时间的关系图所示,相同时间内Y放出氢气的 质量大于X,可判断金属活动性顺序是Y>X,故说法正确;
D.金属与酸的反应生成氢气时,氢气来源于酸中的氢元素,所以生成的氢气与消耗的酸的多少顺序一致,消耗硫酸的质量:X>Y,故说法正确。故选:D。
4.A
【解析】
在金属活动性顺序中,镁>锌>铁,与硫酸反应时镁的速率最快,在坐标中斜线最陡,铁的反应速率最慢,在坐标中斜线最平缓,观察图象,排除BC;等质量的镁,锌,铁,分别跟足量的稀硫酸在室温下起反应,则镁生成的氢气最多,锌生成的氢气最少,观察图象,排除D;故选:A。
5.B
【解析】
A.铁先和硝酸银反应生成银和硝酸亚铁,反应完全,多余的铁和硝酸铜反应生成铜和硝酸亚铁,向滤渣中加入稀盐酸,无气泡产生,说明加入的铁全部发生了反应,滤渣中一定没有Fe粉,故A不正确;
B.铁先和硝酸银反应生成银和硝酸亚铁,滤渣中一定有Ag粉,故B正确;
C.铁先和硝酸银反应生成银和硝酸亚铁,滤液中一定有Fe(NO3)2,向滤渣中加入稀盐酸,无气泡产生,说明加入的铁全部发生了反应,不能确定滤液中是否含有AgNO3、Cu(NO3)2,故C不正确;
D.向滤渣中加入稀盐酸,无气泡产生,说明加入的铁全部发生了反应,则一定有银被置换出来;由于铁粉为一定量,无法判断铁粉是否与AgNO3完全反应,也就无法进一步判断是否和混合溶液中的Cu(NO3)2发生了反应,不能确定滤液中是否含有AgNO3和Cu(NO3)2,故D不正确。故选B。
【点睛】
铁先和硝酸银反应生成银和硝酸亚铁,反应完全,多余的铁和硝酸铜反应生成铜和硝酸亚铁,向滤渣中加入稀盐酸,无气泡产生,说明加入的铁全部发生了反应。
6.D
【解析】
【分析】
先比较锌和铁的金属活动性,锌大于铁,因此锌与稀盐酸反应放出氢气的速率大于铁,从而质量的减少速率也大于铁,因此加入锌的烧杯质量减少较快,指针偏向铁的,即右偏;相同质量的锌和铁与稀盐酸反应,金属完全反应,铁放出的气体更多,因此反应结束后,指针向左偏。根据反应规律,指针先向右铁片烧杯中偏,反应结束后,偏向锌片烧杯,即向左偏移,故选D。
7.C
【解析】
A.由锌和稀硫酸反应产生氢气Zn+H2SO4=ZnSO4+H2↑的关系可知:6.5 g锌能产生0.2 g氢气,则6 g锌产生氢气小于0.2 g,铜不能产生氢气;则6g的锌和铜合金产生氢气小于
0.2 g;故选项错误;
B.铜和金都不能与稀硫酸反应产生氢气;故选项错误;
C.由锌和稀硫酸反应产生氢气Zn+H2SO4=ZnSO4+H2↑的关系可知:6.5 g锌能产生0.2 g氢气,则6 g锌产生氢气小于0.2 g,由铁和稀硫酸反应产生氢气Fe+H2SO4=FeSO4+H2↑的关系可知;5.6 g铁能产生0.2 g氢气,6.5 g铁能产生氢气大于0.2 g,则6 g的锌和铁合金可以产生0.2 g氢气;故选项正确;
D.由镁和稀硫酸反应产生氢气Mg+H2SO4=MgSO4+H2↑的关系可知:2.4 g镁能产0.2 g
氢气;6.5 g镁产生的氢气大于0.2 g,由铝和稀硫酸反应产生氢气2Al+3H2SO4=2Al2(SO4)3+3H2↑的关系可知:1.8 g铝能产生0.2 g氢气;6.0 g铝产生的氢气大于0.2 g;则6 g的镁和铝合金产生氢气质量大于0.2 g;故选项错误;
故选:C。
8.C
【解析】
A.镁的金属活动性比锌强,故镁的反应速率快,镁与稀硫酸反应:,锌与稀硫酸反应:,等质量的Mg和Zn中加入等质量、等浓度且过量的稀硫酸,镁的相对原子质量小于锌,最后镁产生的氢气质量大,图像中表示的是锌反应快,错误,不符合题意;
B.镁的金属活动性比锌强,故镁的反应速率快,等质量且足量的Mg和Zn中 加入等质量、等浓度的稀硫酸,最后生成氢气的质量一样大,不符合题意;
C.镁的金属活动性比锌强,故镁的反应速率快,等质量且足量的Mg和Zn中 加入等质量、等浓度的稀硫酸,最后生成氢气的质量一样大,符合题意;
D.镁的金属活动性比锌强,故镁的反应速率快,镁与稀硫酸反应:,锌与稀硫酸反应:,等质量的Mg和Zn中加入等质量、等浓度且过量的稀硫酸,镁的相对原子质量小于锌,最后镁产生的氢气质量大,不符合题意;
故选C。
9.A
【解析】
解:设锌的质量为,
铜在空气中高温灼烧,质量仍然是m g,说明锌的质量和反应的氧气质量相等,
则原混合物中锌粉的质量分数为:,
故选:A。
10.B
【解析】
碳、铜和盐酸不反应,而锌、铁、镁、铝与酸反应时,金属和氢气的质量关系如下:
同质量的四种金属,生成氢气的关系:铝>镁>铁>锌。故:
A.锌和铜混合物比同质量的铁生成氢气少,选项错误;
B.锌和镁混合物可能与同质量的铁生成氢气相同,选项正确;
C.铝和镁混合物比同质量的铁生成氢气多,选项错误;
D.碳和铜混合物不与酸生成氢气,选项错误。
故选B。
11.C
【解析】
A.如果金属都过量,则生成氢气质量决定于稀硫酸,由于是质量和溶质质量分数均相同的三份稀硫酸,因此生成氢气质量相等,该选项对应关系有可能,不符合题意;
B.如果稀硫酸过量,则生成氢气质量决定于金属质量,镁、铝、锌和稀硫酸反应的化学方程式及其质量关系:
由以上质量关系可知,相等质量的金属完全反应时,铝反应生成氢气质量最大,其次是镁,锌反应生成氢气质量最小,该选项对应关系有可能,不符合题意;
C.如果镁、锌反应生成氢气质量相等,则稀硫酸不足,对于铝来说,稀硫酸也是不足,因此生成氢气质量应该相等,该选项对应关系没有可能,符合题意;
D.当铝恰好和硫酸反应时,镁过量,锌不足,镁、铝和稀硫酸反应生成的氢气质量相等,锌和稀硫酸反应生成的氢气质量小于镁、铝和稀硫酸反应生成的氢气质量,该选项对应关系可能正确,不符合题意;
故选:C。
12.B
【解析】
A.铝是过量的,硝酸银、硝酸铜均完全反应,则滤液中一定含Al3+,无铜离子和银离子,故选项说法错误;
B.铝是过量的,滤渣中一定含Ag、Cu、Al,故选项说法正确;
C.铝是过量的,硝酸银、硝酸铜均完全反应,则滤液中一定含Al3+,一定不含Cu2+、Ag+,故选项说法错误;
D.铝是过量的,滤渣中一定含Ag、Cu、Al,故选项说法错误。
故选:B。
13.B
【解析】
A.等质量的Mg、Fe、Zn三种金属分别放入质量和溶质质量分数均相同的三份足量的稀盐酸中,产生的氢气的质量可用金属的化合价÷金属相对原子质量的比值进行比较,则有,由于它们的金属活动性顺序为Mg>Zn>Fe;分析图象可知,质量均为10克的Mg、Fe、Zn三种金属分别放入质量和溶质质量分数均相同的三份足量的稀盐酸中,产生氢气的质量与图象一致,故A正确;
B.分析图象可知,当10 gMg、10 gZn分别放入质量和溶质质量分数均相同的两份的稀盐酸中产生等质量氢气时,说明金属镁是过量的,而锌是恰好与酸完全反应或是过量,则10 gFe一定是过量的,产生的氢气应与10 gMg、Zn产生氢气相同,故B错误;
C.质量均为10克的Mg、Fe、Zn三种金属分别放入一定质量和溶质质量分数均相同的三份的稀盐酸中,当10 g铁与盐酸恰好完全反应时,根据A选项分析,10 g镁是过量的,则镁和铁产生的氢气质量相等,而10 g锌产生氢气的质量小于10 g镁和铁,与图象一致,故C正确;
D.等质量且足量的Mg、Fe、Zn三种金属分别放入一定质量和溶质质量分数均相同的三份的稀盐酸中,产生的氢气是相等的,则将质量均为10克且足量的Mg、Fe、Zn三种金属分别放入质量和溶质质量分数均相同的三份稀盐酸中,反应完成后,酸都被消耗,则生成氢气的质量相等,与图象一致,故D正确。
故选:B。
14.D
【解析】
A.金属粉末与稀硫酸反应,得到无色溶液,固体无剩余,说明粉末中一定不包括铁和银,通过上面计算可知,金属粉末可能组成为镁、铝和锌、铝、镁和锌,组成有三种可能,说法错误;
B.由质量守恒定律可知:生成的氢气中氢元素都来源于硫酸中的氢元素,生成0.2 g氢气,100 g一定溶质质量分数的稀硫酸中氢元素的质量=0.2 g,则硫酸溶液中硫酸的质量=,稀硫酸的溶质质量分数=,说法错误;
C.由A可知,该样品中不一定含有镁,说法错误;
D.反应后所得溶液中溶质的为金属硫酸盐,金属的质量=2.4 g,硫酸根的质量=,所得溶液中溶质的质量=9.6 g+2.4 g=12 g;
答案:D。
15.A
【解析】
由题目信息可知,假设金属镁的质量为x,产生的氢气质量为y,由反应方程式可得,并由此得到关系式: ,;
假设合金中,铁的质量为a,铝的质量为b,根据铁和铝与盐酸反应的方程式可以得出,铁与盐酸反应产生的氢气的质量为:,铝与盐酸反应产生的氢气的质量为:;
由于金属镁和合金的质量相等,则有:,且二者产生的氢气也相等,故可以得出以下关系式: ,化简可以得出:,;
所以合金中铁、铝元素的质量比为7∶12,故选择A。
16.不溶性杂质 漏斗、烧杯、玻璃棒 铁 CuSO4+Fe=FeSO4+Cu 稀硫酸 H2SO4+Fe=FeSO4+H2↑
【解析】
(1)过滤是将不溶性固体从溶液中分离出来的操作,组装过滤器需要的仪器有:铁架台、漏斗、滤纸、烧杯和玻璃棒,其中玻璃仪器为:漏斗、烧杯、玻璃棒.
(2)从图框中可以知道,向废液中加入过量的金属X得到了不纯的铜,根据题干要求及废水中的成分并结合最后得到物质为硫酸亚铁晶体,可以判断金属X为铁;铜排在氢后面,不与酸反应,而铁排在氢前面,与酸反应,因此为除去混在铜粉里的铁粉并且得到FeSO4溶液,把金属混合物放入足量的稀硫酸并过滤即可,故溶液Y为稀硫酸.
故答为:(1)不溶性杂质,漏斗、烧杯、玻璃棒;(2)铁,CuSO4+Fe=FeSO4+Cu,稀硫酸,H2SO4+Fe=FeSO4+H2↑.
17.a H2SO4 Fe
【解析】
试题分析:(1)通过观察产生氢气的质量与时间的关系图,可以看出a反应速率更快,从而说明金属a 的活动性更强,故表示锌粉与稀硫酸反应的曲线是:a
(2)由于曲线a 表示的是锌粉与稀硫酸反应的曲线,等质量的锌粉和铁粉,锌消耗的H2SO4质量更小,故对于锌来说,H2SO4有剩余
(3)根据反应:Zn + H2SO4 ===ZnSO4 + H2↑中Zn与H2SO4的质量关系为65:98,而反应:Fe + H2SO4 ===FeSO4 + H2↑中Fe与H2SO4的质量关系为56:98,故相同质量的H2SO4,消耗Zn的质量更多,故若有一种金属剩余,则剩余的金属一定是Fe。
考点:金属与酸反应的现象及有关计算
18.单质 稳定
【解析】
(1)沙里淘金是物理变化,说明沙子里黄金是以单质的形式存在;
(2)黄金在高温的条件下不与氧气反应,说明黄金的化学性质不活泼;
19.硫酸 镁
【解析】
【详解】
等质量的Zn、Mg分别放入等质量等浓度(溶质质量分数)的稀硫酸中。若生成氢气相等,则参加反应的硫酸的质量相等,参加反应的锌的质量大于镁的质量,分别放入等质量等浓度(溶质质量分数)的稀硫酸中的Zn、Mg质量相等,故镁一定有剩余,所以一定没有剩余的是硫酸。
20.置换反应; A 10%
【解析】
(1)铁与硫酸铜的反应产物是铜与硫酸亚铁,其方程式为:Fe+CuSO4═FeSO4+Cu,该反应的反应物、生成物均是一种单质与一种化合物,所以属于置换反应;(2)A.使用托盘天平称量时,用镊子取用砝码,防止污染砝码,正确;B.在托盘天平上称量药品时,要注意称量一般药品时,要在左、右盘上放相同质量的纸,如果称量易潮解、有腐蚀性的药品时,必须放到玻璃器皿中称量,否则会把托盘腐蚀,造成称量的误差,错误;C.观察分度盘的指针是否在中间判断天平平衡,不是观察左右托盘高度,错误;D.称取一定质量的铁粉,应先加砝码,再调节游码,然后再将铁粉放在托盘上,直至天平平衡,错误。故选A;
(3)设硫酸铜的质量为x,
Fe+CuSO4═FeSO4+Cu
56 160
5.6 g x
x=16 g
该硫酸铜溶液中溶质质量的分数=×100%=10%
21.金属 8 四 原子 SO3 A AC AC
【解析】
【分析】
金属材料包括纯金属和合金,四氧化三铁和一氧化碳高温生成铁和二氧化碳,锌和硫酸亚铁反应生成铁和硫酸锌,铁和硫酸铜反应生成硫酸锌和铜,锌和稀硫酸反应生成硫酸锌和氢气,铁和稀硫酸反应生成硫酸亚铁和氢气。
【详解】
(1)金属材料包括纯金属和合金,故钛合金属于金属材料。
(2)在原子中,质子数=核外电子数,由钛原子结构示意图,,则;钛原子核外有4个电子层,故钛元素位于元素周期表第四周期。
(3)金属是由原子构成的,故构成金属钛的粒子是原子,由质量守恒定律可知,反应前后原子种类和数目均相同,工业制取钛的反应为:,反应前有1个钛原子,4个氟原子,4个氢原子,2个硫原子,8个氧原子,反应后有4个氢原子,4个氟原子,1个钛原子,2个氧原子,还有2个硫原子,6个氧原子,X前面的化学计量数为2,故X的化学式为SO3。
(4)利用新技术能将不锈钢加工成柔软的金属丝,用它和棉纤维一起编织成性能优良的劳保防护服,这是利用了不锈钢延展性,故选A。
(5)以磁铁矿为原料炼铁的反应是四氧化三铁和一氧化碳高温生成铁和二氧化碳,故反应的化学方程式为。
(6)A.锌和硫酸亚铁反应生成铁和硫酸锌,则锌的金属活动性强于铁,铜和硫酸亚铁不反应,则铁的金属活动性强于铜,则三种金属的活动性顺序为锌、铁、铜,故A正确;
B.Cu、Fe均和ZnSO4溶液不反应,说明铜、铁的金属活动性弱于锌,不能比较铜、铁的金属活动,故B不正确;
C.铁和硫酸锌不反应,说明锌的金属活动性强于铁,铁和硫酸铜反应生成硫酸锌和铜,说明铁的金属活动性强于铜,则三种金属的活动性顺序为锌、铁、铜,故C正确;
D.锌和硫酸亚铁反应生成铁和硫酸锌,锌和硫酸铜反应生成硫酸锌和铜,说明锌的金属活动性强于铁、铜,不能比较铜、铁的金属活动,故D不正确。故选AC。
(7)A.在金属活动性顺序表中,锌的金属活动性强于铁,和稀硫酸反应速率较快,反应需要时间短,反应的关系式为,,65份的锌和稀硫酸反应生成2份的氢气,56份的铁和稀硫酸反应生成2份的氢气,等质量的两种金属,最终铁和稀硫酸反应生成的氢气多,因此甲是铁,乙是锌,故A正确;
B.锌的金属活动性强于铁,和稀硫酸反应速率较快,反应需要时间短,等质量的两种金属,最终铁和稀硫酸反应生成的氢气多,甲是铁,乙是锌,故B不正确;
C.图1中由生成氢气的质量可知,当锌完全反应后,铁还继续反应生成氢气,说明和锌反应的稀硫酸有剩余,故C正确;
D.图2中最终生成氢气质量相等,说明稀硫酸完全反应,铁一定有剩余,故D不正确。故选AC。
【点睛】
由质量守恒定律可知,反应前后原子种类和数目均相同,在金属活动性顺序表中,前面的金属和后面的金属的盐溶液反应,把其从盐溶液中置换出来。
22.这种说法不正确。根据金属活动性顺序表,锌比铁活泼,海水中先腐蚀锌片从而保护了铁制品。
【解析】
这种说法不正确。锌的活动性比铁强,在轮船的金属外壳上铆上一些锌片,根据金属活动性顺序表,锌比铁活泼,海水中先腐蚀锌片从而保护了铁制品。
23.Fe + 2HCl = FeCl2+H2↑ A、C
【解析】
根据金属的活动性顺序可知,铁与稀盐酸反应生成氯化亚铁和氢气,而铜与稀盐酸不反应;反应的方程式是:Fe+2HCl=FeCl2+H2↑;随着反应的进行,氢气的质量增加,当铁完全反应后,氢气的质量不再改变;随着铁的反应,金属混合物的质量不断减小,当铁完全反应后,剩余固体是铜,质量不再减小。所以AC正确。
试卷第2页,共18页
1
