10.2酸和碱的中和反应-课件(人教版)(共67张PPT)
文档属性
| 名称 | 10.2酸和碱的中和反应-课件(人教版)(共67张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 30.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 12:19:00 | ||
图片预览










文档简介
(共67张PPT)
课题2 酸和碱的中和反应
第十单元 酸 和 碱
在一条高速公路上,一辆满载硫酸的货车发生侧翻,导致硫酸泄漏,工作人员和消防官兵正在撒熟石灰清理现场。
同学们有这样的经历吗
蚊 子 叮 咬
蜂蜜、蚊虫叮咬之时,在它们的口器中分泌出一种有机酸(蚁酸),在家庭中可使用浓肥皂水涂抹,可迅速止痒。
知道这是什么道理吗?
蜜蜂蜇伤
思 考:
酸有相似的化学性质,碱也有相似的化学性质,那么,酸和碱能否发生反应呢?
实验2、盐酸与氢氧化钠溶液混合
发生了反应
盐酸和氢氧化钠有没有发生反应呢?怎样验证?
实验1、稀硫酸与氢氧化钡溶液混合
生成白色沉淀
H2SO4+Ba(OH)2=BaSO4↓+2H2O
一、中和反应
无明显现象
借助指示剂,如先在NaOH溶液中滴加酚酞,再逐滴加入盐酸
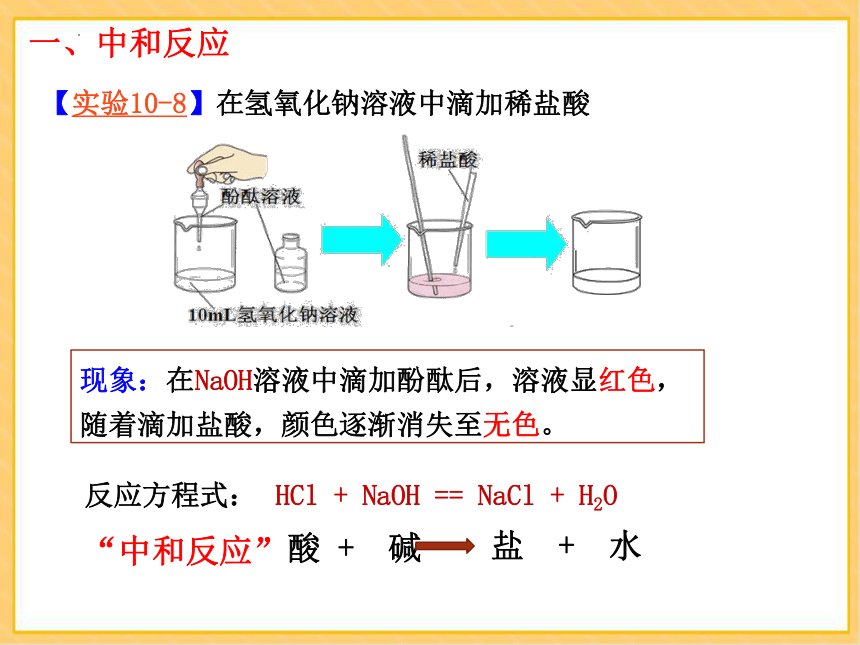
【实验10-8】在氢氧化钠溶液中滴加稀盐酸
一、中和反应
现象:在NaOH溶液中滴加酚酞后,溶液显红色,随着滴加盐酸,颜色逐渐消失至无色。
【实验10-8】在氢氧化钠溶液中滴加稀盐酸
一、中和反应
HCl + NaOH == NaCl + H2O
反应方程式:
“中和反应”
酸 + 碱
盐 + 水
1.概念:酸跟碱作用生成盐和水的反应,叫做中和反应。
2. 中和反应的实质:
一、中和反应
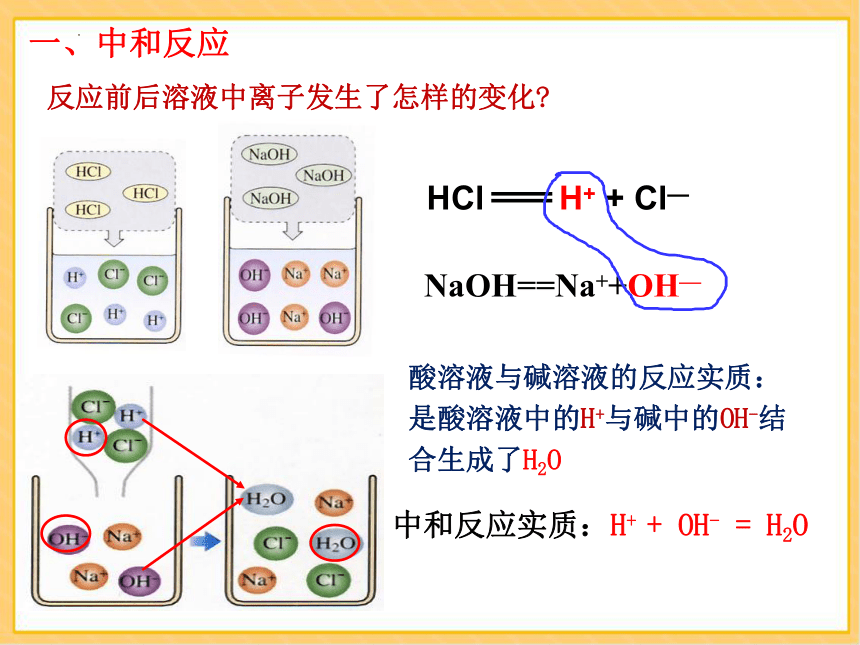
中和反应实质:H+ + OH- = H2O
一、中和反应
反应前后溶液中离子发生了怎样的变化
HCl H+ + Cl—
NaOH==Na++OH—
酸溶液与碱溶液的反应实质:是酸溶液中的H+与碱中的OH-结合生成了H2O
1.概念:酸跟碱作用生成盐和水的反应,叫做中和反应。
2. 中和反应的实质:
H+ + OH – = H2O
一、中和反应
答:不对。因为能生成盐和水的反应有3种
① 酸 + 金属氧化物 = 盐 + 水
如:2HCl + CuO = CuCl2 + H2O
② 酸 + 碱 = 盐 + 水
如:HCl + NaOH = NaCl + H2O
③ 碱 + 酸性氧化物 = 盐 + 水
如:2NaOH + CO2 = Na2CO3 + H2O
思考:有人说:凡是生成盐和水的反应就是中和反应,对不对?
3. 中和反应的注意事项:
任意酸与碱都能发生中和反应,都生成盐和水
中和反应隶属于复分解反应
中和反应是放热反应,并且恰好反应时放出的热量最多
(放热反应还有:CaO+H2O=Ca(OH)2;活泼金属与酸的反应)
④中和反应生成盐和水,但生成盐和水的反应不一定是中和反应。
一、中和反应
1.概念:酸跟碱作用生成盐和水的反应,叫做中和反应。
2. 中和反应的实质:
H+ + OH – = H2O
我们化学上所说的“盐”,是否就是我们日常生活中所说的“盐”?
“盐”:由金属离子(或铵根离子)和酸根离子构成的化合物
例如:NaCl、Na2CO3、CaCO3、KMnO4、CuSO4、Fe(NO3)3、NaHCO3、NH4NO3、FeCl3等等。
常见酸根离子:
CO32-(碳酸根离子)、SO42-(硫酸根离子)、NO3-(硝酸根离子)
Cl-(氯离子)、HCO3-(碳酸氢根离子)
思考与交流:
随堂练习
1.下列反应属于中和反应的是( )
A.CuO + H2SO4 = CuSO4 + H2O
B.Ca(OH)2 + 2HCl = CaCl2 + 2H2O
C.2NaOH + SO2 = Na2SO3 + H2O
D.2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
B
NaOH + H2SO4 ==
NaOH + HNO3 ==
Ca(OH)2 + HCl ==
Ca(OH)2 + HNO3 ==
Na2SO4 + 2H2O
NaNO3 + H2O
CaCl2 + 2H2O
Ca(NO3)2 + 2H2O
2
2
2
2.试着完成以下反应的化学方程式:
HCl + KOH ==
KCl + H2O
二、中和反应在实际中的应用
植物需要在一定酸碱性的土壤中生长,但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长,应怎样去改变酸性土壤?
用熟石灰中和。
1、农业:改良土壤的酸碱性
2、处理工厂的废水
①硫酸厂的污水怎么处理
Ca(OH)2+H2SO4=CaSO4+2H2O
用熟石灰进行中和处理
②假如印染厂的废水呈碱性,
我们应如何处理?
可加入硫酸进行中和
二、中和反应在实际中的应用
3、医疗:治疗胃酸过多
Al(OH)3+3HCl=AlCl3+3H2O
①氢氧化铝能中和胃酸
(胃酸的主要成分是盐酸)
②也可用Mg(OH)2中和胃酸
Mg(OH)2+2HCl=MgCl2+2H2O
二、中和反应在实际中的应用
NaHCO3 + HCl = NaCl + H2O + C02↑
③小苏打片(主要成分是NaHCO3)
注意:胃酸过多同时有胃溃疡的患者,
不能服用小苏打,溶液造成胃穿孔!
4.其它
改善生活:
食醋去除皮蛋的涩味、食醋去除热水壶上的水垢等。
中和蚊虫叮咬时“注射”的蚁酸可以用含碱性物质的溶液,如肥皂水、稀氨水。
二、中和反应在实际中的应用
思考:化学实验产生的酸性或碱性废液能否直接倒入下水道中?应如何处理?
交流讨论
不能。应该用相应试剂将溶液调节为中性,再倒入指定的容器中统一处理。
课堂小结
概念
中和反应
应用
酸和碱作用生成盐和水的反应。
实质
(1)改良土壤酸碱性
(2)处理工厂废水
(3)用于医药
H+ + OH – = H2O
1. 土壤酸化会降低土壤微生物的活性,溶出土壤的营养元素,造成土壤贫瘠化。科学家正在考虑利用中和反应原理解决这一世界难题。下列反应属于中和反应的是( )
A. CO2+2NaOH == Na2CO3+H2O
B. Fe2O3+3H2SO4 == Fe2(SO4)3+3H2O
C. Fe+2HCl == FeCl2+H2↑
D. KOH+HNO3 == KNO3+H2O
D
典例探究
2.下列实际应用中,不是利用中和反应原理的是( )
①施用熟石灰改良酸性土壤
②用熟石灰和硫酸铜配制杀菌剂
③用硫酸除铁锈
④生石灰作干燥剂
⑤服用胃舒平[主要成分为Al(OH)3]治疗胃酸过多
A.①②③ B.①④⑤ C.②④⑤ D.②③④
典例探究
D
日常生活中,在我们吃食醋、橘子、葡萄等水果时,会感到它们酸的程度是不一样的,那么,如何表示物质酸性的强弱呢
三、溶液酸碱度的表示法—pH
溶液的酸碱性指的是溶液呈酸性、碱性还是中性。
酸性溶液:
能使紫色石蕊试液变红的溶液。
碱性溶液:
能使紫色石蕊试液变蓝,使无色酚酞试液变红的溶液。
中性溶液:
不能使石蕊及酚酞试液变色的溶液。
常用酸碱指示剂测定;
2.常温时,pH的范围在0~14之间。
酸性溶液pH<7
碱性溶液pH>7
中性溶液pH=7
pH越小,酸性越强
pH越大,碱性越强
(如NaCl溶液、Na2SO4溶液的pH=7)
三、溶液酸碱度的表示法—pH
1.化学上用pH表示溶液酸碱性的强弱程度。
三、溶液酸碱度的表示法—pH
②pH是溶液中所含H+的浓度或OH-浓度大小的一种表示方法,溶液中H+浓度越大,则酸性越强,pH越小;
溶液中OH-的浓度越大,则碱性越强,pH越大;
当溶液中H+和OH-浓度相等时,则溶液的pH=7,呈中性。
①溶液酸性越强,pH越小;溶液碱性越强,pH越大。
注意:
2.常温时,pH的范围在0~14之间。
1.化学上用pH表示溶液酸碱性的强弱程度。
3. 溶液的浓度与pH的关系
浓度越小,酸性越弱,pH越大;
浓度越小,碱性越弱,pH越小;
浓度越大,酸性越强,pH越小。
浓度越大,碱性越强,pH越大。
酸溶液
碱溶液
三、溶液酸碱度的表示法—pH
问:NaCl 的水溶液呢?浓度对pH有什么影响?
氯化钠溶液是中性的, pH =7,所以不管溶液的浓度高低,溶液的pH都是7,因此无影响。
4、pH的测定——用pH试纸测定(最简便的方法)
测定方法:在白瓷板或玻璃片上放一小片pH 试纸,用干净的玻璃棒蘸取被测液滴到试纸中央,待试纸显示后,与标准比色卡比较,即可得出被测液的pH 。
三、溶液酸碱度的表示法—pH
标准比色卡
pH试纸
注意:两种错误的测定方法:
1、直接将PH试纸放入待测液中
2、事先用蒸馏水将PH试纸润湿
容易带入杂质,将原溶液污染了
原溶液为酸性,会使pH变大;
原溶液为碱性,会使pH变小;
原溶液为中性,不会对pH影响;
三、溶液酸碱度的表示法—pH
用水润湿后的pH试纸会将待测溶液稀释,从而导致误差
(1)我们实验室一般使用的pH试纸是广泛pH试纸,
测出的pH值是1~14的整数;
酸度计
几点说明:
三、溶液酸碱度的表示法—pH
(2)更精确的pH测试仪器——pH计
(酸度计)
(3)酸溶液都是酸性溶液,但酸性溶液不一定是酸溶液,例如NH4NO3溶液是酸性溶液,但不是酸溶液, NH4NO3是一种盐。
总之,酸性溶液包含酸溶液。
酸溶液
酸性溶液
三、溶液酸碱度的表示法—pH
几点说明:
酸溶液的pH<7,碱溶液的pH>7。
即:酸溶液显酸性,碱溶液显碱性。
(4)碱溶液都是碱性溶液,但碱性溶液不一定是碱溶液,例如Na2CO3溶液是碱性溶液,但不是碱溶液, Na2CO3是一种盐.
总之,碱性溶液包含碱溶液.
碱溶液
碱性溶液
酸溶液的pH<7,碱溶液的pH>7。
即:酸溶液显酸性,碱溶液显碱性。
三、溶液酸碱度的表示法—pH
几点说明:
⑴加碱: pH增大至=或﹥ 7
若pH
﹤7
﹥7
若pH
⑵加水: pH增大至≈7
⑴加酸: pH减小到=或﹤ 7
⑵加水: pH减小至≈7
调节溶液pH的方法
三、溶液酸碱度的表示法—pH
实验10-9 10-10
三、溶液酸碱度的表示法—pH
填写P63表格
测定生活中一些物质的pH,说明它们的酸碱性。
实验10-9 10-10
三、溶液酸碱度的表示法—pH
填写P63表格
1. 小明不慎被蜜蜂蜇伤,蜜蜂的刺液是酸性的,下列物品中可以用来涂抹在蜇伤处,减轻疼痛的是( )
A.苹果汁(pH约为3)
B.肥皂水(pH约为10)
C.矿泉水(pH约为7)
D.牛奶(pH约为6.5)
B
课堂练习
2.用pH试纸测溶液的pH,下列有关pH试纸的使用说法正确的是( )
A.把pH试纸浸入待测液
B.用湿润的玻璃棒蘸取待测液
C.把显色的pH试纸与标准比色卡对照读数
D.测出石灰水的pH为12.4
C
课堂练习
3.如图是X、Y、Z三种液体的对应近似pH,下列判断
不正确的是( )
A.X显酸性 B.Y一定是水
C.Z可能是碳酸钠溶液D. Z可使紫色石蕊溶液变蓝
课堂练习
B
4.同样是清洁剂,炉具清洁剂有强碱性,而厕所清洁剂则有强酸性,用这两种清洁剂进行实验得到的结果一定有误的是( )
A.测得炉具清洁剂pH=13
B.测得厕所清洁剂pH=8
C.炉具清洁剂使无色酚酞溶液变红
D.厕所清洁剂使紫色石蕊溶液变红
课堂练习
B
5.部分食物和体液的近似pH如表所示。下列说法中正确的是( )
A.血浆和牛奶显碱性
B.胃液和苹果汁显酸性
C.胃液比苹果汁酸性弱
D.胃酸过多的人应多饮苹果汁
课堂练习
B
1.人的体液的pH必须维持在一定范围内,如果超越正常范围,会导致生理功能失调或发生疾病,甚至出现酸中毒或碱中毒。
人体中几种重要体液的正常pH范围
体液 血液 唾液 胃液 乳汁 尿液
pH 7.35-7.45 6.6-7.1 0.9-1.5 6.6-7.6 4.7-8.4
酸碱度的意义
三、溶液酸碱度的表示法—pH
P63-64
2.大多数农作物适宜在接近中性的土壤中生长
茶
(5~5.5)
莲
(8~9)
棉花
(6~8)
水稻
(6~7)
酸碱度的意义
三、溶液酸碱度的表示法—pH
P63-64
3. 测定雨水的pH,可以了解空气的污染情况
雨水一般呈弱酸性(由于空气中的CO2溶解在雨水中),人们一般把pH小于5.6 的雨水称为酸雨。
酸雨的危害
三、溶液酸碱度的表示法—pH
了解溶液的酸碱性的重要意义:
1.化工生产中许多反应必须在一定pH溶液里才能进行;
2.在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
3.测定雨水的pH,可以了解空气的污染情况
4.测定人体内或排出的液体的pH,可以了解人体的健康状况。
归纳总结
洗发水和护发素的酸碱性
讨论:溶液的酸碱度对头发有什么影响?对你选择洗发液有什么启示?
碱性物质对头发有损坏作用。所以洗发液应选接近中性的,不要选碱性大的洗发液,然后再用微酸性的护发素来保护头发。
三、溶液酸碱度的表示法—pH
洗发水和护发素的酸碱性
课堂小结
溶液酸碱度与pH的关系
溶液酸碱度表示
了解溶液的酸碱度在实际生活中有重要的意义
pH<7 溶液呈酸性
pH>7 溶液呈碱性
pH=7 溶液呈中性
测定pH最简便的方法
使用pH试纸
1.将稀盐酸慢慢滴入装有NaOH溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸质量增加而发生变化,如图所示.有关叙述中错误的是( )
A.从a到b过程中,烧杯中溶液的pH逐渐减小
B.b点表示氢氧化钠和盐酸恰好完全反应
C.c点表示所得溶液中溶质只有NaCl
D.稀盐酸与氢氧化钠溶液发生的反应是放热反应
C
典例探究
2. 如图所示的图像能正确反映其对应变化关系的是( )
A.向一定质量的稀盐酸溶液中不断加入水
B.向一定质量的氢氧化钠溶液中不断加入稀盐酸
C.向pH=2的稀盐酸中不断加入pH=12的氢氧化钠溶液
D.向氯化钙和盐酸的混合溶液中加入过量的R,R为
碳酸钠溶液
B
【方法点拨】pH变化的图像分析
(1)酸和碱的反应
①强酸入强碱:
开始时溶液的pH>7,此时溶液呈碱性,
随着酸的加入,pH不断减小,
当酸碱恰好中和时,溶液的pH=7,
继续加入酸,溶液的pH<7,溶液呈酸性,溶液最终pH比加入酸的pH大;
②强碱入强酸:
跟“酸入碱”时情况相反。
【方法点拨】pH变化的图像分析
(2)酸、碱稀释
③酸中加水:
④碱中加水:
开始时溶液的pH<7,随着加水量的增加,pH不断增大至无限接近于7,但不会大于7;
开始时溶液的pH>7,随着加水量的增加,pH不断减小至无限接近于7,但不会小于7。
1. 山药中含有碱性皂角素,有些人皮肤沾上会奇痒难忍,涂抹下列厨房中的某物质能明显缓解不适,该物质是( )
A. 食醋 B. 花生油
C. 酱油 D. 面粉
A
随堂练习
2. ①酸奶、②肥皂水、③食盐水是生活中常见的三种物质。酸奶能使紫色石蕊溶液变红,肥皂水显碱性,食盐水的pH=7,它们的pH由小到大排列,
正确的是( )
A.①②③ B.①③② C.②①③ D.③①②
B
随堂练习
3. 下列关于“酸和碱的中和反应实验”的说法中,正确的是( )
A. 若不使用酚酞,HCl就无法和NaOH反应
B. 酚酞由红色变无色,说明发生了中和反应
C. 滴加酚酞前溶液为无色,加入稀盐酸后溶液仍无色,说明没有发生反应
D. 若将酚酞换成石蕊,则不能达到实验目的
B
解析:石蕊遇碱变蓝,遇酸变红
随堂练习
4. 下列各组物质,要借助酸碱指示剂才能判断反应发生的是( )
A. 石灰石和稀盐酸
B. Fe2O3和稀盐酸
C. 锌与稀硫酸
D. NaOH和稀HCl
D
随堂练习
5.用pH试纸测定石灰水的pH,如图所示,则测得结果与实际值相比( )
A.偏高 B.偏低 C.相等 D.无法确定
B
随堂练习
6.测得生活中一些物质的pH如下表所示,下列说法正确的是( )
随堂练习
食品 胃液 人体血液 肥皂水 洗涤剂
pH 0.8~1.5 7.35~7.45 10.2 12.2
A. 人体血液呈酸性
B. 用NaOH可以治疗胃酸过多
C. 洗涤剂比肥皂水的碱性强
D. 肥皂水能使蓝色石蕊试纸变红
C
7、下列有关pH试纸的使用说法正确的是( )
A.把pH试纸浸入待测液
B.用湿润的玻璃棒蘸取待测液
C.把显色的pH试纸与标准比色卡对照读数
D. 测出石灰水的pH为12.4
C
随堂练习
8.向部分变质的NaOH溶液中滴加过量稀盐酸,下列图像能正确反映对应变化关系的是( )
随堂练习
A
D
C
B
C
9. 根据所学中和反应在实际中的应用,回答下列问题:
(1)改良土壤的酸碱性:形成酸雨的主要气体是 ,中和土壤酸性的碱是______。
(2)处理工厂的废水:硫酸厂的污水中含有硫酸等杂质,可以用______进行处理;化学方程式为__________________________。
SO2、NO2
熟石灰
熟石灰
Ca(OH)2 + H2SO4 =CaSO4 + 2H2O
(1)实验1:证明酸和碱发生了反应。在烧杯中加入5毫升氢氧化钠溶液,滴入几滴无色酚酞溶液,此时溶液呈____色。再用滴管慢慢滴入稀硫酸,并用玻璃棒_____________,至溶液颜色恰好变为无色为止,该反应的化学方程式是_____________________________________________。
红
不断搅拌
2NaOH + H2SO4=Na2SO4 + 2H2O
10.某研究性学习小组对中和反应进行探究,请你参与实验:
①实验乙的实验目的是______________________________________________。
(2)实验2:证明酸和碱反应有水生成。小明同学取变色硅胶(吸水后由蓝色变红色)、无水醋酸(一种酸,常温下为无色液体)和氢氧化钠固体进行如图一所示的三个实验。
证明了氢氧化钠不含有水,不能使硅胶变色
10.某研究性学习小组对中和反应进行探究,请你参与实验:
(2)实验2:证明酸和碱反应有水生成。小明同学取变色硅胶(吸水后由蓝色变红色)、无水醋酸(一种酸,常温下为无色液体)和氢氧化钠固体进行如图一所示的三个实验。
②加入试剂后,要迅速塞紧橡胶塞的原因是____________________________________________。
③能证明酸和碱反应有水生成的现象是____________________________________________。
防止空气中的水分进入试管干扰实验
试管丙中的硅胶由蓝色变为红色,试管甲乙中的硅胶不变色
10.某研究性学习小组对中和反应进行探究,请你参与实验:
(3)实验3:探究酸和碱反应过程的热效应。在滴加稀硫酸的过程中,利用温度传感器测量实验过程中烧杯内液体温度的变化情况,如图二为该反应中温度与滴加的硫酸质量变化关系的理论值和测量值的曲线比较情况。
放热
低
10.某研究性学习小组对中和反应进行探究,请你参与实验:
①图示说明酸和碱的反应是______(填“吸热”或“放热”)反应,实验中测得的中和反应放出的热量比理论值____(填“高”或“低”)。
(3)实验3:探究酸和碱反应过程的热效应。在滴加稀硫酸的过程中,利用温度传感器测量实验过程中烧杯内液体温度的变化情况,如图二为该反应中温度与滴加的硫酸质量变化关系的理论值和测量值的曲线比较情况。
10.某研究性学习小组对中和反应进行探究,请你参与实验:
②请指出造成理论值和测量值差异的一点原因______________。
③图中温度达到最高值后降低的原因是____________________
_____________________________________________________。
没有采取隔热处理
完全反应后不再放热,
继续加入稀硫酸时会降温,同时溶液散热
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
课题2 酸和碱的中和反应
第十单元 酸 和 碱
在一条高速公路上,一辆满载硫酸的货车发生侧翻,导致硫酸泄漏,工作人员和消防官兵正在撒熟石灰清理现场。
同学们有这样的经历吗
蚊 子 叮 咬
蜂蜜、蚊虫叮咬之时,在它们的口器中分泌出一种有机酸(蚁酸),在家庭中可使用浓肥皂水涂抹,可迅速止痒。
知道这是什么道理吗?
蜜蜂蜇伤
思 考:
酸有相似的化学性质,碱也有相似的化学性质,那么,酸和碱能否发生反应呢?
实验2、盐酸与氢氧化钠溶液混合
发生了反应
盐酸和氢氧化钠有没有发生反应呢?怎样验证?
实验1、稀硫酸与氢氧化钡溶液混合
生成白色沉淀
H2SO4+Ba(OH)2=BaSO4↓+2H2O
一、中和反应
无明显现象
借助指示剂,如先在NaOH溶液中滴加酚酞,再逐滴加入盐酸
【实验10-8】在氢氧化钠溶液中滴加稀盐酸
一、中和反应
现象:在NaOH溶液中滴加酚酞后,溶液显红色,随着滴加盐酸,颜色逐渐消失至无色。
【实验10-8】在氢氧化钠溶液中滴加稀盐酸
一、中和反应
HCl + NaOH == NaCl + H2O
反应方程式:
“中和反应”
酸 + 碱
盐 + 水
1.概念:酸跟碱作用生成盐和水的反应,叫做中和反应。
2. 中和反应的实质:
一、中和反应
中和反应实质:H+ + OH- = H2O
一、中和反应
反应前后溶液中离子发生了怎样的变化
HCl H+ + Cl—
NaOH==Na++OH—
酸溶液与碱溶液的反应实质:是酸溶液中的H+与碱中的OH-结合生成了H2O
1.概念:酸跟碱作用生成盐和水的反应,叫做中和反应。
2. 中和反应的实质:
H+ + OH – = H2O
一、中和反应
答:不对。因为能生成盐和水的反应有3种
① 酸 + 金属氧化物 = 盐 + 水
如:2HCl + CuO = CuCl2 + H2O
② 酸 + 碱 = 盐 + 水
如:HCl + NaOH = NaCl + H2O
③ 碱 + 酸性氧化物 = 盐 + 水
如:2NaOH + CO2 = Na2CO3 + H2O
思考:有人说:凡是生成盐和水的反应就是中和反应,对不对?
3. 中和反应的注意事项:
任意酸与碱都能发生中和反应,都生成盐和水
中和反应隶属于复分解反应
中和反应是放热反应,并且恰好反应时放出的热量最多
(放热反应还有:CaO+H2O=Ca(OH)2;活泼金属与酸的反应)
④中和反应生成盐和水,但生成盐和水的反应不一定是中和反应。
一、中和反应
1.概念:酸跟碱作用生成盐和水的反应,叫做中和反应。
2. 中和反应的实质:
H+ + OH – = H2O
我们化学上所说的“盐”,是否就是我们日常生活中所说的“盐”?
“盐”:由金属离子(或铵根离子)和酸根离子构成的化合物
例如:NaCl、Na2CO3、CaCO3、KMnO4、CuSO4、Fe(NO3)3、NaHCO3、NH4NO3、FeCl3等等。
常见酸根离子:
CO32-(碳酸根离子)、SO42-(硫酸根离子)、NO3-(硝酸根离子)
Cl-(氯离子)、HCO3-(碳酸氢根离子)
思考与交流:
随堂练习
1.下列反应属于中和反应的是( )
A.CuO + H2SO4 = CuSO4 + H2O
B.Ca(OH)2 + 2HCl = CaCl2 + 2H2O
C.2NaOH + SO2 = Na2SO3 + H2O
D.2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
B
NaOH + H2SO4 ==
NaOH + HNO3 ==
Ca(OH)2 + HCl ==
Ca(OH)2 + HNO3 ==
Na2SO4 + 2H2O
NaNO3 + H2O
CaCl2 + 2H2O
Ca(NO3)2 + 2H2O
2
2
2
2.试着完成以下反应的化学方程式:
HCl + KOH ==
KCl + H2O
二、中和反应在实际中的应用
植物需要在一定酸碱性的土壤中生长,但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长,应怎样去改变酸性土壤?
用熟石灰中和。
1、农业:改良土壤的酸碱性
2、处理工厂的废水
①硫酸厂的污水怎么处理
Ca(OH)2+H2SO4=CaSO4+2H2O
用熟石灰进行中和处理
②假如印染厂的废水呈碱性,
我们应如何处理?
可加入硫酸进行中和
二、中和反应在实际中的应用
3、医疗:治疗胃酸过多
Al(OH)3+3HCl=AlCl3+3H2O
①氢氧化铝能中和胃酸
(胃酸的主要成分是盐酸)
②也可用Mg(OH)2中和胃酸
Mg(OH)2+2HCl=MgCl2+2H2O
二、中和反应在实际中的应用
NaHCO3 + HCl = NaCl + H2O + C02↑
③小苏打片(主要成分是NaHCO3)
注意:胃酸过多同时有胃溃疡的患者,
不能服用小苏打,溶液造成胃穿孔!
4.其它
改善生活:
食醋去除皮蛋的涩味、食醋去除热水壶上的水垢等。
中和蚊虫叮咬时“注射”的蚁酸可以用含碱性物质的溶液,如肥皂水、稀氨水。
二、中和反应在实际中的应用
思考:化学实验产生的酸性或碱性废液能否直接倒入下水道中?应如何处理?
交流讨论
不能。应该用相应试剂将溶液调节为中性,再倒入指定的容器中统一处理。
课堂小结
概念
中和反应
应用
酸和碱作用生成盐和水的反应。
实质
(1)改良土壤酸碱性
(2)处理工厂废水
(3)用于医药
H+ + OH – = H2O
1. 土壤酸化会降低土壤微生物的活性,溶出土壤的营养元素,造成土壤贫瘠化。科学家正在考虑利用中和反应原理解决这一世界难题。下列反应属于中和反应的是( )
A. CO2+2NaOH == Na2CO3+H2O
B. Fe2O3+3H2SO4 == Fe2(SO4)3+3H2O
C. Fe+2HCl == FeCl2+H2↑
D. KOH+HNO3 == KNO3+H2O
D
典例探究
2.下列实际应用中,不是利用中和反应原理的是( )
①施用熟石灰改良酸性土壤
②用熟石灰和硫酸铜配制杀菌剂
③用硫酸除铁锈
④生石灰作干燥剂
⑤服用胃舒平[主要成分为Al(OH)3]治疗胃酸过多
A.①②③ B.①④⑤ C.②④⑤ D.②③④
典例探究
D
日常生活中,在我们吃食醋、橘子、葡萄等水果时,会感到它们酸的程度是不一样的,那么,如何表示物质酸性的强弱呢
三、溶液酸碱度的表示法—pH
溶液的酸碱性指的是溶液呈酸性、碱性还是中性。
酸性溶液:
能使紫色石蕊试液变红的溶液。
碱性溶液:
能使紫色石蕊试液变蓝,使无色酚酞试液变红的溶液。
中性溶液:
不能使石蕊及酚酞试液变色的溶液。
常用酸碱指示剂测定;
2.常温时,pH的范围在0~14之间。
酸性溶液pH<7
碱性溶液pH>7
中性溶液pH=7
pH越小,酸性越强
pH越大,碱性越强
(如NaCl溶液、Na2SO4溶液的pH=7)
三、溶液酸碱度的表示法—pH
1.化学上用pH表示溶液酸碱性的强弱程度。
三、溶液酸碱度的表示法—pH
②pH是溶液中所含H+的浓度或OH-浓度大小的一种表示方法,溶液中H+浓度越大,则酸性越强,pH越小;
溶液中OH-的浓度越大,则碱性越强,pH越大;
当溶液中H+和OH-浓度相等时,则溶液的pH=7,呈中性。
①溶液酸性越强,pH越小;溶液碱性越强,pH越大。
注意:
2.常温时,pH的范围在0~14之间。
1.化学上用pH表示溶液酸碱性的强弱程度。
3. 溶液的浓度与pH的关系
浓度越小,酸性越弱,pH越大;
浓度越小,碱性越弱,pH越小;
浓度越大,酸性越强,pH越小。
浓度越大,碱性越强,pH越大。
酸溶液
碱溶液
三、溶液酸碱度的表示法—pH
问:NaCl 的水溶液呢?浓度对pH有什么影响?
氯化钠溶液是中性的, pH =7,所以不管溶液的浓度高低,溶液的pH都是7,因此无影响。
4、pH的测定——用pH试纸测定(最简便的方法)
测定方法:在白瓷板或玻璃片上放一小片pH 试纸,用干净的玻璃棒蘸取被测液滴到试纸中央,待试纸显示后,与标准比色卡比较,即可得出被测液的pH 。
三、溶液酸碱度的表示法—pH
标准比色卡
pH试纸
注意:两种错误的测定方法:
1、直接将PH试纸放入待测液中
2、事先用蒸馏水将PH试纸润湿
容易带入杂质,将原溶液污染了
原溶液为酸性,会使pH变大;
原溶液为碱性,会使pH变小;
原溶液为中性,不会对pH影响;
三、溶液酸碱度的表示法—pH
用水润湿后的pH试纸会将待测溶液稀释,从而导致误差
(1)我们实验室一般使用的pH试纸是广泛pH试纸,
测出的pH值是1~14的整数;
酸度计
几点说明:
三、溶液酸碱度的表示法—pH
(2)更精确的pH测试仪器——pH计
(酸度计)
(3)酸溶液都是酸性溶液,但酸性溶液不一定是酸溶液,例如NH4NO3溶液是酸性溶液,但不是酸溶液, NH4NO3是一种盐。
总之,酸性溶液包含酸溶液。
酸溶液
酸性溶液
三、溶液酸碱度的表示法—pH
几点说明:
酸溶液的pH<7,碱溶液的pH>7。
即:酸溶液显酸性,碱溶液显碱性。
(4)碱溶液都是碱性溶液,但碱性溶液不一定是碱溶液,例如Na2CO3溶液是碱性溶液,但不是碱溶液, Na2CO3是一种盐.
总之,碱性溶液包含碱溶液.
碱溶液
碱性溶液
酸溶液的pH<7,碱溶液的pH>7。
即:酸溶液显酸性,碱溶液显碱性。
三、溶液酸碱度的表示法—pH
几点说明:
⑴加碱: pH增大至=或﹥ 7
若pH
﹤7
﹥7
若pH
⑵加水: pH增大至≈7
⑴加酸: pH减小到=或﹤ 7
⑵加水: pH减小至≈7
调节溶液pH的方法
三、溶液酸碱度的表示法—pH
实验10-9 10-10
三、溶液酸碱度的表示法—pH
填写P63表格
测定生活中一些物质的pH,说明它们的酸碱性。
实验10-9 10-10
三、溶液酸碱度的表示法—pH
填写P63表格
1. 小明不慎被蜜蜂蜇伤,蜜蜂的刺液是酸性的,下列物品中可以用来涂抹在蜇伤处,减轻疼痛的是( )
A.苹果汁(pH约为3)
B.肥皂水(pH约为10)
C.矿泉水(pH约为7)
D.牛奶(pH约为6.5)
B
课堂练习
2.用pH试纸测溶液的pH,下列有关pH试纸的使用说法正确的是( )
A.把pH试纸浸入待测液
B.用湿润的玻璃棒蘸取待测液
C.把显色的pH试纸与标准比色卡对照读数
D.测出石灰水的pH为12.4
C
课堂练习
3.如图是X、Y、Z三种液体的对应近似pH,下列判断
不正确的是( )
A.X显酸性 B.Y一定是水
C.Z可能是碳酸钠溶液D. Z可使紫色石蕊溶液变蓝
课堂练习
B
4.同样是清洁剂,炉具清洁剂有强碱性,而厕所清洁剂则有强酸性,用这两种清洁剂进行实验得到的结果一定有误的是( )
A.测得炉具清洁剂pH=13
B.测得厕所清洁剂pH=8
C.炉具清洁剂使无色酚酞溶液变红
D.厕所清洁剂使紫色石蕊溶液变红
课堂练习
B
5.部分食物和体液的近似pH如表所示。下列说法中正确的是( )
A.血浆和牛奶显碱性
B.胃液和苹果汁显酸性
C.胃液比苹果汁酸性弱
D.胃酸过多的人应多饮苹果汁
课堂练习
B
1.人的体液的pH必须维持在一定范围内,如果超越正常范围,会导致生理功能失调或发生疾病,甚至出现酸中毒或碱中毒。
人体中几种重要体液的正常pH范围
体液 血液 唾液 胃液 乳汁 尿液
pH 7.35-7.45 6.6-7.1 0.9-1.5 6.6-7.6 4.7-8.4
酸碱度的意义
三、溶液酸碱度的表示法—pH
P63-64
2.大多数农作物适宜在接近中性的土壤中生长
茶
(5~5.5)
莲
(8~9)
棉花
(6~8)
水稻
(6~7)
酸碱度的意义
三、溶液酸碱度的表示法—pH
P63-64
3. 测定雨水的pH,可以了解空气的污染情况
雨水一般呈弱酸性(由于空气中的CO2溶解在雨水中),人们一般把pH小于5.6 的雨水称为酸雨。
酸雨的危害
三、溶液酸碱度的表示法—pH
了解溶液的酸碱性的重要意义:
1.化工生产中许多反应必须在一定pH溶液里才能进行;
2.在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
3.测定雨水的pH,可以了解空气的污染情况
4.测定人体内或排出的液体的pH,可以了解人体的健康状况。
归纳总结
洗发水和护发素的酸碱性
讨论:溶液的酸碱度对头发有什么影响?对你选择洗发液有什么启示?
碱性物质对头发有损坏作用。所以洗发液应选接近中性的,不要选碱性大的洗发液,然后再用微酸性的护发素来保护头发。
三、溶液酸碱度的表示法—pH
洗发水和护发素的酸碱性
课堂小结
溶液酸碱度与pH的关系
溶液酸碱度表示
了解溶液的酸碱度在实际生活中有重要的意义
pH<7 溶液呈酸性
pH>7 溶液呈碱性
pH=7 溶液呈中性
测定pH最简便的方法
使用pH试纸
1.将稀盐酸慢慢滴入装有NaOH溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸质量增加而发生变化,如图所示.有关叙述中错误的是( )
A.从a到b过程中,烧杯中溶液的pH逐渐减小
B.b点表示氢氧化钠和盐酸恰好完全反应
C.c点表示所得溶液中溶质只有NaCl
D.稀盐酸与氢氧化钠溶液发生的反应是放热反应
C
典例探究
2. 如图所示的图像能正确反映其对应变化关系的是( )
A.向一定质量的稀盐酸溶液中不断加入水
B.向一定质量的氢氧化钠溶液中不断加入稀盐酸
C.向pH=2的稀盐酸中不断加入pH=12的氢氧化钠溶液
D.向氯化钙和盐酸的混合溶液中加入过量的R,R为
碳酸钠溶液
B
【方法点拨】pH变化的图像分析
(1)酸和碱的反应
①强酸入强碱:
开始时溶液的pH>7,此时溶液呈碱性,
随着酸的加入,pH不断减小,
当酸碱恰好中和时,溶液的pH=7,
继续加入酸,溶液的pH<7,溶液呈酸性,溶液最终pH比加入酸的pH大;
②强碱入强酸:
跟“酸入碱”时情况相反。
【方法点拨】pH变化的图像分析
(2)酸、碱稀释
③酸中加水:
④碱中加水:
开始时溶液的pH<7,随着加水量的增加,pH不断增大至无限接近于7,但不会大于7;
开始时溶液的pH>7,随着加水量的增加,pH不断减小至无限接近于7,但不会小于7。
1. 山药中含有碱性皂角素,有些人皮肤沾上会奇痒难忍,涂抹下列厨房中的某物质能明显缓解不适,该物质是( )
A. 食醋 B. 花生油
C. 酱油 D. 面粉
A
随堂练习
2. ①酸奶、②肥皂水、③食盐水是生活中常见的三种物质。酸奶能使紫色石蕊溶液变红,肥皂水显碱性,食盐水的pH=7,它们的pH由小到大排列,
正确的是( )
A.①②③ B.①③② C.②①③ D.③①②
B
随堂练习
3. 下列关于“酸和碱的中和反应实验”的说法中,正确的是( )
A. 若不使用酚酞,HCl就无法和NaOH反应
B. 酚酞由红色变无色,说明发生了中和反应
C. 滴加酚酞前溶液为无色,加入稀盐酸后溶液仍无色,说明没有发生反应
D. 若将酚酞换成石蕊,则不能达到实验目的
B
解析:石蕊遇碱变蓝,遇酸变红
随堂练习
4. 下列各组物质,要借助酸碱指示剂才能判断反应发生的是( )
A. 石灰石和稀盐酸
B. Fe2O3和稀盐酸
C. 锌与稀硫酸
D. NaOH和稀HCl
D
随堂练习
5.用pH试纸测定石灰水的pH,如图所示,则测得结果与实际值相比( )
A.偏高 B.偏低 C.相等 D.无法确定
B
随堂练习
6.测得生活中一些物质的pH如下表所示,下列说法正确的是( )
随堂练习
食品 胃液 人体血液 肥皂水 洗涤剂
pH 0.8~1.5 7.35~7.45 10.2 12.2
A. 人体血液呈酸性
B. 用NaOH可以治疗胃酸过多
C. 洗涤剂比肥皂水的碱性强
D. 肥皂水能使蓝色石蕊试纸变红
C
7、下列有关pH试纸的使用说法正确的是( )
A.把pH试纸浸入待测液
B.用湿润的玻璃棒蘸取待测液
C.把显色的pH试纸与标准比色卡对照读数
D. 测出石灰水的pH为12.4
C
随堂练习
8.向部分变质的NaOH溶液中滴加过量稀盐酸,下列图像能正确反映对应变化关系的是( )
随堂练习
A
D
C
B
C
9. 根据所学中和反应在实际中的应用,回答下列问题:
(1)改良土壤的酸碱性:形成酸雨的主要气体是 ,中和土壤酸性的碱是______。
(2)处理工厂的废水:硫酸厂的污水中含有硫酸等杂质,可以用______进行处理;化学方程式为__________________________。
SO2、NO2
熟石灰
熟石灰
Ca(OH)2 + H2SO4 =CaSO4 + 2H2O
(1)实验1:证明酸和碱发生了反应。在烧杯中加入5毫升氢氧化钠溶液,滴入几滴无色酚酞溶液,此时溶液呈____色。再用滴管慢慢滴入稀硫酸,并用玻璃棒_____________,至溶液颜色恰好变为无色为止,该反应的化学方程式是_____________________________________________。
红
不断搅拌
2NaOH + H2SO4=Na2SO4 + 2H2O
10.某研究性学习小组对中和反应进行探究,请你参与实验:
①实验乙的实验目的是______________________________________________。
(2)实验2:证明酸和碱反应有水生成。小明同学取变色硅胶(吸水后由蓝色变红色)、无水醋酸(一种酸,常温下为无色液体)和氢氧化钠固体进行如图一所示的三个实验。
证明了氢氧化钠不含有水,不能使硅胶变色
10.某研究性学习小组对中和反应进行探究,请你参与实验:
(2)实验2:证明酸和碱反应有水生成。小明同学取变色硅胶(吸水后由蓝色变红色)、无水醋酸(一种酸,常温下为无色液体)和氢氧化钠固体进行如图一所示的三个实验。
②加入试剂后,要迅速塞紧橡胶塞的原因是____________________________________________。
③能证明酸和碱反应有水生成的现象是____________________________________________。
防止空气中的水分进入试管干扰实验
试管丙中的硅胶由蓝色变为红色,试管甲乙中的硅胶不变色
10.某研究性学习小组对中和反应进行探究,请你参与实验:
(3)实验3:探究酸和碱反应过程的热效应。在滴加稀硫酸的过程中,利用温度传感器测量实验过程中烧杯内液体温度的变化情况,如图二为该反应中温度与滴加的硫酸质量变化关系的理论值和测量值的曲线比较情况。
放热
低
10.某研究性学习小组对中和反应进行探究,请你参与实验:
①图示说明酸和碱的反应是______(填“吸热”或“放热”)反应,实验中测得的中和反应放出的热量比理论值____(填“高”或“低”)。
(3)实验3:探究酸和碱反应过程的热效应。在滴加稀硫酸的过程中,利用温度传感器测量实验过程中烧杯内液体温度的变化情况,如图二为该反应中温度与滴加的硫酸质量变化关系的理论值和测量值的曲线比较情况。
10.某研究性学习小组对中和反应进行探究,请你参与实验:
②请指出造成理论值和测量值差异的一点原因______________。
③图中温度达到最高值后降低的原因是____________________
_____________________________________________________。
没有采取隔热处理
完全反应后不再放热,
继续加入稀硫酸时会降温,同时溶液散热
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
