11.1.1生活中常见的盐-课件(人教版)(共57张PPT)
文档属性
| 名称 | 11.1.1生活中常见的盐-课件(人教版)(共57张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 46.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 12:19:14 | ||
图片预览










文档简介
(共57张PPT)
课题1 生活中常见的盐
第十一单元 盐 化肥
第1课时 生活中常见的盐
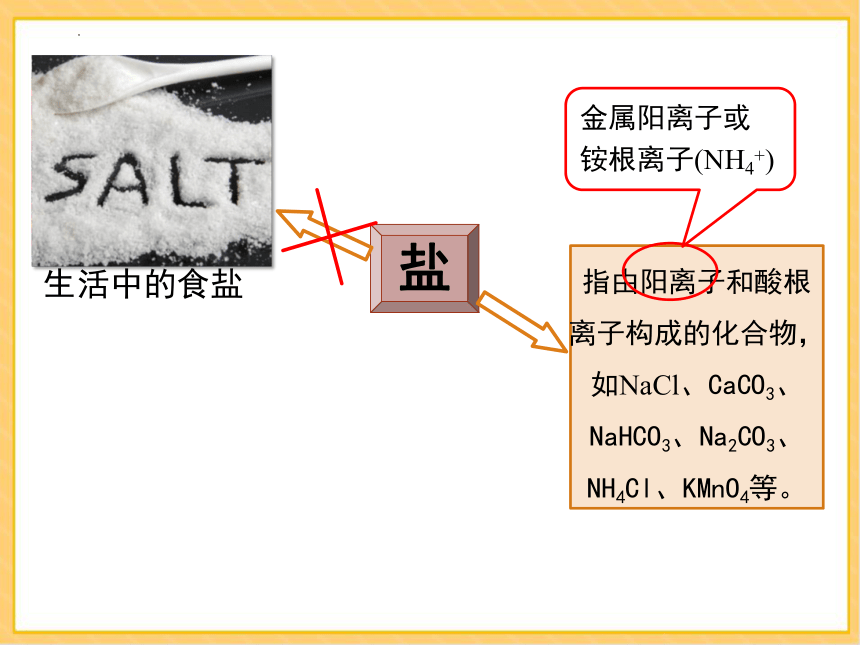
盐是什么
盐
生活中的食盐
指由阳离子和酸根离子构成的化合物,如NaCl、CaCO3、NaHCO3、Na2CO3、NH4Cl、KMnO4等。
金属阳离子或
铵根离子(NH4+)
1.概念:由_____________________和_________组成的化合物。
如NaCl、NH4HCO3、KMnO4等。
盐的概念及分类
金属离子(或铵根离子)
酸根离子
[提示] 酸根离子指酸解离出的阴离子。如Cl-、CO32-、HCO3-等。
2.盐的分类
①根据盐的组成里所含阴、阳离子的特点,可将盐分类并称为某盐
钠盐:NaCl、Na2SO4 、 Na2CO3
钾盐:KCl、K2SO4 、 K2CO3
铵盐: (NH4)2SO 4 、 NH4Cl、 NH4NO3
碳酸盐: K2CO3 、CaCO3 、 Na2CO3
硫酸盐: (NH4)2SO 4 、 K2SO4 、 Na2SO4
NaCl Na2SO4 BaSO4
KCl (NH4)2SO4 NH4Cl
NaHSO4 NaHCO3 NaH2PO4 CaHPO4
Cu2(OH)2CO3 MgOHCl
正盐
酸式盐
碱式盐
盐
盐的分类②:
按酸碱中和反应进行的程度来划分。
思考?
1.如何从组成上区分正盐,酸式盐,碱式盐?
2.什么样的酸在反应时可以形成酸式盐? 什么样的碱在反应时可以形成碱式盐?
多元酸
多元碱
盐的水溶液的颜色
铜盐 溶液一般 呈 蓝色
铁盐溶液一般 呈 黄色
亚铁盐溶液一般呈浅绿色
高锰酸钾溶液呈紫红色
其它盐溶液一般为无色
例1 试用:①H2SO4、②NaCl、③CaCO3、④Na2SO4、⑤NaHCO3,填写下列空白(填写编号)。
属于盐类的是 ,其中属于钠盐的是 ,
属于碳酸盐的是 。
[应用示例]
②③④⑤
②④⑤
③
我国曾发生过多次将工业用盐(亚硝酸钠)误作食盐用于烹调而引起的中毒事件,你能猜测是什么原因吗?
1.亚硝酸钠的外观和食盐极其相似,也有咸味,但是它有毒
2.混淆了盐和食盐的概念
生活中常见的盐
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
自主学习
阅读第72页相关内容,回答以下问题
1.氯化钠的化学式?
2.除调味外,你还能说出食盐的其他用途吗?
3.在自然界中,氯化钠是如何分布的?
4.海水如何制精盐?
氯化钠
一
生活中常见的盐
1.氯化钠简介
(1)俗称:
(2)化学式:
(3)性状:
(4)主要来源:
氯化钠
一
海水、盐湖、盐井、盐矿。
白色晶体,易溶于水,有咸味,溶液呈中性;
NaCl;
食盐;
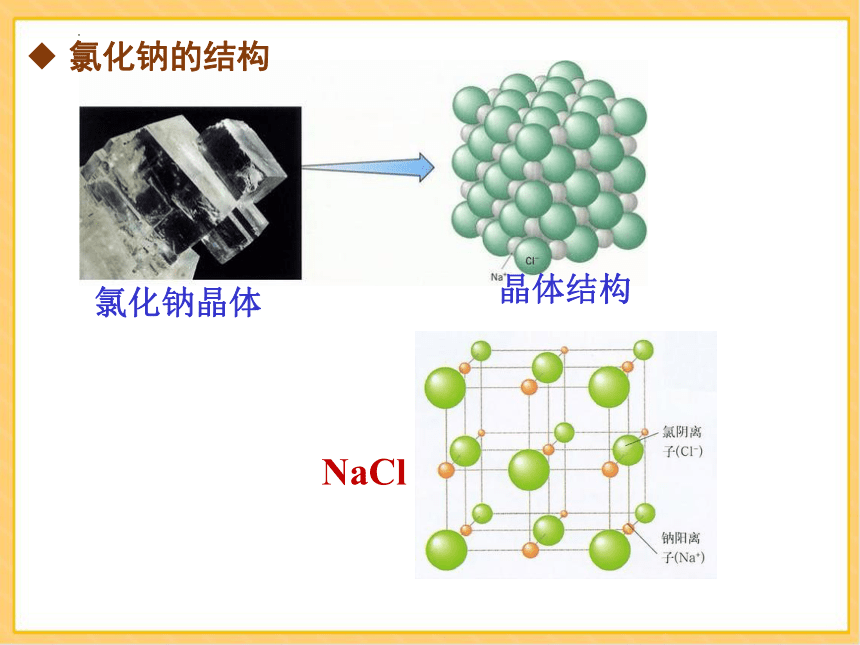
氯化钠晶体
晶体结构
NaCl
氯化钠的结构
2.氯化钠的用途
生活中:氯化钠是重要的调味品
氯化钠
一
用食盐腌制蔬菜、鱼、肉、蛋等。
(0.9%的氯化钠溶液)
Na+对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用
Cl-是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用
2.氯化钠的用途
氯化钠
一
医疗上:
(1)配制生理盐水;
(3)用盐水漱口防治口腔炎症。
(2)预防感冒;
农业:用10%~16%的食盐溶液来选种
公路:用氯化钠来消除积雪
工业:以氯化钠为原料来制取纯碱、烧碱、氯气和盐酸等
2.氯化钠的用途
氯化钠
一
[提示] 盐水的密度大于水,在盐水中籽粒饱满的种子会下沉,而不饱满的种子会上浮。
(1)清晨喝一杯盐开水,可以治大便不通。喝盐开水可以治喉咙痛牙痛。
(2)用盐水洗头可减少头发脱落;茄子根加点盐水洗脚,可治脚气病。
(3)每天用淡盐开水漱口,可以预防各种口腔病。
(4)洗浴时,在水中加少量食盐,可使皮肤强健。
(5)豆腐易变质,如将食盐化在开水中,冷却后将豆腐浸入,即使在夏天,也可保存数月。
(6)花生油内含水分,久贮会发臭。可将盐炒热,凉后,按40斤油1斤盐的比例,加入食盐,可以使花生油2--3年仍保持色滑、味香。
食盐的实用价值
(7)鲜花插入稀盐水里,可数日不谢。
(8)新买的玻璃器皿,用盐水煮一煮,不易破裂。
(9)洗有颜色的衣服,先用5%盐水浸泡10分钟,然后再洗,则不易掉色。
(10)洗有汗渍的白衣服,先在5%的盐水中揉一揉,再用肥皂洗净,就不会出现黄色汗斑。
(11)将胡萝卜砸碎拌上盐,可擦去衣服上的血迹。
(12)铜器生锈或出现黑点,用盐可以擦掉。
(13)皮肤被热水烫了,用盐水洗一下可以减轻疼痛。
(14)炸东西时,在油里放点盐,油不外溅。
食盐的实用价值
趣说食盐
在古罗马表示富有与贫穷,不看拥有黄金的多少,而是比藏有盐粒的数量,被历史上称为食盐货币时代。
我国的西藏过去也使用过盐巴货币。为了换取生活必需的一小块盐巴,需要付出昂贵的代价。
贵州解放前只有少数人家吃得起吊盐(吃完饭以后,用舌头在吊挂着的盐块上舔一下),可见食盐的贵重。
海盐
湖盐
岩盐
井盐
3.氯化钠在自然界中的分布
氯化钠
一
3.氯化钠在自然界中的获取
氯化钠
一
通过晾晒海水或煮盐井水,盐湖水等,可以蒸发除去其水分,得到含有较多杂质的氯化钠晶体——粗盐。
蒸发池
结晶池
海水
“海水晒盐” 过程
水分
蒸发
粗盐
母液
粗盐
?
精盐
海水“晒盐”等方法得到的是粗盐,含有可溶性和不溶性杂质。
氯化镁、氯化钙等
泥沙等
粗盐初步提纯:
溶解→沉淀→过滤→蒸发→结晶
——去除粗盐中不溶性杂质
(1)过滤(提示:一贴、二低、三靠)
仔细观察滤纸上剩余物及滤液的颜色,如滤液仍浑浊,应再过滤一次。如果两次过滤后滤液仍浑浊,应如何检查实验装置并找出原因
一贴:滤纸紧贴漏斗内壁。
二低:滤纸低于漏斗边缘,滤液低于滤纸边缘。
玻璃棒:引流,防止液体飞溅。
三靠:烧杯紧靠玻璃棒,玻璃棒紧靠三层滤纸处,漏斗长端紧靠烧杯内壁。
【知识回顾】
过滤和蒸发的操作要点和注意事项
(2)蒸发(蒸发结晶:蒸发溶剂,食盐以晶体的形式析出。)
①蒸发皿放在铁圈上,用酒精灯加热;
②蒸发皿里的液体以不超过蒸发皿容 积的 为宜;
③加热时用玻璃棒不停地搅拌,防止 ;
④当蒸发皿中 时,即停止加热 ,利用余热使滤液蒸干。
注意:停止加热后,不要把蒸发皿立即放在桌上 ,
应用坩埚钳夹住放到石棉网上面!
【知识回顾】
过滤和蒸发的操作要点和注意事项
2/3
局部温度过高,造成液滴飞溅
出现较多量的固体
4.粗盐初步提纯
——去除粗盐中不溶性杂质
4.粗盐初步提纯
①溶解
②过滤
③蒸发结晶
思考:①上述过程中玻璃棒的用途分别是什么?
④转移
搅拌,加速溶解
引流,防止液体飞溅
搅拌,防止局部温度过高液滴飞溅
转移固体
——去除粗盐中不溶性杂质
②过滤时使用的玻璃仪器有哪些?
③能否采用降低溶液温度的方法使食盐溶液浓缩?
烧杯、玻璃棒、漏斗
④过滤能除去粗盐中的可溶性杂质吗?
不能,因为氯化钠的溶解度受温度影响不大。
不能 只能除去不溶性杂质
思考
⑥如何计算精盐的产率?
精盐质量
溶解的粗盐质量
×100%
⑤如果两次过滤后滤液仍浑浊,找出原因?
(说明滤液仍含有不溶性杂质。滤纸破损或滤液液面超过滤纸的边缘或仪器不干净等。)
思考
课 堂 达 标
2.某盐在人体的新陈代谢中十分重要。它可维持血液中适当的酸碱度,并通过人体复杂的作用产生消化液,帮助消化。该盐是( )
A.氯化钙 B.氯化钠 C.硝酸钾 D.碳酸钠
1.下列说法正确的是( )
A.盐都能食用,故称食盐 B.盐就是食盐,易溶于水
C.盐都有咸味,都是白色晶体 D.盐是一类物质的总称
D
B
3. 冬天,为确保道路畅通,有关部门向公路上的积雪撒盐以使冰雪很快融化。其原因是( )
A.盐水的凝固点较低 B.盐水的沸点较高
C.盐水的凝固点较高 D.盐与雪发生反应
4.氯化钠是一种重要的化工原料。下列有关说法不正确的是( )
A.氯化钠俗称食盐
B.氯化钠中钠元素的化合价为+1
C.氯化钠可以治疗胃酸过多症
D.生理盐水是0.9%的氯化钠溶液
A
C
5. 下列关于粗盐提纯实验的部分操作中,不正确的是( )
C
6.粗盐提纯的操作步骤如图,相关说法错误的是( )
A.图中“操作1”是称量
B.溶解时用玻璃棒搅拌
C.过滤时用玻璃棒引流
D.蒸发至滤液被蒸干后移去酒精灯
D
(1)俗名:
(2)化学式
(3)性状:
1.碳酸钠
碳酸钠、碳酸氢钠和碳酸钙
二
注意:纯碱不是碱,而是盐,但显碱性
Na2CO3粉末
纯碱、苏打;
: Na2CO3;
白色粉末状固体,
易溶于水,水溶液显碱性。
1.碳酸钠
碳酸钠、碳酸氢钠和碳酸钙
二
碳酸钠晶体
Na2CO3﹒10H2O == Na2CO3 + 10H2O
风化
Na2CO3粉末
(4)碳酸钠晶体
Na2CO3﹒10H2O
风化:室温和干燥空气中,结晶水合物失去结晶水的现象。
( 变化)
化学
洗涤剂
造纸
(5)碳酸钠的用途
纺织印染
玻璃瓷砖
1.碳酸钠
碳酸钠、碳酸氢钠和碳酸钙
二
——“重要的化工原料”
我国制碱工业的先驱——侯德榜
拓展阅读
侯德榜一生在化工技术上有三大贡献。
第一,揭开了苏尔维法的秘密。
第二,创立了中国人自己的制碱工艺——侯氏制碱法。
第三,就是他为发展小化肥(氮肥)工业所做的贡献。
在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。
侯氏制碱法(联合制碱法)
原理:
NH3+CO2+H2O +NaCl ==NaHCO3↓+NH4Cl
将二氧化碳通入氨水的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠析出。
NH3+CO2+H2O ==NH4HCO3
NH4HCO3+NaCl ==NaHCO3↓+NH4Cl
总反应:
2NaHCO3 ===Na2CO3+H2O+CO2↑
△
2.碳酸氢钠
碳酸钠、碳酸氢钠和碳酸钙
二
(1)俗名:小苏打;
(2)化学式: NaHCO3;
(3)性状:细小的白色晶体,能溶于水,
水溶液有 弱的碱性,较易分解。
2.碳酸氢钠
2NaHCO3 Na2CO3+H2O+CO2
碳酸钠、碳酸氢钠和碳酸钙
二
面点发酵剂
做中和胃酸的胃药
(4)碳酸氢钠的用途
灭火剂原料
饮料原料
3.碳酸钙
碳酸钠、碳酸氢钠和碳酸钙
二
3.碳酸钙
(1)大理石、石灰石主要成分;
(2)化学式: CaCO3;
(3)性状:多为灰白色矿物,纯净物为白色粉末;
碳酸钠、碳酸氢钠和碳酸钙
二
不溶于水,能溶于酸。
大理石、石灰石、方解石、钟乳石、珊瑚、贝壳、白垩、鸡蛋壳等主要成分是碳酸钙
珍珠首饰
建筑材料
(4)碳酸钙的用途
补钙剂
水泥原料
碳酸钠、碳酸氢钠和碳酸钙
二
实验室制取二氧化碳
氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式
俗 称
颜色状态
溶解性
用 途
NaCl
食盐
白色晶体
易溶
调味品、生理盐水、消除公路积雪、农业选种、工业原料等
Na2CO3
纯碱、苏打
白色粉末状固体
易溶
玻璃、造纸、纺织、洗涤剂的生产等
NaHCO3
小苏打
细小白色晶体
易溶
发酵粉、治疗胃酸过多、灭火剂等
CaCO3
白色固体
难溶
建筑材料、
补钙剂等
归纳总结
【例1】下列关于常见盐的用途,错误的是( )
A.食盐用作调味品 B.纯碱用于除水垢
C.碳酸钙用作补钙剂 D. 碳酸氢钠用于焙制糕点
典例探究
B
3.下列各组物质名称不代表同一物质的一组是( )
A.氯化钠、盐 B.氢氧化钠、苛性钠
C.碳酸钠、纯碱 D.碳酸氢钠、小苏打
A
6.
6.
试剂的加入顺序:
总结分析:
(3)稀盐酸是用于调节溶液酸碱性,最后加入时只能适量。
(2)产生的沉淀BaCO3、CaCO3和Mg(OH)2都会溶于稀盐酸,过滤操作必须在稀盐酸加入前进行。
(1)Na2CO3的作用:除去CaCl2和多余的BaCl2. Na2CO3一定要在BaCl2之后加入;
Na2CO3
BaCl2
NaOH
过滤沉淀
适量稀HCl
BaSO4
CaCO3
Mg(OH)2
BaCO3
——粗盐的提纯
【归纳总结1】
——粗盐的提纯
粗盐的成分:
主要NaCl[杂质CaCl2、MgCl2、硫酸钠、泥沙等]
过量BaCl2
过量Na2CO3
过量NaOH
过滤
沉淀和泥沙
滤液
适量盐酸
蒸发结晶
纯的NaCl晶体
【误区警示】粗盐提纯中的“两个必须”
必须一:除杂试剂Na2CO3溶液必须在BaCl2溶液之后;
必须二:加入盐酸之前必须先过滤。
2.物质分离、提纯的基本原则
不增
不减
易分离
易复原
☆注意事项:
①除杂试剂应过量;
②过量试剂需除尽;
③去除多种杂质时,要考虑加入试剂的顺序;
④选择最佳的除杂途径。
“前门驱虎,后门进狼”
(不引入新杂质)
(不减少被提纯物质)
(被提纯物易复原)
(杂质转化为沉淀、气体或水等易分离物质)
【归纳总结2】
某KNO3溶液中含杂质KCl、K2SO4和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
A.Ba(NO3)2、 K2CO3、 AgNO3、 HNO3
B.K2CO3、 Ba(NO3)2、 AgNO3、 HNO3
C.Ba(NO3)2、 AgNO3、 K2CO3、 HNO3
D.AgNO3、 Ba(NO3)2、 K2CO3、 HNO3
C D
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
课题1 生活中常见的盐
第十一单元 盐 化肥
第1课时 生活中常见的盐
盐是什么
盐
生活中的食盐
指由阳离子和酸根离子构成的化合物,如NaCl、CaCO3、NaHCO3、Na2CO3、NH4Cl、KMnO4等。
金属阳离子或
铵根离子(NH4+)
1.概念:由_____________________和_________组成的化合物。
如NaCl、NH4HCO3、KMnO4等。
盐的概念及分类
金属离子(或铵根离子)
酸根离子
[提示] 酸根离子指酸解离出的阴离子。如Cl-、CO32-、HCO3-等。
2.盐的分类
①根据盐的组成里所含阴、阳离子的特点,可将盐分类并称为某盐
钠盐:NaCl、Na2SO4 、 Na2CO3
钾盐:KCl、K2SO4 、 K2CO3
铵盐: (NH4)2SO 4 、 NH4Cl、 NH4NO3
碳酸盐: K2CO3 、CaCO3 、 Na2CO3
硫酸盐: (NH4)2SO 4 、 K2SO4 、 Na2SO4
NaCl Na2SO4 BaSO4
KCl (NH4)2SO4 NH4Cl
NaHSO4 NaHCO3 NaH2PO4 CaHPO4
Cu2(OH)2CO3 MgOHCl
正盐
酸式盐
碱式盐
盐
盐的分类②:
按酸碱中和反应进行的程度来划分。
思考?
1.如何从组成上区分正盐,酸式盐,碱式盐?
2.什么样的酸在反应时可以形成酸式盐? 什么样的碱在反应时可以形成碱式盐?
多元酸
多元碱
盐的水溶液的颜色
铜盐 溶液一般 呈 蓝色
铁盐溶液一般 呈 黄色
亚铁盐溶液一般呈浅绿色
高锰酸钾溶液呈紫红色
其它盐溶液一般为无色
例1 试用:①H2SO4、②NaCl、③CaCO3、④Na2SO4、⑤NaHCO3,填写下列空白(填写编号)。
属于盐类的是 ,其中属于钠盐的是 ,
属于碳酸盐的是 。
[应用示例]
②③④⑤
②④⑤
③
我国曾发生过多次将工业用盐(亚硝酸钠)误作食盐用于烹调而引起的中毒事件,你能猜测是什么原因吗?
1.亚硝酸钠的外观和食盐极其相似,也有咸味,但是它有毒
2.混淆了盐和食盐的概念
生活中常见的盐
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
自主学习
阅读第72页相关内容,回答以下问题
1.氯化钠的化学式?
2.除调味外,你还能说出食盐的其他用途吗?
3.在自然界中,氯化钠是如何分布的?
4.海水如何制精盐?
氯化钠
一
生活中常见的盐
1.氯化钠简介
(1)俗称:
(2)化学式:
(3)性状:
(4)主要来源:
氯化钠
一
海水、盐湖、盐井、盐矿。
白色晶体,易溶于水,有咸味,溶液呈中性;
NaCl;
食盐;
氯化钠晶体
晶体结构
NaCl
氯化钠的结构
2.氯化钠的用途
生活中:氯化钠是重要的调味品
氯化钠
一
用食盐腌制蔬菜、鱼、肉、蛋等。
(0.9%的氯化钠溶液)
Na+对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用
Cl-是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用
2.氯化钠的用途
氯化钠
一
医疗上:
(1)配制生理盐水;
(3)用盐水漱口防治口腔炎症。
(2)预防感冒;
农业:用10%~16%的食盐溶液来选种
公路:用氯化钠来消除积雪
工业:以氯化钠为原料来制取纯碱、烧碱、氯气和盐酸等
2.氯化钠的用途
氯化钠
一
[提示] 盐水的密度大于水,在盐水中籽粒饱满的种子会下沉,而不饱满的种子会上浮。
(1)清晨喝一杯盐开水,可以治大便不通。喝盐开水可以治喉咙痛牙痛。
(2)用盐水洗头可减少头发脱落;茄子根加点盐水洗脚,可治脚气病。
(3)每天用淡盐开水漱口,可以预防各种口腔病。
(4)洗浴时,在水中加少量食盐,可使皮肤强健。
(5)豆腐易变质,如将食盐化在开水中,冷却后将豆腐浸入,即使在夏天,也可保存数月。
(6)花生油内含水分,久贮会发臭。可将盐炒热,凉后,按40斤油1斤盐的比例,加入食盐,可以使花生油2--3年仍保持色滑、味香。
食盐的实用价值
(7)鲜花插入稀盐水里,可数日不谢。
(8)新买的玻璃器皿,用盐水煮一煮,不易破裂。
(9)洗有颜色的衣服,先用5%盐水浸泡10分钟,然后再洗,则不易掉色。
(10)洗有汗渍的白衣服,先在5%的盐水中揉一揉,再用肥皂洗净,就不会出现黄色汗斑。
(11)将胡萝卜砸碎拌上盐,可擦去衣服上的血迹。
(12)铜器生锈或出现黑点,用盐可以擦掉。
(13)皮肤被热水烫了,用盐水洗一下可以减轻疼痛。
(14)炸东西时,在油里放点盐,油不外溅。
食盐的实用价值
趣说食盐
在古罗马表示富有与贫穷,不看拥有黄金的多少,而是比藏有盐粒的数量,被历史上称为食盐货币时代。
我国的西藏过去也使用过盐巴货币。为了换取生活必需的一小块盐巴,需要付出昂贵的代价。
贵州解放前只有少数人家吃得起吊盐(吃完饭以后,用舌头在吊挂着的盐块上舔一下),可见食盐的贵重。
海盐
湖盐
岩盐
井盐
3.氯化钠在自然界中的分布
氯化钠
一
3.氯化钠在自然界中的获取
氯化钠
一
通过晾晒海水或煮盐井水,盐湖水等,可以蒸发除去其水分,得到含有较多杂质的氯化钠晶体——粗盐。
蒸发池
结晶池
海水
“海水晒盐” 过程
水分
蒸发
粗盐
母液
粗盐
?
精盐
海水“晒盐”等方法得到的是粗盐,含有可溶性和不溶性杂质。
氯化镁、氯化钙等
泥沙等
粗盐初步提纯:
溶解→沉淀→过滤→蒸发→结晶
——去除粗盐中不溶性杂质
(1)过滤(提示:一贴、二低、三靠)
仔细观察滤纸上剩余物及滤液的颜色,如滤液仍浑浊,应再过滤一次。如果两次过滤后滤液仍浑浊,应如何检查实验装置并找出原因
一贴:滤纸紧贴漏斗内壁。
二低:滤纸低于漏斗边缘,滤液低于滤纸边缘。
玻璃棒:引流,防止液体飞溅。
三靠:烧杯紧靠玻璃棒,玻璃棒紧靠三层滤纸处,漏斗长端紧靠烧杯内壁。
【知识回顾】
过滤和蒸发的操作要点和注意事项
(2)蒸发(蒸发结晶:蒸发溶剂,食盐以晶体的形式析出。)
①蒸发皿放在铁圈上,用酒精灯加热;
②蒸发皿里的液体以不超过蒸发皿容 积的 为宜;
③加热时用玻璃棒不停地搅拌,防止 ;
④当蒸发皿中 时,即停止加热 ,利用余热使滤液蒸干。
注意:停止加热后,不要把蒸发皿立即放在桌上 ,
应用坩埚钳夹住放到石棉网上面!
【知识回顾】
过滤和蒸发的操作要点和注意事项
2/3
局部温度过高,造成液滴飞溅
出现较多量的固体
4.粗盐初步提纯
——去除粗盐中不溶性杂质
4.粗盐初步提纯
①溶解
②过滤
③蒸发结晶
思考:①上述过程中玻璃棒的用途分别是什么?
④转移
搅拌,加速溶解
引流,防止液体飞溅
搅拌,防止局部温度过高液滴飞溅
转移固体
——去除粗盐中不溶性杂质
②过滤时使用的玻璃仪器有哪些?
③能否采用降低溶液温度的方法使食盐溶液浓缩?
烧杯、玻璃棒、漏斗
④过滤能除去粗盐中的可溶性杂质吗?
不能,因为氯化钠的溶解度受温度影响不大。
不能 只能除去不溶性杂质
思考
⑥如何计算精盐的产率?
精盐质量
溶解的粗盐质量
×100%
⑤如果两次过滤后滤液仍浑浊,找出原因?
(说明滤液仍含有不溶性杂质。滤纸破损或滤液液面超过滤纸的边缘或仪器不干净等。)
思考
课 堂 达 标
2.某盐在人体的新陈代谢中十分重要。它可维持血液中适当的酸碱度,并通过人体复杂的作用产生消化液,帮助消化。该盐是( )
A.氯化钙 B.氯化钠 C.硝酸钾 D.碳酸钠
1.下列说法正确的是( )
A.盐都能食用,故称食盐 B.盐就是食盐,易溶于水
C.盐都有咸味,都是白色晶体 D.盐是一类物质的总称
D
B
3. 冬天,为确保道路畅通,有关部门向公路上的积雪撒盐以使冰雪很快融化。其原因是( )
A.盐水的凝固点较低 B.盐水的沸点较高
C.盐水的凝固点较高 D.盐与雪发生反应
4.氯化钠是一种重要的化工原料。下列有关说法不正确的是( )
A.氯化钠俗称食盐
B.氯化钠中钠元素的化合价为+1
C.氯化钠可以治疗胃酸过多症
D.生理盐水是0.9%的氯化钠溶液
A
C
5. 下列关于粗盐提纯实验的部分操作中,不正确的是( )
C
6.粗盐提纯的操作步骤如图,相关说法错误的是( )
A.图中“操作1”是称量
B.溶解时用玻璃棒搅拌
C.过滤时用玻璃棒引流
D.蒸发至滤液被蒸干后移去酒精灯
D
(1)俗名:
(2)化学式
(3)性状:
1.碳酸钠
碳酸钠、碳酸氢钠和碳酸钙
二
注意:纯碱不是碱,而是盐,但显碱性
Na2CO3粉末
纯碱、苏打;
: Na2CO3;
白色粉末状固体,
易溶于水,水溶液显碱性。
1.碳酸钠
碳酸钠、碳酸氢钠和碳酸钙
二
碳酸钠晶体
Na2CO3﹒10H2O == Na2CO3 + 10H2O
风化
Na2CO3粉末
(4)碳酸钠晶体
Na2CO3﹒10H2O
风化:室温和干燥空气中,结晶水合物失去结晶水的现象。
( 变化)
化学
洗涤剂
造纸
(5)碳酸钠的用途
纺织印染
玻璃瓷砖
1.碳酸钠
碳酸钠、碳酸氢钠和碳酸钙
二
——“重要的化工原料”
我国制碱工业的先驱——侯德榜
拓展阅读
侯德榜一生在化工技术上有三大贡献。
第一,揭开了苏尔维法的秘密。
第二,创立了中国人自己的制碱工艺——侯氏制碱法。
第三,就是他为发展小化肥(氮肥)工业所做的贡献。
在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。
侯氏制碱法(联合制碱法)
原理:
NH3+CO2+H2O +NaCl ==NaHCO3↓+NH4Cl
将二氧化碳通入氨水的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠析出。
NH3+CO2+H2O ==NH4HCO3
NH4HCO3+NaCl ==NaHCO3↓+NH4Cl
总反应:
2NaHCO3 ===Na2CO3+H2O+CO2↑
△
2.碳酸氢钠
碳酸钠、碳酸氢钠和碳酸钙
二
(1)俗名:小苏打;
(2)化学式: NaHCO3;
(3)性状:细小的白色晶体,能溶于水,
水溶液有 弱的碱性,较易分解。
2.碳酸氢钠
2NaHCO3 Na2CO3+H2O+CO2
碳酸钠、碳酸氢钠和碳酸钙
二
面点发酵剂
做中和胃酸的胃药
(4)碳酸氢钠的用途
灭火剂原料
饮料原料
3.碳酸钙
碳酸钠、碳酸氢钠和碳酸钙
二
3.碳酸钙
(1)大理石、石灰石主要成分;
(2)化学式: CaCO3;
(3)性状:多为灰白色矿物,纯净物为白色粉末;
碳酸钠、碳酸氢钠和碳酸钙
二
不溶于水,能溶于酸。
大理石、石灰石、方解石、钟乳石、珊瑚、贝壳、白垩、鸡蛋壳等主要成分是碳酸钙
珍珠首饰
建筑材料
(4)碳酸钙的用途
补钙剂
水泥原料
碳酸钠、碳酸氢钠和碳酸钙
二
实验室制取二氧化碳
氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式
俗 称
颜色状态
溶解性
用 途
NaCl
食盐
白色晶体
易溶
调味品、生理盐水、消除公路积雪、农业选种、工业原料等
Na2CO3
纯碱、苏打
白色粉末状固体
易溶
玻璃、造纸、纺织、洗涤剂的生产等
NaHCO3
小苏打
细小白色晶体
易溶
发酵粉、治疗胃酸过多、灭火剂等
CaCO3
白色固体
难溶
建筑材料、
补钙剂等
归纳总结
【例1】下列关于常见盐的用途,错误的是( )
A.食盐用作调味品 B.纯碱用于除水垢
C.碳酸钙用作补钙剂 D. 碳酸氢钠用于焙制糕点
典例探究
B
3.下列各组物质名称不代表同一物质的一组是( )
A.氯化钠、盐 B.氢氧化钠、苛性钠
C.碳酸钠、纯碱 D.碳酸氢钠、小苏打
A
6.
6.
试剂的加入顺序:
总结分析:
(3)稀盐酸是用于调节溶液酸碱性,最后加入时只能适量。
(2)产生的沉淀BaCO3、CaCO3和Mg(OH)2都会溶于稀盐酸,过滤操作必须在稀盐酸加入前进行。
(1)Na2CO3的作用:除去CaCl2和多余的BaCl2. Na2CO3一定要在BaCl2之后加入;
Na2CO3
BaCl2
NaOH
过滤沉淀
适量稀HCl
BaSO4
CaCO3
Mg(OH)2
BaCO3
——粗盐的提纯
【归纳总结1】
——粗盐的提纯
粗盐的成分:
主要NaCl[杂质CaCl2、MgCl2、硫酸钠、泥沙等]
过量BaCl2
过量Na2CO3
过量NaOH
过滤
沉淀和泥沙
滤液
适量盐酸
蒸发结晶
纯的NaCl晶体
【误区警示】粗盐提纯中的“两个必须”
必须一:除杂试剂Na2CO3溶液必须在BaCl2溶液之后;
必须二:加入盐酸之前必须先过滤。
2.物质分离、提纯的基本原则
不增
不减
易分离
易复原
☆注意事项:
①除杂试剂应过量;
②过量试剂需除尽;
③去除多种杂质时,要考虑加入试剂的顺序;
④选择最佳的除杂途径。
“前门驱虎,后门进狼”
(不引入新杂质)
(不减少被提纯物质)
(被提纯物易复原)
(杂质转化为沉淀、气体或水等易分离物质)
【归纳总结2】
某KNO3溶液中含杂质KCl、K2SO4和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
A.Ba(NO3)2、 K2CO3、 AgNO3、 HNO3
B.K2CO3、 Ba(NO3)2、 AgNO3、 HNO3
C.Ba(NO3)2、 AgNO3、 K2CO3、 HNO3
D.AgNO3、 Ba(NO3)2、 K2CO3、 HNO3
C D
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
