2.1化学反应速率与化学平衡(概念及计算)课件(共21张PPT)2022-2023学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1化学反应速率与化学平衡(概念及计算)课件(共21张PPT)2022-2023学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 693.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 10:58:08 | ||
图片预览








文档简介
(共21张PPT)
化学反应速率
基本概念和计算
2、数学表达式:
c
t
v
=
v=
浓度变化量( )
mol/L
时间变化量( )
S、min或h
化学反应速率通常是用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
1、定义:
一、化学反应速率的概念及有关计算
3、单位:
mol/(L s)
mol L-1 s-1
mol/(L min)
mol L-1 min-1
或
1mol/(L·s)=60 mol/(L·min)
1、反应4A(固)+5B(气)=4C(气)+6D(气)在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol。下列论述正确的是
A、A的平均反应速率是0.010 mol·L-1·s-1
B、容器中含D的物质的量至少为0.45mol
C、容器中A、B、C、D的物质的量比一定是4:5:4:6
D、半分钟时,C的反应速率是0.010 mol·L-1·s-1
B
练一练
结论1、对于固体或纯液体的反应物,一般情况下其浓度是常数,通常不用这个公式表示反应速率。
结论2、我们所说的速率是指在整个过程中的平均速率。且均为正值
练后反思
练后反思
结论3、同一反应中,如 m A(g)+n B(g) = pC(g)+q D(g),用不同的物质来表示的速率,数值可能不同,但意义相同。因此表示反应速率时一定要指明反应物和生成物中哪种物质做标准。
速率之比等于化学计量数之比,
也等于相应物质在同一段时间内的变化量之比。
即ひ(A) ︰ひ(B) ︰ひ(C) ︰ひ(D)= m︰n︰p︰q
=△c(A)︰△c(B)︰△c(C)︰△c(D)
=△n(A)︰△n(B)︰△n(C)︰△n(D)
结论4、用化学反应速率来比较同一反应在不同条件下反应的快慢时,应选择同一物质并用同一单位(即统一标准)来比较。
4、化学反应速率其他计算公式
用单位时间内浓度的变化量来(v= )表示化学反应速率只是最常见的一种,不是唯一的形式。例如:
v=_________ Pa/min; v=_________ mol/min。
v=_________ g/min; v=_________ mL/s。
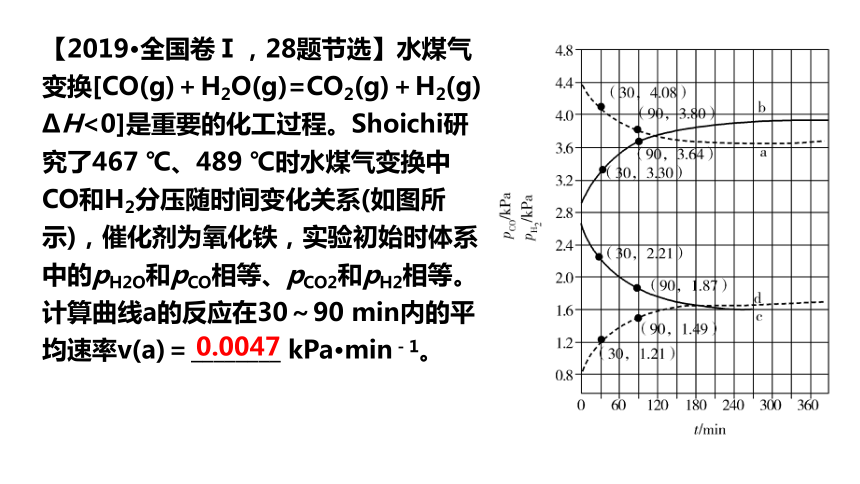
【2019·全国卷Ⅰ,28题节选】水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0]是重要的化工过程。Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体系中的pH2O和pCO相等、pCO2和pH2相等。计算曲线a的反应在30~90 min内的平均速率v(a)=________ kPa·min-1。
0.0047
研究发现利用NH3可消除硝酸工业尾气中的NO污染。NH3与NO的物质的量之比分别为1∶3、3∶1、4∶1时,NO脱除率随温度变化的曲线如图所示。
曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为 mg/(m3·s1)。
从A点到B点的浓度变化为
(0.75-0.55)×6×10-4mg·m-3=
1.2×10-4 mg·m-3,
脱除速率为(1.2×10-4mg·m-3)/0.8s=1.5×10-4 mg·m-3·s-1;
正、逆反应的速率常数与平衡常数的关系对于基元反应aA(g)+bB(g)??cC(g)+dD(g),
已知:v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),请列出K和v正、k正、v逆、k逆的关系式。
5、速率常数与平衡常数关系
K=cc(C)·cd(D)/【ca(A)·cb(B)】
=k正·v逆/(k逆·v正),反应达到平衡时v正=v逆,故K=k正/k逆
1.已知反应2NO(g)+2H2(g)=N2(g)+2H2O(g)生成N2的初始速率与NO、H2的初始浓度的关系为v=kcx(NO)·cy(H2),k为速率常数。在800 ℃时测得的相关数据如下表所示。
实验数据 初始浓度 生成N2的初始速率/
mol·L-1·s-1
c(NO)/mol·L-1 c(H2)/mol·L-1 1 2.00×10-3 6.00×10-3 1.92×10-3
2 1.00×10-3 6.00×10-3 4.80×10-4
3 2.00×10-3 3.00×10-3 9.60×10-4
【学以致用】
下列说法中不正确的是
A、关系式中x=2,y=2
B、800 ℃时,k值为8×104
C、若800 ℃时,初始浓度c(NO)=c(H2)=4.00×10-3 mol·L-1,则生成N2的初始速率为5.12×10-3 mol·L-1·s-1
D、当其他条件不变时,升高温度,速率常数将增大
A
【2020·全国卷Ⅱ,28题节选】高温下,甲烷生成乙烷的反应如下:2CH4 → C2H6+H2。反应在初期阶段的速率方程为:r=k×c(CH4), 其中k为反应速率常数。(1)设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=________r1。 (2)对于处于初期阶段的该反应,下列说法正确的是________。 A.增加甲烷浓度,r增大 B.增加H2浓度,r增大C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
高温
(1-α)
AD
【2016年海南节选】顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:
该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
已知:t1温度下,k(正)=0.006s-1,k(逆)=0.002s-1,该温度下反应的平衡常数值K1=_____;
3
【2018年全国Ⅲ节选】对于反应2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
①343 K时反应的平衡转化率α=_____%。
平衡常数K343 K=______(保留2位小数)。
22
0.02
②比较a、b处反应速率大小:va vb(填“大于”“小于”或“等于”)。
反应速率v=v正 v逆=
k正x2(SiHCl3) k逆x(SiH2Cl2)x(SiCl4),
k正、k逆分别为正、逆向反应速率常数,
x为物质的量分数,计算a处v正/v逆=_________(保留1位小数)
大于
1.3
298 K时,将20 mL 3x mol·L 1 Na3AsO3、20 mL 3x mol·L 1 I2和20 mL NaOH溶液混合,发生可逆反应:AsO33 (aq)+I2(aq)+2OH AsO43 (aq)+2I (aq)+ H2O(l)。溶液中c(AsO43 )与反应时间(t)的关系如图所示。
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是__________________
大于
小于
反应还没有达到平衡,逆反应不断增加
升高温度绝大多数的化学反应速率增大,但是
2NO(g)+O2(g) 2NO2(g)的速率却随温度的升高而减小。某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
①2NO(g) N2O2(g)(快) ΔH1<0
V1正=k1正·c2(NO) V1逆=k1逆·c(N2O2)
②N2O2(g)+O2(g) 2NO2(g) (慢) ΔH2<0
V2正=k2正·c(N2O2)·c(O2) V2逆=k2逆·c2(NO2)
请回答下列问题:
(1)一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ,根据速率方程分析,升高温度该反应速率减小的原因是 (填字母)。
a.k2正增大,c(N2O2)增大 b.k2正减小,c(N2O2)减小
c.k2正增大,c(N2O2)减小 d.k2正减小,c(N2O2)增大
b
4、某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
实验序号 时间温度/℃ 0 10 20 30 40 50 60
1 800 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800 c2 0.60 0.50 0.50 0.50 0.50 0.50
3 800 c3 0.92 0.75 0.63 0.60 0.60 0.60
4 820 1.0 0.40 0.25 0.20 0.20 0.20 0.20
根据上述数据,完成下列填空:
(1)在实验1中,反应在10~20 min时间内平均速率为________ mol/(L·min)。
0.013
练一练
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
实验序号 时间温度/℃ 0 10 20 30 40 50 60
1 800 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800 c2 0.60 0.50 0.50 0.50 0.50 0.50
3 800 c3 0.92 0.75 0.63 0.60 0.60 0.60
4 820 1.0 0.40 0.25 0.20 0.20 0.20 0.20
(2)在实验2中,A的初始浓度c2=________mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是 。
1.0
催化剂
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
实验序号 时间温度/℃ 0 10 20 30 40 50 60
1 800 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800 c2 0.60 0.50 0.50 0.50 0.50 0.50
3 800 c3 0.92 0.75 0.63 0.60 0.60 0.60
4 820 1.0 0.40 0.25 0.20 0.20 0.20 0.20
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3________v1,且c3________1.0 mol·L-1(填“=”、“>”或“<”)。
>
>
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
实验序号 时间温度/℃ 0 10 20 30 40 50 60
1 800 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800 c2 0.60 0.50 0.50 0.50 0.50 0.50
3 800 c3 0.92 0.75 0.63 0.60 0.60 0.60
4 820 1.0 0.40 0.25 0.20 0.20 0.20 0.20
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”或“放热”),理由是:
吸热
温度升高时,平衡时向右移动
【2014·北京卷】一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。下列叙述不正确的是(溶液体积变化忽略不计)A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1[]B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1C.反应至6 min时,c(H2O2)=0.30 mol/LD.反应至6 min时,H2O2分解了50%t/min0246810V(O2)/mL0.09.917.222.426.529.9C分子
运动
相互
碰撞
分子具有
足够能量
活化分子
有合适的取向
有效碰撞
化学反应
n活=n总×W活%
二、有效碰撞理论
③有效碰撞:指能够发生化学反应的碰撞。
①活化分子:指能够发生有效碰撞的分子。
②活化分子百分数:指活化分子在反应物分子中所占的百分数。
外界因素 活化能 分子总数 活化分子总数 活化分子百分数 单位体积活化分子数 有效碰撞次数 反应速率
增大浓度
压缩体积
升高温度
加催化剂
小结:影响化学反应速率的外因
不变 增多 增多 不变 增多 增多 加快
不变 不变 不变 不变 增多 增多 加快
不变 不变 增多 增多 增多 增多 加快
降低 不变 增多 增多 增多 增多 加快
化学反应速率
基本概念和计算
2、数学表达式:
c
t
v
=
v=
浓度变化量( )
mol/L
时间变化量( )
S、min或h
化学反应速率通常是用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
1、定义:
一、化学反应速率的概念及有关计算
3、单位:
mol/(L s)
mol L-1 s-1
mol/(L min)
mol L-1 min-1
或
1mol/(L·s)=60 mol/(L·min)
1、反应4A(固)+5B(气)=4C(气)+6D(气)在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol。下列论述正确的是
A、A的平均反应速率是0.010 mol·L-1·s-1
B、容器中含D的物质的量至少为0.45mol
C、容器中A、B、C、D的物质的量比一定是4:5:4:6
D、半分钟时,C的反应速率是0.010 mol·L-1·s-1
B
练一练
结论1、对于固体或纯液体的反应物,一般情况下其浓度是常数,通常不用这个公式表示反应速率。
结论2、我们所说的速率是指在整个过程中的平均速率。且均为正值
练后反思
练后反思
结论3、同一反应中,如 m A(g)+n B(g) = pC(g)+q D(g),用不同的物质来表示的速率,数值可能不同,但意义相同。因此表示反应速率时一定要指明反应物和生成物中哪种物质做标准。
速率之比等于化学计量数之比,
也等于相应物质在同一段时间内的变化量之比。
即ひ(A) ︰ひ(B) ︰ひ(C) ︰ひ(D)= m︰n︰p︰q
=△c(A)︰△c(B)︰△c(C)︰△c(D)
=△n(A)︰△n(B)︰△n(C)︰△n(D)
结论4、用化学反应速率来比较同一反应在不同条件下反应的快慢时,应选择同一物质并用同一单位(即统一标准)来比较。
4、化学反应速率其他计算公式
用单位时间内浓度的变化量来(v= )表示化学反应速率只是最常见的一种,不是唯一的形式。例如:
v=_________ Pa/min; v=_________ mol/min。
v=_________ g/min; v=_________ mL/s。
【2019·全国卷Ⅰ,28题节选】水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0]是重要的化工过程。Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体系中的pH2O和pCO相等、pCO2和pH2相等。计算曲线a的反应在30~90 min内的平均速率v(a)=________ kPa·min-1。
0.0047
研究发现利用NH3可消除硝酸工业尾气中的NO污染。NH3与NO的物质的量之比分别为1∶3、3∶1、4∶1时,NO脱除率随温度变化的曲线如图所示。
曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为 mg/(m3·s1)。
从A点到B点的浓度变化为
(0.75-0.55)×6×10-4mg·m-3=
1.2×10-4 mg·m-3,
脱除速率为(1.2×10-4mg·m-3)/0.8s=1.5×10-4 mg·m-3·s-1;
正、逆反应的速率常数与平衡常数的关系对于基元反应aA(g)+bB(g)??cC(g)+dD(g),
已知:v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),请列出K和v正、k正、v逆、k逆的关系式。
5、速率常数与平衡常数关系
K=cc(C)·cd(D)/【ca(A)·cb(B)】
=k正·v逆/(k逆·v正),反应达到平衡时v正=v逆,故K=k正/k逆
1.已知反应2NO(g)+2H2(g)=N2(g)+2H2O(g)生成N2的初始速率与NO、H2的初始浓度的关系为v=kcx(NO)·cy(H2),k为速率常数。在800 ℃时测得的相关数据如下表所示。
实验数据 初始浓度 生成N2的初始速率/
mol·L-1·s-1
c(NO)/mol·L-1 c(H2)/mol·L-1 1 2.00×10-3 6.00×10-3 1.92×10-3
2 1.00×10-3 6.00×10-3 4.80×10-4
3 2.00×10-3 3.00×10-3 9.60×10-4
【学以致用】
下列说法中不正确的是
A、关系式中x=2,y=2
B、800 ℃时,k值为8×104
C、若800 ℃时,初始浓度c(NO)=c(H2)=4.00×10-3 mol·L-1,则生成N2的初始速率为5.12×10-3 mol·L-1·s-1
D、当其他条件不变时,升高温度,速率常数将增大
A
【2020·全国卷Ⅱ,28题节选】高温下,甲烷生成乙烷的反应如下:2CH4 → C2H6+H2。反应在初期阶段的速率方程为:r=k×c(CH4), 其中k为反应速率常数。(1)设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=________r1。 (2)对于处于初期阶段的该反应,下列说法正确的是________。 A.增加甲烷浓度,r增大 B.增加H2浓度,r增大C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
高温
(1-α)
AD
【2016年海南节选】顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:
该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
已知:t1温度下,k(正)=0.006s-1,k(逆)=0.002s-1,该温度下反应的平衡常数值K1=_____;
3
【2018年全国Ⅲ节选】对于反应2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
①343 K时反应的平衡转化率α=_____%。
平衡常数K343 K=______(保留2位小数)。
22
0.02
②比较a、b处反应速率大小:va vb(填“大于”“小于”或“等于”)。
反应速率v=v正 v逆=
k正x2(SiHCl3) k逆x(SiH2Cl2)x(SiCl4),
k正、k逆分别为正、逆向反应速率常数,
x为物质的量分数,计算a处v正/v逆=_________(保留1位小数)
大于
1.3
298 K时,将20 mL 3x mol·L 1 Na3AsO3、20 mL 3x mol·L 1 I2和20 mL NaOH溶液混合,发生可逆反应:AsO33 (aq)+I2(aq)+2OH AsO43 (aq)+2I (aq)+ H2O(l)。溶液中c(AsO43 )与反应时间(t)的关系如图所示。
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是__________________
大于
小于
反应还没有达到平衡,逆反应不断增加
升高温度绝大多数的化学反应速率增大,但是
2NO(g)+O2(g) 2NO2(g)的速率却随温度的升高而减小。某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
①2NO(g) N2O2(g)(快) ΔH1<0
V1正=k1正·c2(NO) V1逆=k1逆·c(N2O2)
②N2O2(g)+O2(g) 2NO2(g) (慢) ΔH2<0
V2正=k2正·c(N2O2)·c(O2) V2逆=k2逆·c2(NO2)
请回答下列问题:
(1)一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ,根据速率方程分析,升高温度该反应速率减小的原因是 (填字母)。
a.k2正增大,c(N2O2)增大 b.k2正减小,c(N2O2)减小
c.k2正增大,c(N2O2)减小 d.k2正减小,c(N2O2)增大
b
4、某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
实验序号 时间温度/℃ 0 10 20 30 40 50 60
1 800 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800 c2 0.60 0.50 0.50 0.50 0.50 0.50
3 800 c3 0.92 0.75 0.63 0.60 0.60 0.60
4 820 1.0 0.40 0.25 0.20 0.20 0.20 0.20
根据上述数据,完成下列填空:
(1)在实验1中,反应在10~20 min时间内平均速率为________ mol/(L·min)。
0.013
练一练
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
实验序号 时间温度/℃ 0 10 20 30 40 50 60
1 800 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800 c2 0.60 0.50 0.50 0.50 0.50 0.50
3 800 c3 0.92 0.75 0.63 0.60 0.60 0.60
4 820 1.0 0.40 0.25 0.20 0.20 0.20 0.20
(2)在实验2中,A的初始浓度c2=________mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是 。
1.0
催化剂
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
实验序号 时间温度/℃ 0 10 20 30 40 50 60
1 800 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800 c2 0.60 0.50 0.50 0.50 0.50 0.50
3 800 c3 0.92 0.75 0.63 0.60 0.60 0.60
4 820 1.0 0.40 0.25 0.20 0.20 0.20 0.20
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3________v1,且c3________1.0 mol·L-1(填“=”、“>”或“<”)。
>
>
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
实验序号 时间温度/℃ 0 10 20 30 40 50 60
1 800 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800 c2 0.60 0.50 0.50 0.50 0.50 0.50
3 800 c3 0.92 0.75 0.63 0.60 0.60 0.60
4 820 1.0 0.40 0.25 0.20 0.20 0.20 0.20
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”或“放热”),理由是:
吸热
温度升高时,平衡时向右移动
【2014·北京卷】一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。下列叙述不正确的是(溶液体积变化忽略不计)A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1[]B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1C.反应至6 min时,c(H2O2)=0.30 mol/LD.反应至6 min时,H2O2分解了50%t/min0246810V(O2)/mL0.09.917.222.426.529.9C分子
运动
相互
碰撞
分子具有
足够能量
活化分子
有合适的取向
有效碰撞
化学反应
n活=n总×W活%
二、有效碰撞理论
③有效碰撞:指能够发生化学反应的碰撞。
①活化分子:指能够发生有效碰撞的分子。
②活化分子百分数:指活化分子在反应物分子中所占的百分数。
外界因素 活化能 分子总数 活化分子总数 活化分子百分数 单位体积活化分子数 有效碰撞次数 反应速率
增大浓度
压缩体积
升高温度
加催化剂
小结:影响化学反应速率的外因
不变 增多 增多 不变 增多 增多 加快
不变 不变 不变 不变 增多 增多 加快
不变 不变 增多 增多 增多 增多 加快
降低 不变 增多 增多 增多 增多 加快
