2.2等效平衡 课件(共23张PPT)2022-2023学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2等效平衡 课件(共23张PPT)2022-2023学年上学期高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 260.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 15:38:18 | ||
图片预览






文档简介
(共23张PPT)
等效平衡
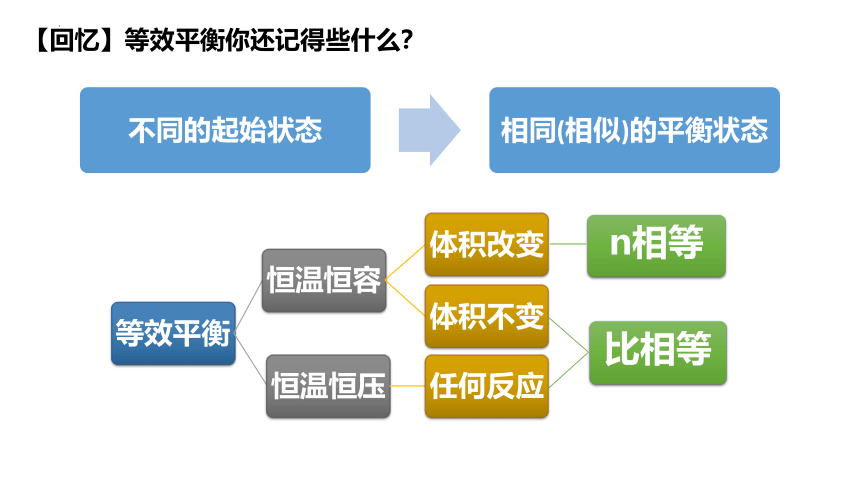
n相等
比相等
【回忆】等效平衡你还记得些什么?
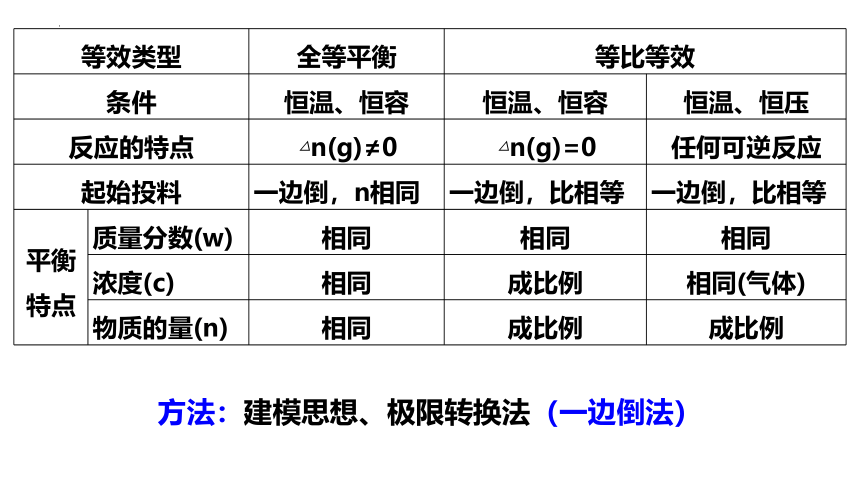
等效类型 全等平衡 等比等效 条件 恒温、恒容 恒温、恒容 恒温、恒压
反应的特点 △n(g)≠0 △n(g)=0 任何可逆反应
起始投料 一边倒,n相同 一边倒,比相等 一边倒,比相等
平衡特点 质量分数(w)
浓度(c)
物质的量(n)
等效类型 全等平衡 等比等效 条件 恒温、恒容 恒温、恒容 恒温、恒压
反应的特点 △n(g)≠0 △n(g)=0 任何可逆反应
起始投料 一边倒,n相同 一边倒,比相等 一边倒,比相等
平衡特点 质量分数(w) 相同 相同 相同
浓度(c) 相同 成比例 相同(气体)
物质的量(n) 相同 成比例 成比例
方法:建模思想、极限转换法(一边倒法)
一、判断等效平衡
【例】有一个固定体积的密闭容器中,加入2molA和1molB发生反应,2 A(g)+B(g) 3C(g)+D(s),达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达平衡时C的浓度仍为Wmol/L的是( )
A.4mol A + 2mol B
B.2mol A + 1mol B + 3mol C + 1mol D
C.3mol C + 1mol D +1mol B
D.3mol C + 1mol D
D
变式:如果改为压强和温度不变,则答案为?
ABD
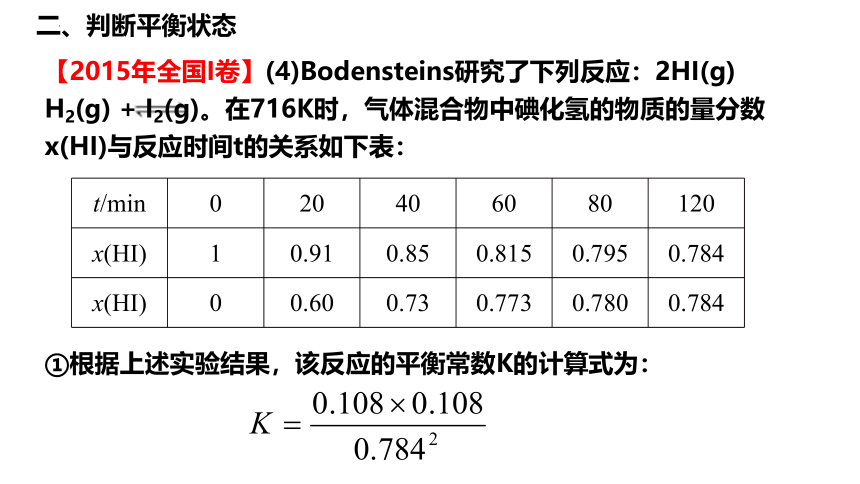
【2015年全国I卷】(4)Bodensteins研究了下列反应:2HI(g) H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min 0 20 40 60 80 120
x(HI) 1 0.91 0.85 0.815 0.795 0.784
x(HI) 0 0.60 0.73 0.773 0.780 0.784
①根据上述实验结果,该反应的平衡常数K的计算式为:
二、判断平衡状态
练习:在恒温、恒压密闭容器中发生反应:
2SO2(g)+O2(g) 2SO3(g),原有反应物SO2、O2均为1 mol,平衡后,再向容器中充入1 mol SO2和1 mol O2,则达到新平衡时,SO2的转化率________(填“增大”“减小”或“不变”)。
不变
变式:如果上诉反应条件改为恒温、恒容,
①加入1 mol SO2和1 mol O2后平衡怎么移动?
②达到新平衡时,SO2的转化率会怎么变?
增大
正移
三、判断平衡转化率
变式:在恒温、恒压密闭容器中发生反应:
2SO3(g) 2SO2(g)+O2(g),原有反应物SO3为1 mol,平衡后,再向容器中充入1 mol SO3,则达到新平衡时,SO3的转化率________(填“增大”“减小”或“不变”)。
变式:如果上诉反应条件改为恒温、恒容,
①加入1 mol SO3后平衡怎么移动?
②达到新平衡时,SO3的转化率会怎么变?
减小
不变
正移
变式:在恒温、恒压密闭容器中发生反应:
I2(g)+H2(g) 2HI(g),原有反应物原I2、H2均为1 mol,平衡后,再向容器中充入0.5 mol I2和0.5 mol H2,则达到新平衡时,I2的转化率________(填“增大”“减小”或“不变”)。
不变
变式:如果上诉反应条件改为恒温、恒容,
①加入0.5 mol I2和0.5 mol H2后平衡怎么移动?
②达到新平衡时,I2的转化率会怎么变?
不变
正移
恒温恒容时, 对于反应aA(g)+bB(g) cC(g)+dD(g),达到平衡后,按原比例同倍数的增加反应物A和B的量
若a+b=c+d,A、B的转化率均
若a+b>c+d,A、B的转化率均
若a+b小结:
不变
增大
减小
相当于加压
【思考】如果增大某一反应物浓度可使其它反应物转化率 ;
【思考】若容器体积不变,使其它反应物的浓度减小,则自身的转化率
。
增大
减小
【思维延伸】若在恒温恒容条件下:aA(g) cC(g)+dD(g)
【思考】若在恒温恒压条件下,增大A的浓度,A的转化率 。
达到平衡后,增加反应物A的量
若a=c+d, A的转化率
若a>c+d, A的转化率
若a相当于加压
等效平衡
不变
增大
减小
不变
练习:某恒温恒容的容器中,建立如下平衡:2NO2(g) N2O4(g),在相同条件下,若分别向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内N2O4的体积分数比原平衡时
A.都增大 B.都减小
C.前者增大后者减小 D.前者减小后者增大
A
【2019·上海高考真题】已知反应式:
mX(g)+nY( ) pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的1/2,c(X)=0.5mol/L,下列说法正确的是( )A.反应向逆方向移动 B.Y可能是固体或液体
C.系数n>m D.Z的体积分数减小
C
【2009·北京高考真题】已知H2(g)+I2(g) 2HI(g) H<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2(g)各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B.甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D.甲增加0.1molH2,乙增加0.1mol I2
C
【2018·天津高考真题】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应:
C2H5OH+HBr C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A.加入NaOH,可增大乙醇的物质的量
B.增大HBr浓度,有利于生成C2H5Br
C.若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D.若起始温度提高至60℃,可缩短反应达到平衡的时间
D
练习:甲、乙、丙三个容器分别为恒温恒容、恒温恒压、恒容绝热。加入相同量反应物时,甲、乙、丙三个容器中反应物A的转化率由大到小的顺序为:
四、非等效平衡时比较平衡状态量
A(g)+B(g) C(g)+D(s) ΔH>0
A(g)+B(g) C(g)+D(s) ΔH<0
A(g)+B(s) C(g)+D(g) ΔH>0
A(g)+B(s) C(g)+D(g) ΔH<0
A(g)+B(g) C(g)+D(g) ΔH>0
A(g)+B(g) C(g)+D(g) ΔH<0
乙>甲>丙
乙>甲>丙
乙>甲>丙
乙>甲>丙
乙=甲>丙
乙=甲>丙
小结:①△n(g)≠0的反应,投料相同时,转化率恒温恒压>恒温恒容>恒容绝热;
②△n(g)=0的反应,投料比同时,转化率恒温恒压=恒温恒容>恒容绝热;
【2013·江苏高考真题】一定条件下存在反应:
CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1mol H2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器I、II中正反应速率相同
B.容器I、III中反应的平衡常数相同
C.容器I中CO的物质的量比容器II中的多
D.容器I中CO的转化率与容器II中CO2的转化率之和等于1
C
1.(2019·海南,3)反应C2H6(g) C2H4(g)+H2(g) ΔH>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是
A.增大容器容积 B.升高反应温度
C.分离出部分氢气 D.等容下通入惰性气体
1
2
3
√
【例】体积完全相同的两个容器A和B,已知A装有SO2和O2各1 mol,B装有SO2和O2各2 mol,在相同温度下反应达到平衡时A中SO3的体积分数为a%,B中SO3的体积分数为b%,则A、B两容器中SO3体积分数的关系正确的是
A.a%>b% B.a%=b% C.a%C
三、非等效平衡时比较平衡状态量
等效平衡
n相等
比相等
【回忆】等效平衡你还记得些什么?
等效类型 全等平衡 等比等效 条件 恒温、恒容 恒温、恒容 恒温、恒压
反应的特点 △n(g)≠0 △n(g)=0 任何可逆反应
起始投料 一边倒,n相同 一边倒,比相等 一边倒,比相等
平衡特点 质量分数(w)
浓度(c)
物质的量(n)
等效类型 全等平衡 等比等效 条件 恒温、恒容 恒温、恒容 恒温、恒压
反应的特点 △n(g)≠0 △n(g)=0 任何可逆反应
起始投料 一边倒,n相同 一边倒,比相等 一边倒,比相等
平衡特点 质量分数(w) 相同 相同 相同
浓度(c) 相同 成比例 相同(气体)
物质的量(n) 相同 成比例 成比例
方法:建模思想、极限转换法(一边倒法)
一、判断等效平衡
【例】有一个固定体积的密闭容器中,加入2molA和1molB发生反应,2 A(g)+B(g) 3C(g)+D(s),达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达平衡时C的浓度仍为Wmol/L的是( )
A.4mol A + 2mol B
B.2mol A + 1mol B + 3mol C + 1mol D
C.3mol C + 1mol D +1mol B
D.3mol C + 1mol D
D
变式:如果改为压强和温度不变,则答案为?
ABD
【2015年全国I卷】(4)Bodensteins研究了下列反应:2HI(g) H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min 0 20 40 60 80 120
x(HI) 1 0.91 0.85 0.815 0.795 0.784
x(HI) 0 0.60 0.73 0.773 0.780 0.784
①根据上述实验结果,该反应的平衡常数K的计算式为:
二、判断平衡状态
练习:在恒温、恒压密闭容器中发生反应:
2SO2(g)+O2(g) 2SO3(g),原有反应物SO2、O2均为1 mol,平衡后,再向容器中充入1 mol SO2和1 mol O2,则达到新平衡时,SO2的转化率________(填“增大”“减小”或“不变”)。
不变
变式:如果上诉反应条件改为恒温、恒容,
①加入1 mol SO2和1 mol O2后平衡怎么移动?
②达到新平衡时,SO2的转化率会怎么变?
增大
正移
三、判断平衡转化率
变式:在恒温、恒压密闭容器中发生反应:
2SO3(g) 2SO2(g)+O2(g),原有反应物SO3为1 mol,平衡后,再向容器中充入1 mol SO3,则达到新平衡时,SO3的转化率________(填“增大”“减小”或“不变”)。
变式:如果上诉反应条件改为恒温、恒容,
①加入1 mol SO3后平衡怎么移动?
②达到新平衡时,SO3的转化率会怎么变?
减小
不变
正移
变式:在恒温、恒压密闭容器中发生反应:
I2(g)+H2(g) 2HI(g),原有反应物原I2、H2均为1 mol,平衡后,再向容器中充入0.5 mol I2和0.5 mol H2,则达到新平衡时,I2的转化率________(填“增大”“减小”或“不变”)。
不变
变式:如果上诉反应条件改为恒温、恒容,
①加入0.5 mol I2和0.5 mol H2后平衡怎么移动?
②达到新平衡时,I2的转化率会怎么变?
不变
正移
恒温恒容时, 对于反应aA(g)+bB(g) cC(g)+dD(g),达到平衡后,按原比例同倍数的增加反应物A和B的量
若a+b=c+d,A、B的转化率均
若a+b>c+d,A、B的转化率均
若a+b
不变
增大
减小
相当于加压
【思考】如果增大某一反应物浓度可使其它反应物转化率 ;
【思考】若容器体积不变,使其它反应物的浓度减小,则自身的转化率
。
增大
减小
【思维延伸】若在恒温恒容条件下:aA(g) cC(g)+dD(g)
【思考】若在恒温恒压条件下,增大A的浓度,A的转化率 。
达到平衡后,增加反应物A的量
若a=c+d, A的转化率
若a>c+d, A的转化率
若a
等效平衡
不变
增大
减小
不变
练习:某恒温恒容的容器中,建立如下平衡:2NO2(g) N2O4(g),在相同条件下,若分别向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内N2O4的体积分数比原平衡时
A.都增大 B.都减小
C.前者增大后者减小 D.前者减小后者增大
A
【2019·上海高考真题】已知反应式:
mX(g)+nY( ) pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的1/2,c(X)=0.5mol/L,下列说法正确的是( )A.反应向逆方向移动 B.Y可能是固体或液体
C.系数n>m D.Z的体积分数减小
C
【2009·北京高考真题】已知H2(g)+I2(g) 2HI(g) H<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2(g)各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B.甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D.甲增加0.1molH2,乙增加0.1mol I2
C
【2018·天津高考真题】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应:
C2H5OH+HBr C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A.加入NaOH,可增大乙醇的物质的量
B.增大HBr浓度,有利于生成C2H5Br
C.若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D.若起始温度提高至60℃,可缩短反应达到平衡的时间
D
练习:甲、乙、丙三个容器分别为恒温恒容、恒温恒压、恒容绝热。加入相同量反应物时,甲、乙、丙三个容器中反应物A的转化率由大到小的顺序为:
四、非等效平衡时比较平衡状态量
A(g)+B(g) C(g)+D(s) ΔH>0
A(g)+B(g) C(g)+D(s) ΔH<0
A(g)+B(s) C(g)+D(g) ΔH>0
A(g)+B(s) C(g)+D(g) ΔH<0
A(g)+B(g) C(g)+D(g) ΔH>0
A(g)+B(g) C(g)+D(g) ΔH<0
乙>甲>丙
乙>甲>丙
乙>甲>丙
乙>甲>丙
乙=甲>丙
乙=甲>丙
小结:①△n(g)≠0的反应,投料相同时,转化率恒温恒压>恒温恒容>恒容绝热;
②△n(g)=0的反应,投料比同时,转化率恒温恒压=恒温恒容>恒容绝热;
【2013·江苏高考真题】一定条件下存在反应:
CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1mol H2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器I、II中正反应速率相同
B.容器I、III中反应的平衡常数相同
C.容器I中CO的物质的量比容器II中的多
D.容器I中CO的转化率与容器II中CO2的转化率之和等于1
C
1.(2019·海南,3)反应C2H6(g) C2H4(g)+H2(g) ΔH>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是
A.增大容器容积 B.升高反应温度
C.分离出部分氢气 D.等容下通入惰性气体
1
2
3
√
【例】体积完全相同的两个容器A和B,已知A装有SO2和O2各1 mol,B装有SO2和O2各2 mol,在相同温度下反应达到平衡时A中SO3的体积分数为a%,B中SO3的体积分数为b%,则A、B两容器中SO3体积分数的关系正确的是
A.a%>b% B.a%=b% C.a%
三、非等效平衡时比较平衡状态量
