3.1晶体的结构与性质课件(共39张PPT)2022-2023学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.1晶体的结构与性质课件(共39张PPT)2022-2023学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 15:40:29 | ||
图片预览








文档简介
(共39张PPT)
第5讲 晶体的结构与性质
常见晶体的结构与性质
一、晶体类型
1、分子晶体:只含分子的晶体(即:分子构成的晶体)或者说分子间通过分子间作用力相结合形成的晶体。
2、共价晶体:相邻原子间以共价键相结合而形成空间立体网状结构的晶体。
(1)“电子气理论”是把金属键描述为金属原子脱落下来的 形成遍布整块晶体的“电子气”,被所有原子所共用,从而把所有金属原子维系在一起,形成“巨分子”。
3、金属晶体
价电子
(2)金属键的实质是金属阳离子与电子气间的静电作用。
(3)用电子气理论解释金属的性质
相对滑动
排列方式
电子气
定向移动
离子晶体:由阴、阳离子通过离子键结合而成的晶体。
过渡晶体:介于典型晶体之间的晶体。
纯粹的典型的晶体是不多的,大多数晶体是它们的过渡晶体。
混合型晶体:石墨晶体,石墨是共价晶体、金属晶体、分子晶体的一种混合型晶体,既有共价键、又有金属键,还有范德华力。
二、四种晶体性质的比较
晶体类型 共价晶体 分子晶体 离子晶体 金属晶体
粒子间作用力 共价键 分子间作用力 离子键 金属键
构成微粒 原子 分子 阴、阳离子 金属阳离子和自由电子
物 理 性 质 熔沸点 很高 很低 较高 差别较大
硬度 很大 很小 硬而脆 差别较大
导电性 无(硅为半导体) 差 差 良导体
延展性 差 差 差 良好
溶解性 难溶于一般溶剂 相似相容 多数易溶于水 不溶于水
三、典型晶体模型
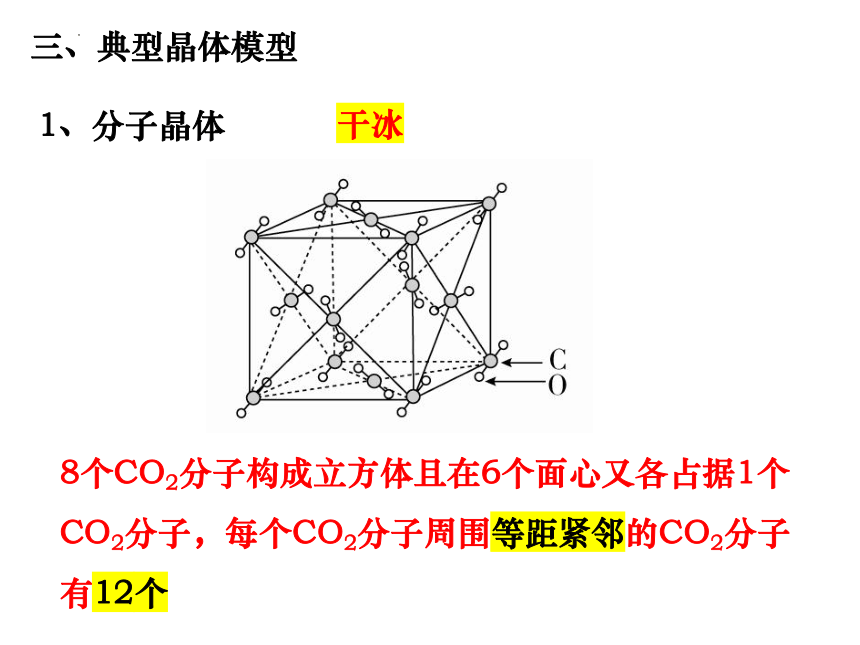
1、分子晶体
干冰
8个CO2分子构成立方体且在6个面心又各占据1个CO2分子,每个CO2分子周围等距紧邻的CO2分子有12个
因为碳氧原子构成的双键结构,干冰晶体中二氧化碳分子的排列方向有4种, 即在顶点上1种, 3对面心上3种.
性质特点:低熔点、易升华
作用:升华吸热、制冷剂、人工降雨等
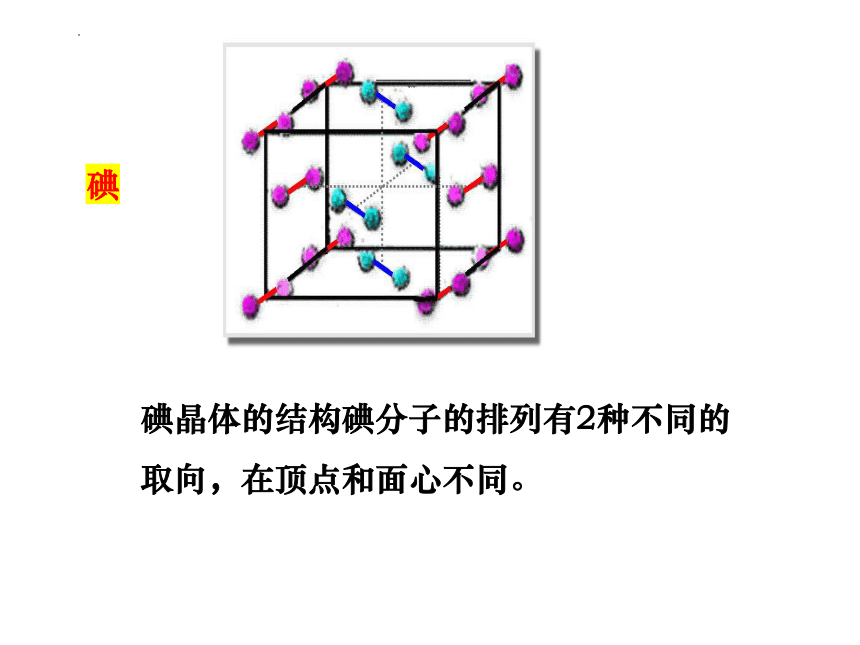
碘晶体的结构碘分子的排列有2种不同的取向,在顶点和面心不同。
碘
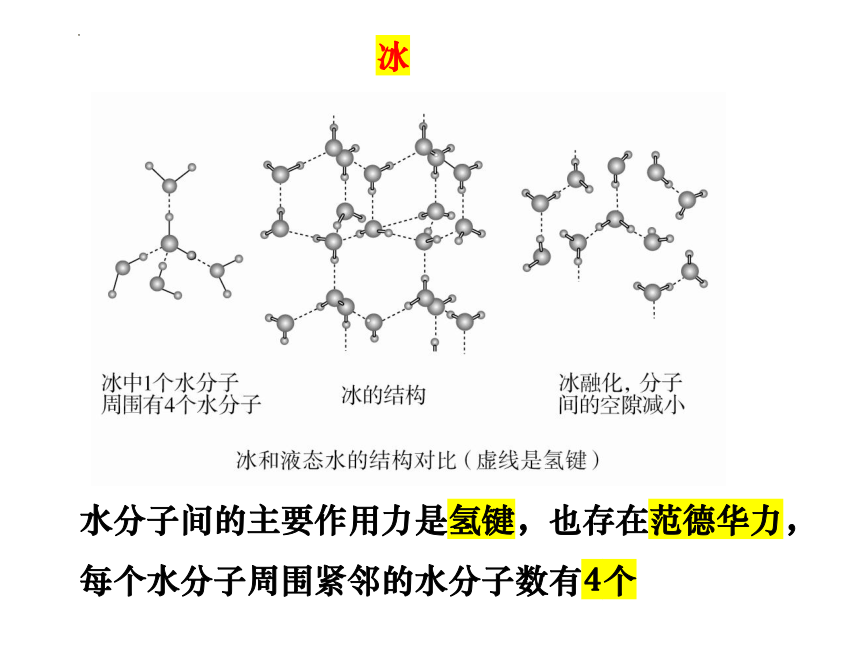
冰
水分子间的主要作用力是氢键,也存在范德华力,每个水分子周围紧邻的水分子数有4个
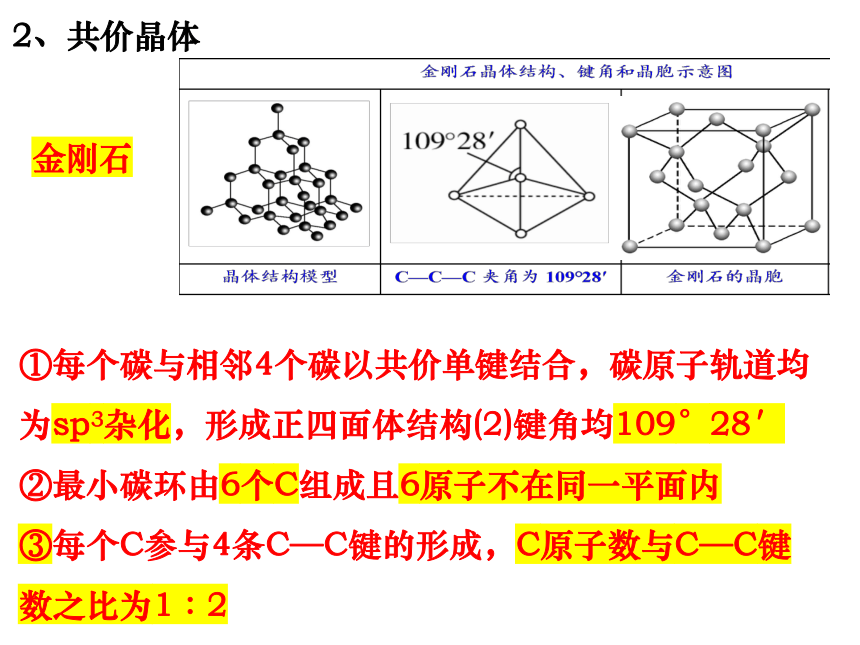
2、共价晶体
金刚石
①每个碳与相邻4个碳以共价单键结合,碳原子轨道均为sp3杂化,形成正四面体结构(2)键角均109°28′
②最小碳环由6个C组成且6原子不在同一平面内
③每个C参与4条C—C键的形成,C原子数与C—C键数之比为1∶2
SiO2
①每个Si与4个O以共价键结合,硅原子轨道均为sp3杂化,形成正四面体结构
②每个正四面体占有1个Si,4个“O”,n(Si)∶n(O)=1∶2
③最小环上有12个原子,即6个O,6个Si
NaCl (型)
三、离子晶体
①每个Na+(Cl-)周围等距且紧邻的Cl-(Na+)有6个。每个Na+周围等距且紧邻的Na+有12个
②每个晶胞中含4个Na+和4个Cl-
CsCl(型)
①每个Cs+周围等距且紧邻的Cl-有8个,每个Cs+
(Cl-)周围等距且紧邻的Cs+(Cl-)有6个
②如图为1个晶胞,每个晶胞中含1个Cs+、1个Cl-
晶胞
晶胞中 微粒数
阴、阳离子 个数比
符合类型
化学式 ZnS CaF2
Zn2+、S2-
都为4
F-为8,
Ca2+为4
1∶1
2∶1
BeO、BeS等
BaF2、PbF2、
CeO2等
常见金属晶体的三种结构型式
结构型式 面心立方最密堆积A1 体心立方密堆积A2 六方最密堆积A3
常见金属
结构示意图
晶胞中的微粒数
4
Ca、Al、Cu、Ag、Au、Pd、Pt
2
Mg、Zn、Ti
2
Li、Na、K、
Ba、W、Fe
4、金属晶体
石墨
5、混合型晶体
(1)层内每个碳原子与3个碳原子形成C-C键,组成正六边形
(2)石墨晶体中碳原子轨道均为sp2杂化
(3)碳原子个数与C—C键数之比为2∶3
四、晶体类型的判断
1、根据物质的分类判断
(1)离子晶体---金属氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体
(2)分子晶体---卤素、氧气、氢气等大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、稀有气体、所有非金属氢化物、多数非金属氧化物(除SiO2外)、含氧酸(几乎所有的酸)、绝大多数有机物的晶体都是分子晶体
(3)共价晶体常见的---某些非金属单质:金刚石、晶体硅(Si) 、晶体硼(B),某些非金属化合物:二氧化硅(SiO2 ) 、碳化硅(SiC )、 Si3N4、BN、 AlN、( Al2O3 )等
(4)金属晶体---金属单质(除汞外)与合金
2、依据组成晶体的微粒及微粒间的作用判断
(4)金属晶体的微粒是金属阳离子和自由电子,微粒间的作用是金属键。
(3)共价晶体的微粒是原子,微粒间的作用是共价键;
(2)分子晶体的微粒是分子,微粒间的作用为分子间作用力;
(1)离子晶体的微粒是阴、阳离子,微粒间的作用是离子键;
3、 依据晶体的熔点判断
(4)金属晶体熔点高低皆有。
(3)共价晶体熔点高,常在一千度至几千度;
(2)分子晶体熔点低,常在数百度以下至很低温度;
(1)离子晶体的熔点较高,常在数百度至一千余度;
4、依据导电性判断
(4)金属晶体是电的良导体。
(3)共价晶体一般为非导体,但有些能导电,如晶体硅(半导体);
(2)分子晶体为非导体,而分子晶体中的电解质(如酸和部分非金属气态氢化物)溶于水,使分子内的化学键断裂形成自由离子也能导电;
(1)离子晶体水溶液及熔化时能导电;
5、依据硬度和机械性能判断
(4)金属晶体多数硬度大,但也有较低的,且具有延展性。
(3)共价晶体硬度大;
(2)分子晶体硬度小且较脆;
(1)离子晶体硬度较大或略硬而脆;
练习1、(2022·湖北黄冈模拟)下列固体分类中正确的一组是( )
A
离子晶体 共价晶体 分子晶体
A 苏打 金刚砂 干冰
B 玻璃 Ar 硫黄
C KNO3 石墨 冰醋酸
D 胆矾 金刚石 SiO2
练习2、分析下列物质的物理性质,判断其晶体类型。
①碳化铝,黄色晶体,熔点2 200 ℃,熔融态不导电:____________。
②溴化铝,无色晶体,熔点98 ℃,熔融态不导电:____________。
③五氟化矾,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮等:____________。
共价晶体
分子晶体
分子晶体
④溴化钾,无色晶体,熔融时或溶于水中都能导电:__________。
⑤SiI4:熔点120.5 ℃,沸点287.4 ℃,易水解:____________。
⑥硼:熔点2 300 ℃,沸点2 550 ℃,硬度大:____________。
⑦硒:熔点217 ℃,沸点685 ℃,溶于氯仿:____________。
⑧锑:熔点630.74 ℃,沸点1 750 ℃,固体
可导电:___________。
离子晶体
分子晶体
共价晶体
分子晶体
金属晶体
五、比较物质的熔、沸点高低的方法
1、首先看物质的状态:
一般情况下,固体>液体>气体;如I2>Hg>O2
二看物质所属晶体类型:
一般是:共价晶体>离子晶体>分子晶体(注意:不是绝对的),结构类型相同时再根据相应规律进行判断。
2、同类晶体熔、沸点比较思路为
(1)共价晶体→共价键键能→键长→原子半径;
(2)分子晶体→分子间作用力→相对分子质量;
a、组成和结构相似的物质,相对分子质量越大,分子间作用力越大,熔沸点越高。
如熔沸点:O2>N2,HI>HBr>HCl, I2 > Br2 > Cl2 > F2。
b、组成和结构不相似的物质,分子极性越大,其熔沸点就越高。如熔沸点:CO>N2。
C、在同分异构体中,一般地说,支链数越多,熔沸点越低,
如熔沸点:正戊烷>异戊烷>新戊烷;同分异构体的芳香烃及其衍生物,其熔沸点高低顺序是邻>间>对位化合物。
(3)离子晶体熔点高低的主要依据:晶格能
①概念:气态离子形成1 mol离子晶体释放的能量。晶格能通常取正值,单位为kJ·mol-1
②影响晶格能大小的因素
离子所带电荷越高,核间距越小,晶格能就越大。
晶格能越大,离子键越强,形成的离子晶体越稳定。
晶格能越大,熔点越高,硬度越大。
③晶格能与离子晶体性质的关系:
练习2、北京大学和中国科学院的化学工作者成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构的分析中正确的是( )
A.K3C60晶体中既有离子键又有极性键
B.K3C60晶体的熔点比C60晶体的熔点低
C.该晶体熔化时能导电
D.C60分子中碳原子是采用sp3杂化的
C
练习3、(2020·南阳模拟)Ⅰ.下列数据是对应物质的熔点,有关的判断错误的是( )
A.只要含有金属阳离子的晶体就一定是离子晶体
B.在共价化合物中各原子都形成8电子结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
Na2O Na AlF3 AlCl3 Al2O3 BCl3 CO2 SiO2
920℃ 97.8℃ 1 291℃ 190℃ 2 073℃ -107℃ -57℃ 1 723℃
A B
练习4、(1)卤化物CsClI2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为_______。解释X的熔点比Y高的原因_______。
CsCl CsCl为离子晶体,ICl为分子晶体
(2)H2Se的沸点低于H2O其原因是_______。
两者都是分子晶体,由于水存在分子间氢键,沸点高
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是________。
甲硫醇不能形成分子间氢键,而水和甲醇均能,且水比甲醇的氢键多
练习5、Fe、Co、Ni是三种重要的金属元素。CoO的面心立方晶胞如图所示。三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为_______________。
三种元素二价氧化物的晶胞类型相同,离子半径Fe2+>Co2+>Ni2+,NiO、CoO、FeO,离子键键长越来越长,键能越来越小,晶格能按NiO、CoO、FeO依次减小,因此其熔点由高到低的顺序为NiO>CoO>FeO。
练习5、现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3 550 ℃ Li:181 ℃ HF:-83 ℃ NaCl:801 ℃
硅晶体:1 410 ℃ Na:98 ℃ HCl:-115 ℃ KCl:776 ℃
硼晶体:2 300 ℃ K:64 ℃ HBr:-89 ℃ RbCl:718 ℃
二氧化硅:1 723 ℃ Rb:39 ℃ HI:-51 ℃ CsCl:645 ℃
据此回答下列问题:
(1)A组属于________晶体,其熔化时克服的微粒间的作用力是________。
(2)B组晶体共同的物理性质是________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
原子
共价键
①②③④
(3)C组中HF熔点反常是由于
__________________________________________。
(4)D组晶体可能具有的性质是________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为
___________________________________________
HF分子间能形成氢键,其熔化时需要消耗的能量更多
②④
D组晶体都为离子晶体,
r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带
电荷数相同的情况下,半径越小,晶格能越大,熔点就越高
A组 B组 C组 D组
金刚石:3 550 ℃ Li:181 ℃ HF:-83 ℃ NaCl:801 ℃
硅晶体:1 410 ℃ Na:98 ℃ HCl:-115 ℃ KCl:776 ℃
硼晶体:2 300 ℃ K:64 ℃ HBr:-89 ℃ RbCl:718 ℃
二氧化硅:1 723 ℃ Rb:39 ℃ HI:-51 ℃ CsCl:645 ℃
练习6、NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是_____________________ _______________________________________________________________________________________________________________。
在MgO、NaCl晶体中,离子半径:r(Mg2+)<r(Na+)、r(O2-)<r(Cl-),且MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数
第5讲 晶体的结构与性质
常见晶体的结构与性质
一、晶体类型
1、分子晶体:只含分子的晶体(即:分子构成的晶体)或者说分子间通过分子间作用力相结合形成的晶体。
2、共价晶体:相邻原子间以共价键相结合而形成空间立体网状结构的晶体。
(1)“电子气理论”是把金属键描述为金属原子脱落下来的 形成遍布整块晶体的“电子气”,被所有原子所共用,从而把所有金属原子维系在一起,形成“巨分子”。
3、金属晶体
价电子
(2)金属键的实质是金属阳离子与电子气间的静电作用。
(3)用电子气理论解释金属的性质
相对滑动
排列方式
电子气
定向移动
离子晶体:由阴、阳离子通过离子键结合而成的晶体。
过渡晶体:介于典型晶体之间的晶体。
纯粹的典型的晶体是不多的,大多数晶体是它们的过渡晶体。
混合型晶体:石墨晶体,石墨是共价晶体、金属晶体、分子晶体的一种混合型晶体,既有共价键、又有金属键,还有范德华力。
二、四种晶体性质的比较
晶体类型 共价晶体 分子晶体 离子晶体 金属晶体
粒子间作用力 共价键 分子间作用力 离子键 金属键
构成微粒 原子 分子 阴、阳离子 金属阳离子和自由电子
物 理 性 质 熔沸点 很高 很低 较高 差别较大
硬度 很大 很小 硬而脆 差别较大
导电性 无(硅为半导体) 差 差 良导体
延展性 差 差 差 良好
溶解性 难溶于一般溶剂 相似相容 多数易溶于水 不溶于水
三、典型晶体模型
1、分子晶体
干冰
8个CO2分子构成立方体且在6个面心又各占据1个CO2分子,每个CO2分子周围等距紧邻的CO2分子有12个
因为碳氧原子构成的双键结构,干冰晶体中二氧化碳分子的排列方向有4种, 即在顶点上1种, 3对面心上3种.
性质特点:低熔点、易升华
作用:升华吸热、制冷剂、人工降雨等
碘晶体的结构碘分子的排列有2种不同的取向,在顶点和面心不同。
碘
冰
水分子间的主要作用力是氢键,也存在范德华力,每个水分子周围紧邻的水分子数有4个
2、共价晶体
金刚石
①每个碳与相邻4个碳以共价单键结合,碳原子轨道均为sp3杂化,形成正四面体结构(2)键角均109°28′
②最小碳环由6个C组成且6原子不在同一平面内
③每个C参与4条C—C键的形成,C原子数与C—C键数之比为1∶2
SiO2
①每个Si与4个O以共价键结合,硅原子轨道均为sp3杂化,形成正四面体结构
②每个正四面体占有1个Si,4个“O”,n(Si)∶n(O)=1∶2
③最小环上有12个原子,即6个O,6个Si
NaCl (型)
三、离子晶体
①每个Na+(Cl-)周围等距且紧邻的Cl-(Na+)有6个。每个Na+周围等距且紧邻的Na+有12个
②每个晶胞中含4个Na+和4个Cl-
CsCl(型)
①每个Cs+周围等距且紧邻的Cl-有8个,每个Cs+
(Cl-)周围等距且紧邻的Cs+(Cl-)有6个
②如图为1个晶胞,每个晶胞中含1个Cs+、1个Cl-
晶胞
晶胞中 微粒数
阴、阳离子 个数比
符合类型
化学式 ZnS CaF2
Zn2+、S2-
都为4
F-为8,
Ca2+为4
1∶1
2∶1
BeO、BeS等
BaF2、PbF2、
CeO2等
常见金属晶体的三种结构型式
结构型式 面心立方最密堆积A1 体心立方密堆积A2 六方最密堆积A3
常见金属
结构示意图
晶胞中的微粒数
4
Ca、Al、Cu、Ag、Au、Pd、Pt
2
Mg、Zn、Ti
2
Li、Na、K、
Ba、W、Fe
4、金属晶体
石墨
5、混合型晶体
(1)层内每个碳原子与3个碳原子形成C-C键,组成正六边形
(2)石墨晶体中碳原子轨道均为sp2杂化
(3)碳原子个数与C—C键数之比为2∶3
四、晶体类型的判断
1、根据物质的分类判断
(1)离子晶体---金属氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体
(2)分子晶体---卤素、氧气、氢气等大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、稀有气体、所有非金属氢化物、多数非金属氧化物(除SiO2外)、含氧酸(几乎所有的酸)、绝大多数有机物的晶体都是分子晶体
(3)共价晶体常见的---某些非金属单质:金刚石、晶体硅(Si) 、晶体硼(B),某些非金属化合物:二氧化硅(SiO2 ) 、碳化硅(SiC )、 Si3N4、BN、 AlN、( Al2O3 )等
(4)金属晶体---金属单质(除汞外)与合金
2、依据组成晶体的微粒及微粒间的作用判断
(4)金属晶体的微粒是金属阳离子和自由电子,微粒间的作用是金属键。
(3)共价晶体的微粒是原子,微粒间的作用是共价键;
(2)分子晶体的微粒是分子,微粒间的作用为分子间作用力;
(1)离子晶体的微粒是阴、阳离子,微粒间的作用是离子键;
3、 依据晶体的熔点判断
(4)金属晶体熔点高低皆有。
(3)共价晶体熔点高,常在一千度至几千度;
(2)分子晶体熔点低,常在数百度以下至很低温度;
(1)离子晶体的熔点较高,常在数百度至一千余度;
4、依据导电性判断
(4)金属晶体是电的良导体。
(3)共价晶体一般为非导体,但有些能导电,如晶体硅(半导体);
(2)分子晶体为非导体,而分子晶体中的电解质(如酸和部分非金属气态氢化物)溶于水,使分子内的化学键断裂形成自由离子也能导电;
(1)离子晶体水溶液及熔化时能导电;
5、依据硬度和机械性能判断
(4)金属晶体多数硬度大,但也有较低的,且具有延展性。
(3)共价晶体硬度大;
(2)分子晶体硬度小且较脆;
(1)离子晶体硬度较大或略硬而脆;
练习1、(2022·湖北黄冈模拟)下列固体分类中正确的一组是( )
A
离子晶体 共价晶体 分子晶体
A 苏打 金刚砂 干冰
B 玻璃 Ar 硫黄
C KNO3 石墨 冰醋酸
D 胆矾 金刚石 SiO2
练习2、分析下列物质的物理性质,判断其晶体类型。
①碳化铝,黄色晶体,熔点2 200 ℃,熔融态不导电:____________。
②溴化铝,无色晶体,熔点98 ℃,熔融态不导电:____________。
③五氟化矾,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮等:____________。
共价晶体
分子晶体
分子晶体
④溴化钾,无色晶体,熔融时或溶于水中都能导电:__________。
⑤SiI4:熔点120.5 ℃,沸点287.4 ℃,易水解:____________。
⑥硼:熔点2 300 ℃,沸点2 550 ℃,硬度大:____________。
⑦硒:熔点217 ℃,沸点685 ℃,溶于氯仿:____________。
⑧锑:熔点630.74 ℃,沸点1 750 ℃,固体
可导电:___________。
离子晶体
分子晶体
共价晶体
分子晶体
金属晶体
五、比较物质的熔、沸点高低的方法
1、首先看物质的状态:
一般情况下,固体>液体>气体;如I2>Hg>O2
二看物质所属晶体类型:
一般是:共价晶体>离子晶体>分子晶体(注意:不是绝对的),结构类型相同时再根据相应规律进行判断。
2、同类晶体熔、沸点比较思路为
(1)共价晶体→共价键键能→键长→原子半径;
(2)分子晶体→分子间作用力→相对分子质量;
a、组成和结构相似的物质,相对分子质量越大,分子间作用力越大,熔沸点越高。
如熔沸点:O2>N2,HI>HBr>HCl, I2 > Br2 > Cl2 > F2。
b、组成和结构不相似的物质,分子极性越大,其熔沸点就越高。如熔沸点:CO>N2。
C、在同分异构体中,一般地说,支链数越多,熔沸点越低,
如熔沸点:正戊烷>异戊烷>新戊烷;同分异构体的芳香烃及其衍生物,其熔沸点高低顺序是邻>间>对位化合物。
(3)离子晶体熔点高低的主要依据:晶格能
①概念:气态离子形成1 mol离子晶体释放的能量。晶格能通常取正值,单位为kJ·mol-1
②影响晶格能大小的因素
离子所带电荷越高,核间距越小,晶格能就越大。
晶格能越大,离子键越强,形成的离子晶体越稳定。
晶格能越大,熔点越高,硬度越大。
③晶格能与离子晶体性质的关系:
练习2、北京大学和中国科学院的化学工作者成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构的分析中正确的是( )
A.K3C60晶体中既有离子键又有极性键
B.K3C60晶体的熔点比C60晶体的熔点低
C.该晶体熔化时能导电
D.C60分子中碳原子是采用sp3杂化的
C
练习3、(2020·南阳模拟)Ⅰ.下列数据是对应物质的熔点,有关的判断错误的是( )
A.只要含有金属阳离子的晶体就一定是离子晶体
B.在共价化合物中各原子都形成8电子结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
Na2O Na AlF3 AlCl3 Al2O3 BCl3 CO2 SiO2
920℃ 97.8℃ 1 291℃ 190℃ 2 073℃ -107℃ -57℃ 1 723℃
A B
练习4、(1)卤化物CsClI2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为_______。解释X的熔点比Y高的原因_______。
CsCl CsCl为离子晶体,ICl为分子晶体
(2)H2Se的沸点低于H2O其原因是_______。
两者都是分子晶体,由于水存在分子间氢键,沸点高
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是________。
甲硫醇不能形成分子间氢键,而水和甲醇均能,且水比甲醇的氢键多
练习5、Fe、Co、Ni是三种重要的金属元素。CoO的面心立方晶胞如图所示。三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为_______________。
三种元素二价氧化物的晶胞类型相同,离子半径Fe2+>Co2+>Ni2+,NiO、CoO、FeO,离子键键长越来越长,键能越来越小,晶格能按NiO、CoO、FeO依次减小,因此其熔点由高到低的顺序为NiO>CoO>FeO。
练习5、现有几组物质的熔点(℃)数据:
A组 B组 C组 D组
金刚石:3 550 ℃ Li:181 ℃ HF:-83 ℃ NaCl:801 ℃
硅晶体:1 410 ℃ Na:98 ℃ HCl:-115 ℃ KCl:776 ℃
硼晶体:2 300 ℃ K:64 ℃ HBr:-89 ℃ RbCl:718 ℃
二氧化硅:1 723 ℃ Rb:39 ℃ HI:-51 ℃ CsCl:645 ℃
据此回答下列问题:
(1)A组属于________晶体,其熔化时克服的微粒间的作用力是________。
(2)B组晶体共同的物理性质是________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
原子
共价键
①②③④
(3)C组中HF熔点反常是由于
__________________________________________。
(4)D组晶体可能具有的性质是________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为
___________________________________________
HF分子间能形成氢键,其熔化时需要消耗的能量更多
②④
D组晶体都为离子晶体,
r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带
电荷数相同的情况下,半径越小,晶格能越大,熔点就越高
A组 B组 C组 D组
金刚石:3 550 ℃ Li:181 ℃ HF:-83 ℃ NaCl:801 ℃
硅晶体:1 410 ℃ Na:98 ℃ HCl:-115 ℃ KCl:776 ℃
硼晶体:2 300 ℃ K:64 ℃ HBr:-89 ℃ RbCl:718 ℃
二氧化硅:1 723 ℃ Rb:39 ℃ HI:-51 ℃ CsCl:645 ℃
练习6、NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是_____________________ _______________________________________________________________________________________________________________。
在MgO、NaCl晶体中,离子半径:r(Mg2+)<r(Na+)、r(O2-)<r(Cl-),且MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数
