3.2.2共价晶体 课件 (共37张ppt) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.2.2共价晶体 课件 (共37张ppt) 2022-2023学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 15:42:30 | ||
图片预览






文档简介
第二节 分子晶体与共价晶体
第二课时 共价晶体
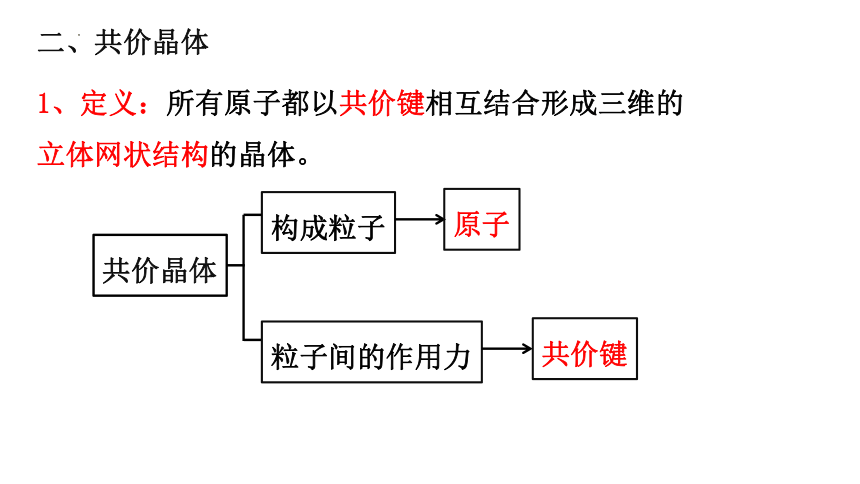
二、共价晶体
构成粒子
共价晶体
原子
粒子间的作用力
共价键
1、定义:所有原子都以共价键相互结合形成三维的
立体网状结构的晶体。
2、典型的共价晶体:
如硼(B)、硅(Si)、锗(Ge)和锡(Sn)等
如碳化硅(SiC)、二氧化硅(SiO2)及氮化硅(Si3N4)等
③极少数金属氧化物,
①某些单质
②某些非金属氧化物
如刚玉(ɑ-Al2O3)
3、共价晶体的物理性质:
①较高的熔点
②硬度很大
③一般不导电,但晶体硅、锗是半导体
④难溶于一般的溶剂
共价晶体中,原子间以较强的共价键相结合,要使物质熔化就要克服共价键,需要很高的能量
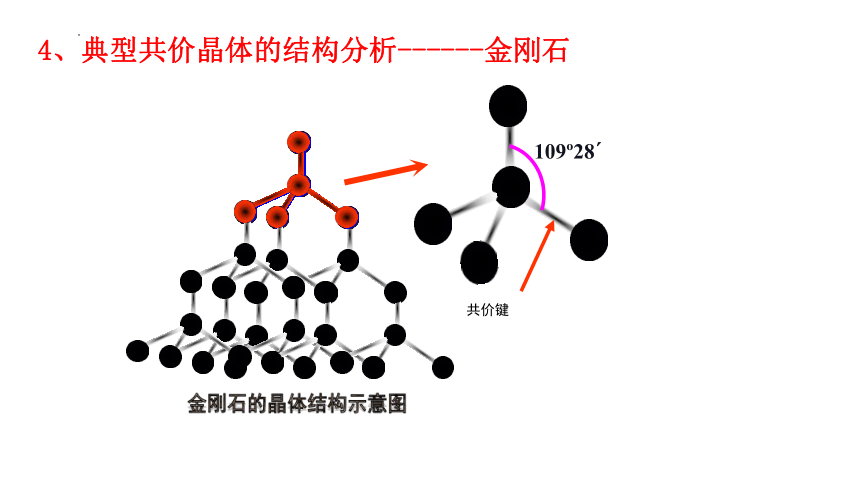
4、典型共价晶体的结构分析------金刚石
109?28?
共价键
金刚石的晶体结构示意图
109?28?
1.55×10-10 m
正四面体
学科网原创
(1)典型共价晶体金刚石的结构分析
②每个碳原子都采取 ;
sp3杂化
③所有的C—C键长相等,键角相等,键角为_________.
109°28'
④晶体中最小的碳环由___个碳组成,且_____同一平面内;
6
不在
⑤晶体中每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子与C—C键数之比为:
1 :( )= 1:2
①在金刚石晶体中每个碳原子周围紧邻的碳原子有 个
4
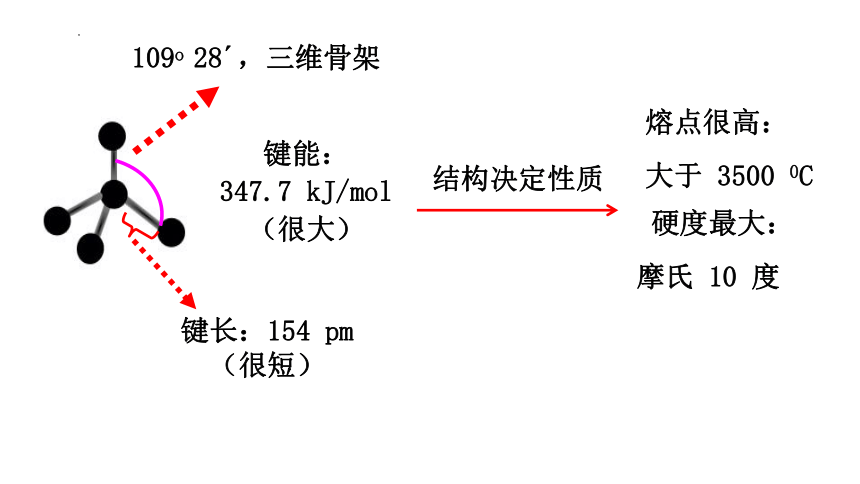
109o 28?,三维骨架
键能:
347.7 kJ/mol
(很大)
键长:154 pm(很短)
熔点很高:
大于 3500 0C
硬度最大:
摩氏 10 度
结构决定性质
金刚石的用途
练习1.金刚石晶胞结构如图所示,回答下列问题。
(1)一个金刚石晶胞中含有__________________个碳原子。
(2)已知晶胞参数为a pm,则金刚石的密度为_____________ g·cm-3。
(3)晶体中两个最近的碳原子之间的距离为_____ pm。
(4)碳原子的半径为r,则a、r有什么关系?
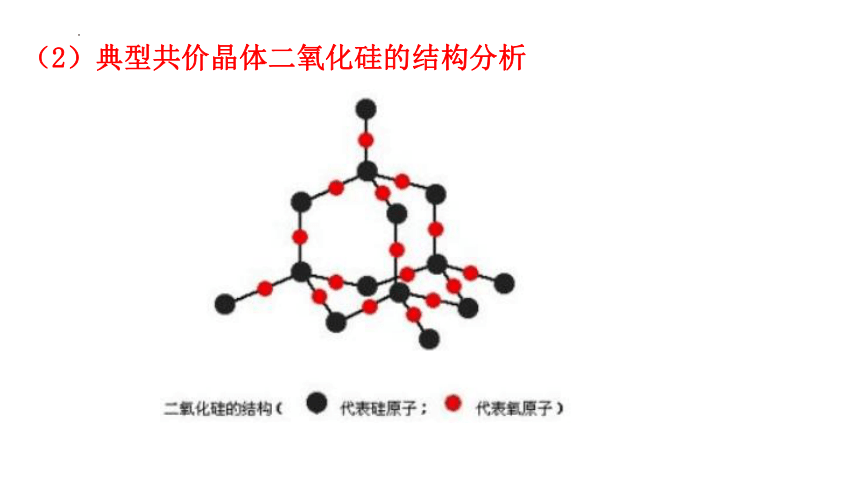
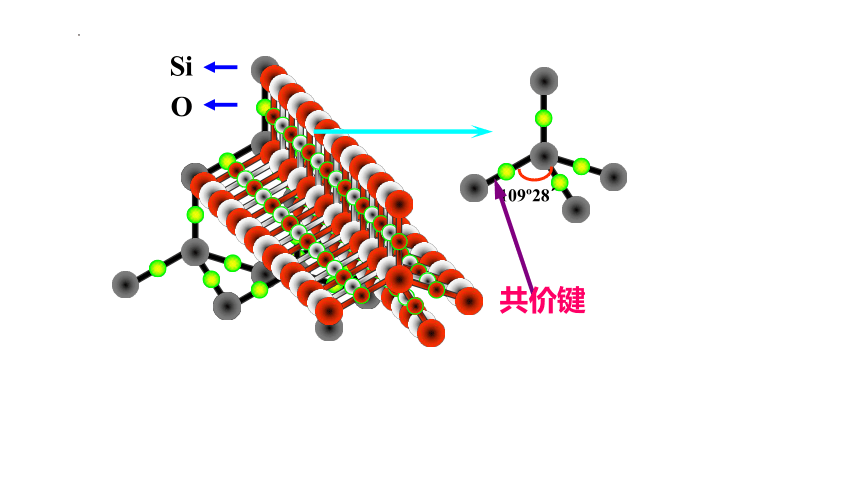
(2)典型共价晶体二氧化硅的结构分析
109?28?
Si
O
共价键
③ 在SiO2 晶体中,最小环为 元环。
2
1:2
4
4
2
12
① 在SiO2晶体中,每个硅原子与 个氧原子结合;每个氧原子与 个硅原子结合;在SiO2晶体中硅原子与氧原子个数之比是 .
②在SiO2 晶体中,每个硅原子形成 个共价键;每个氧原子形成 个共价键;
石英的左、右型晶体
二氧化硅晶体中
硅氧四面体螺旋结构
石英表
低温二氧化硅晶体的用途
二氧化硅是自然界含量最高的固态二元氧化物,有多种结构,最常见的是低温石英(α?SiO2)。低温石英的结构中有顶角相连的硅氧四面体形成螺旋上升的长链,这一结构决定了它具有手性,被广泛用作压电材料。
SiO2具有许多重要用途,是制造水泥、玻璃、人造红宝石、单晶硅、硅光电池、芯片和光导纤维的原料。
思考讨论1:有关资料报道:在40GPa高压下,用激光器加热到1800K,制得了与二氧化硅晶体结构相似,高熔点、高硬度的二氧化碳晶体。该二氧化碳晶体的熔点、硬度与二氧化硅晶体相比如何?
“C-O”键长 < “Si-O”键长
“C-O”键能 >“Si-O”键能
熔点、硬度:该二氧化碳晶体>二氧化硅晶体
原子半径: C < Si
SiC器件的主要用途是车载设备。SiC器件可以使纯电动汽车、混合动力车的电机控制系统损失的功率降低到1/10,实现低功耗化;同时,能将新能源汽车的效率提高10%,使用SiC工艺生产的功率器件的导通电阻更低、芯片尺寸更小、工作频率更高,并可耐受更高的环境温度。
SiC 的球棍模型
新能源汽车中的明星材料---碳化硅(SiC)
资料卡片
碳化硅(SiC)
SiC 的球棍模型
思考讨论
思考讨论2: SiC俗称“金刚砂”,类似于金刚石的构造。已知SiC晶体中只存在“Si-C”共价键,根据SiC中Si元素和C元素的比例,你能否在金刚石晶体的结构基础上将C原子和Si原子标示出来?
Si
C
或
金刚石晶体
SiC晶胞结构
思考与讨论:
(1)怎么从原子结构的角度理解金刚石、硅 、锗的熔点和硬度依次下降?
在金刚石、硅和锗中,每个原子均以sp3杂化轨道与相邻的4个原子形成σ键,整体上形成三维骨架结构,同属于共价晶体,熔点和硬度都较高。但金刚石、硅和锗的结构差别在于C、Si、Ge原子半径依次递增,C-C、Si-Si、Ge-Ge的键长依次递增,键长越大,键能越小,所以熔点和硬度依次降低。
思考与讨论:
(2)“具有共价键的晶体叫做共价晶体”这种说法对吗?为什么?
此说法不对。“具有共价键”并不是判断共价晶体的唯一条件,分子晶体除了单原子分子之外,如H2O、CO2等大多数分子中也有共价键,很多离子晶体,如NH4Cl、NaOH、KNO3等,在阴阳离子的内部也含有共价键。共价晶体除具有共价键外,还要求形成晶体的粒子是原子,共价晶体的微观空间里没有分子。
分子晶体与共价晶体的比较
晶体类型
共价晶体
分子晶体
概 念
组成微粒
作用力
熔沸点
硬 度
溶解性
导电性
相邻原子间以共价键相结合而形成空间网状结构
分子间以分子间作用力结合
原子
分子
共价键
分子间作用力
很高
较低
很大
较小
不溶于任何溶剂
部分溶于水
不导电,个别为半导体
固体和熔化状态都不导电,部分溶于水导电
小结:判断共价晶体和分子晶体的方法
①依据组成晶体的粒子和粒子间的作用力判断
组成共价晶体的粒子是原子,粒子间的作用力是共价键;组成分子晶体的粒子是分子,粒子间的的作用力是分子间作用力。
②依据晶体的熔点判断
共价晶体的熔沸点高,常在1000℃以上;分子晶体的熔、沸点低,常在数百摄氏度以下。
一般易挥发的物质呈固态时都属于分子晶体。
③依据物质的状态判断
一般常温常压下,呈气态或液态的单质与化合物,在固态时属于分子晶体。
④依据物质的挥发性判断
小结:分子晶体、共价晶体的熔、沸点比较
(1)不同类型的晶体熔、沸点:
共价晶体>分子晶体
分子晶体:
①看是否含有氢键
有分子间氢键的熔沸点高
都有分子间氢键,看氢键的个数,个数越多熔沸点越高
②比较范德华力
组成和结构相似,相对分子质量越大,熔沸点越高
③比较分子极性
相对分子质量相近,分子极性越大,熔沸点越高。
④同分异构体的支链越多,熔、沸点越低。
(2)同一类型的晶体熔、沸点:
如比较金刚石、碳化硅、晶体硅的熔点高低:原子半径:C碳化硅>晶体硅。
共价晶体:
①晶体的熔、沸点高低取决于共价键的键长和键能。
键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。
②若没有告知键长或键能数据时,可比较原子半径的大小。一般原子半径越小,键长越短,键能越大,晶体的熔点就越高。
练习1、下列事实能说明刚玉(Al2O3)是一种共价晶体的是( )
①Al2O3是两性氧化物 ②硬度很大 ③它的熔点为2 045 ℃ ④几乎不溶于水 ⑤自然界中的刚玉有红宝石和蓝宝石
A.①②③ B.②③④ C.④⑤ D.②⑤
B
练习2、将SiCl4与过量的液氨反应可生成化合物Si(NH2)4。将该化合物在无氧条件下高温灼烧,可得到氮化硅(Si3N4)固体,氮化硅是一种新型耐高温、耐磨材料,在工业上有广泛的应用。下列推断可能正确的是( )
A.SiCl4、Si3N4的晶体类型相同
B.Si3N4晶体是立体网状结构
C.Si3N4中一个Si周围有3个氮,1个氮周围有4个硅
D.SiCl4晶体在熔化过程中化学键断裂
B
练习3、已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中错误的是( )。
A.C3N4晶体与金刚石同属于共价晶体
B.C3N4晶体中C—N的键长比金刚石中C—C的键长长
C.C3N4晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
D.C3N4晶体中含有极性共价键,不含非极性共价键
B
练习4、下表是某些共价晶体的熔点和硬度,分析表中的数据判断下列叙述正确的是( )
共价晶体
金刚石
氮化硼
碳化硅
石英
硅
锗
熔点/℃
3 900
3 000
2 700
1 710
1 410
1 211
硬度
10
9.5
9.5
7
6.5
6.0
①构成共价晶体的原子种类越多,晶体的熔点越高
②构成共价晶体的原子间的共价键的键能越大,晶体的熔点越高
③构成共价晶体的原子半径越大,晶体的硬度越大
④构成共价晶体的原子半径越小,晶体的硬度越大
A.①② B.③④ C.①③ D.②④
D
【例】碳化硅和立方氮化硼的结构与金刚石类似,碳化硅硬度仅次于金刚石,立方氮化硼硬度与金刚石相当,其晶胞结构如图所示。
请回答下列问题:
(1)碳化硅晶体中,硅原子杂化类型为 ,每个硅原子周围与其距离最近的碳原子有 个;设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为 (用含a、b的式子表示)。
??????????????????·???? mol-1
?
sp3
4
请回答下列问题:
(2)立方氮化硼晶胞中有 个硼原 子,
个氮原子,硼原子的杂化类型为 ,若晶胞的边长为a cm,则立方氮化硼
的密度表达式为 , g·cm-3(设NA为阿伏加德罗常数的值)。
????????????????????·???????? g·cm-3
?
4
4
sp3
—B—N—B—N—
—N—B—N—B—
—B—N—B—N—
第二课时 共价晶体
二、共价晶体
构成粒子
共价晶体
原子
粒子间的作用力
共价键
1、定义:所有原子都以共价键相互结合形成三维的
立体网状结构的晶体。
2、典型的共价晶体:
如硼(B)、硅(Si)、锗(Ge)和锡(Sn)等
如碳化硅(SiC)、二氧化硅(SiO2)及氮化硅(Si3N4)等
③极少数金属氧化物,
①某些单质
②某些非金属氧化物
如刚玉(ɑ-Al2O3)
3、共价晶体的物理性质:
①较高的熔点
②硬度很大
③一般不导电,但晶体硅、锗是半导体
④难溶于一般的溶剂
共价晶体中,原子间以较强的共价键相结合,要使物质熔化就要克服共价键,需要很高的能量
4、典型共价晶体的结构分析------金刚石
109?28?
共价键
金刚石的晶体结构示意图
109?28?
1.55×10-10 m
正四面体
学科网原创
(1)典型共价晶体金刚石的结构分析
②每个碳原子都采取 ;
sp3杂化
③所有的C—C键长相等,键角相等,键角为_________.
109°28'
④晶体中最小的碳环由___个碳组成,且_____同一平面内;
6
不在
⑤晶体中每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子与C—C键数之比为:
1 :( )= 1:2
①在金刚石晶体中每个碳原子周围紧邻的碳原子有 个
4
109o 28?,三维骨架
键能:
347.7 kJ/mol
(很大)
键长:154 pm(很短)
熔点很高:
大于 3500 0C
硬度最大:
摩氏 10 度
结构决定性质
金刚石的用途
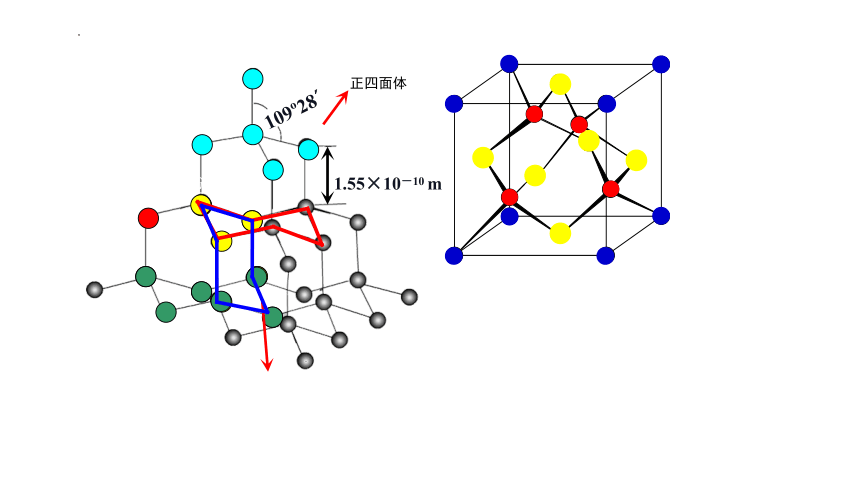
练习1.金刚石晶胞结构如图所示,回答下列问题。
(1)一个金刚石晶胞中含有__________________个碳原子。
(2)已知晶胞参数为a pm,则金刚石的密度为_____________ g·cm-3。
(3)晶体中两个最近的碳原子之间的距离为_____ pm。
(4)碳原子的半径为r,则a、r有什么关系?
(2)典型共价晶体二氧化硅的结构分析
109?28?
Si
O
共价键
③ 在SiO2 晶体中,最小环为 元环。
2
1:2
4
4
2
12
① 在SiO2晶体中,每个硅原子与 个氧原子结合;每个氧原子与 个硅原子结合;在SiO2晶体中硅原子与氧原子个数之比是 .
②在SiO2 晶体中,每个硅原子形成 个共价键;每个氧原子形成 个共价键;
石英的左、右型晶体
二氧化硅晶体中
硅氧四面体螺旋结构
石英表
低温二氧化硅晶体的用途
二氧化硅是自然界含量最高的固态二元氧化物,有多种结构,最常见的是低温石英(α?SiO2)。低温石英的结构中有顶角相连的硅氧四面体形成螺旋上升的长链,这一结构决定了它具有手性,被广泛用作压电材料。
SiO2具有许多重要用途,是制造水泥、玻璃、人造红宝石、单晶硅、硅光电池、芯片和光导纤维的原料。
思考讨论1:有关资料报道:在40GPa高压下,用激光器加热到1800K,制得了与二氧化硅晶体结构相似,高熔点、高硬度的二氧化碳晶体。该二氧化碳晶体的熔点、硬度与二氧化硅晶体相比如何?
“C-O”键长 < “Si-O”键长
“C-O”键能 >“Si-O”键能
熔点、硬度:该二氧化碳晶体>二氧化硅晶体
原子半径: C < Si
SiC器件的主要用途是车载设备。SiC器件可以使纯电动汽车、混合动力车的电机控制系统损失的功率降低到1/10,实现低功耗化;同时,能将新能源汽车的效率提高10%,使用SiC工艺生产的功率器件的导通电阻更低、芯片尺寸更小、工作频率更高,并可耐受更高的环境温度。
SiC 的球棍模型
新能源汽车中的明星材料---碳化硅(SiC)
资料卡片
碳化硅(SiC)
SiC 的球棍模型
思考讨论
思考讨论2: SiC俗称“金刚砂”,类似于金刚石的构造。已知SiC晶体中只存在“Si-C”共价键,根据SiC中Si元素和C元素的比例,你能否在金刚石晶体的结构基础上将C原子和Si原子标示出来?
Si
C
或
金刚石晶体
SiC晶胞结构
思考与讨论:
(1)怎么从原子结构的角度理解金刚石、硅 、锗的熔点和硬度依次下降?
在金刚石、硅和锗中,每个原子均以sp3杂化轨道与相邻的4个原子形成σ键,整体上形成三维骨架结构,同属于共价晶体,熔点和硬度都较高。但金刚石、硅和锗的结构差别在于C、Si、Ge原子半径依次递增,C-C、Si-Si、Ge-Ge的键长依次递增,键长越大,键能越小,所以熔点和硬度依次降低。
思考与讨论:
(2)“具有共价键的晶体叫做共价晶体”这种说法对吗?为什么?
此说法不对。“具有共价键”并不是判断共价晶体的唯一条件,分子晶体除了单原子分子之外,如H2O、CO2等大多数分子中也有共价键,很多离子晶体,如NH4Cl、NaOH、KNO3等,在阴阳离子的内部也含有共价键。共价晶体除具有共价键外,还要求形成晶体的粒子是原子,共价晶体的微观空间里没有分子。
分子晶体与共价晶体的比较
晶体类型
共价晶体
分子晶体
概 念
组成微粒
作用力
熔沸点
硬 度
溶解性
导电性
相邻原子间以共价键相结合而形成空间网状结构
分子间以分子间作用力结合
原子
分子
共价键
分子间作用力
很高
较低
很大
较小
不溶于任何溶剂
部分溶于水
不导电,个别为半导体
固体和熔化状态都不导电,部分溶于水导电
小结:判断共价晶体和分子晶体的方法
①依据组成晶体的粒子和粒子间的作用力判断
组成共价晶体的粒子是原子,粒子间的作用力是共价键;组成分子晶体的粒子是分子,粒子间的的作用力是分子间作用力。
②依据晶体的熔点判断
共价晶体的熔沸点高,常在1000℃以上;分子晶体的熔、沸点低,常在数百摄氏度以下。
一般易挥发的物质呈固态时都属于分子晶体。
③依据物质的状态判断
一般常温常压下,呈气态或液态的单质与化合物,在固态时属于分子晶体。
④依据物质的挥发性判断
小结:分子晶体、共价晶体的熔、沸点比较
(1)不同类型的晶体熔、沸点:
共价晶体>分子晶体
分子晶体:
①看是否含有氢键
有分子间氢键的熔沸点高
都有分子间氢键,看氢键的个数,个数越多熔沸点越高
②比较范德华力
组成和结构相似,相对分子质量越大,熔沸点越高
③比较分子极性
相对分子质量相近,分子极性越大,熔沸点越高。
④同分异构体的支链越多,熔、沸点越低。
(2)同一类型的晶体熔、沸点:
如比较金刚石、碳化硅、晶体硅的熔点高低:原子半径:C
共价晶体:
①晶体的熔、沸点高低取决于共价键的键长和键能。
键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。
②若没有告知键长或键能数据时,可比较原子半径的大小。一般原子半径越小,键长越短,键能越大,晶体的熔点就越高。
练习1、下列事实能说明刚玉(Al2O3)是一种共价晶体的是( )
①Al2O3是两性氧化物 ②硬度很大 ③它的熔点为2 045 ℃ ④几乎不溶于水 ⑤自然界中的刚玉有红宝石和蓝宝石
A.①②③ B.②③④ C.④⑤ D.②⑤
B
练习2、将SiCl4与过量的液氨反应可生成化合物Si(NH2)4。将该化合物在无氧条件下高温灼烧,可得到氮化硅(Si3N4)固体,氮化硅是一种新型耐高温、耐磨材料,在工业上有广泛的应用。下列推断可能正确的是( )
A.SiCl4、Si3N4的晶体类型相同
B.Si3N4晶体是立体网状结构
C.Si3N4中一个Si周围有3个氮,1个氮周围有4个硅
D.SiCl4晶体在熔化过程中化学键断裂
B
练习3、已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中错误的是( )。
A.C3N4晶体与金刚石同属于共价晶体
B.C3N4晶体中C—N的键长比金刚石中C—C的键长长
C.C3N4晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
D.C3N4晶体中含有极性共价键,不含非极性共价键
B
练习4、下表是某些共价晶体的熔点和硬度,分析表中的数据判断下列叙述正确的是( )
共价晶体
金刚石
氮化硼
碳化硅
石英
硅
锗
熔点/℃
3 900
3 000
2 700
1 710
1 410
1 211
硬度
10
9.5
9.5
7
6.5
6.0
①构成共价晶体的原子种类越多,晶体的熔点越高
②构成共价晶体的原子间的共价键的键能越大,晶体的熔点越高
③构成共价晶体的原子半径越大,晶体的硬度越大
④构成共价晶体的原子半径越小,晶体的硬度越大
A.①② B.③④ C.①③ D.②④
D
【例】碳化硅和立方氮化硼的结构与金刚石类似,碳化硅硬度仅次于金刚石,立方氮化硼硬度与金刚石相当,其晶胞结构如图所示。
请回答下列问题:
(1)碳化硅晶体中,硅原子杂化类型为 ,每个硅原子周围与其距离最近的碳原子有 个;设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为 (用含a、b的式子表示)。
??????????????????·???? mol-1
?
sp3
4
请回答下列问题:
(2)立方氮化硼晶胞中有 个硼原 子,
个氮原子,硼原子的杂化类型为 ,若晶胞的边长为a cm,则立方氮化硼
的密度表达式为 , g·cm-3(设NA为阿伏加德罗常数的值)。
????????????????????·???????? g·cm-3
?
4
4
sp3
—B—N—B—N—
—N—B—N—B—
—B—N—B—N—
