1.1《物质的分类及转化》(第二课时)课件(共45张PPT)
文档属性
| 名称 | 1.1《物质的分类及转化》(第二课时)课件(共45张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 15:23:07 | ||
图片预览







文档简介
(共45张PPT)
物质的转化
Material transformation
第二课时
第一章 第一节
青年时种下什么,老年时就收获什么。
——易卜生
原料:石灰石、水、纯碱
要求:写出生产流程图
请判断以上转化的反应类型。
问题解决
土法制碱
石灰石
生石灰
熟石灰
烧碱
高温
水
纯碱
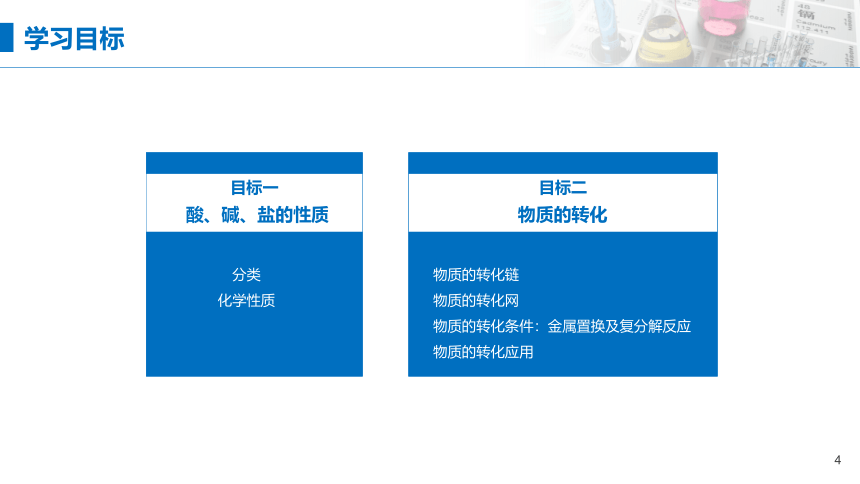
分类
化学性质
物质的转化链
物质的转化网
物质的转化条件:金属置换及复分解反应
物质的转化应用
目标一
目标二
物质的转化
酸、碱、盐的性质
学习目标
酸、碱、盐的性质
01
将HCl、H2SO4、HNO3进行分类。
HCl、H2SO4、HNO3
小试身手
1.1.1 分类
1. 酸、碱、盐的性质
1.1 酸
组成中是否含氧
无氧酸
H2SO4、HNO3
HCl、H2S
酸
含氧酸
小试身手
将HCl、H2SO4、HNO3进行分类。
HCl、H2SO4、HNO3
组成中是否含氧
无氧酸
H2SO4、HNO3
HCl、H2S
电离出的H+数目
一元酸
二元酸
三元酸
HCl、HNO3
H2SO4
H3PO4
有无挥发性
挥发酸
难挥发酸
HCl、HNO3
H2SO4
电离能力
强酸
弱酸
HCl、H2SO4、HNO3
H2CO3
CH3COOH
HClO
酸
含氧酸
1.1.1 分类
1. 酸、碱、盐的性质
1.1 酸
以硫酸为例,写出可能与哪些物质发生反应。
回顾练习
生成盐和氢气
与活泼金属反应
生成盐和水
与碱性氧化物反应
生成盐和水
与碱反应
生成新酸和新盐。
与某些盐反应
1.1.2 化学性质
1. 酸、碱、盐的性质
1.1 酸
酸
1
2
3
4
1.2.1 分类
1. 酸、碱、盐的性质
1.2 碱
碱
溶解性
易溶
NaOH KOH Ba(OH)2
Mg(OH)2 Fe(OH)2 Fe(OH)3
微溶
Ca(OH)2
难溶
电离OH-数目
一元碱
NaOH KOH
二元碱
Ca(OH)2 Ba(OH)2 Fe(OH)2
电离能力
强碱
弱碱
NaOH KOH Ba(OH)2
Mg(OH)2 Fe(OH)2 Fe(OH)3
以烧碱为例,写出可能与哪些物质发生反应。
回顾练习
1.2.2 化学性质
1. 酸、碱、盐的性质
1.2 碱
生成盐和水
与酸性氧化物反应
生成新酸和新盐。
与酸反应
碱
1
2
3
生成新碱和新盐
与酸反应
将Na2CO3、NaHCO3、CaCO3、Cu2(OH)2CO3进行分类。
问题解决
溶解性
溶解性
可溶盐
难溶盐
微溶盐
Na2CO3
CaCO3、Cu2(OH)2CO3
CaSO4
1.3.1 分类
1. 酸、碱、盐的性质
1.3 盐
盐
问题解决
将Na2CO3、NaHCO3、CaCO3、Cu2(OH)2CO3进行分类。
组成
组成
正盐
酸式盐
碱式盐
Na2CO3、CaCO3
1. 酸、碱、盐的性质
1.3.1 分类
1.3 盐
溶解性
可溶盐
难溶盐
微溶盐
Na2CO3
CaCO3、Cu2(OH)2CO3
CaSO4
盐
物质分类的依据不同,其结果不同,试对NaHSO4按照不同的标准进行分类。
钠盐 硫酸盐
酸式盐 可溶性盐
含氧酸盐等。
考考你自己
回顾练习
以纯碱为例,写出可能与哪些物质发生反应。
1.3.2 化学性质
1. 酸、碱、盐的性质
1.3 盐
生成新盐和新金属
与金属反应
生成新盐和新碱
与碱反应
盐
1
2
3
生成新碱和新盐
与某些盐反应
交流讨论
酸、碱、盐的反应中,涉及了哪些反应类型?
反应模型 反应类型
A+B=AB
AB=A+B
AB+C=A+CB
AB+CD=AD+CB
知识回顾
化合反应
分解反应
置换反应
复分解反应
置换反应
----金属与酸、盐
复分解反应
----酸与碱、盐;盐与碱、盐
A.K2SO4―→KOH
B.Zn―→ZnCl2
C.Fe2O3―→Fe(OH)3
D.MgCl2―→Mg(OH)2
牛刀小试
下列物质的转化,不能一步实现的是
A.BaCl2→BaSO4
B.CuO→Cu(OH)2
C.NaOH→Na2SO3
D.MgSO4→Mg(OH)2
你学会了吗?
下列变化不能通过一步化学反应实现的是
A.仅①②
B.仅①④⑤
C.仅②④⑤
D.全部
下列物质可直接与其他物质反应生成盐的有
①金属 ②碱性氧化物 ③碱 ④酸性氧化物 ⑤酸
牛刀小试
你学会了吗?
A.盐和盐的反应
B.碱性氧化物和水的反应
C.酸与碱的反应
D.酸性氧化物和碱的反应
X、Y、Z、W各代表一种物质,若X+Y==Z+W,则X和Y之间不可能是
物质的转化
02
写出下列物质之间转化的化学方程式,体会由金属单质、非金属单质到盐的转化关系。
Ca → CaO → Ca(OH)2 → CaSO4
C → CO2 → H2CO3 → CaCO3
对于上述转化关系,从物质分类的角度看,你发现了什么规律?
将你的想法与同学交流。
思考﹒ 讨论
金属单质
碱性氧化物
碱
盐
酸或酸性氧化物
H2O
O2
非金属单质
酸性氧化物
酸
盐
碱或碱性氧化物
H2O
O2
FeO Fe2O3 CuO等不与水反应
SiO2不与水反应
各物质间还有没有其他什么转化?
2. 物质的转化
2.1 转化链
2. 物质的转化
2.2 转化网
金属单质
碱性氧化物
碱
盐
酸或酸性氧化物
H2O
O2
非金属单质
酸性氧化物
酸
盐
碱或碱性氧化物
H2O
O2
盐
判断以下反应能否发生。
1.锌与氯化铜
2.银与硫酸铜溶
3.碳酸钾与稀盐酸
4.硝酸银与氯化钡溶液
5.稀硫酸与氢氧化钠溶液
6.稀硝酸与硫酸钠
看谁做得既准又快!
2.3.1 置换反应
活泼性强的金属置换活泼性弱的金属
2.3.2 复分解反应
(K、Na、Ca、Ba先与水反应!)
有三物质中之一即可
气体、沉淀、水
2. 物质的转化
2.3 转化条件
无机物能否生成有机物?
6H2O+6CO2
C6H12O6+6O2
光照
1828年,他在合成氰酸铵时,却得到了尿素
1824年开始研究氰酸铵
化学史话
如何制备氢氧化钠?请写出化学方程式。
氧化钠与水反应
碳酸钠与氢氧化钙反应
上述过程的成本都较高,现在的工业生产中,一般选择电解饱和食盐水的方法来生产氢氧化钠
2NaCl2+2H2O 2NaOH+H2↑+Cl2↑
通电
问题探究
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
酸、碱、盐的性质
课堂小结
酸有共同的性质:酸溶液中,都含有H+
碱有共同的性质:碱溶液中,都含有OH-
某类盐有共同的性质:盐溶液中,都含有相同酸根
酸、碱、盐的性质
课堂小结
酸有共同的性质:酸溶液中,都含有H+
碱有共同的性质:碱溶液中,都含有OH-
某类盐有共同的性质:盐溶液中,都含有相同酸根
氯化镁用于制金属镁、氧化镁、冷冻盐水、陶瓷,并用于填充织物、造纸等方面。
请写出制备氯化镁的途径,看谁写得最多。
盐
金属
碱性氧化物
酸
盐
非金属单质
盐
酸性氧化物
酸
金属
碱性氧化物
碱
酸
碱
盐
思考﹒ 运用
金属
单质
碱
盐
酸
盐
盐
盐和水
碱性
氧化物
酸性
氧化物
非金属
单质
课堂小结
物
质
的
转
化
课堂小结
铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是
A.复分解反应、复分解反应、化合反应、置换反应
B.中和反应、置换反应、复分解反应、置换反应
C.复分解反应、复分解反应、置换反应、置换反应
D.分解反应、复分解反应、置换反应、置换反应
牛刀小试
A.甲为CuO、乙为CO2、丙为CO
B.甲为C、乙为CO、丙为CO2
C.甲为CaCO3、乙为CaO、丙为Ca(OH)2
D.甲为H2SO4、乙为H2O、丙为H2
甲
乙
丙
请你试一试
下表所列各组物质中,物质之间按箭头方向不能通过一步反应实现如图所示转化的是
图中,“——”表示相连的物质间在一定条件下可以反应,“―→”表示丁在一定条件下通过置换反应可以转化为乙。下面四组选项中,符合图示要求的是
选项 甲 乙 丙 丁
A H2SO4 Na2SO4 NaOH NaCl
B BaCl2 K2CO3 HCl KOH
C O2 CO CuO C
D Fe CuCl2 Zn HCl
甲
乙
丙
丁
看我七十二变
物质的转化
Material transformation
第二课时
第一章 第一节
青年时种下什么,老年时就收获什么。
——易卜生
原料:石灰石、水、纯碱
要求:写出生产流程图
请判断以上转化的反应类型。
问题解决
土法制碱
石灰石
生石灰
熟石灰
烧碱
高温
水
纯碱
分类
化学性质
物质的转化链
物质的转化网
物质的转化条件:金属置换及复分解反应
物质的转化应用
目标一
目标二
物质的转化
酸、碱、盐的性质
学习目标
酸、碱、盐的性质
01
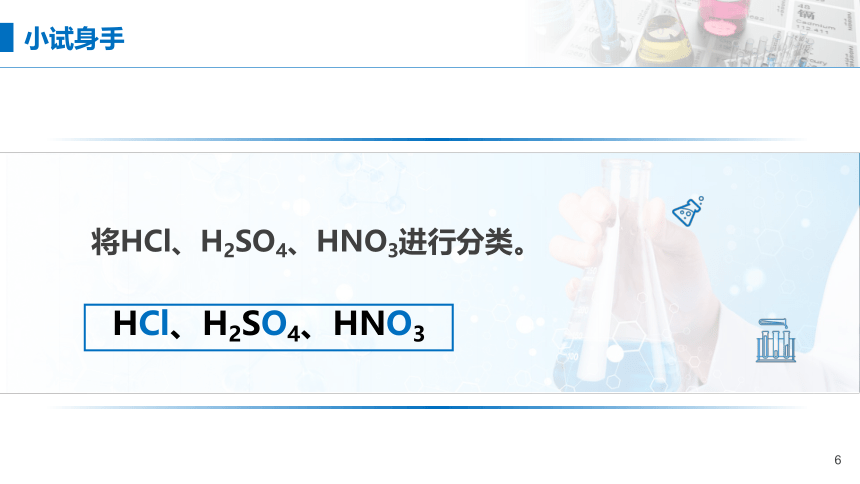
将HCl、H2SO4、HNO3进行分类。
HCl、H2SO4、HNO3
小试身手
1.1.1 分类
1. 酸、碱、盐的性质
1.1 酸
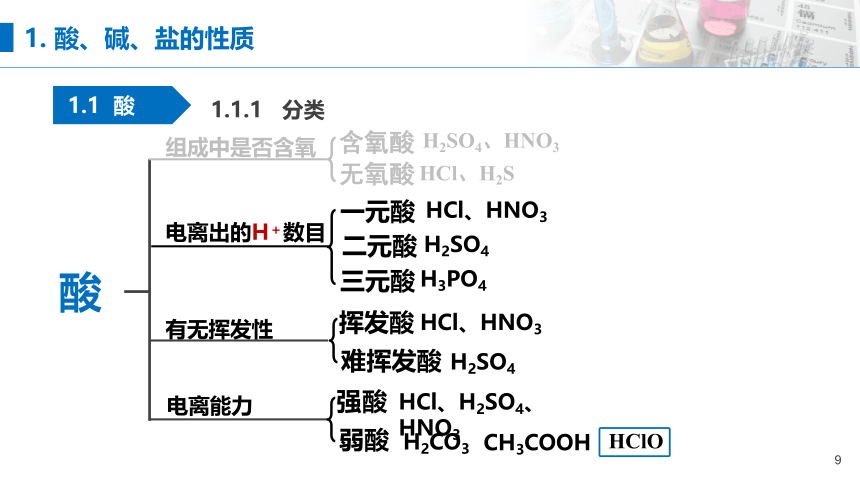
组成中是否含氧
无氧酸
H2SO4、HNO3
HCl、H2S
酸
含氧酸
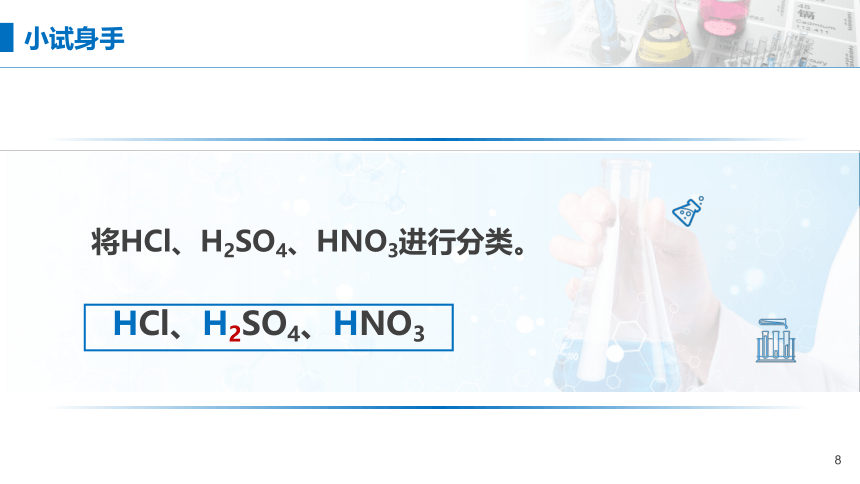
小试身手
将HCl、H2SO4、HNO3进行分类。
HCl、H2SO4、HNO3
组成中是否含氧
无氧酸
H2SO4、HNO3
HCl、H2S
电离出的H+数目
一元酸
二元酸
三元酸
HCl、HNO3
H2SO4
H3PO4
有无挥发性
挥发酸
难挥发酸
HCl、HNO3
H2SO4
电离能力
强酸
弱酸
HCl、H2SO4、HNO3
H2CO3
CH3COOH
HClO
酸
含氧酸
1.1.1 分类
1. 酸、碱、盐的性质
1.1 酸
以硫酸为例,写出可能与哪些物质发生反应。
回顾练习
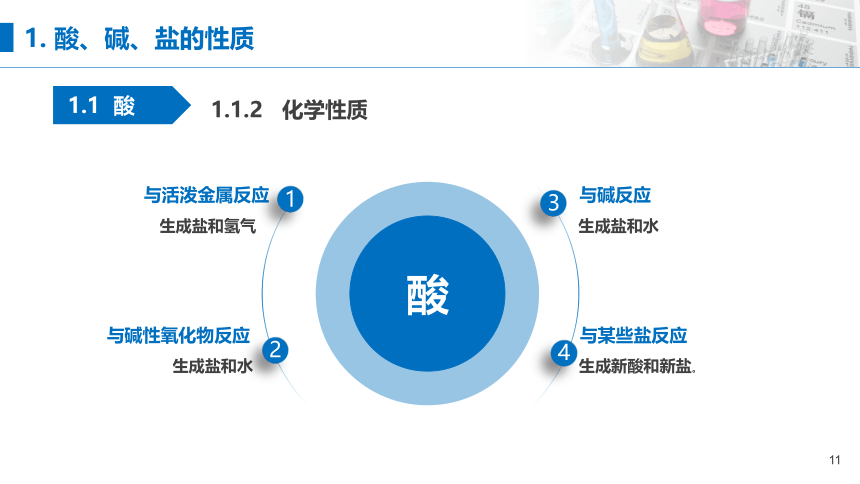
生成盐和氢气
与活泼金属反应
生成盐和水
与碱性氧化物反应
生成盐和水
与碱反应
生成新酸和新盐。
与某些盐反应
1.1.2 化学性质
1. 酸、碱、盐的性质
1.1 酸
酸
1
2
3
4
1.2.1 分类
1. 酸、碱、盐的性质
1.2 碱
碱
溶解性
易溶
NaOH KOH Ba(OH)2
Mg(OH)2 Fe(OH)2 Fe(OH)3
微溶
Ca(OH)2
难溶
电离OH-数目
一元碱
NaOH KOH
二元碱
Ca(OH)2 Ba(OH)2 Fe(OH)2
电离能力
强碱
弱碱
NaOH KOH Ba(OH)2
Mg(OH)2 Fe(OH)2 Fe(OH)3
以烧碱为例,写出可能与哪些物质发生反应。
回顾练习
1.2.2 化学性质
1. 酸、碱、盐的性质
1.2 碱
生成盐和水
与酸性氧化物反应
生成新酸和新盐。
与酸反应
碱
1
2
3
生成新碱和新盐
与酸反应
将Na2CO3、NaHCO3、CaCO3、Cu2(OH)2CO3进行分类。
问题解决
溶解性
溶解性
可溶盐
难溶盐
微溶盐
Na2CO3
CaCO3、Cu2(OH)2CO3
CaSO4
1.3.1 分类
1. 酸、碱、盐的性质
1.3 盐
盐
问题解决
将Na2CO3、NaHCO3、CaCO3、Cu2(OH)2CO3进行分类。
组成
组成
正盐
酸式盐
碱式盐
Na2CO3、CaCO3
1. 酸、碱、盐的性质
1.3.1 分类
1.3 盐
溶解性
可溶盐
难溶盐
微溶盐
Na2CO3
CaCO3、Cu2(OH)2CO3
CaSO4
盐
物质分类的依据不同,其结果不同,试对NaHSO4按照不同的标准进行分类。
钠盐 硫酸盐
酸式盐 可溶性盐
含氧酸盐等。
考考你自己
回顾练习
以纯碱为例,写出可能与哪些物质发生反应。
1.3.2 化学性质
1. 酸、碱、盐的性质
1.3 盐
生成新盐和新金属
与金属反应
生成新盐和新碱
与碱反应
盐
1
2
3
生成新碱和新盐
与某些盐反应
交流讨论
酸、碱、盐的反应中,涉及了哪些反应类型?
反应模型 反应类型
A+B=AB
AB=A+B
AB+C=A+CB
AB+CD=AD+CB
知识回顾
化合反应
分解反应
置换反应
复分解反应
置换反应
----金属与酸、盐
复分解反应
----酸与碱、盐;盐与碱、盐
A.K2SO4―→KOH
B.Zn―→ZnCl2
C.Fe2O3―→Fe(OH)3
D.MgCl2―→Mg(OH)2
牛刀小试
下列物质的转化,不能一步实现的是
A.BaCl2→BaSO4
B.CuO→Cu(OH)2
C.NaOH→Na2SO3
D.MgSO4→Mg(OH)2
你学会了吗?
下列变化不能通过一步化学反应实现的是
A.仅①②
B.仅①④⑤
C.仅②④⑤
D.全部
下列物质可直接与其他物质反应生成盐的有
①金属 ②碱性氧化物 ③碱 ④酸性氧化物 ⑤酸
牛刀小试
你学会了吗?
A.盐和盐的反应
B.碱性氧化物和水的反应
C.酸与碱的反应
D.酸性氧化物和碱的反应
X、Y、Z、W各代表一种物质,若X+Y==Z+W,则X和Y之间不可能是
物质的转化
02
写出下列物质之间转化的化学方程式,体会由金属单质、非金属单质到盐的转化关系。
Ca → CaO → Ca(OH)2 → CaSO4
C → CO2 → H2CO3 → CaCO3
对于上述转化关系,从物质分类的角度看,你发现了什么规律?
将你的想法与同学交流。
思考﹒ 讨论
金属单质
碱性氧化物
碱
盐
酸或酸性氧化物
H2O
O2
非金属单质
酸性氧化物
酸
盐
碱或碱性氧化物
H2O
O2
FeO Fe2O3 CuO等不与水反应
SiO2不与水反应
各物质间还有没有其他什么转化?
2. 物质的转化
2.1 转化链
2. 物质的转化
2.2 转化网
金属单质
碱性氧化物
碱
盐
酸或酸性氧化物
H2O
O2
非金属单质
酸性氧化物
酸
盐
碱或碱性氧化物
H2O
O2
盐
判断以下反应能否发生。
1.锌与氯化铜
2.银与硫酸铜溶
3.碳酸钾与稀盐酸
4.硝酸银与氯化钡溶液
5.稀硫酸与氢氧化钠溶液
6.稀硝酸与硫酸钠
看谁做得既准又快!
2.3.1 置换反应
活泼性强的金属置换活泼性弱的金属
2.3.2 复分解反应
(K、Na、Ca、Ba先与水反应!)
有三物质中之一即可
气体、沉淀、水
2. 物质的转化
2.3 转化条件
无机物能否生成有机物?
6H2O+6CO2
C6H12O6+6O2
光照
1828年,他在合成氰酸铵时,却得到了尿素
1824年开始研究氰酸铵
化学史话
如何制备氢氧化钠?请写出化学方程式。
氧化钠与水反应
碳酸钠与氢氧化钙反应
上述过程的成本都较高,现在的工业生产中,一般选择电解饱和食盐水的方法来生产氢氧化钠
2NaCl2+2H2O 2NaOH+H2↑+Cl2↑
通电
问题探究
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
酸、碱、盐的性质
课堂小结
酸有共同的性质:酸溶液中,都含有H+
碱有共同的性质:碱溶液中,都含有OH-
某类盐有共同的性质:盐溶液中,都含有相同酸根
酸、碱、盐的性质
课堂小结
酸有共同的性质:酸溶液中,都含有H+
碱有共同的性质:碱溶液中,都含有OH-
某类盐有共同的性质:盐溶液中,都含有相同酸根
氯化镁用于制金属镁、氧化镁、冷冻盐水、陶瓷,并用于填充织物、造纸等方面。
请写出制备氯化镁的途径,看谁写得最多。
盐
金属
碱性氧化物
酸
盐
非金属单质
盐
酸性氧化物
酸
金属
碱性氧化物
碱
酸
碱
盐
思考﹒ 运用
金属
单质
碱
盐
酸
盐
盐
盐和水
碱性
氧化物
酸性
氧化物
非金属
单质
课堂小结
物
质
的
转
化
课堂小结
铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是
A.复分解反应、复分解反应、化合反应、置换反应
B.中和反应、置换反应、复分解反应、置换反应
C.复分解反应、复分解反应、置换反应、置换反应
D.分解反应、复分解反应、置换反应、置换反应
牛刀小试
A.甲为CuO、乙为CO2、丙为CO
B.甲为C、乙为CO、丙为CO2
C.甲为CaCO3、乙为CaO、丙为Ca(OH)2
D.甲为H2SO4、乙为H2O、丙为H2
甲
乙
丙
请你试一试
下表所列各组物质中,物质之间按箭头方向不能通过一步反应实现如图所示转化的是
图中,“——”表示相连的物质间在一定条件下可以反应,“―→”表示丁在一定条件下通过置换反应可以转化为乙。下面四组选项中,符合图示要求的是
选项 甲 乙 丙 丁
A H2SO4 Na2SO4 NaOH NaCl
B BaCl2 K2CO3 HCl KOH
C O2 CO CuO C
D Fe CuCl2 Zn HCl
甲
乙
丙
丁
看我七十二变
