5.1《硫及其化合物——硫酸及硫酸根离子的检验》(第2课时)课件(共24张PPT)
文档属性
| 名称 | 5.1《硫及其化合物——硫酸及硫酸根离子的检验》(第2课时)课件(共24张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 15:25:36 | ||
图片预览







文档简介
(共24张PPT)
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第2课时 硫酸及硫酸根离子的检验
第2课时 硫酸及硫酸根离子的检验
第五章
化工生产中的重要非金属元素
第一节 硫及其化合物
选择性必修一
2nd
学习目标
1、了解浓硫酸的三大特性。
2、能运用氧化还原反应知识理解浓硫酸的氧化性。
3、认识硫酸在相关反应中体现的性质。
核心素养
1、通过对浓硫酸性质的学习,培养学生论据推理与模型认知的化学核心素养。
2、通过对化学实验的设计及操作的学习,培养学生科学探究与创新意识的化学核心素养。
学习目标
化工生产中的重要非金属元素
1、了解浓硫酸的三大特性。
2、能运用氧化还原反应知识理解浓硫酸的氧化性。
3、认识硫酸在相关反应中体现的性质。
核心素养
1、通过对浓硫酸性质的学习,培养学生论据推理与模型认知的化学核心素养。
2、通过对化学实验的设计及操作的学习,培养学生科学探究与创新意识的化学核心素养。
纯净的硫酸是无色黏稠的油状液体,密度比水大,能与水以任意比混合,沸点高,难挥发。
【思考一】如何稀释浓硫酸?
注酸入水,杯壁下流!
一、硫酸的物理性质
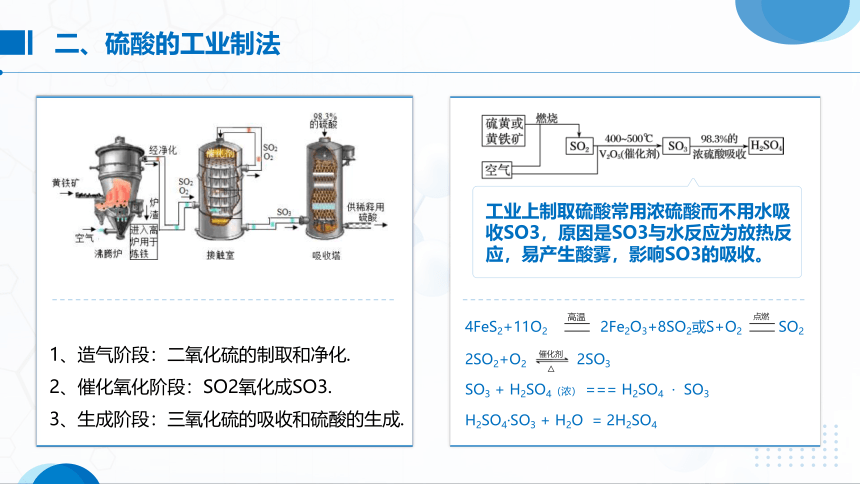
1、造气阶段:二氧化硫的制取和净化.
2、催化氧化阶段:SO2氧化成SO3. 3、生成阶段:三氧化硫的吸收和硫酸的生成.
工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生酸雾,影响SO3的吸收。
H2SO4·SO3 + H2O = 2H2SO4
SO3 + H2SO4(浓) === H2SO4 · SO3
二、硫酸的工业制法
工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生酸雾,影响SO3的吸收。
4FeS2+11O2
2Fe2O3+8SO2或S+O2
SO2
高温
点燃
2SO2+O2
2SO3
催化剂
△
1. 稀硫酸的性质
①硫酸在水里很容易电离出H+,是强酸。
②具有酸的通性。
与指示剂显色
石蕊变红
与活泼金属 (如Fe )
与碱 [如Mg(OH)2]
与碱性氧化物(如MgO)
与盐(如Na2CO3)
稀硫酸
Fe+2H+===Fe2+ ++H2↑
MgO+2H+===Mg2++H2O
Mg(OH)2+2H+===Mg2+++2H2O
三、硫酸的化学性质
H2SO4
2H++SO2-
4
CO2-+2H+
3
CO2
+H2O
(1) 吸水性:浓硫酸能吸收存在于周围环境中的水分及固体中的结晶水(化学变化),常用做 。
(2) 脱水性:浓硫酸能将蔗糖、纸张、棉布和木材等有机物中的氧、氢元素按水的组成比脱去。
2. 浓硫酸的特性
干燥剂
C12H22O11
浓硫酸
12C + 11H2O
(蔗糖)
现象:蔗糖变黑,体积膨胀,变成疏松多孔的海绵状,并有刺激性气味的气体放出
三、硫酸的化学性质
浓硫酸与
蔗糖反应
皮肤烧伤的女性
CHINA PRESS DAY
Click here to enter your text, change the color or size of the text. You can also format the appropriate text and adjust the line spacing of the text.
Matters needing attention
根据元素组成分类
01
注意:在实验时要防止浓硫酸溅到衣服或皮肤上而损坏衣服或灼伤皮肤。即通常所说的腐蚀性(脱水性)
S + 2H2SO4(浓) ===
3SO2↑+ 2H2O
② 与非金属反应:
C+2H2SO4(浓) ===CO2↑+2SO2↑+2H2O
③ 与具有还原性的化合物反应,如HI、HBr、H2S、FeCl2等。
加热时,浓硫酸也能与部分非金属反应(如C) 生成非金属氧化物,硫酸被还原成SO2气体。
请设计实验方案
验证碳和浓硫酸反应的产物
(3) 强氧化性
三、硫酸的化学性质
(3) 强氧化性
① 与金属反应
d将a试管里的溶液慢慢倒入水中,溶液变为 。
a试管中铜丝表面 _______________________ 且溶液中有固体生成。
b试管中的品红溶液逐渐变为_______。
c试管中的紫色石蕊溶液逐渐变为_______。
逐渐变黑,有气泡产生
无色
红色
蓝色
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
还原剂 氧化剂 氧化产物 还原产物
提示:加热时,浓硫酸能与大多数金属反应(Au、Pt除外) ,一般没有氢气生成通常生成SO2气体。
三、硫酸的化学性质
(1) 2mol 的浓H2SO4与足量的铜反应,可制得多少SO2 ?
(2) 浓硫酸在这个反应中体现了什么性质?
(3) 实验室用金属和酸反应制取氢气时,往往用稀硫酸、而不用浓硫酸,这是为什么?
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
常温下,浓硫酸能使Fe、Al金属表面形成一层致密的氧化膜而钝化,从而阻止浓硫酸与铁、铝继续反应。
【思考二】
(酸性和强氧化性)
(硫酸盐和SO2)
三、硫酸的化学性质
浓H2SO4:由H2SO4分子构成— 强氧化性(由 S 体现)—加热时可与大多数金属和某些非金属反应,通常生成SO2
稀H2SO4:由H+和SO42-构成——弱氧化性(由H+体现)—可与活泼金属反应生成H2
①浓硫酸能与大多数金属反应
生成高价态金属的硫酸盐本身一般被还原为SO2
②常温下,浓硫酸能使铁、铝钝化
③浓硫酸可将碳、磷等非金属单质氧化成高价态的氧化物或含氧酸本身被还原为SO2
【思考二】
三、硫酸的化学性质
① 重要的化工原料,实验室必备的重要试剂。
② 工业上可用于生产化肥、农药、炸药、染料、盐类等。
③ 用于精炼石油、金属加工前的酸洗及制取各种挥发性酸、作干燥剂等。
可干燥:酸性气体(如CO2、SO2、Cl2等)和中性气体(如O2、N2、CO等)。
不可干燥:碱性气体(如NH3)和某些还原性气体(如HBr、HI、H2S等)。
四、硫酸的用途
H2SO4(浓)+NaCl
===
NaHSO4+HCl
五、几种常见的硫酸盐
硫酸盐 主要性质 主要应用
硫酸钙 制作模型和医用石膏绷带
调节水泥的硬化速率
硫酸钡 又称重晶石,不溶于水和酸 且不易被X射线透过 用作消化系统X射线检查的
内服药剂,即“钡餐”
硫酸铜 检验水的存在
与石灰乳混合制备波尔多液
CaSO · 2H2O
150℃
H2O
2CaSO4 · H2O
生石膏
熟石膏
CuSO4
H2O
CuSO4 · 5H2O(胆矾)
白色
蓝色
1.下列各过程主要表现了浓硫酸的哪些性质?
①强酸性 ②强氧化性 ③高沸点、难挥发性 ④脱水性 ⑤吸水性
(1)用氯化钠固体和浓硫酸在加热条件下制氯化氢气体 。
(2)用磷矿物[主要成分是磷酸钙]和硫酸反应制磷酸 。
(3)浓硫酸干燥氢气、氧气、氯气、二氧化硫等气体 。
解析:浓硫酸具有高沸点、难挥发性,氯化氢气体易挥发。
解析:磷酸是高沸点的中强酸,利用强酸与弱酸盐反应制弱酸的原理制磷酸。
解析:可干燥酸性气体(如CO2、SO2、Cl2等)和中性气体(如O2、N2、CO等)。
不可干燥气体:碱性气体(如NH3)和某些还原性气体(如HBr、HI、H2S等)。
③高沸点
①强酸性
⑤吸水性
六、课堂小结、深度思考
(4)常温下可以用铁或铝的容器贮存浓硫酸 。
(5)胆矾放在盛浓硫酸的干燥器中变成白色粉末 。
(6)不能用浓硫酸干燥溴化氢、碘化氢和硫化氢等气体 。
解析:浓硫酸具有强氧化性,而溴化氢、碘化氢和硫化氢具有强还原性。
解析:常温下,浓硫酸和铝、铁反应,在金属表面生成一层薄而致密的氧化物薄膜,阻止内部的金属和浓硫酸继续反应。
解析:浓硫酸吸收胆矾晶体中的结晶水,使之变成无水硫酸铜白色粉末。
解析:浓硫酸可使湿润的蓝色石蕊试纸先变红,利用了浓硫酸的酸性,后变黑是把氢原子和氧原子按照2∶1脱去剩余碳,利用了浓硫酸的脱水性。
(7)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑 。
①强酸性 ②强氧化性 ③高沸点、难挥发性 ④脱水性 ⑤吸水性
②强氧化性
⑤吸水性
②强氧化性
①强酸性 ④脱水性
六、课堂小结、深度思考
2.实验证明铜在低温下不能和氧气发生反应,也不能和稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取硫酸铜溶液的。铜屑在此状态下发生的一系列化学反应的方程式为:
。
利用铜和浓硫酸在加热条件下也能制备硫酸铜溶液,其化学方程式为
。
以上两种方法哪种好?______________ ,原因是 ,
。
六、课堂小结、深度思考
第一种方法好
2Cu+O2
2CuO
CuO+H2SO4(稀)
CuSO4+H2O
Cu+2H2SO4(浓)
CuSO4+SO2 +2H2O
②第二种方法生成SO2会造成大气污染
③第一种方法节约能源
①制得相同质量的产品
第一种方法
消耗的硫酸少
【实验5-4】
六、课堂小结、深度思考
实验操作
实验现象 先 , , 加入盐酸后 。 先 , , 加入盐酸后 。
先 ,
, 加入盐酸
后 ,
。
实验结论 与Ba2+反应生成不溶于盐酸 的 , 离子方程式: 。 与Ba2+反应生成白色沉淀BaCO3可溶于盐酸
生成白色
沉淀
不溶解
生成白色
沉淀
沉
淀不溶解
生成白色
沉淀
沉淀溶解
产生
白色沉淀
沉淀
不溶解
生成白色
沉淀
且有气泡产生
+Ba2+===BaSO4↓
SO2-
4
七、硫酸根离子的检验
先加稀盐酸的目是 。
待测液
取清液
产生白色沉淀,
即可确定判断有
②再加入BaCl2溶液,若存在 ,发生反应的离子方程式为 。
加足量盐酸酸化
滴加BaCl2溶液
Ba2++SO2-
===
4
BaSO4
CO2-、SO2-、Ag+干扰
3
3
现在我们炒菜用的精盐又细又白,粗盐中含有不溶性的泥沙以及一些可溶性的硫酸盐、CaCl2、MgCl2等杂质。你知道精盐是由粗盐经过什么样的程序制得的吗?
七、硫酸根离子的检验
八、粗盐的提纯
实验步骤 实验操作
①溶解 用托盘天平称取5 g粗盐放入烧杯中,然后加入20 mL水,用玻璃棒 ,使粗盐溶解,得到粗盐水。
②沉淀 向粗盐水中依次滴加过量的氯化钡溶液、氢氧化钠溶液、饱和碳酸钠溶液,使 完全沉淀析出。
搅拌
关键点:为保障杂质离子完全除去,只要碳酸钠溶液在氯化钡之后加入即可。
④中和 向滤液中滴加盐酸,用玻璃棒搅拌,直到 ,
并用pH试纸检验,使滤液呈中性或微酸性。
无气
泡冒出
⑤蒸发 将滤液倒入蒸发皿,用酒精灯加热,并用玻璃棒不断 。当蒸发皿中出现 时,停止加热。利用蒸发皿的余热使滤液蒸干。冷却后,得到除去杂质离子的精盐。
搅拌
较多固体
③过滤 将烧杯静置后过滤,除去生成的沉淀和不溶性杂质、过滤中玻璃棒的作用是 ,滤液呈 性
引流
碱
八、粗盐的提纯
八、粗盐的提纯
向奋斗在一线的老师致敬
课堂小结
感谢您的观看
选择性必修一
THS
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第2课时 硫酸及硫酸根离子的检验
第2课时 硫酸及硫酸根离子的检验
第五章
化工生产中的重要非金属元素
第一节 硫及其化合物
选择性必修一
2nd
学习目标
1、了解浓硫酸的三大特性。
2、能运用氧化还原反应知识理解浓硫酸的氧化性。
3、认识硫酸在相关反应中体现的性质。
核心素养
1、通过对浓硫酸性质的学习,培养学生论据推理与模型认知的化学核心素养。
2、通过对化学实验的设计及操作的学习,培养学生科学探究与创新意识的化学核心素养。
学习目标
化工生产中的重要非金属元素
1、了解浓硫酸的三大特性。
2、能运用氧化还原反应知识理解浓硫酸的氧化性。
3、认识硫酸在相关反应中体现的性质。
核心素养
1、通过对浓硫酸性质的学习,培养学生论据推理与模型认知的化学核心素养。
2、通过对化学实验的设计及操作的学习,培养学生科学探究与创新意识的化学核心素养。
纯净的硫酸是无色黏稠的油状液体,密度比水大,能与水以任意比混合,沸点高,难挥发。
【思考一】如何稀释浓硫酸?
注酸入水,杯壁下流!
一、硫酸的物理性质
1、造气阶段:二氧化硫的制取和净化.
2、催化氧化阶段:SO2氧化成SO3. 3、生成阶段:三氧化硫的吸收和硫酸的生成.
工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生酸雾,影响SO3的吸收。
H2SO4·SO3 + H2O = 2H2SO4
SO3 + H2SO4(浓) === H2SO4 · SO3
二、硫酸的工业制法
工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生酸雾,影响SO3的吸收。
4FeS2+11O2
2Fe2O3+8SO2或S+O2
SO2
高温
点燃
2SO2+O2
2SO3
催化剂
△
1. 稀硫酸的性质
①硫酸在水里很容易电离出H+,是强酸。
②具有酸的通性。
与指示剂显色
石蕊变红
与活泼金属 (如Fe )
与碱 [如Mg(OH)2]
与碱性氧化物(如MgO)
与盐(如Na2CO3)
稀硫酸
Fe+2H+===Fe2+ ++H2↑
MgO+2H+===Mg2++H2O
Mg(OH)2+2H+===Mg2+++2H2O
三、硫酸的化学性质
H2SO4
2H++SO2-
4
CO2-+2H+
3
CO2
+H2O
(1) 吸水性:浓硫酸能吸收存在于周围环境中的水分及固体中的结晶水(化学变化),常用做 。
(2) 脱水性:浓硫酸能将蔗糖、纸张、棉布和木材等有机物中的氧、氢元素按水的组成比脱去。
2. 浓硫酸的特性
干燥剂
C12H22O11
浓硫酸
12C + 11H2O
(蔗糖)
现象:蔗糖变黑,体积膨胀,变成疏松多孔的海绵状,并有刺激性气味的气体放出
三、硫酸的化学性质
浓硫酸与
蔗糖反应
皮肤烧伤的女性
CHINA PRESS DAY
Click here to enter your text, change the color or size of the text. You can also format the appropriate text and adjust the line spacing of the text.
Matters needing attention
根据元素组成分类
01
注意:在实验时要防止浓硫酸溅到衣服或皮肤上而损坏衣服或灼伤皮肤。即通常所说的腐蚀性(脱水性)
S + 2H2SO4(浓) ===
3SO2↑+ 2H2O
② 与非金属反应:
C+2H2SO4(浓) ===CO2↑+2SO2↑+2H2O
③ 与具有还原性的化合物反应,如HI、HBr、H2S、FeCl2等。
加热时,浓硫酸也能与部分非金属反应(如C) 生成非金属氧化物,硫酸被还原成SO2气体。
请设计实验方案
验证碳和浓硫酸反应的产物
(3) 强氧化性
三、硫酸的化学性质
(3) 强氧化性
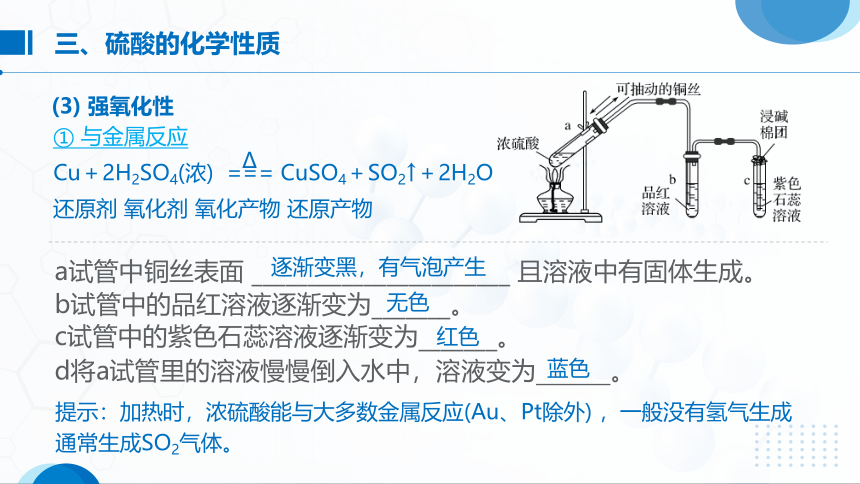
① 与金属反应
d将a试管里的溶液慢慢倒入水中,溶液变为 。
a试管中铜丝表面 _______________________ 且溶液中有固体生成。
b试管中的品红溶液逐渐变为_______。
c试管中的紫色石蕊溶液逐渐变为_______。
逐渐变黑,有气泡产生
无色
红色
蓝色
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
还原剂 氧化剂 氧化产物 还原产物
提示:加热时,浓硫酸能与大多数金属反应(Au、Pt除外) ,一般没有氢气生成通常生成SO2气体。
三、硫酸的化学性质
(1) 2mol 的浓H2SO4与足量的铜反应,可制得多少SO2 ?
(2) 浓硫酸在这个反应中体现了什么性质?
(3) 实验室用金属和酸反应制取氢气时,往往用稀硫酸、而不用浓硫酸,这是为什么?
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
常温下,浓硫酸能使Fe、Al金属表面形成一层致密的氧化膜而钝化,从而阻止浓硫酸与铁、铝继续反应。
【思考二】
(酸性和强氧化性)
(硫酸盐和SO2)
三、硫酸的化学性质
浓H2SO4:由H2SO4分子构成— 强氧化性(由 S 体现)—加热时可与大多数金属和某些非金属反应,通常生成SO2
稀H2SO4:由H+和SO42-构成——弱氧化性(由H+体现)—可与活泼金属反应生成H2
①浓硫酸能与大多数金属反应
生成高价态金属的硫酸盐本身一般被还原为SO2
②常温下,浓硫酸能使铁、铝钝化
③浓硫酸可将碳、磷等非金属单质氧化成高价态的氧化物或含氧酸本身被还原为SO2
【思考二】
三、硫酸的化学性质
① 重要的化工原料,实验室必备的重要试剂。
② 工业上可用于生产化肥、农药、炸药、染料、盐类等。
③ 用于精炼石油、金属加工前的酸洗及制取各种挥发性酸、作干燥剂等。
可干燥:酸性气体(如CO2、SO2、Cl2等)和中性气体(如O2、N2、CO等)。
不可干燥:碱性气体(如NH3)和某些还原性气体(如HBr、HI、H2S等)。
四、硫酸的用途
H2SO4(浓)+NaCl
===
NaHSO4+HCl
五、几种常见的硫酸盐
硫酸盐 主要性质 主要应用
硫酸钙 制作模型和医用石膏绷带
调节水泥的硬化速率
硫酸钡 又称重晶石,不溶于水和酸 且不易被X射线透过 用作消化系统X射线检查的
内服药剂,即“钡餐”
硫酸铜 检验水的存在
与石灰乳混合制备波尔多液
CaSO · 2H2O
150℃
H2O
2CaSO4 · H2O
生石膏
熟石膏
CuSO4
H2O
CuSO4 · 5H2O(胆矾)
白色
蓝色
1.下列各过程主要表现了浓硫酸的哪些性质?
①强酸性 ②强氧化性 ③高沸点、难挥发性 ④脱水性 ⑤吸水性
(1)用氯化钠固体和浓硫酸在加热条件下制氯化氢气体 。
(2)用磷矿物[主要成分是磷酸钙]和硫酸反应制磷酸 。
(3)浓硫酸干燥氢气、氧气、氯气、二氧化硫等气体 。
解析:浓硫酸具有高沸点、难挥发性,氯化氢气体易挥发。
解析:磷酸是高沸点的中强酸,利用强酸与弱酸盐反应制弱酸的原理制磷酸。
解析:可干燥酸性气体(如CO2、SO2、Cl2等)和中性气体(如O2、N2、CO等)。
不可干燥气体:碱性气体(如NH3)和某些还原性气体(如HBr、HI、H2S等)。
③高沸点
①强酸性
⑤吸水性
六、课堂小结、深度思考
(4)常温下可以用铁或铝的容器贮存浓硫酸 。
(5)胆矾放在盛浓硫酸的干燥器中变成白色粉末 。
(6)不能用浓硫酸干燥溴化氢、碘化氢和硫化氢等气体 。
解析:浓硫酸具有强氧化性,而溴化氢、碘化氢和硫化氢具有强还原性。
解析:常温下,浓硫酸和铝、铁反应,在金属表面生成一层薄而致密的氧化物薄膜,阻止内部的金属和浓硫酸继续反应。
解析:浓硫酸吸收胆矾晶体中的结晶水,使之变成无水硫酸铜白色粉末。
解析:浓硫酸可使湿润的蓝色石蕊试纸先变红,利用了浓硫酸的酸性,后变黑是把氢原子和氧原子按照2∶1脱去剩余碳,利用了浓硫酸的脱水性。
(7)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑 。
①强酸性 ②强氧化性 ③高沸点、难挥发性 ④脱水性 ⑤吸水性
②强氧化性
⑤吸水性
②强氧化性
①强酸性 ④脱水性
六、课堂小结、深度思考
2.实验证明铜在低温下不能和氧气发生反应,也不能和稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取硫酸铜溶液的。铜屑在此状态下发生的一系列化学反应的方程式为:
。
利用铜和浓硫酸在加热条件下也能制备硫酸铜溶液,其化学方程式为
。
以上两种方法哪种好?______________ ,原因是 ,
。
六、课堂小结、深度思考
第一种方法好
2Cu+O2
2CuO
CuO+H2SO4(稀)
CuSO4+H2O
Cu+2H2SO4(浓)
CuSO4+SO2 +2H2O
②第二种方法生成SO2会造成大气污染
③第一种方法节约能源
①制得相同质量的产品
第一种方法
消耗的硫酸少
【实验5-4】
六、课堂小结、深度思考
实验操作
实验现象 先 , , 加入盐酸后 。 先 , , 加入盐酸后 。
先 ,
, 加入盐酸
后 ,
。
实验结论 与Ba2+反应生成不溶于盐酸 的 , 离子方程式: 。 与Ba2+反应生成白色沉淀BaCO3可溶于盐酸
生成白色
沉淀
不溶解
生成白色
沉淀
沉
淀不溶解
生成白色
沉淀
沉淀溶解
产生
白色沉淀
沉淀
不溶解
生成白色
沉淀
且有气泡产生
+Ba2+===BaSO4↓
SO2-
4
七、硫酸根离子的检验
先加稀盐酸的目是 。
待测液
取清液
产生白色沉淀,
即可确定判断有
②再加入BaCl2溶液,若存在 ,发生反应的离子方程式为 。
加足量盐酸酸化
滴加BaCl2溶液
Ba2++SO2-
===
4
BaSO4
CO2-、SO2-、Ag+干扰
3
3
现在我们炒菜用的精盐又细又白,粗盐中含有不溶性的泥沙以及一些可溶性的硫酸盐、CaCl2、MgCl2等杂质。你知道精盐是由粗盐经过什么样的程序制得的吗?
七、硫酸根离子的检验
八、粗盐的提纯
实验步骤 实验操作
①溶解 用托盘天平称取5 g粗盐放入烧杯中,然后加入20 mL水,用玻璃棒 ,使粗盐溶解,得到粗盐水。
②沉淀 向粗盐水中依次滴加过量的氯化钡溶液、氢氧化钠溶液、饱和碳酸钠溶液,使 完全沉淀析出。
搅拌
关键点:为保障杂质离子完全除去,只要碳酸钠溶液在氯化钡之后加入即可。
④中和 向滤液中滴加盐酸,用玻璃棒搅拌,直到 ,
并用pH试纸检验,使滤液呈中性或微酸性。
无气
泡冒出
⑤蒸发 将滤液倒入蒸发皿,用酒精灯加热,并用玻璃棒不断 。当蒸发皿中出现 时,停止加热。利用蒸发皿的余热使滤液蒸干。冷却后,得到除去杂质离子的精盐。
搅拌
较多固体
③过滤 将烧杯静置后过滤,除去生成的沉淀和不溶性杂质、过滤中玻璃棒的作用是 ,滤液呈 性
引流
碱
八、粗盐的提纯
八、粗盐的提纯
向奋斗在一线的老师致敬
课堂小结
感谢您的观看
选择性必修一
THS
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
