5.1《硫及其化合物——不同价态含硫物质的转化》(第3课时)课件
文档属性
| 名称 | 5.1《硫及其化合物——不同价态含硫物质的转化》(第3课时)课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 17:22:38 | ||
图片预览





文档简介
(共24张PPT)
第3课时 不同价态含硫物质的转化
第五章
化工生产中的重要非金属元素
第一节 硫及其化合物
选择性必修一
1st
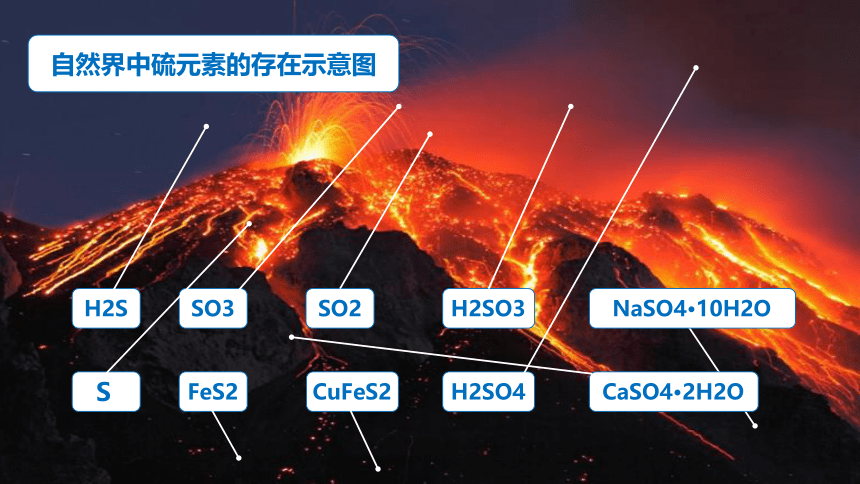
H2S
CaSO4 2H2O
SO3
FeS2
SO2
H2SO3
H2SO4
CuFeS2
NaSO4 10H2O
S
自然界中硫元素的存在示意图
S
SO2
SO3
H2S
H2SO3
H2SO4
岩层深处海洋深处
硫化物(黄铁矿、黄铜矿等)
地表硫化物
硫酸盐
一、自然界中硫元素的循环
一、自然界中硫元素的循环
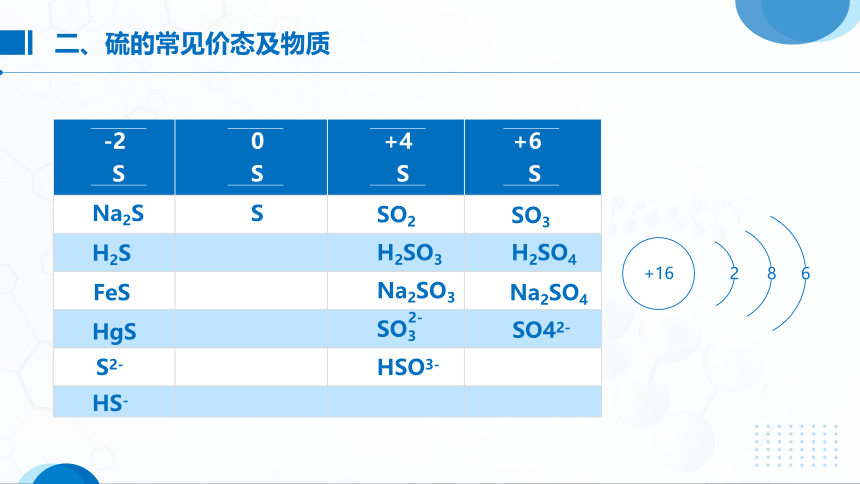
二、硫的常见价态及物质
-2
0
+4
+6
S
S
S
S
Na2S
H2S
FeS
HgS
S
SO2
H2SO3
Na2SO3
SO3
SO3
H2SO4
Na2SO4
SO42-
S2-
HS-
HSO3-
2-
+16
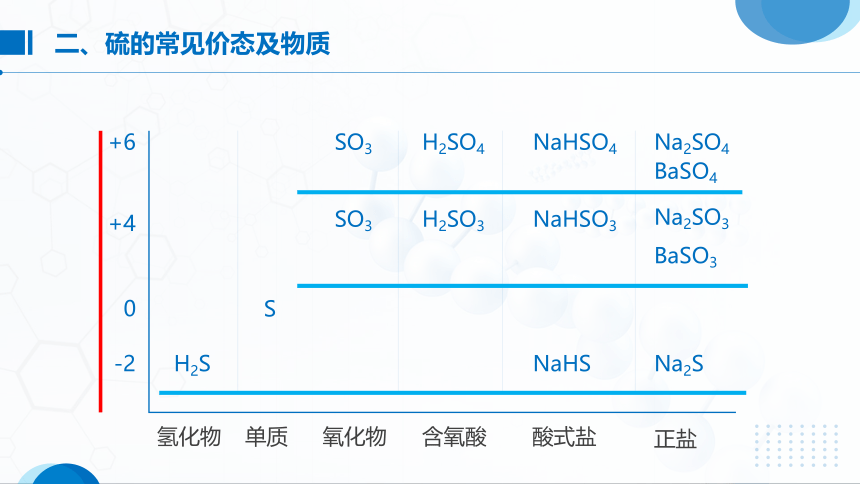
二、硫的常见价态及物质
二、硫的常见价态及物质
SO3
SO3
H2SO4
NaHSO4
Na2SO4
BaSO4
BaSO3
Na2SO3
NaHSO3
H2SO3
H2S
NaHS
Na2S
S
+6
+4
0
-2
氢化物
单质
氧化物
含氧酸
酸式盐
正盐
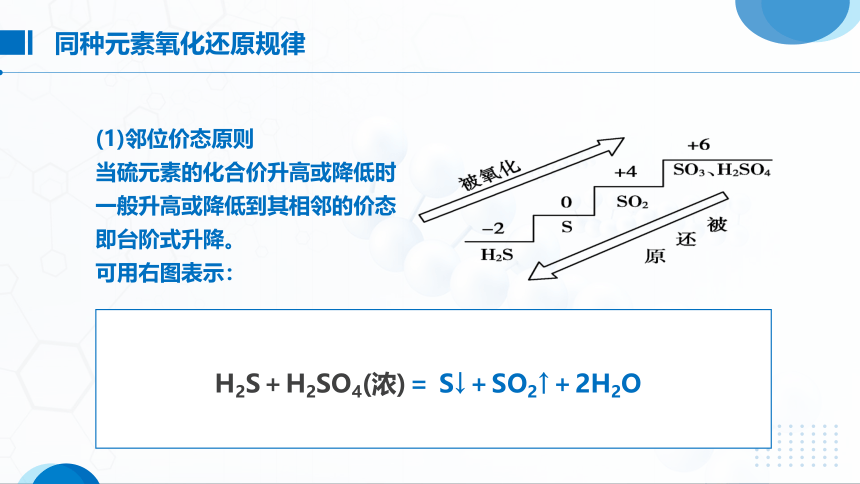
(1)邻位价态原则
当硫元素的化合价升高或降低时
一般升高或降低到其相邻的价态
即台阶式升降。
可用右图表示:
同种元素氧化还原规律
H2S+H2SO4(浓)= S↓+SO2↑+2H2O
(2)同种元素相邻价态粒子不反应
如S和H2S、S和SO2、SO2
和浓硫酸之间不发生氧化还原反应,
即使两者氧化性、还原性区分明显。
同种元素氧化还原规律
2H2S+SO2===3S↓+2H2O
S+2H2SO4(浓)=== 3SO2↓+2H2O
同种元素氧化还原规律
(3)归中律
当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态产物,如-2价S的化合物与+4价S的化合物在酸性环境中生成S单质,S单质与浓硫酸反应生成SO2。
(4)含硫物质的连续氧化规律
FeS2→SO2→SO3→H2SO4
H2O
O2
O2
S→SO2→SO3→H2SO4
O2
O2
H2O
H2S→SO2→SO3→H2SO4
足量O2
O2
H2O
同种元素氧化还原规律
-2
0
+4
+6
S
S
S
S
只有还原性
既有氧化性又有还原性
只有氧化性
常用氧化剂:浓硫酸、KMnO4、X2等
常用还原剂:金属单质、I-、Na2S等
发生还原反应
发生氧化反应
三、不同价态含硫物质的转化
利用氧化剂,可将硫元素从低价态转化到高价态;
利用还原剂,可将硫元素从高价态转化到低价态。
S S S S
-2 0 +4 +6
氧化性
加还原剂
如H2S等
加氧化剂
如O2、Cl2、Br2、KMnO4、HNO3等
氧化性
加还原剂
如金属单质、H2等
还原性
高价态显氧化性,低价态显还原性
中间价态既有氧化性,又有还原性。
三、不同价态含硫物质的转化
从物质类别的视角认识含硫物质间的转化
单质
S
含氧酸
H2SO3
氧化物
SO2
盐
Na2SO3
氢化物
H2S
H2+S H2S
点燃
SO2 +H2O H2SO3
S+O2 SO2
点燃
H2SO3 +2NaOH Na2SO3+2H2O
三、不同价态含硫物质的转化
序号 价态变化 转化前含硫物质 选择试剂 转化后含硫物质 预期现象
1 -2→0
2 0→-2
3 0→+4
4 +4→0
5 +4→+6
6 +6→+4
7 ······
S
H2、Na、Fe、Cu
H2S、NaS
SO2、X2、KMnO4
S
O2
SO2 、SO32-
H2S、NaS
SO2、SO32-
O2、X2、KMnO4 、H2O2
浓H2SO4
S、C、Cu
探究·转化方案设计
提示:常用的氧化剂有浓硫酸、Cl2、KMnO4等,
还原剂有金属单质、H2、Na2S等,
实验设计:从上述转化关系中选择你感兴趣的一种或几种
设计实验实现其转化,并填写下表:
转化目标 (价态变化) 转化前的 含硫物质 选择试剂 (氧化剂或还原剂) 转化后的含硫物质 预期现象
-2→0
H2S
SO2
S
有黄色固体
探究·转化方案设计
中学阶段常见的符合A B C D转化关系的有哪些?
Na Na2O Na2O2 NaOH
硫元素:
H2S SO2 SO3 H2SO4
S SO2 SO3 H2SO4
碳元素:
C CO CO2 H2CO3
钠元素:
O2
O2
H2O
思考与交流
化学实验设计是指实验者在实施化学实验之前,根据一定的实验目的,运用化学知识与技能,按照一定的实验方法,对实验的原理、试剂、仪器与装置、步骤和方法等所进行的规划。例如,设计“不同价态含硫物质的转化”实验,当确定了要实现的转化关系后,需要明确转化前后的含硫物质时哪些,通过怎样的反应(氧化/还原)实现转化,用到的氧化剂或还原剂是什么,等等。
化学实验设计
化学实验设计
进行化学实验设计时,应遵循科学性,可行性、安全性和绿色化原则。化学实验设计一般以实验设计方案的形式呈现,通常包括实验课题、实验目的、实验原理、实验仪器与实际、实验步骤及注意事项、实验数据及处理、实验结论与讨论等。
实验室没有现成的H2S气体和亚硫酸溶液怎么办?
阅读课本化学与职业——化工工程师,谈谈自己的感想。
关注化学与职业
化工工程师通过观察仪表参数监控化工生产过程
课堂小结
1.下列物质中的硫元素不能表现氧化性的是( )
A.Na2S B.S
C.SO2 D.H2SO4
A
课堂练习
[解析]:
S的最高化合价只有氧化性,最低化合价只有还原性,中间价态既有氧化性又有还原性。
2.请分析下图,并上网查阅相关资料,简述硫在自然界的循环过程,思考人类活动对硫的循环由什么影响。
课堂练习
解答:自然界的硫最初来自黄铁矿与黄铜矿等矿物,由风化进入土壤当中,再经由植物或微生物的吸收,或经由冲刷进入河流,再流入大海,然后沉积或由途中的微生物继续利用等。硫也是自然界生态循环中最重要的元素之一。
其中硫酸根是自然界硫最主要的形式之一,除了被生物再吸收利用外。一部分的硫则由生物转化为硫化氢(如哺乳动物的放屁、硫酸根离子在无氧状况下被硫酸盐还原菌还原成硫化氢),并释放到大气当中,或透过微生物反应重新便为硫元素停留在自然界。硫循环会参予微生物与生物之生物化学反应。有些微生物氧化各种硫化合物,有些则进行还原。
课堂练习
感谢您的观看
选择性必修一
THS
第3课时 不同价态含硫物质的转化
第五章
化工生产中的重要非金属元素
第一节 硫及其化合物
选择性必修一
1st
H2S
CaSO4 2H2O
SO3
FeS2
SO2
H2SO3
H2SO4
CuFeS2
NaSO4 10H2O
S
自然界中硫元素的存在示意图
S
SO2
SO3
H2S
H2SO3
H2SO4
岩层深处海洋深处
硫化物(黄铁矿、黄铜矿等)
地表硫化物
硫酸盐
一、自然界中硫元素的循环
一、自然界中硫元素的循环
二、硫的常见价态及物质
-2
0
+4
+6
S
S
S
S
Na2S
H2S
FeS
HgS
S
SO2
H2SO3
Na2SO3
SO3
SO3
H2SO4
Na2SO4
SO42-
S2-
HS-
HSO3-
2-
+16
二、硫的常见价态及物质
二、硫的常见价态及物质
SO3
SO3
H2SO4
NaHSO4
Na2SO4
BaSO4
BaSO3
Na2SO3
NaHSO3
H2SO3
H2S
NaHS
Na2S
S
+6
+4
0
-2
氢化物
单质
氧化物
含氧酸
酸式盐
正盐
(1)邻位价态原则
当硫元素的化合价升高或降低时
一般升高或降低到其相邻的价态
即台阶式升降。
可用右图表示:
同种元素氧化还原规律
H2S+H2SO4(浓)= S↓+SO2↑+2H2O
(2)同种元素相邻价态粒子不反应
如S和H2S、S和SO2、SO2
和浓硫酸之间不发生氧化还原反应,
即使两者氧化性、还原性区分明显。
同种元素氧化还原规律
2H2S+SO2===3S↓+2H2O
S+2H2SO4(浓)=== 3SO2↓+2H2O
同种元素氧化还原规律
(3)归中律
当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态产物,如-2价S的化合物与+4价S的化合物在酸性环境中生成S单质,S单质与浓硫酸反应生成SO2。
(4)含硫物质的连续氧化规律
FeS2→SO2→SO3→H2SO4
H2O
O2
O2
S→SO2→SO3→H2SO4
O2
O2
H2O
H2S→SO2→SO3→H2SO4
足量O2
O2
H2O
同种元素氧化还原规律
-2
0
+4
+6
S
S
S
S
只有还原性
既有氧化性又有还原性
只有氧化性
常用氧化剂:浓硫酸、KMnO4、X2等
常用还原剂:金属单质、I-、Na2S等
发生还原反应
发生氧化反应
三、不同价态含硫物质的转化
利用氧化剂,可将硫元素从低价态转化到高价态;
利用还原剂,可将硫元素从高价态转化到低价态。
S S S S
-2 0 +4 +6
氧化性
加还原剂
如H2S等
加氧化剂
如O2、Cl2、Br2、KMnO4、HNO3等
氧化性
加还原剂
如金属单质、H2等
还原性
高价态显氧化性,低价态显还原性
中间价态既有氧化性,又有还原性。
三、不同价态含硫物质的转化
从物质类别的视角认识含硫物质间的转化
单质
S
含氧酸
H2SO3
氧化物
SO2
盐
Na2SO3
氢化物
H2S
H2+S H2S
点燃
SO2 +H2O H2SO3
S+O2 SO2
点燃
H2SO3 +2NaOH Na2SO3+2H2O
三、不同价态含硫物质的转化
序号 价态变化 转化前含硫物质 选择试剂 转化后含硫物质 预期现象
1 -2→0
2 0→-2
3 0→+4
4 +4→0
5 +4→+6
6 +6→+4
7 ······
S
H2、Na、Fe、Cu
H2S、NaS
SO2、X2、KMnO4
S
O2
SO2 、SO32-
H2S、NaS
SO2、SO32-
O2、X2、KMnO4 、H2O2
浓H2SO4
S、C、Cu
探究·转化方案设计
提示:常用的氧化剂有浓硫酸、Cl2、KMnO4等,
还原剂有金属单质、H2、Na2S等,
实验设计:从上述转化关系中选择你感兴趣的一种或几种
设计实验实现其转化,并填写下表:
转化目标 (价态变化) 转化前的 含硫物质 选择试剂 (氧化剂或还原剂) 转化后的含硫物质 预期现象
-2→0
H2S
SO2
S
有黄色固体
探究·转化方案设计
中学阶段常见的符合A B C D转化关系的有哪些?
Na Na2O Na2O2 NaOH
硫元素:
H2S SO2 SO3 H2SO4
S SO2 SO3 H2SO4
碳元素:
C CO CO2 H2CO3
钠元素:
O2
O2
H2O
思考与交流
化学实验设计是指实验者在实施化学实验之前,根据一定的实验目的,运用化学知识与技能,按照一定的实验方法,对实验的原理、试剂、仪器与装置、步骤和方法等所进行的规划。例如,设计“不同价态含硫物质的转化”实验,当确定了要实现的转化关系后,需要明确转化前后的含硫物质时哪些,通过怎样的反应(氧化/还原)实现转化,用到的氧化剂或还原剂是什么,等等。
化学实验设计
化学实验设计
进行化学实验设计时,应遵循科学性,可行性、安全性和绿色化原则。化学实验设计一般以实验设计方案的形式呈现,通常包括实验课题、实验目的、实验原理、实验仪器与实际、实验步骤及注意事项、实验数据及处理、实验结论与讨论等。
实验室没有现成的H2S气体和亚硫酸溶液怎么办?
阅读课本化学与职业——化工工程师,谈谈自己的感想。
关注化学与职业
化工工程师通过观察仪表参数监控化工生产过程
课堂小结
1.下列物质中的硫元素不能表现氧化性的是( )
A.Na2S B.S
C.SO2 D.H2SO4
A
课堂练习
[解析]:
S的最高化合价只有氧化性,最低化合价只有还原性,中间价态既有氧化性又有还原性。
2.请分析下图,并上网查阅相关资料,简述硫在自然界的循环过程,思考人类活动对硫的循环由什么影响。
课堂练习
解答:自然界的硫最初来自黄铁矿与黄铜矿等矿物,由风化进入土壤当中,再经由植物或微生物的吸收,或经由冲刷进入河流,再流入大海,然后沉积或由途中的微生物继续利用等。硫也是自然界生态循环中最重要的元素之一。
其中硫酸根是自然界硫最主要的形式之一,除了被生物再吸收利用外。一部分的硫则由生物转化为硫化氢(如哺乳动物的放屁、硫酸根离子在无氧状况下被硫酸盐还原菌还原成硫化氢),并释放到大气当中,或透过微生物反应重新便为硫元素停留在自然界。硫循环会参予微生物与生物之生物化学反应。有些微生物氧化各种硫化合物,有些则进行还原。
课堂练习
感谢您的观看
选择性必修一
THS
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
