1.1.2 有机化合物中的共价键-高二化学课件(共19张PPT)(人教版2019选择性必修3)
文档属性
| 名称 | 1.1.2 有机化合物中的共价键-高二化学课件(共19张PPT)(人教版2019选择性必修3) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 08:57:30 | ||
图片预览





文档简介
(共19张PPT)
第一章 有机化合物的结构特点与研究方法
第一节 有机化合物的结构特点
第二课时 有机化合物中的共价键
新课导入
在有机化合物分子中,碳原子通过共用电子对与其他原子相连接形成不同类型的共价键,共价键的类型和极性对有机化合物的性质有很大的影响
任务驱动一
复习回顾共价键的定义及类型
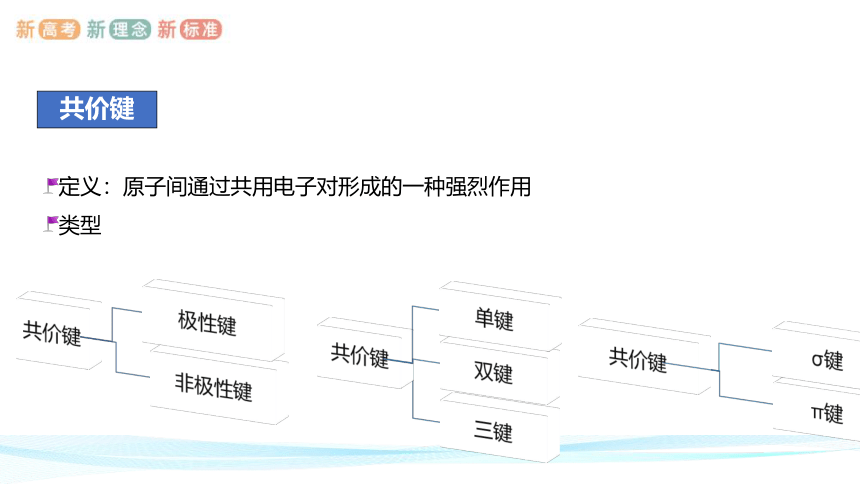
共价键
定义:原子间通过共用电子对形成的一种强烈作用
类型
共价键的类型
任务驱动二
1、σ键和π键的成键方式及特点
2、σ键和π键的判断
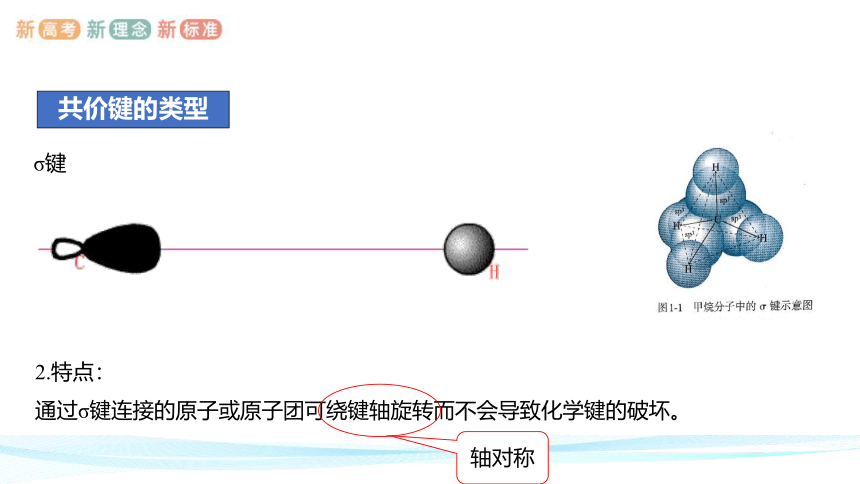
σ键
形成:
氢原子的1s轨道与碳原子的一个sp3杂化轨道沿着两个原子核间的键轴,以“头碰头”的形式相互重叠。
共价键的类型
σ键
2.特点:
通过σ键连接的原子或原子团可绕键轴旋转而不会导致化学键的破坏。
轴对称
共价键的类型
π键
形成:
在乙烯分子中,两个碳原子均以sp2杂化轨道与氢原子的1s轨道及另一个碳原子的sp2杂化轨道进行重叠,形成4个C—H σ键与一个C—C σ键;两个碳原子未参与杂化的p轨道以“肩并肩”的形式从侧面重叠,形成了π键。
共价键的类型
“肩并肩”重叠成键
π键
2.特点:
π键的轨道重叠程度比σ键的小,所以不如σ键牢固,比较容易断裂而发生化学反应。
通过π键连接的原子或原子团不能绕键轴旋转。
镜面对称
共价键的类型
σ、π键个数的计算
单键是σ键
双键中含有一个π键和一个σ键
三键中含有一个σ键和两个π键。
共价键的类型
共价键的类型与有机反应类型的关系
甲烷分子中含有C—H σ键,能发生取代反应
乙烯和乙炔分子的双键和三键中含有π键,能发生加成反应
σ键,发生取代反应
含有π键,发生加成反应。
共价键的类型
σ键和π键的比较
σ键 π键
原子轨道重叠方式
对称类型
原子轨道重叠程度
键的强度
旋转情况
断键与反应类型的关系
成键规律 头碰头
肩并肩
轴对称
镜面对称
大
小
轨道重叠程度大,键的强度较
大,键越牢固
轨道重叠程度较小,键比较
容易断裂,不如σ键牢固
可以绕轴旋转,并不破坏σ键的结构
以形成π键的两个原子核的连线为轴,任意一个原子并不能单独旋转,若单独旋转则会破坏π键的结构
取代反应
加成反应
有机化合物中单键是σ键;双键中一个键是σ键,另一个键是
π键;三键中一个键是σ键,另外两个键是π键
共价键的极性与有机反应
实验1-1
向两只分别盛有蒸馏水和无水乙醇的烧杯中各加入同样大小的钠(约绿豆大),观察现象
[实验现象]
有气泡产生,乙醇与钠的反应没有水与钠的反应剧烈
水和钠 无水乙醇和钠
实验原理
实验现象
剧烈程度 剧烈程度:H2O>CH3CH2OH
受乙基的影响,乙醇分子中氢氧键的极性比水分子氢氧键的极性弱,乙醇比水更难电离出氢离子
2Na+2H2O=2NaOH+H2↑
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
浮、熔、游、响、红
钠沉入底部,有气体产生,最终钠粒消失,液体仍为无色透明。
基团之间相互影响使官能团中化学键的极性发生变化,从而影响着官能团和物质的性质
共价键的极性与有机反应
共价键的极性与有机反应
任务驱动三
通过乙醇与HBr反应再探共价键的极性与有机反应的关系
由于羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,反应中乙醇分子中断裂的键是碳氧单键 。
共价键断裂需要吸收能量,有机化合物分子中共价键断裂的位置存在多种可能
相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂。
有机反应的特点
共价键的极性与有机反应
由于不同的成键原子间电负性的差异,共用电子对会发生偏移
基团之间相互影响使官能团中化学键的极性发生变化,从而影响着官能团和物质的性质
偏移的程度越大,共价键极性越强,在反应中越容易发生断裂
有机化合物的官能团及其邻位的化学键往往是发生化学反应的活性部位
共价键的极性与有机反应
任务驱动四
请从化学键和官能团的角度分析下列反应中有机化合物的变化
①
② CH2=CH2 + Br2→CH2 Br—CH2 Br
甲烷分子中含有C—H σ键,能发生取代反应
CH2=CH2中碳碳双键为π键,π键的轨道重叠程度比σ键的小,所以不如σ键牢固,比较容易断裂而发生加成反应
共价键的极性与有机反应
本节知识网络
感谢您的观看
第一章 有机化合物的结构特点与研究方法
第一节 有机化合物的结构特点
第二课时 有机化合物中的共价键
新课导入
在有机化合物分子中,碳原子通过共用电子对与其他原子相连接形成不同类型的共价键,共价键的类型和极性对有机化合物的性质有很大的影响
任务驱动一
复习回顾共价键的定义及类型
共价键
定义:原子间通过共用电子对形成的一种强烈作用
类型
共价键的类型
任务驱动二
1、σ键和π键的成键方式及特点
2、σ键和π键的判断
σ键
形成:
氢原子的1s轨道与碳原子的一个sp3杂化轨道沿着两个原子核间的键轴,以“头碰头”的形式相互重叠。
共价键的类型
σ键
2.特点:
通过σ键连接的原子或原子团可绕键轴旋转而不会导致化学键的破坏。
轴对称
共价键的类型
π键
形成:
在乙烯分子中,两个碳原子均以sp2杂化轨道与氢原子的1s轨道及另一个碳原子的sp2杂化轨道进行重叠,形成4个C—H σ键与一个C—C σ键;两个碳原子未参与杂化的p轨道以“肩并肩”的形式从侧面重叠,形成了π键。
共价键的类型
“肩并肩”重叠成键
π键
2.特点:
π键的轨道重叠程度比σ键的小,所以不如σ键牢固,比较容易断裂而发生化学反应。
通过π键连接的原子或原子团不能绕键轴旋转。
镜面对称
共价键的类型
σ、π键个数的计算
单键是σ键
双键中含有一个π键和一个σ键
三键中含有一个σ键和两个π键。
共价键的类型
共价键的类型与有机反应类型的关系
甲烷分子中含有C—H σ键,能发生取代反应
乙烯和乙炔分子的双键和三键中含有π键,能发生加成反应
σ键,发生取代反应
含有π键,发生加成反应。
共价键的类型
σ键和π键的比较
σ键 π键
原子轨道重叠方式
对称类型
原子轨道重叠程度
键的强度
旋转情况
断键与反应类型的关系
成键规律 头碰头
肩并肩
轴对称
镜面对称
大
小
轨道重叠程度大,键的强度较
大,键越牢固
轨道重叠程度较小,键比较
容易断裂,不如σ键牢固
可以绕轴旋转,并不破坏σ键的结构
以形成π键的两个原子核的连线为轴,任意一个原子并不能单独旋转,若单独旋转则会破坏π键的结构
取代反应
加成反应
有机化合物中单键是σ键;双键中一个键是σ键,另一个键是
π键;三键中一个键是σ键,另外两个键是π键
共价键的极性与有机反应
实验1-1
向两只分别盛有蒸馏水和无水乙醇的烧杯中各加入同样大小的钠(约绿豆大),观察现象
[实验现象]
有气泡产生,乙醇与钠的反应没有水与钠的反应剧烈
水和钠 无水乙醇和钠
实验原理
实验现象
剧烈程度 剧烈程度:H2O>CH3CH2OH
受乙基的影响,乙醇分子中氢氧键的极性比水分子氢氧键的极性弱,乙醇比水更难电离出氢离子
2Na+2H2O=2NaOH+H2↑
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
浮、熔、游、响、红
钠沉入底部,有气体产生,最终钠粒消失,液体仍为无色透明。
基团之间相互影响使官能团中化学键的极性发生变化,从而影响着官能团和物质的性质
共价键的极性与有机反应
共价键的极性与有机反应
任务驱动三
通过乙醇与HBr反应再探共价键的极性与有机反应的关系
由于羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,反应中乙醇分子中断裂的键是碳氧单键 。
共价键断裂需要吸收能量,有机化合物分子中共价键断裂的位置存在多种可能
相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂。
有机反应的特点
共价键的极性与有机反应
由于不同的成键原子间电负性的差异,共用电子对会发生偏移
基团之间相互影响使官能团中化学键的极性发生变化,从而影响着官能团和物质的性质
偏移的程度越大,共价键极性越强,在反应中越容易发生断裂
有机化合物的官能团及其邻位的化学键往往是发生化学反应的活性部位
共价键的极性与有机反应
任务驱动四
请从化学键和官能团的角度分析下列反应中有机化合物的变化
①
② CH2=CH2 + Br2→CH2 Br—CH2 Br
甲烷分子中含有C—H σ键,能发生取代反应
CH2=CH2中碳碳双键为π键,π键的轨道重叠程度比σ键的小,所以不如σ键牢固,比较容易断裂而发生加成反应
共价键的极性与有机反应
本节知识网络
感谢您的观看
