2.3.3溶解性手性 高二化学课件(共22张PPT)(人教版2019选择性必修2)
文档属性
| 名称 | 2.3.3溶解性手性 高二化学课件(共22张PPT)(人教版2019选择性必修2) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 16:02:27 | ||
图片预览








文档简介
(共22张PPT)
2.3.3 溶解性 手性
教
学
目
标
1、知道物质的溶解性与分子结构的关系;了解“相似相溶”规律。
2、学会判断“手性分子”。
3、结合实例初步认识分子的手性对其性质的影响。
教
学
重
点
物质的溶解性和“手性分子”的判断
教
学
难
点
“手性分子”的概念
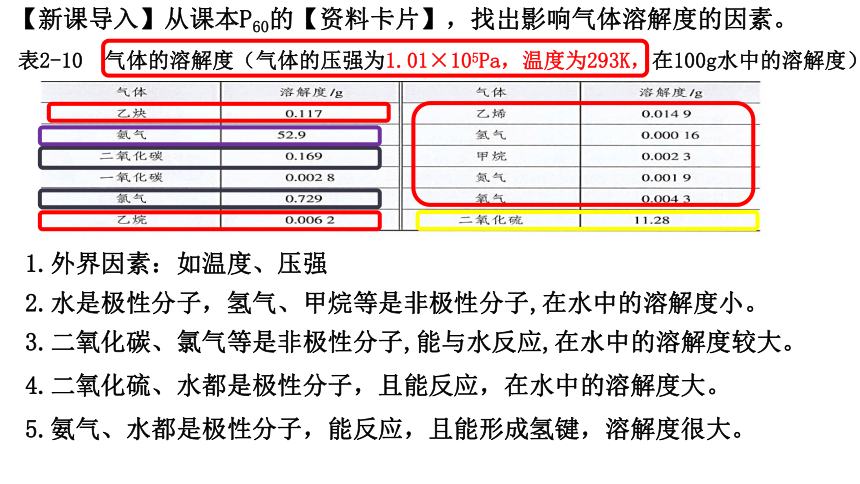
表2-10 气体的溶解度(气体的压强为1.01×105Pa,温度为293K,在100g水中的溶解度)
【新课导入】从课本P60的【资料卡片】,找岀影响气体溶解度的因素。
2.水是极性分子,氢气、甲烷等是非极性分子,在水中的溶解度小。
1.外界因素:如温度、压强
3.二氧化碳、氯气等是非极性分子,能与水反应,在水中的溶解度较大。
4.二氧化硫、水都是极性分子,且能反应,在水中的溶解度大。
5.氨气、水都是极性分子,能反应,且能形成氢键,溶解度很大。
一、溶解性
物质相互溶解的性质十分复杂,受许多因素影响。
(1)影响物质溶解性的外因:
①固体:
主要因素为温度,温度升高,大部分固体溶解度增加(氢氧化钙除外)。
②气体:
主要因素为温度和压强,温度升高,溶解度减小;压强增大,溶解度增大。
例:CCl4是非极性分子,是非极性溶剂;而H2O是极性分子,是极性溶剂。
a.萘、Br2、I2等都是非极性分子,所以易溶于CCl4、苯,而难溶于水。
b.蔗糖、氨、HCl、H2SO4是极性分子,易溶于水而难溶于CCl4。
c.盐类(NaCl等)离子化合物可看是极性最强的,它们易溶于水而不溶于CCl4、苯等非极性溶剂。
(2)影响物质溶解性的内因:
①“相似相溶”规律:——极性相似相溶
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
说明:(1)“相似”指的是分子的极性相似。
(2)这是经验规律,有特例,如CO、NO为极性分子,却难溶于水。
乙醇CH3CH2OH分子中的-OH与水分子的-OH相近,因而乙醇与水能互溶;而戊醇CH3CH2CH2CH2CH2OH中的烃基较大,其中的-OH跟水分子的-OH相似因素小得多,它大水中的溶解度明显减小。
②“相似相溶”规律——结构相似相溶
溶质和溶剂的分子结构相似程度越大,其溶解性越好。
图2-30 相似相溶—水和甲醇的相互溶解(虚线表示氢键)
③氢键的作用
当溶质分子和溶剂分子间能形成氢键时,溶质在该溶剂中溶解度增大。溶剂和溶质之间的氢键作用力越大,溶解性越好。
④溶质与溶剂发生反应
当溶质和溶剂间能发生反应时,溶解度增大。
如二氧化硫分子为极性分子且能与水反应,易溶于水。
SO2+H2O H2SO3
如甲醇与水任意比互溶等
再如氨气为极性分子且能与水反应,又能形成氢键,极易溶于水。
练习1.已知O3的空间结构为 V 形,分子中正电中心和负电中心不重合,则下列关于O3和O2在水中的溶解度叙述正确的是 ( )
A. O3 在水中的溶解度和O2一样 B. O3在水中的溶解度比O2小
C. O3 在水中的溶解度比O2 大 D. 无法比较
C
练习2.下列现象不能用“相似相溶”规律解释的是 ( )
A. 氯化氢易溶于水 B. 氯气易溶于NaOH溶液
C. 碘易溶于CCl4 D. 酒精易溶于水
B
(1)比较NH3和CH4在水中的溶解度。怎样用相似相溶规律理解它们的溶 解度不同?
氨气和水均为极性分子,根据相似相溶规律,NH3易溶于水;氨气能与水反应,又能与水形成氢键,增大NH3在水中的溶解度,因此氨气极易溶于水;CH4为非极性分子,水为极性分子,根据相似相溶规律,CH4不易溶于水。
(2)为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
油漆是非极性分子,有机溶剂(如乙酸乙酯)也是非极性溶剂,而水为极性溶剂,根据相似相溶规律,应当用有机溶剂溶解油漆而不能用水溶解油漆。
【思考与讨论】课本P59
(3)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。在碘水溶液中加入约1 mL四氯化碳(CCl4),振荡试管,观察碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液。再向试管里加入1 mL浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如下反应:
I2+I- I3-。实验表明碘在纯水还是
在四氯化碳中溶解性较好?为什么?
2、KI3 易溶于水,碘单质与I-发生反应 。
加入 CCl4
加入 KI 溶液
振荡
振荡
实验现象:
实验结论:
1、I2 在 CCl4 中溶解性比在水中好。
I2 溶于水中
溶液呈黄色
溶液分层,下层
溶液呈紫红色
溶液分层,下层溶液紫红色变浅
2、碘水中加入浓的KI溶液后,由于发生反应:I2+I-=I3-,碘生成了无色的I3-,并溶解到水中,碘的浓度降低,所以溶液紫色变浅。
1、碘是非极性分子,在极性溶剂水中的溶解度很小,而易溶于非极性溶剂四氯化碳。因此水层颜色明显变浅,而CC14层呈紫红色。
现象分析:
非极性分子I2在非极性溶剂四氯化碳、苯中的溶解性远大于在极性分子水中的溶解性,所以可用四氯化碳、苯作萃取剂把I2从水溶液中提取出来。
1.萃取:利用A物质在B溶剂中的溶解能力小于在C溶剂中的溶解能力,把A物质从B溶剂提取到C溶剂里(B和C互不相溶)的分离方法。
2.萃取剂的选择:①溶质在萃取剂中的溶解度比在原溶剂中大;②萃取剂与原溶剂不反应、不相溶;③萃取剂与溶质不反应。
【实验拓展】
180°
180°
不是同一物质
同一物质
观察下图,左图与右图是什么关系,它们能在空间里重合吗?
【思考与讨论】
二、分子的手性
具有完全相同的组成和原子排列的一对分子,如同左右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体(或对映异构体)。
1、手性异构体
2、手性分子
有手性异构体的分子叫做手性分子。
注意:
(1)手性分子的物质不是同一种物质,二者互为同分异构体。
(2)互为手性分子的物质组成、结构几乎完全相同,化学性质几乎完全相同
3、手性碳原子
当碳原子连接4 个不同的原子或基团时,该碳原子称为手性碳原子,标记为﹡。手性碳原子一定是饱和碳原子。
HOOC—CH—CH3
OH
﹡
练习3.青蒿素是从黄花蒿中提取得到的一种无色针状晶体,分子结构如图所示,则青蒿素分子中含有 个手性碳原子。
7
*
*
*
*
*
*
*
练习4.下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )
B.丙氨酸
C.葡萄糖
D.甘油醛
A.苹果酸
HOOC—CH2—CHOH—COOH
*
CH3—CH—COOH
NH2
—
*
CH2—CH—CH—CH—CH—CHO
OH
—
—
OH
—
OH
—
OH
OH
—
*
CH2OH
—
CHOH
CHO
—
*
A
4、手性分子的判断
(1)观察实物与其镜像能否重合,如果不能重合,说明是手性分子。如右图:
(2)观察有机物分子中是否有手性碳原子,如果有一个手性碳原子,则该有机物分子就是手性分子,具有手性异构体。含有两个或两个以上手性碳原子的有机物分子不一定是手性分子。
H
H
H
Cl
Cl
H
H
H
Cl
Cl
H
H
手性分子
非手性分子
*
*
*
*
当分子中有多个手性中心时,要借助对称因素。无对称轴,又无对称中心的分子,必是手性分子。
练习5.有机物 具有手性,其与H2发生加成反应后,
其产物还有手性吗
原有机物中与—OH相连的碳原子为手性碳原子;与H2加成后,与该碳原子相连的CH2=CH—变为CH3—CH2—,此时该碳原子连有两个乙基,不再具有手性。
5、了解手性分子的发展和应用
人类从这一药物史上的悲剧中吸取教训,不久各国纷纷规定,今后凡生产手性药物,必须把手性异构体分离开,只出售能治病的那种手性异构体的药物。
有毒副作用,
可导致胎儿畸形
无毒副作用,
可用作镇静剂或减轻孕妇妊娠反应
德国制药厂在1957年10月1日上市的高效镇静剂,中文名为“反应停”。
该药品上市不久就发现世界各地相继出现了一些畸形儿,后被科学家证实,是孕妇服用了这种药物导致,随后的药物化学研究证实,在这种药物中,只有图左边的分子才有这种毒副作用,而右边的分子却没有这种毒副作用。
1.影响物质的溶解性的因素
相似相溶原理——极性或者结构相似
氢键对溶解性的影响
与水是否反应溶解性
2.分子的手性
手性异构体
手性分子
手性碳原子(与四个不同的原子或原子团单键相连)
课堂小结
1.下列现象与氢键有关的是( )
①HF的熔、沸点比ⅦA族其他元素氢化物的高
②乙醇可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定
⑤ 邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A.②③④⑤ B.①②③⑤ C.①②③④ D.①②③④⑤
B
【课堂检测】
2.下列化合物分子中含有手性碳原子的是( )
A. CCl2F2 B. CH3CH2OH
D
D.
C.
3.下图中两分子所表示的物质间的关系是( )
A.互为同分异构体 B.为同一种物质
C.互为手性异构体 D.互为同系物
B
4、莽草酸的结构简式如图所示(分子中只有C、H、O三种原子),
其分子中手性碳原子的个数为( )
A.1 B.2 C.3 D.4
C
﹡
﹡
﹡
5、指出下列物质中的手性碳原子
﹡
﹡
﹡
﹡
﹡
﹡
﹡
2.3.3 溶解性 手性
教
学
目
标
1、知道物质的溶解性与分子结构的关系;了解“相似相溶”规律。
2、学会判断“手性分子”。
3、结合实例初步认识分子的手性对其性质的影响。
教
学
重
点
物质的溶解性和“手性分子”的判断
教
学
难
点
“手性分子”的概念
表2-10 气体的溶解度(气体的压强为1.01×105Pa,温度为293K,在100g水中的溶解度)
【新课导入】从课本P60的【资料卡片】,找岀影响气体溶解度的因素。
2.水是极性分子,氢气、甲烷等是非极性分子,在水中的溶解度小。
1.外界因素:如温度、压强
3.二氧化碳、氯气等是非极性分子,能与水反应,在水中的溶解度较大。
4.二氧化硫、水都是极性分子,且能反应,在水中的溶解度大。
5.氨气、水都是极性分子,能反应,且能形成氢键,溶解度很大。
一、溶解性
物质相互溶解的性质十分复杂,受许多因素影响。
(1)影响物质溶解性的外因:
①固体:
主要因素为温度,温度升高,大部分固体溶解度增加(氢氧化钙除外)。
②气体:
主要因素为温度和压强,温度升高,溶解度减小;压强增大,溶解度增大。
例:CCl4是非极性分子,是非极性溶剂;而H2O是极性分子,是极性溶剂。
a.萘、Br2、I2等都是非极性分子,所以易溶于CCl4、苯,而难溶于水。
b.蔗糖、氨、HCl、H2SO4是极性分子,易溶于水而难溶于CCl4。
c.盐类(NaCl等)离子化合物可看是极性最强的,它们易溶于水而不溶于CCl4、苯等非极性溶剂。
(2)影响物质溶解性的内因:
①“相似相溶”规律:——极性相似相溶
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
说明:(1)“相似”指的是分子的极性相似。
(2)这是经验规律,有特例,如CO、NO为极性分子,却难溶于水。
乙醇CH3CH2OH分子中的-OH与水分子的-OH相近,因而乙醇与水能互溶;而戊醇CH3CH2CH2CH2CH2OH中的烃基较大,其中的-OH跟水分子的-OH相似因素小得多,它大水中的溶解度明显减小。
②“相似相溶”规律——结构相似相溶
溶质和溶剂的分子结构相似程度越大,其溶解性越好。
图2-30 相似相溶—水和甲醇的相互溶解(虚线表示氢键)
③氢键的作用
当溶质分子和溶剂分子间能形成氢键时,溶质在该溶剂中溶解度增大。溶剂和溶质之间的氢键作用力越大,溶解性越好。
④溶质与溶剂发生反应
当溶质和溶剂间能发生反应时,溶解度增大。
如二氧化硫分子为极性分子且能与水反应,易溶于水。
SO2+H2O H2SO3
如甲醇与水任意比互溶等
再如氨气为极性分子且能与水反应,又能形成氢键,极易溶于水。
练习1.已知O3的空间结构为 V 形,分子中正电中心和负电中心不重合,则下列关于O3和O2在水中的溶解度叙述正确的是 ( )
A. O3 在水中的溶解度和O2一样 B. O3在水中的溶解度比O2小
C. O3 在水中的溶解度比O2 大 D. 无法比较
C
练习2.下列现象不能用“相似相溶”规律解释的是 ( )
A. 氯化氢易溶于水 B. 氯气易溶于NaOH溶液
C. 碘易溶于CCl4 D. 酒精易溶于水
B
(1)比较NH3和CH4在水中的溶解度。怎样用相似相溶规律理解它们的溶 解度不同?
氨气和水均为极性分子,根据相似相溶规律,NH3易溶于水;氨气能与水反应,又能与水形成氢键,增大NH3在水中的溶解度,因此氨气极易溶于水;CH4为非极性分子,水为极性分子,根据相似相溶规律,CH4不易溶于水。
(2)为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
油漆是非极性分子,有机溶剂(如乙酸乙酯)也是非极性溶剂,而水为极性溶剂,根据相似相溶规律,应当用有机溶剂溶解油漆而不能用水溶解油漆。
【思考与讨论】课本P59
(3)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。在碘水溶液中加入约1 mL四氯化碳(CCl4),振荡试管,观察碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液。再向试管里加入1 mL浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如下反应:
I2+I- I3-。实验表明碘在纯水还是
在四氯化碳中溶解性较好?为什么?
2、KI3 易溶于水,碘单质与I-发生反应 。
加入 CCl4
加入 KI 溶液
振荡
振荡
实验现象:
实验结论:
1、I2 在 CCl4 中溶解性比在水中好。
I2 溶于水中
溶液呈黄色
溶液分层,下层
溶液呈紫红色
溶液分层,下层溶液紫红色变浅
2、碘水中加入浓的KI溶液后,由于发生反应:I2+I-=I3-,碘生成了无色的I3-,并溶解到水中,碘的浓度降低,所以溶液紫色变浅。
1、碘是非极性分子,在极性溶剂水中的溶解度很小,而易溶于非极性溶剂四氯化碳。因此水层颜色明显变浅,而CC14层呈紫红色。
现象分析:
非极性分子I2在非极性溶剂四氯化碳、苯中的溶解性远大于在极性分子水中的溶解性,所以可用四氯化碳、苯作萃取剂把I2从水溶液中提取出来。
1.萃取:利用A物质在B溶剂中的溶解能力小于在C溶剂中的溶解能力,把A物质从B溶剂提取到C溶剂里(B和C互不相溶)的分离方法。
2.萃取剂的选择:①溶质在萃取剂中的溶解度比在原溶剂中大;②萃取剂与原溶剂不反应、不相溶;③萃取剂与溶质不反应。
【实验拓展】
180°
180°
不是同一物质
同一物质
观察下图,左图与右图是什么关系,它们能在空间里重合吗?
【思考与讨论】
二、分子的手性
具有完全相同的组成和原子排列的一对分子,如同左右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体(或对映异构体)。
1、手性异构体
2、手性分子
有手性异构体的分子叫做手性分子。
注意:
(1)手性分子的物质不是同一种物质,二者互为同分异构体。
(2)互为手性分子的物质组成、结构几乎完全相同,化学性质几乎完全相同
3、手性碳原子
当碳原子连接4 个不同的原子或基团时,该碳原子称为手性碳原子,标记为﹡。手性碳原子一定是饱和碳原子。
HOOC—CH—CH3
OH
﹡
练习3.青蒿素是从黄花蒿中提取得到的一种无色针状晶体,分子结构如图所示,则青蒿素分子中含有 个手性碳原子。
7
*
*
*
*
*
*
*
练习4.下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )
B.丙氨酸
C.葡萄糖
D.甘油醛
A.苹果酸
HOOC—CH2—CHOH—COOH
*
CH3—CH—COOH
NH2
—
*
CH2—CH—CH—CH—CH—CHO
OH
—
—
OH
—
OH
—
OH
OH
—
*
CH2OH
—
CHOH
CHO
—
*
A
4、手性分子的判断
(1)观察实物与其镜像能否重合,如果不能重合,说明是手性分子。如右图:
(2)观察有机物分子中是否有手性碳原子,如果有一个手性碳原子,则该有机物分子就是手性分子,具有手性异构体。含有两个或两个以上手性碳原子的有机物分子不一定是手性分子。
H
H
H
Cl
Cl
H
H
H
Cl
Cl
H
H
手性分子
非手性分子
*
*
*
*
当分子中有多个手性中心时,要借助对称因素。无对称轴,又无对称中心的分子,必是手性分子。
练习5.有机物 具有手性,其与H2发生加成反应后,
其产物还有手性吗
原有机物中与—OH相连的碳原子为手性碳原子;与H2加成后,与该碳原子相连的CH2=CH—变为CH3—CH2—,此时该碳原子连有两个乙基,不再具有手性。
5、了解手性分子的发展和应用
人类从这一药物史上的悲剧中吸取教训,不久各国纷纷规定,今后凡生产手性药物,必须把手性异构体分离开,只出售能治病的那种手性异构体的药物。
有毒副作用,
可导致胎儿畸形
无毒副作用,
可用作镇静剂或减轻孕妇妊娠反应
德国制药厂在1957年10月1日上市的高效镇静剂,中文名为“反应停”。
该药品上市不久就发现世界各地相继出现了一些畸形儿,后被科学家证实,是孕妇服用了这种药物导致,随后的药物化学研究证实,在这种药物中,只有图左边的分子才有这种毒副作用,而右边的分子却没有这种毒副作用。
1.影响物质的溶解性的因素
相似相溶原理——极性或者结构相似
氢键对溶解性的影响
与水是否反应溶解性
2.分子的手性
手性异构体
手性分子
手性碳原子(与四个不同的原子或原子团单键相连)
课堂小结
1.下列现象与氢键有关的是( )
①HF的熔、沸点比ⅦA族其他元素氢化物的高
②乙醇可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定
⑤ 邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
A.②③④⑤ B.①②③⑤ C.①②③④ D.①②③④⑤
B
【课堂检测】
2.下列化合物分子中含有手性碳原子的是( )
A. CCl2F2 B. CH3CH2OH
D
D.
C.
3.下图中两分子所表示的物质间的关系是( )
A.互为同分异构体 B.为同一种物质
C.互为手性异构体 D.互为同系物
B
4、莽草酸的结构简式如图所示(分子中只有C、H、O三种原子),
其分子中手性碳原子的个数为( )
A.1 B.2 C.3 D.4
C
﹡
﹡
﹡
5、指出下列物质中的手性碳原子
﹡
﹡
﹡
﹡
﹡
﹡
﹡
