2.3.1共价键的极性 高二化学课件((共32张PPT)人教版2019选择性必修2)
文档属性
| 名称 | 2.3.1共价键的极性 高二化学课件((共32张PPT)人教版2019选择性必修2) |  | |
| 格式 | pptx | ||
| 文件大小 | 73.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 16:04:15 | ||
图片预览






文档简介
(共32张PPT)
第二章 分子结构与性质
2019人教版选择性必修二
第三节 分子结构与物质的性质
第一课时 共价键的极性
核心素养发展目标
1.宏观辨识与微观探析:通过认识分子间的相互作用及分子的相关性质,形成"结构决定性质"的观念。
2.通过对键的极性与分子极性关系的判断,,建立能运用模型解释化学现象,培养证据推理与模型认知的核心素养。
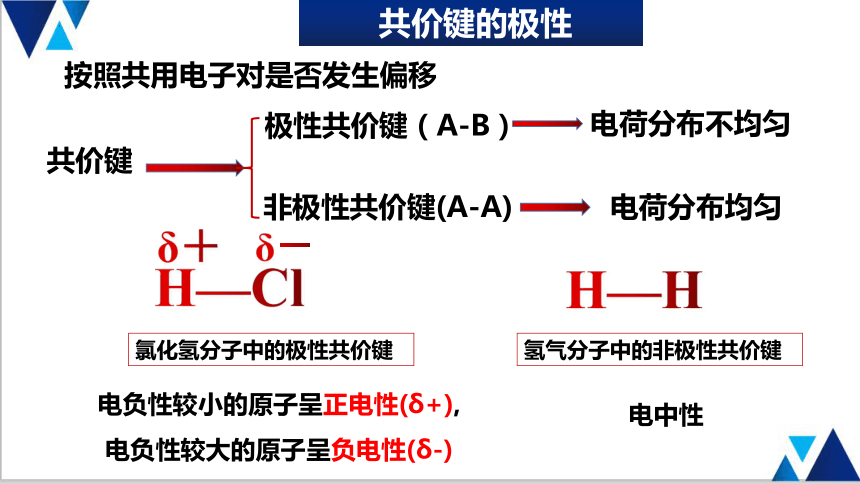
共价键的极性
按照共用电子对是否发生偏移
共价键
极性共价键(A-B)
非极性共价键(A-A)
电荷分布不均匀
电荷分布均匀
H—Cl
δ+
δ-
氯化氢分子中的极性共价键
H—H
氢气分子中的非极性共价键
电负性较小的原子呈正电性(δ+),
电负性较大的原子呈负电性(δ-)
电中性
电负性:2.1 3.0
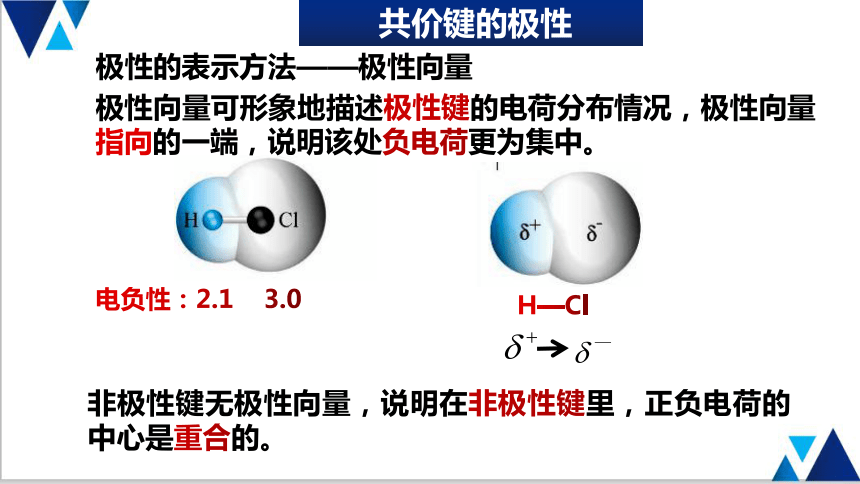
极性向量可形象地描述极性键的电荷分布情况,极性向量指向的一端,说明该处负电荷更为集中。
极性的表示方法——极性向量
共价键的极性
非极性键无极性向量,说明在非极性键里,正负电荷的中心是重合的。
H—Cl
判断下列物质中的共价键类型
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键 非极性键
非极性键
极性键
共价键的极性
含有共价键的物质类型:单质、共价化合物、离子化合物
共价键有极性键、非极性键之分,以共价键结合的分子是否也有极性分子、非极性分子之分呢?
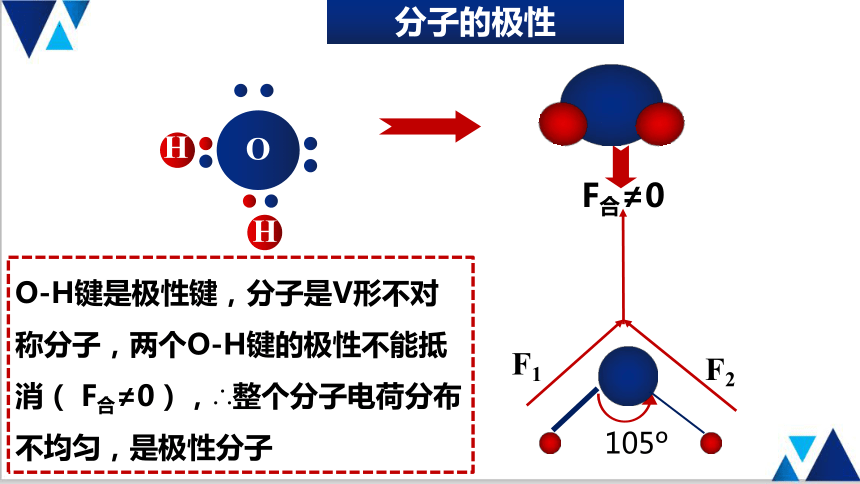
分子的极性
H
O
H
105
F1
F2
F合≠0
O-H键是极性键,分子是V形不对称分子,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子
分子的极性
C
Cl
Cl
Cl
Cl
109 28'
正四面体形 ,对称分子,C-H键的极性互相抵消( F合=0) ,是非极性分子
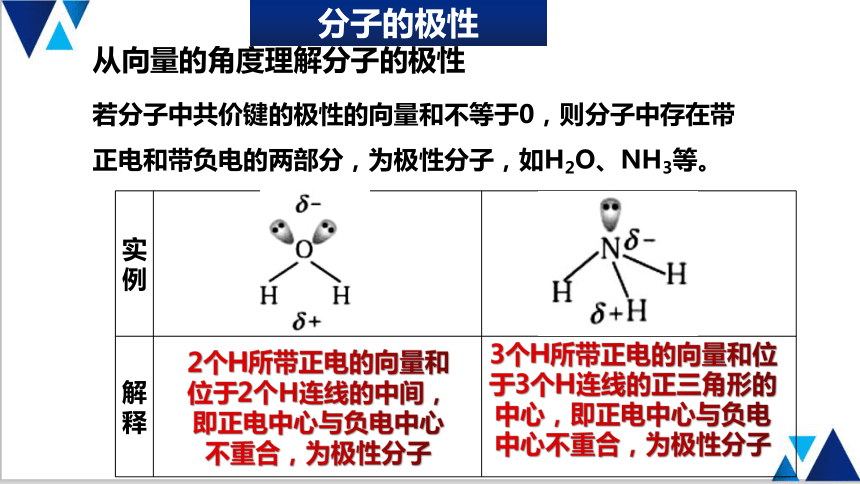
分子的极性
若分子中共价键的极性的向量和不等于0,则分子中存在带正电和带负电的两部分,为极性分子,如H2O、NH3等。
实例
解释
2个H所带正电的向量和位于2个H连线的中间,即正电中心与负电中心不重合,为极性分子
3个H所带正电的向量和位于3个H连线的正三角形的中心,即正电中心与负电中心不重合,为极性分子
从向量的角度理解分子的极性
分子的极性
若分子中共价键的极性的向量和等于0,则分子中没有带正电和带负电的两部分,为非极性分子,如BF3、CH4、CCl4等。
从向量的角度理解分子的极性
实例
解释
对称的3个F所带负电的向量和位于分子中心,即与B重合,且负电量与B所带正电量相等,分子不带电,为非极性分子
对称的4个H所带正电的向量和位于分子中心,即与C重合,且正电量与C所带负电量相等,分子不带电,为非极性分子
分子的极性
极性分子
非极性分子
只含非极性键的分子
含有极性键的分子
共价键的极性和分子的极性
分子
正电中心与负电中心不重合
正电中心与负电中心重合
极性键的向量和不等于零
一定是
极性键的向量和等于零
常见的极性分子和非极性分子
非极性分子
极性分子
非极性分子
非极性分子
非极性分子
非极性分子
极性分子
极性分子
极性分子
臭氧是一种重要物质。大气高空的臭氧层保护了地球生物的生存;空气质量预报中臭氧含量是空气质量的重要指标;它还是有机合成的氧化剂、替代氯气的净水剂……
臭氧分子的空间结构与水分子的相似,
臭氧分子有极性,但很微弱。
仅是水分子的极性的28%。
臭氧分子中的共价键是极性键,
其中心氧原子是呈正电性的,
而端位的两个氧原子是呈电负性的。
臭氧的极性微弱,它在四氯化碳中的溶解度高于在水中的溶解度
臭氧是极性分子
【资料卡片】
一、化合价法
ABn型分子中
中心原子化合价的绝对值
该元素的价电子数
=
该分子为非极性分子
分子的空间结构中心对称
直线形
平面正三角形
正四面体
……
判断分子极性的方法
分子 BF3 CO2 PCl5 SO3
化合价绝对值
价电子数
分子极性
3
3
非极性分子
4
4
5
5
6
6
非极性分子
非极性分子
非极性分子
ABn型分子中
中心原子化合价的绝对值
该元素的价电子数
≠
该分子为极性分子
分子的空间结构不中心对称
V形
三角锥形
四面体
……
一、化合价法
判断分子极性的方法
分子 H2O NH3 SO2
化合价绝对值
价电子数
分子极性
2
6
3
5
4
6
极性分子
极性分子
极性分子
二、根据分子的空间结构判断
分子类型 价电子对数 空间结构 分子极性 代表物
A2
AB
AB2
AB3
AB4
2+0
2+1
2+2
直线形
V形
V形
非极性分子
极性分子
极性分子
CO2、CS2
SO2
H2O、H2S
3+0
3+1
平面三角形
三角锥形
非极性分子
极性分子
BF3、AlCl3
NH3、PCl3
4+0
正四面体
非极性分子
CH4、CCl4
直线形
非极性分子
极性分子
O2、H2
HF、CO
判断分子极性的方法
分子的极性
分子中的中心原子最外层电子若全部参与成键,不存在孤电子对,此分子一般为非极性分子,如:CH4、BF3、CO2等分子中的中心原子的最外层电子均全部参与成键,它们都是非极性分子
三、根据中心原子最外层电子是否全部成键判断
分子中的中心原子最外层电子若未全部参与成键,存在孤电子对,此分子一般为极性分子,如H2O、NH3、NF3等分子中的中心原子的最外层电子均未全部参与成键,它们都是极性分子。
①稀有气体分子是非极性分子,但不含共价键
②臭氧是极性分子,共价键为极性键
③H2O2是由极性键和非极性键构成的极性分子
分子的极性
注意:
表面活性剂
表面活性剂的去污原理
表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
分子的极性应用——表面活性剂
2Na+2H2O===2NaOH+H2↑
钠和水的反应
钠和乙醇的反应
为什么钠和水的反应比钠和乙醇的反应剧烈?
2Na+2CH3CH2OH 2CH3CH2ONa+H2↑
键的极性对化学性质的影响
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈
键的极性对化学性质的影响
键的极性对物质的化学性质有重要影响。
pKa=-lgKa
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
键的极性对化学性质的影响
例如,羧酸是一大类含羧基的有机酸。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
H
O
H
δ+
δ-
O
C
烃基(R-)是推电子基团,烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
随着烃基加长,酸性的差异越来越小
酸
性
增
强
羧酸 pKa
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
键的极性对化学性质的影响
由于氯的电负性较大,
极性:Cl3C— > Cl2CH— > ClCH2—
导致三氯乙酸中的羧基的极性最大,更易电离出氢离子
CH2
O
H
δ+
δ-
O
C
Cl
CH
O
H
δ+
δ-
O
C
Cl
Cl
C
O
H
δ+
δ-
O
C
Cl
Cl
Cl
F的电负性
Cl的电负性
>
F-C的极性
Cl-C的极性
>
F3-C的极性
Cl3-C的极性
>
三氟乙酸的羧基中的羟基的极性更大
三氟乙酸更容易电离出氢离子
羧酸 pKa
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
键的极性对化学性质的影响
三氟乙酸的酸性强于三氯乙酸
(1)键的极性对羧酸酸性大小的影响实质是通过改变羧基中羟基的极性而实现的,羧基中羟基的极性越大,越容易电离出H+,则羧酸的酸性越大。
(2)与羧基相邻的共价键的极性越大,通过传导作用使羧基中羟基的极性越大,则羧酸的酸性越大。
(3)烃基是推电子基团,即将电子推向羟基,从而减小羟基的极性,导致羧酸的酸性减小。一般地,烃基越长,推电子效应越大,羧酸的酸性越小。
键的极性对化学性质的影响
分子结构修饰与分子的性质
三氯蔗糖
不改变分子的主体骨架,保持分子的基本结构不变,仅改变分子结构中的某些基团而得到新的分子,分子被修饰后,其性质也可以发生显著的变化
三氯蔗糖又名蔗糖素,其甜度高、热量值极低,安全性好,可供糖尿病患者食用,被认为是近乎完美的甜味剂。
小结
共价键
极性键
非极性键
空间不对称
极性分子
双原子分子:HCl、NO、CO
V型分子:H2O、H2S、SO2
三角锥形分子:NH3、PH3
非正四面体:CHCl3
非极性分子
直线形分子:CO2、CS2、C2H2
正三角形:SO3、BF3
平面形:苯、乙烯
正四面体:CH4、CCl4、SiF4
空间对称
小结
特别的:H2O2、O3
单质分子:Cl2、N2、P4、O2
学以致用
1.下列物质:①BeCl2 ②Ar ③白磷 ④BF3 ⑤NH3 ⑥H2O2,其中含极性键的非极性分子是( )
A.①④⑥ B.②③⑥ C.①④ D.①③④⑤
①BeCl2空间结构是直线形,Cl—Be—Cl是含极性键的非极性分子;
②Ar为稀有气体,分子中不含化学键;
③白磷分子式为P4,不含极性键,含有的是非极性键;
④BF3是平面三角形结构,是极性键构成的非极性分子;
⑤过氧化氢是由极性键和非极性键构成的极性分子。
C
学以致用
2.下列物质的酸性强弱比较正确的是( )
A.CH3COOH>HCOOH B.HCOOH>CH3COOH>CH3CH2COOH
C.HClO3D.CH2FCOOH>CH2ClCOOH>CH3COOH
BD
CH3—的推电子作用使CH3COOH酸性弱于HCOOH,A项错误;
含碳原子数越多的烷基推电子作用越强,使O—H键极性越弱,导致相应羧酸的酸性减弱,所以B项正确;
同一元素不同价态的含氧酸中非羟基氧原子越多,酸性越强,C项错误;
由于吸电子能力F>Cl>H,故D项正确。
第二章 分子结构与性质
2019人教版选择性必修二
第三节 分子结构与物质的性质
第一课时 共价键的极性
核心素养发展目标
1.宏观辨识与微观探析:通过认识分子间的相互作用及分子的相关性质,形成"结构决定性质"的观念。
2.通过对键的极性与分子极性关系的判断,,建立能运用模型解释化学现象,培养证据推理与模型认知的核心素养。
共价键的极性
按照共用电子对是否发生偏移
共价键
极性共价键(A-B)
非极性共价键(A-A)
电荷分布不均匀
电荷分布均匀
H—Cl
δ+
δ-
氯化氢分子中的极性共价键
H—H
氢气分子中的非极性共价键
电负性较小的原子呈正电性(δ+),
电负性较大的原子呈负电性(δ-)
电中性
电负性:2.1 3.0
极性向量可形象地描述极性键的电荷分布情况,极性向量指向的一端,说明该处负电荷更为集中。
极性的表示方法——极性向量
共价键的极性
非极性键无极性向量,说明在非极性键里,正负电荷的中心是重合的。
H—Cl
判断下列物质中的共价键类型
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键 非极性键
非极性键
极性键
共价键的极性
含有共价键的物质类型:单质、共价化合物、离子化合物
共价键有极性键、非极性键之分,以共价键结合的分子是否也有极性分子、非极性分子之分呢?
分子的极性
H
O
H
105
F1
F2
F合≠0
O-H键是极性键,分子是V形不对称分子,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子
分子的极性
C
Cl
Cl
Cl
Cl
109 28'
正四面体形 ,对称分子,C-H键的极性互相抵消( F合=0) ,是非极性分子
分子的极性
若分子中共价键的极性的向量和不等于0,则分子中存在带正电和带负电的两部分,为极性分子,如H2O、NH3等。
实例
解释
2个H所带正电的向量和位于2个H连线的中间,即正电中心与负电中心不重合,为极性分子
3个H所带正电的向量和位于3个H连线的正三角形的中心,即正电中心与负电中心不重合,为极性分子
从向量的角度理解分子的极性
分子的极性
若分子中共价键的极性的向量和等于0,则分子中没有带正电和带负电的两部分,为非极性分子,如BF3、CH4、CCl4等。
从向量的角度理解分子的极性
实例
解释
对称的3个F所带负电的向量和位于分子中心,即与B重合,且负电量与B所带正电量相等,分子不带电,为非极性分子
对称的4个H所带正电的向量和位于分子中心,即与C重合,且正电量与C所带负电量相等,分子不带电,为非极性分子
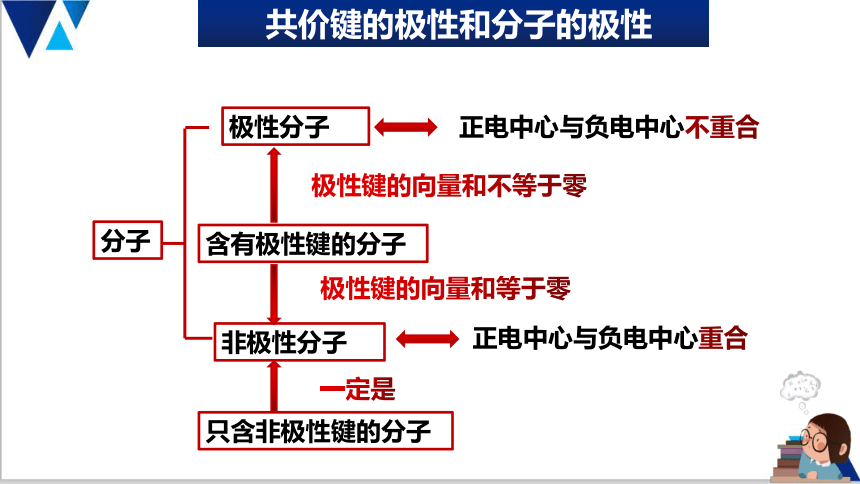
分子的极性
极性分子
非极性分子
只含非极性键的分子
含有极性键的分子
共价键的极性和分子的极性
分子
正电中心与负电中心不重合
正电中心与负电中心重合
极性键的向量和不等于零
一定是
极性键的向量和等于零
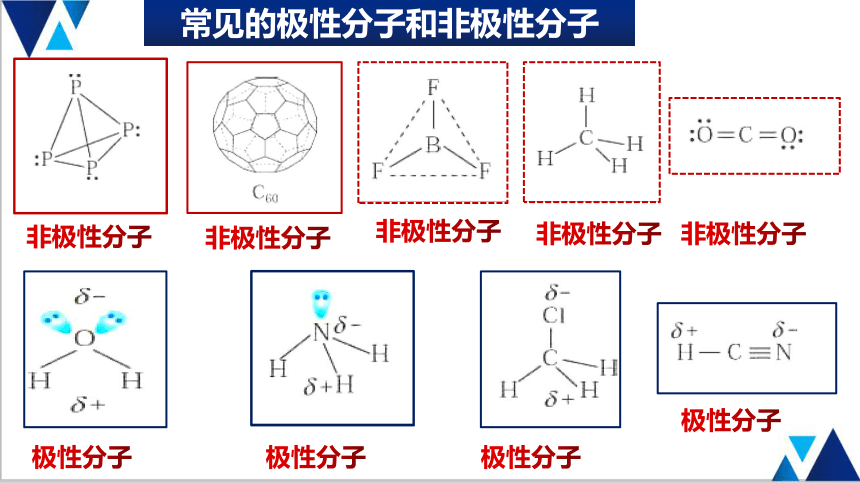
常见的极性分子和非极性分子
非极性分子
极性分子
非极性分子
非极性分子
非极性分子
非极性分子
极性分子
极性分子
极性分子
臭氧是一种重要物质。大气高空的臭氧层保护了地球生物的生存;空气质量预报中臭氧含量是空气质量的重要指标;它还是有机合成的氧化剂、替代氯气的净水剂……
臭氧分子的空间结构与水分子的相似,
臭氧分子有极性,但很微弱。
仅是水分子的极性的28%。
臭氧分子中的共价键是极性键,
其中心氧原子是呈正电性的,
而端位的两个氧原子是呈电负性的。
臭氧的极性微弱,它在四氯化碳中的溶解度高于在水中的溶解度
臭氧是极性分子
【资料卡片】
一、化合价法
ABn型分子中
中心原子化合价的绝对值
该元素的价电子数
=
该分子为非极性分子
分子的空间结构中心对称
直线形
平面正三角形
正四面体
……
判断分子极性的方法
分子 BF3 CO2 PCl5 SO3
化合价绝对值
价电子数
分子极性
3
3
非极性分子
4
4
5
5
6
6
非极性分子
非极性分子
非极性分子
ABn型分子中
中心原子化合价的绝对值
该元素的价电子数
≠
该分子为极性分子
分子的空间结构不中心对称
V形
三角锥形
四面体
……
一、化合价法
判断分子极性的方法
分子 H2O NH3 SO2
化合价绝对值
价电子数
分子极性
2
6
3
5
4
6
极性分子
极性分子
极性分子
二、根据分子的空间结构判断
分子类型 价电子对数 空间结构 分子极性 代表物
A2
AB
AB2
AB3
AB4
2+0
2+1
2+2
直线形
V形
V形
非极性分子
极性分子
极性分子
CO2、CS2
SO2
H2O、H2S
3+0
3+1
平面三角形
三角锥形
非极性分子
极性分子
BF3、AlCl3
NH3、PCl3
4+0
正四面体
非极性分子
CH4、CCl4
直线形
非极性分子
极性分子
O2、H2
HF、CO
判断分子极性的方法
分子的极性
分子中的中心原子最外层电子若全部参与成键,不存在孤电子对,此分子一般为非极性分子,如:CH4、BF3、CO2等分子中的中心原子的最外层电子均全部参与成键,它们都是非极性分子
三、根据中心原子最外层电子是否全部成键判断
分子中的中心原子最外层电子若未全部参与成键,存在孤电子对,此分子一般为极性分子,如H2O、NH3、NF3等分子中的中心原子的最外层电子均未全部参与成键,它们都是极性分子。
①稀有气体分子是非极性分子,但不含共价键
②臭氧是极性分子,共价键为极性键
③H2O2是由极性键和非极性键构成的极性分子
分子的极性
注意:
表面活性剂
表面活性剂的去污原理
表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
分子的极性应用——表面活性剂
2Na+2H2O===2NaOH+H2↑
钠和水的反应
钠和乙醇的反应
为什么钠和水的反应比钠和乙醇的反应剧烈?
2Na+2CH3CH2OH 2CH3CH2ONa+H2↑
键的极性对化学性质的影响
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈
键的极性对化学性质的影响
键的极性对物质的化学性质有重要影响。
pKa=-lgKa
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
键的极性对化学性质的影响
例如,羧酸是一大类含羧基的有机酸。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
H
O
H
δ+
δ-
O
C
烃基(R-)是推电子基团,烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
随着烃基加长,酸性的差异越来越小
酸
性
增
强
羧酸 pKa
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
键的极性对化学性质的影响
由于氯的电负性较大,
极性:Cl3C— > Cl2CH— > ClCH2—
导致三氯乙酸中的羧基的极性最大,更易电离出氢离子
CH2
O
H
δ+
δ-
O
C
Cl
CH
O
H
δ+
δ-
O
C
Cl
Cl
C
O
H
δ+
δ-
O
C
Cl
Cl
Cl
F的电负性
Cl的电负性
>
F-C的极性
Cl-C的极性
>
F3-C的极性
Cl3-C的极性
>
三氟乙酸的羧基中的羟基的极性更大
三氟乙酸更容易电离出氢离子
羧酸 pKa
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
键的极性对化学性质的影响
三氟乙酸的酸性强于三氯乙酸
(1)键的极性对羧酸酸性大小的影响实质是通过改变羧基中羟基的极性而实现的,羧基中羟基的极性越大,越容易电离出H+,则羧酸的酸性越大。
(2)与羧基相邻的共价键的极性越大,通过传导作用使羧基中羟基的极性越大,则羧酸的酸性越大。
(3)烃基是推电子基团,即将电子推向羟基,从而减小羟基的极性,导致羧酸的酸性减小。一般地,烃基越长,推电子效应越大,羧酸的酸性越小。
键的极性对化学性质的影响
分子结构修饰与分子的性质
三氯蔗糖
不改变分子的主体骨架,保持分子的基本结构不变,仅改变分子结构中的某些基团而得到新的分子,分子被修饰后,其性质也可以发生显著的变化
三氯蔗糖又名蔗糖素,其甜度高、热量值极低,安全性好,可供糖尿病患者食用,被认为是近乎完美的甜味剂。
小结
共价键
极性键
非极性键
空间不对称
极性分子
双原子分子:HCl、NO、CO
V型分子:H2O、H2S、SO2
三角锥形分子:NH3、PH3
非正四面体:CHCl3
非极性分子
直线形分子:CO2、CS2、C2H2
正三角形:SO3、BF3
平面形:苯、乙烯
正四面体:CH4、CCl4、SiF4
空间对称
小结
特别的:H2O2、O3
单质分子:Cl2、N2、P4、O2
学以致用
1.下列物质:①BeCl2 ②Ar ③白磷 ④BF3 ⑤NH3 ⑥H2O2,其中含极性键的非极性分子是( )
A.①④⑥ B.②③⑥ C.①④ D.①③④⑤
①BeCl2空间结构是直线形,Cl—Be—Cl是含极性键的非极性分子;
②Ar为稀有气体,分子中不含化学键;
③白磷分子式为P4,不含极性键,含有的是非极性键;
④BF3是平面三角形结构,是极性键构成的非极性分子;
⑤过氧化氢是由极性键和非极性键构成的极性分子。
C
学以致用
2.下列物质的酸性强弱比较正确的是( )
A.CH3COOH>HCOOH B.HCOOH>CH3COOH>CH3CH2COOH
C.HClO3
BD
CH3—的推电子作用使CH3COOH酸性弱于HCOOH,A项错误;
含碳原子数越多的烷基推电子作用越强,使O—H键极性越弱,导致相应羧酸的酸性减弱,所以B项正确;
同一元素不同价态的含氧酸中非羟基氧原子越多,酸性越强,C项错误;
由于吸电子能力F>Cl>H,故D项正确。
