4.1.1 醇和酚(第1课时 醇)(课件)(共30张PPT)高二化学(苏教版2019选择性必修3)
文档属性
| 名称 | 4.1.1 醇和酚(第1课时 醇)(课件)(共30张PPT)高二化学(苏教版2019选择性必修3) |

|
|
| 格式 | pptx | ||
| 文件大小 | 51.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 09:09:54 | ||
图片预览








文档简介
(共30张PPT)
第1课 醇和酚
第1课时:醇
第四单元
醇的结构和性质
01
醇的重要应用
02
醇的结构和性质
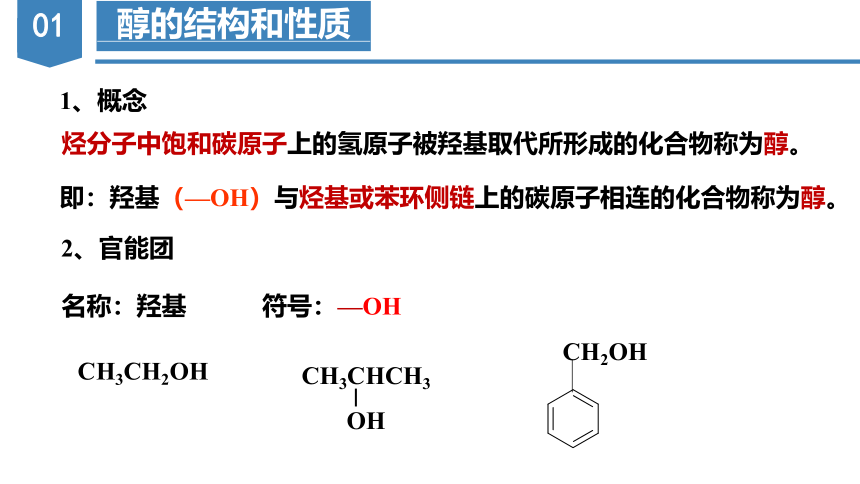
醇的结构和性质
即:羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
2、官能团
名称:羟基 符号:—OH
1、概念
CH3CH2OH
CH2OH
CH3CHCH3
OH
烃分子中饱和碳原子上的氢原子被羟基取代所形成的化合物称为醇。
醇的结构和性质
C—C—O—H
H
H
H
H
H
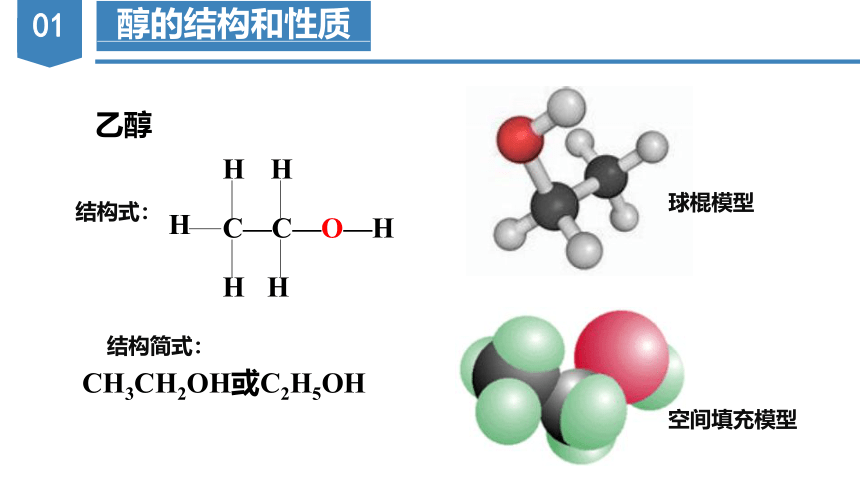
结构式:
CH3CH2OH或C2H5OH
结构简式:
空间填充模型
球棍模型
乙醇
醇的结构和性质
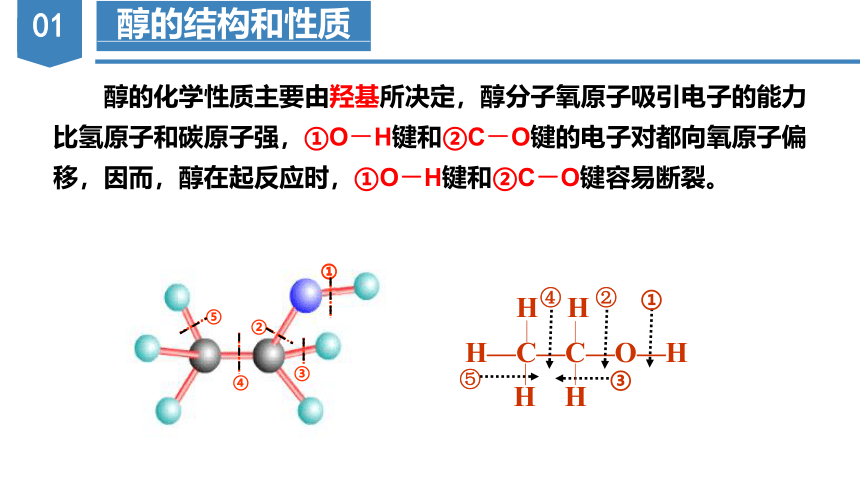
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O-H键和②C-O键的电子对都向氧原子偏移,因而,醇在起反应时,①O-H键和②C-O键容易断裂。
④
⑤
②
③
①
①
⑤
①
③
H—C—C—O—H
H H
H H
②
④
醇的结构和性质
醇的结构和性质
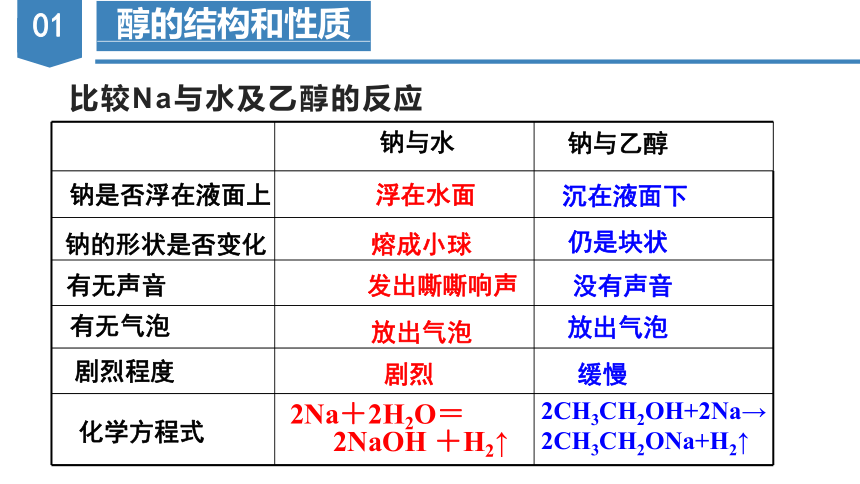
比较Na与水及乙醇的反应
钠与水
钠与乙醇
钠是否浮在液面上
浮在水面
沉在液面下
钠的形状是否变化
熔成小球
仍是块状
有无声音
发出嘶嘶响声
没有声音
有无气泡
放出气泡
放出气泡
剧烈程度
剧烈
缓慢
化学方程式
2Na+2H2O=
2NaOH +H2↑
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
醇的结构和性质
【结论】
乙醇羟基上的氢原子比水中氢原子不活泼。
每2mol 羟基与足量的Na反应生成1mol H2
乙醇钠
断①号键
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
置换反应
④
⑤
②
③
①
①
其它活泼金属如钾、钙等也可与乙醇反应产生H2。
醚不能跟钠反应。
醇的结构和性质
乙醇能够被氧化剂氧化。
①燃烧(淡蓝色火焰):
2CO2 +3H2O
C2H5OH +3 O2
点燃
醇的结构和性质
乙醇能够被氧化剂氧化。
②与强氧化剂反应:
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
重铬酸钾由橙色变为绿色检验酒驾
酸性高锰酸钾紫色褪去
醇的结构和性质
③催化氧化
(去氢):
④
⑤
②
③
①
①
醇的结构和性质
断①③号键
2Cu + O2 2CuO 红色变为黑色
△
CH3CH2OH + CuO CH3CHO+Cu+H2O
△
乙 醛
乙 醇
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
2CH3—C
Cu 或Ag
△
+ O2
+ 2 H2O
2CH3—C—H
O—H
H
O
H
乙醛
结构条件:α-C有H(α-H)
醇的结构和性质
实验现象:
Ⅱ中产生油状液体
CH3CH2Br
C2H5 OH + H Br C2H5Br + H2O
△
断②号键
④
⑤
②
③
①
①
醇不仅可以与氢溴酸反应,还可以与其他氢卤酸反应。
在反应中,醇分子中的羟基被卤素原子取代生成卤代烃:
R—OH+HX―→R—X+H2O
醇的结构和性质
乙醇的消去反应
醇的结构和性质
实验现象:
稀酸性高锰酸钾溶液褪色
生成了乙烯
1700C
浓H2SO4
H C C H H2O + CH2=CH2
H
H
H
OH
断②⑤号键
④
⑤
②
③
①
①
醇的结构和性质
在一定条件下,一个有机化合物分子内脱去一个或几个小分子生成不饱和化合物(含双键或三键)的反应。
消去反应
CH3-CH2-CH-CH3
OH
浓硫酸
△
浓硫酸
△
CH2-CH2-CH2-CH2
OH
OH
CH3-CH=CH-CH3
或CH3-CH2-CH=CH2
+H2O
CH2=CH-CH=CH2
+H2O
结构条件:β-C有H(β-H)
④
⑤
②
③
①
①
醇的结构和性质
断①②号键
分子间脱水:
CH3CH2-OH+H-O-CH2CH3 CH3CH2-O-CH2CH3
浓H2SO4
140 ℃
+H2O
温度适中使人着迷(醚)
温度过高使人窒息(制烯)
注意:
实验室制备的乙烯常含有有乙醚、乙醇蒸气、SO2、CO2及H2O
醚:分子由两个烃基通过氧原子连接而成的有机化合物。烃基可以是烷基、烯基、苯基等。醚常用作有机溶剂。
乙醚
醇的结构和性质
②浓硫酸的作用是什么
①放入几片碎
瓷片作用是
什么
③酒精与浓硫酸混合液如何配置(1:3)
④温度计的位置?
⑥混合液颜色如何变化?为什么?
⑤为何使液体温度迅速升到170℃,不能过高或高低?
⑦有何杂质气体?如何除去?
⑧如何收集气体
醇的结构和性质
R C C R
H
H
H
O H
β α
分析结构
性质
断键部位
反应类型
反应产物
反应试剂 条件
取代反应
Na
羧酸
醇钠
酯
氧化反应
O2,Cu
醛、酮
①
②
③
④
①
①③
②
取代反应
氢卤酸
卤代烃
②④
消去反应
浓H2SO4
烯烃
①或②
取代反应
浓H2SO4
醚
'
醇的重要应用
醇的重要应用
(1)按分子中羟基的数目分:
一元醇 二元醇 多元醇
CH2=CHCH2-OH
一元醇
多元醇
饱和一元醇 (R-OH)
不饱和一元醇:
醇
通式:CnH2n+1OH (n≥1)
CH2-OH
CH2-OH
CH2-OH
CH-OH
CH2-OH
乙二醇
丙三醇
醇的分类
醇的重要应用
(2)按烃基是否饱和分:
(3)按烃基的种类分:
饱和醇 不饱和醇
脂肪醇 脂环醇 芳香醇
(4) 按与羟基相接的碳原子的级数分:
CH3CH2OH
CH3CHCH3
OH
C(CH3)3-OH
伯醇 RCH2OH
仲醇 R2CHOH
叔醇 R3COH
1 醇(伯醇) 2 醇(仲醇) 3 醇(叔醇)
醇的重要应用
是组成最简单的一元醇,也称木醇。
无色、具有挥发性的液体,沸点65℃左右。有毒。
重要的化工原料,也可用作燃料。
CH3OH
甲醇
醇的重要应用
无色、无臭、具有甜味的黏稠液体。熔点-16℃ ,沸点197℃ 。能与水以任意比例互溶。是汽车防冻液的主要成分、合成涤纶的主要原料。
CH2
CH2
OH
OH
乙二醇
醇的重要应用
俗称甘油,无色、无臭、具有甜味的黏稠液体。沸点290℃ 。能与水以任意比例互溶,具有很强的吸水能力。主要用于制造日用化妆品和三硝酸甘油酯。
丙三醇
CH2
CH
CH2
OH
OH
OH
下列关于乙醇、乙二醇、丙三醇的说法不正确的是( )A.均易溶于水,且丙三醇可作护肤剂,乙二醇可作汽车发动机的抗冻剂B.均能被催化氧化成醛,也能脱水生成醚C.均能发生酯化反应,丙三醇与硝酸反应的产物可以作炸药D.若与足量的钠反应产生的氢气相等时,消耗三者的物质的量之比为3∶2∶1
D
氧气
金属钠
氢卤酸
羧酸
浓硫酸
浓硫酸
第1课 醇
第1课 醇和酚
第1课时:醇
第四单元
醇的结构和性质
01
醇的重要应用
02
醇的结构和性质
醇的结构和性质
即:羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
2、官能团
名称:羟基 符号:—OH
1、概念
CH3CH2OH
CH2OH
CH3CHCH3
OH
烃分子中饱和碳原子上的氢原子被羟基取代所形成的化合物称为醇。
醇的结构和性质
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH或C2H5OH
结构简式:
空间填充模型
球棍模型
乙醇
醇的结构和性质
醇的化学性质主要由羟基所决定,醇分子氧原子吸引电子的能力比氢原子和碳原子强,①O-H键和②C-O键的电子对都向氧原子偏移,因而,醇在起反应时,①O-H键和②C-O键容易断裂。
④
⑤
②
③
①
①
⑤
①
③
H—C—C—O—H
H H
H H
②
④
醇的结构和性质
醇的结构和性质
比较Na与水及乙醇的反应
钠与水
钠与乙醇
钠是否浮在液面上
浮在水面
沉在液面下
钠的形状是否变化
熔成小球
仍是块状
有无声音
发出嘶嘶响声
没有声音
有无气泡
放出气泡
放出气泡
剧烈程度
剧烈
缓慢
化学方程式
2Na+2H2O=
2NaOH +H2↑
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
醇的结构和性质
【结论】
乙醇羟基上的氢原子比水中氢原子不活泼。
每2mol 羟基与足量的Na反应生成1mol H2
乙醇钠
断①号键
2CH3CH2O-H+2Na→2CH3CH2ONa+H2↑
置换反应
④
⑤
②
③
①
①
其它活泼金属如钾、钙等也可与乙醇反应产生H2。
醚不能跟钠反应。
醇的结构和性质
乙醇能够被氧化剂氧化。
①燃烧(淡蓝色火焰):
2CO2 +3H2O
C2H5OH +3 O2
点燃
醇的结构和性质
乙醇能够被氧化剂氧化。
②与强氧化剂反应:
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
重铬酸钾由橙色变为绿色检验酒驾
酸性高锰酸钾紫色褪去
醇的结构和性质
③催化氧化
(去氢):
④
⑤
②
③
①
①
醇的结构和性质
断①③号键
2Cu + O2 2CuO 红色变为黑色
△
CH3CH2OH + CuO CH3CHO+Cu+H2O
△
乙 醛
乙 醇
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
2CH3—C
Cu 或Ag
△
+ O2
+ 2 H2O
2CH3—C—H
O—H
H
O
H
乙醛
结构条件:α-C有H(α-H)
醇的结构和性质
实验现象:
Ⅱ中产生油状液体
CH3CH2Br
C2H5 OH + H Br C2H5Br + H2O
△
断②号键
④
⑤
②
③
①
①
醇不仅可以与氢溴酸反应,还可以与其他氢卤酸反应。
在反应中,醇分子中的羟基被卤素原子取代生成卤代烃:
R—OH+HX―→R—X+H2O
醇的结构和性质
乙醇的消去反应
醇的结构和性质
实验现象:
稀酸性高锰酸钾溶液褪色
生成了乙烯
1700C
浓H2SO4
H C C H H2O + CH2=CH2
H
H
H
OH
断②⑤号键
④
⑤
②
③
①
①
醇的结构和性质
在一定条件下,一个有机化合物分子内脱去一个或几个小分子生成不饱和化合物(含双键或三键)的反应。
消去反应
CH3-CH2-CH-CH3
OH
浓硫酸
△
浓硫酸
△
CH2-CH2-CH2-CH2
OH
OH
CH3-CH=CH-CH3
或CH3-CH2-CH=CH2
+H2O
CH2=CH-CH=CH2
+H2O
结构条件:β-C有H(β-H)
④
⑤
②
③
①
①
醇的结构和性质
断①②号键
分子间脱水:
CH3CH2-OH+H-O-CH2CH3 CH3CH2-O-CH2CH3
浓H2SO4
140 ℃
+H2O
温度适中使人着迷(醚)
温度过高使人窒息(制烯)
注意:
实验室制备的乙烯常含有有乙醚、乙醇蒸气、SO2、CO2及H2O
醚:分子由两个烃基通过氧原子连接而成的有机化合物。烃基可以是烷基、烯基、苯基等。醚常用作有机溶剂。
乙醚
醇的结构和性质
②浓硫酸的作用是什么
①放入几片碎
瓷片作用是
什么
③酒精与浓硫酸混合液如何配置(1:3)
④温度计的位置?
⑥混合液颜色如何变化?为什么?
⑤为何使液体温度迅速升到170℃,不能过高或高低?
⑦有何杂质气体?如何除去?
⑧如何收集气体
醇的结构和性质
R C C R
H
H
H
O H
β α
分析结构
性质
断键部位
反应类型
反应产物
反应试剂 条件
取代反应
Na
羧酸
醇钠
酯
氧化反应
O2,Cu
醛、酮
①
②
③
④
①
①③
②
取代反应
氢卤酸
卤代烃
②④
消去反应
浓H2SO4
烯烃
①或②
取代反应
浓H2SO4
醚
'
醇的重要应用
醇的重要应用
(1)按分子中羟基的数目分:
一元醇 二元醇 多元醇
CH2=CHCH2-OH
一元醇
多元醇
饱和一元醇 (R-OH)
不饱和一元醇:
醇
通式:CnH2n+1OH (n≥1)
CH2-OH
CH2-OH
CH2-OH
CH-OH
CH2-OH
乙二醇
丙三醇
醇的分类
醇的重要应用
(2)按烃基是否饱和分:
(3)按烃基的种类分:
饱和醇 不饱和醇
脂肪醇 脂环醇 芳香醇
(4) 按与羟基相接的碳原子的级数分:
CH3CH2OH
CH3CHCH3
OH
C(CH3)3-OH
伯醇 RCH2OH
仲醇 R2CHOH
叔醇 R3COH
1 醇(伯醇) 2 醇(仲醇) 3 醇(叔醇)
醇的重要应用
是组成最简单的一元醇,也称木醇。
无色、具有挥发性的液体,沸点65℃左右。有毒。
重要的化工原料,也可用作燃料。
CH3OH
甲醇
醇的重要应用
无色、无臭、具有甜味的黏稠液体。熔点-16℃ ,沸点197℃ 。能与水以任意比例互溶。是汽车防冻液的主要成分、合成涤纶的主要原料。
CH2
CH2
OH
OH
乙二醇
醇的重要应用
俗称甘油,无色、无臭、具有甜味的黏稠液体。沸点290℃ 。能与水以任意比例互溶,具有很强的吸水能力。主要用于制造日用化妆品和三硝酸甘油酯。
丙三醇
CH2
CH
CH2
OH
OH
OH
下列关于乙醇、乙二醇、丙三醇的说法不正确的是( )A.均易溶于水,且丙三醇可作护肤剂,乙二醇可作汽车发动机的抗冻剂B.均能被催化氧化成醛,也能脱水生成醚C.均能发生酯化反应,丙三醇与硝酸反应的产物可以作炸药D.若与足量的钠反应产生的氢气相等时,消耗三者的物质的量之比为3∶2∶1
D
氧气
金属钠
氢卤酸
羧酸
浓硫酸
浓硫酸
第1课 醇
同课章节目录
