5.2.4 铵盐-高一化学课件(共22张ppt)(人教版2019必修第二册)
文档属性
| 名称 | 5.2.4 铵盐-高一化学课件(共22张ppt)(人教版2019必修第二册) |  | |
| 格式 | pptx | ||
| 文件大小 | 26.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 09:11:21 | ||
图片预览






文档简介
第二节 氮及其化合物
铵盐和氨气的制法
一、铵盐
铵盐是由铵根离子(????????????+)和酸根离子组成的化合物,铵盐是农业上常用的氮肥。
?
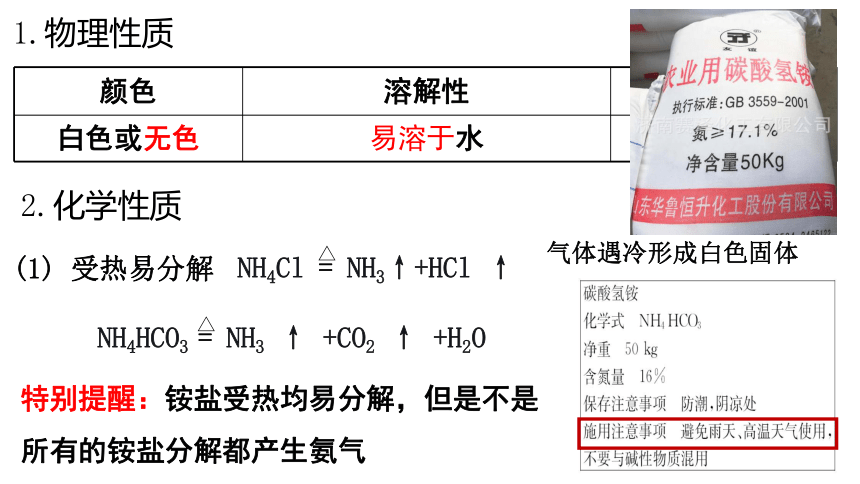
1.物理性质
颜色
溶解性
状态
白色或无色
易溶于水
晶体
2.化学性质
(1) 受热易分解
NH4Cl = NH3↑+HCl ↑
气体遇冷形成白色固体
NH4HCO3 = NH3 ↑ +CO2 ↑ +H2O
特别提醒:铵盐受热均易分解,但是不是所有的铵盐分解都产生氨气
(2)铵盐与碱反应
NH4Cl稀溶液与NaOH稀溶液混合的离子方程式:
NH4+ + OH- = NH3·H2O
NH4Cl溶液与NaOH浓溶液混合加热的离子方程式:
NH4+ + OH- ? NH3 ↑+ H2O
注意:NH4+与OH-离子在溶液中不能大量共存
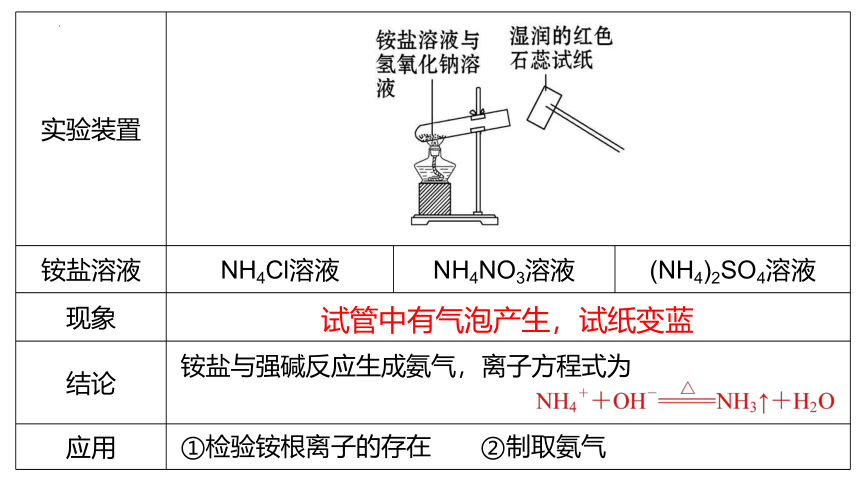
在实验室中,常利用铵盐与强碱反应产生氨这一性质来检验铵根离子的存在和制取氨。
{5940675A-B579-460E-94D1-54222C63F5DA}实验装置
铵盐溶液
NH4Cl溶液
NH4NO3溶液
(NH4)2SO4溶液
现象
结论
应用
试管中有气泡产生,试纸变蓝
铵盐与强碱反应生成氨气,离子方程式为
①检验铵根离子的存在
②制取氨气
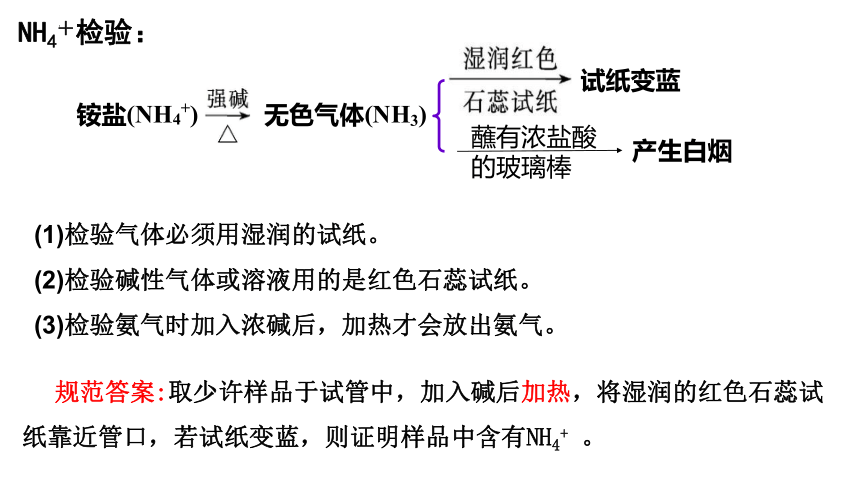
NH4+检验:
铵盐(NH4+)
无色气体(NH3)
试纸变蓝
蘸有浓盐酸
的玻璃棒
产生白烟
规范答案:取少许样品于试管中,加入碱后加热,将湿润的红色石蕊试纸靠近管口,若试纸变蓝,则证明样品中含有NH4+ 。
(1)检验气体必须用湿润的试纸。
(2)检验碱性气体或溶液用的是红色石蕊试纸。
(3)检验氨气时加入浓碱后,加热才会放出氨气。
4、铵盐的用途
生产氮肥;制炸药;氯化铵常用作制干电池的原料、除去金属表面的氧化物薄膜。
铵盐是农业上常用的化肥,铵态氮肥在使用和保存时应注意密封,低温保存,不与碱性物质混用。
(NH4)2SO4
NH4NO3
NH4HCO3
NH4Cl
CO(NH2)2
二、氨气的制法
【思考与讨论】
右图实验室制取氨的简易装置示意图。请仔细观察实验装置,思考如何检验试管中已收集满氨,如何吸收处理实验中多余的氮。
1. 氨气的实验室制法
(1) 原料:
NH4Cl与Ca(OH)2
(2) 原理:
2NH4Cl+Ca(OH)2 ? CaCl2+2NH3↑+2H2O
(3) 制取装置:
固固加热装置
与制氧气的装置相同
(4) 收集装置:
向下排空气法
(5) 棉花的作用:
减少与空气的对流,提高氨气的集气速度和纯度。
(6) 验满:
a. 将湿润的红色石蕊试纸置于试管口,试纸变蓝
b. 将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生
特别提示
(1)收集装置和反应装置的试管和导管必须是干燥的。
(2)发生装置的试管口略向下倾斜。
(3)由于氨气的密度比空气小,因此收集氨气时,导管口应插入试管的底部。
(4)棉花团上蘸有稀硫酸,既防止空气对流又防止氨气逸出污染空气。
(5)NH3极易溶于水,当NH3通入水溶液时要设计防倒吸装置。
(6)干燥NH3不能用P2O5、浓硫酸等酸性干燥剂,也不能用CaCl2干燥,原因是CaCl2与NH3反应生成CaCl2·8NH3。
其它实验室制取NH3的简易方法
{5940675A-B579-460E-94D1-54222C63F5DA}方法
化学方程式(或原理)
气体发生装置
加热浓氨水
NH3·H2O==NH3↑+H2O
浓氨水+固体NaOH
NaOH溶于水放热,促使NH3·H2O分解,且OH-浓度的增大也有利于NH3的生成
浓氨水+固体CaO
CaO与水反应生成OH-,使溶剂(水)减少;且反应放热,促使NH3·H2O分解。化学方程式:
NH3·H2O+CaO==NH3↑+Ca(OH)2
N2+3H2 2NH3
高温高压
催化剂
2. 氨气的工业制法
铵盐(NH4+)
物理性质
化学性质
不稳定,受热分解
与碱反应生成氨气
NH4+的检验
NH3的制取
原理
装置
收集
干燥
验满
尾气处理
课堂小结
1.判断正误(正确的打“√”,错误的打“×”)
(1)铵盐都易溶于水,且都易分解( )
(2)铵盐都不稳定,受热分解都生成NH3( )
(3)向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶液中一定无NH4+ ( )
(4)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl( )
(5)NH4HCO3受热易分解,因而可用作氮肥( )
(6)NH4HCO3与足量NaOH溶液共热时,发生反应的离子方程式为NH4++OH-=====NH3↑+H2O( )
△
×
×
×
×
×
√
(7)某同学根据铵盐受热分解的性质,认为可以采用加热NH4Cl分解的方法来制取氨( )
(8)由于氨极易溶于水,所以不能用排水法收集氨,只能用向下排空气法收集( )
(9)由于氨极易溶于水,所以多余的氨可以用导管直接插入水中进行吸收
( )
(10)氨可以用浓硫酸来进行干燥( )
(11)为加快产生NH3的速率,实验室可以用NaOH固体和NH4Cl固体反应制NH3( )
×
×
×
×
√
2.关于铵盐的叙述:①绝大多数铵盐易溶于水;②铵盐中氮元素均为-3价;③铵盐受热易分解;④铵盐都只能跟碱反应,不能跟酸反应;⑤铵态氮肥不宜跟碱性物质如草木灰混合施用。其中正确的是
A.①②③④⑤ B.③④⑤ C.①③⑤ D.①②④
C
解析:①绝大数铵盐易溶于水,故①正确;②铵盐中氮元素不一定都是-3价,如NH4NO3,氮元素化合价为-3、+5价,故②错误;③铵盐不稳定,受热易分解,故③正确;④铵盐都能与碱反应,部分铵盐也能与酸反应,如NH4HCO3、(NH4)2CO3等弱酸铵盐,故④错误;⑤铵态氮肥不能与草木灰混合使用,发生双水解反应,造成N元素的损失,故⑤正确;综上所述,①③⑤正确,即选项C正确;
3.关于实验室制取NH3的下列说法,正确的是
A.用N2和H2作反应物 B.用Ca(OH)2和NH4Cl作反应物
C.用向上排空气法收集 D.用湿润的蓝色石蕊试纸检验试管是否充满气体
B
解析:A.用N2和H2作反应物,在高温、高压、催化剂条件下合成氨气,反应条件实验室不具备,因此不能用于实验室中制取NH3,A错误;
B.用Ca(OH)2和NH4Cl作反应物在加热条件下发生反应产生NH3、CaCl2、H2O,该方法可以用于实验室制取NH3,B正确;
C.NH3的密度比空气小,应该使用向下排空气的方法收集,C错误;
D.NH3的水溶液显碱性,应该用湿润的红色石蕊试纸检验试管是否充满气体,若氨气收集满了,则湿润的红色石蕊试纸会变为蓝色,D错误。
C
4.下列物质的性质与用途对应关系正确的是
A.氯化铵易分解,可用来制取氨气
B.碳酸氢铵易溶于水,可用作氮肥
C.氨易液化,可用来做制冷剂
D.铁与浓硝酸不反应,可用铁槽车贮运硝酸
解析:A.氯化铵受热分解生成的氨气和HCl遇冷会重新化合成氯化铵,不能用氯化铵分解制取氨气,A错误;B.碳酸氢铵中含氮元素,可用作氮肥,B错误;C.氨易液化,液氨汽化时会吸收大量的热,使周围温度迅速降低,可用来做制冷剂,C正确;
D.常温下Fe与浓硝酸发生钝化,在表面生成一层致密的氧化物薄膜,对内部金属起保护作用,可用铁槽车贮运浓硝酸,D错误。
5.能将NH4Cl 、(NH4)2SO4、NaCl、 Na2SO4四种溶液一一区别开来的试剂是( )A NaOH B AgNO3 C BaCl2 D Ba(OH)2
D
解析:A.向Na2SO4 、NaCl、(NH4)2SO4、NH4Cl四种溶液分别滴加NaOH溶液并加热,分别观察到的现象为:无明显现象、无明显现象、产生刺激性气味的气体和产生刺激性气味的气体,物无法区别,A不合题意;B.向Na2SO4 、NaCl、(NH4)2SO4、NH4Cl四种溶液分别滴加AgNO3溶液,观察到的现象都是产生白色沉淀,无法区别,B不合题意;C.向Na2SO4 、NaCl、(NH4)2SO4、NH4Cl四种溶液分别滴加BaCl2溶液,观察到的现象分别为产生白色沉淀、无明显现象、产生白色沉淀和无明显现象,无法区别,C不合题意;D.向Na2SO4 、NaCl、(NH4)2SO4、NH4Cl四种溶液分别滴加Ba(OH)2溶液并加热,观察到的现象分别为:产生白色沉淀、无明显现象、产生白色沉淀并放出刺激性气味的气体和产生刺激性气味的气体,故可以区别,D符合题意。
6、下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
A. ①② B. ②③ C. ①③ D. ③④
C
知识巩固
铵盐和氨气的制法
一、铵盐
铵盐是由铵根离子(????????????+)和酸根离子组成的化合物,铵盐是农业上常用的氮肥。
?
1.物理性质
颜色
溶解性
状态
白色或无色
易溶于水
晶体
2.化学性质
(1) 受热易分解
NH4Cl = NH3↑+HCl ↑
气体遇冷形成白色固体
NH4HCO3 = NH3 ↑ +CO2 ↑ +H2O
特别提醒:铵盐受热均易分解,但是不是所有的铵盐分解都产生氨气
(2)铵盐与碱反应
NH4Cl稀溶液与NaOH稀溶液混合的离子方程式:
NH4+ + OH- = NH3·H2O
NH4Cl溶液与NaOH浓溶液混合加热的离子方程式:
NH4+ + OH- ? NH3 ↑+ H2O
注意:NH4+与OH-离子在溶液中不能大量共存
在实验室中,常利用铵盐与强碱反应产生氨这一性质来检验铵根离子的存在和制取氨。
{5940675A-B579-460E-94D1-54222C63F5DA}实验装置
铵盐溶液
NH4Cl溶液
NH4NO3溶液
(NH4)2SO4溶液
现象
结论
应用
试管中有气泡产生,试纸变蓝
铵盐与强碱反应生成氨气,离子方程式为
①检验铵根离子的存在
②制取氨气
NH4+检验:
铵盐(NH4+)
无色气体(NH3)
试纸变蓝
蘸有浓盐酸
的玻璃棒
产生白烟
规范答案:取少许样品于试管中,加入碱后加热,将湿润的红色石蕊试纸靠近管口,若试纸变蓝,则证明样品中含有NH4+ 。
(1)检验气体必须用湿润的试纸。
(2)检验碱性气体或溶液用的是红色石蕊试纸。
(3)检验氨气时加入浓碱后,加热才会放出氨气。
4、铵盐的用途
生产氮肥;制炸药;氯化铵常用作制干电池的原料、除去金属表面的氧化物薄膜。
铵盐是农业上常用的化肥,铵态氮肥在使用和保存时应注意密封,低温保存,不与碱性物质混用。
(NH4)2SO4
NH4NO3
NH4HCO3
NH4Cl
CO(NH2)2
二、氨气的制法
【思考与讨论】
右图实验室制取氨的简易装置示意图。请仔细观察实验装置,思考如何检验试管中已收集满氨,如何吸收处理实验中多余的氮。
1. 氨气的实验室制法
(1) 原料:
NH4Cl与Ca(OH)2
(2) 原理:
2NH4Cl+Ca(OH)2 ? CaCl2+2NH3↑+2H2O
(3) 制取装置:
固固加热装置
与制氧气的装置相同
(4) 收集装置:
向下排空气法
(5) 棉花的作用:
减少与空气的对流,提高氨气的集气速度和纯度。
(6) 验满:
a. 将湿润的红色石蕊试纸置于试管口,试纸变蓝
b. 将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生
特别提示
(1)收集装置和反应装置的试管和导管必须是干燥的。
(2)发生装置的试管口略向下倾斜。
(3)由于氨气的密度比空气小,因此收集氨气时,导管口应插入试管的底部。
(4)棉花团上蘸有稀硫酸,既防止空气对流又防止氨气逸出污染空气。
(5)NH3极易溶于水,当NH3通入水溶液时要设计防倒吸装置。
(6)干燥NH3不能用P2O5、浓硫酸等酸性干燥剂,也不能用CaCl2干燥,原因是CaCl2与NH3反应生成CaCl2·8NH3。
其它实验室制取NH3的简易方法
{5940675A-B579-460E-94D1-54222C63F5DA}方法
化学方程式(或原理)
气体发生装置
加热浓氨水
NH3·H2O==NH3↑+H2O
浓氨水+固体NaOH
NaOH溶于水放热,促使NH3·H2O分解,且OH-浓度的增大也有利于NH3的生成
浓氨水+固体CaO
CaO与水反应生成OH-,使溶剂(水)减少;且反应放热,促使NH3·H2O分解。化学方程式:
NH3·H2O+CaO==NH3↑+Ca(OH)2
N2+3H2 2NH3
高温高压
催化剂
2. 氨气的工业制法
铵盐(NH4+)
物理性质
化学性质
不稳定,受热分解
与碱反应生成氨气
NH4+的检验
NH3的制取
原理
装置
收集
干燥
验满
尾气处理
课堂小结
1.判断正误(正确的打“√”,错误的打“×”)
(1)铵盐都易溶于水,且都易分解( )
(2)铵盐都不稳定,受热分解都生成NH3( )
(3)向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶液中一定无NH4+ ( )
(4)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl( )
(5)NH4HCO3受热易分解,因而可用作氮肥( )
(6)NH4HCO3与足量NaOH溶液共热时,发生反应的离子方程式为NH4++OH-=====NH3↑+H2O( )
△
×
×
×
×
×
√
(7)某同学根据铵盐受热分解的性质,认为可以采用加热NH4Cl分解的方法来制取氨( )
(8)由于氨极易溶于水,所以不能用排水法收集氨,只能用向下排空气法收集( )
(9)由于氨极易溶于水,所以多余的氨可以用导管直接插入水中进行吸收
( )
(10)氨可以用浓硫酸来进行干燥( )
(11)为加快产生NH3的速率,实验室可以用NaOH固体和NH4Cl固体反应制NH3( )
×
×
×
×
√
2.关于铵盐的叙述:①绝大多数铵盐易溶于水;②铵盐中氮元素均为-3价;③铵盐受热易分解;④铵盐都只能跟碱反应,不能跟酸反应;⑤铵态氮肥不宜跟碱性物质如草木灰混合施用。其中正确的是
A.①②③④⑤ B.③④⑤ C.①③⑤ D.①②④
C
解析:①绝大数铵盐易溶于水,故①正确;②铵盐中氮元素不一定都是-3价,如NH4NO3,氮元素化合价为-3、+5价,故②错误;③铵盐不稳定,受热易分解,故③正确;④铵盐都能与碱反应,部分铵盐也能与酸反应,如NH4HCO3、(NH4)2CO3等弱酸铵盐,故④错误;⑤铵态氮肥不能与草木灰混合使用,发生双水解反应,造成N元素的损失,故⑤正确;综上所述,①③⑤正确,即选项C正确;
3.关于实验室制取NH3的下列说法,正确的是
A.用N2和H2作反应物 B.用Ca(OH)2和NH4Cl作反应物
C.用向上排空气法收集 D.用湿润的蓝色石蕊试纸检验试管是否充满气体
B
解析:A.用N2和H2作反应物,在高温、高压、催化剂条件下合成氨气,反应条件实验室不具备,因此不能用于实验室中制取NH3,A错误;
B.用Ca(OH)2和NH4Cl作反应物在加热条件下发生反应产生NH3、CaCl2、H2O,该方法可以用于实验室制取NH3,B正确;
C.NH3的密度比空气小,应该使用向下排空气的方法收集,C错误;
D.NH3的水溶液显碱性,应该用湿润的红色石蕊试纸检验试管是否充满气体,若氨气收集满了,则湿润的红色石蕊试纸会变为蓝色,D错误。
C
4.下列物质的性质与用途对应关系正确的是
A.氯化铵易分解,可用来制取氨气
B.碳酸氢铵易溶于水,可用作氮肥
C.氨易液化,可用来做制冷剂
D.铁与浓硝酸不反应,可用铁槽车贮运硝酸
解析:A.氯化铵受热分解生成的氨气和HCl遇冷会重新化合成氯化铵,不能用氯化铵分解制取氨气,A错误;B.碳酸氢铵中含氮元素,可用作氮肥,B错误;C.氨易液化,液氨汽化时会吸收大量的热,使周围温度迅速降低,可用来做制冷剂,C正确;
D.常温下Fe与浓硝酸发生钝化,在表面生成一层致密的氧化物薄膜,对内部金属起保护作用,可用铁槽车贮运浓硝酸,D错误。
5.能将NH4Cl 、(NH4)2SO4、NaCl、 Na2SO4四种溶液一一区别开来的试剂是( )A NaOH B AgNO3 C BaCl2 D Ba(OH)2
D
解析:A.向Na2SO4 、NaCl、(NH4)2SO4、NH4Cl四种溶液分别滴加NaOH溶液并加热,分别观察到的现象为:无明显现象、无明显现象、产生刺激性气味的气体和产生刺激性气味的气体,物无法区别,A不合题意;B.向Na2SO4 、NaCl、(NH4)2SO4、NH4Cl四种溶液分别滴加AgNO3溶液,观察到的现象都是产生白色沉淀,无法区别,B不合题意;C.向Na2SO4 、NaCl、(NH4)2SO4、NH4Cl四种溶液分别滴加BaCl2溶液,观察到的现象分别为产生白色沉淀、无明显现象、产生白色沉淀和无明显现象,无法区别,C不合题意;D.向Na2SO4 、NaCl、(NH4)2SO4、NH4Cl四种溶液分别滴加Ba(OH)2溶液并加热,观察到的现象分别为:产生白色沉淀、无明显现象、产生白色沉淀并放出刺激性气味的气体和产生刺激性气味的气体,故可以区别,D符合题意。
6、下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
A. ①② B. ②③ C. ①③ D. ③④
C
知识巩固
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
