5.2.1 氮气和氮的固定-高一化学课件(共26张PPT)(人教版2019必修第二册)
文档属性
| 名称 | 5.2.1 氮气和氮的固定-高一化学课件(共26张PPT)(人教版2019必修第二册) |  | |
| 格式 | pptx | ||
| 文件大小 | 66.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 09:13:09 | ||
图片预览






文档简介
(共26张PPT)
第二节 氮及其化合物
第二节 氮及其化合物
氮气和氮的固定
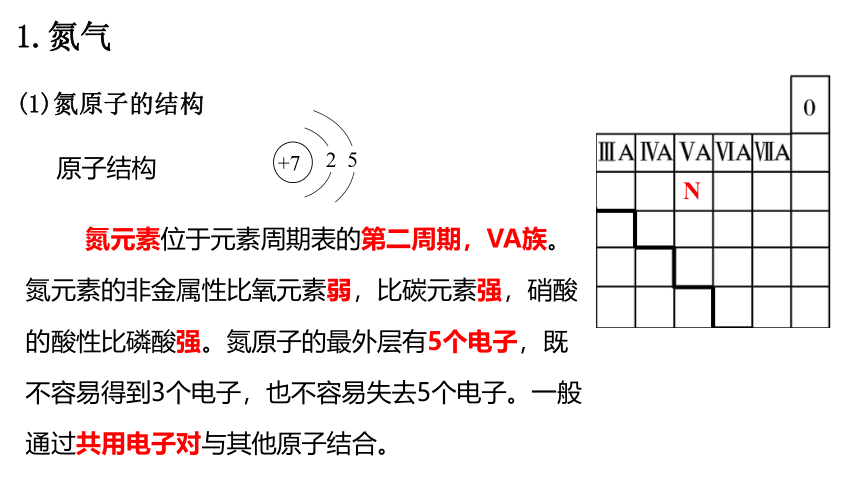
N
原子结构
+7
2
5
氮元素位于元素周期表的第二周期,VA族。氮元素的非金属性比氧元素弱,比碳元素强,硝酸的酸性比磷酸强。氮原子的最外层有5个电子,既不容易得到3个电子,也不容易失去5个电子。一般通过共用电子对与其他原子结合。
1.氮气
(1)氮原子的结构
(2)氮元素在自然界中的存在:
自然界中,氮元素主要以氮气的形式存在于空气中。
游离态:以氮分子(N2)的形式存在于空气中。
化合态:存在于土壤、海洋里的硝酸盐和铵盐中及动植物体内的蛋白质中。
空气中氮气的体积分数约为78%
(3)氮气的物理性质
颜色 状态 气味 密度 溶解性
无色 气体 无味 密度与空气接近 难溶于水
收集氮气时用排水法不用排空法
常温下无色、无味的气体有:H2、O2、N2、CO、CO2、NO、CH4。
直接排入空气的有: O2、N2、CO2
难溶于水的有 : O2、N2、H2、CO、NO、CH4。
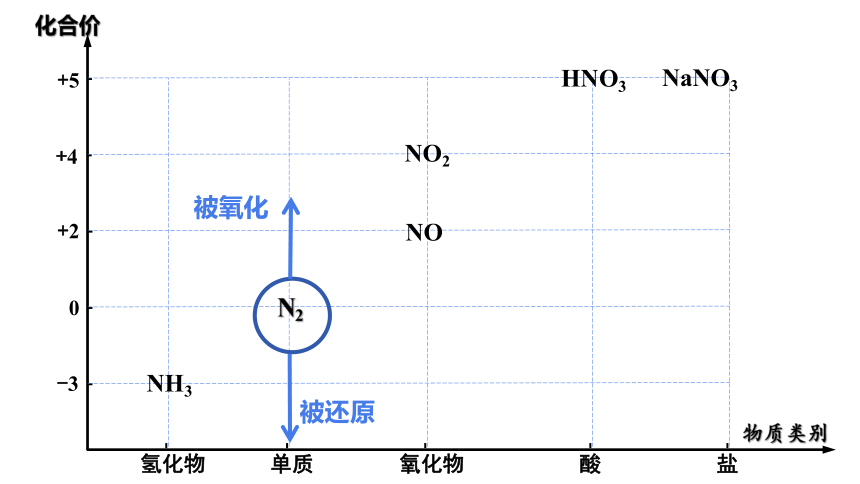
物质类别
化合价
氢化物
单质
氧化物
酸
盐
-3
0
+2
+5
+4
N2
HNO3
NO
NO2
NH3
NaNO3
被氧化
被还原
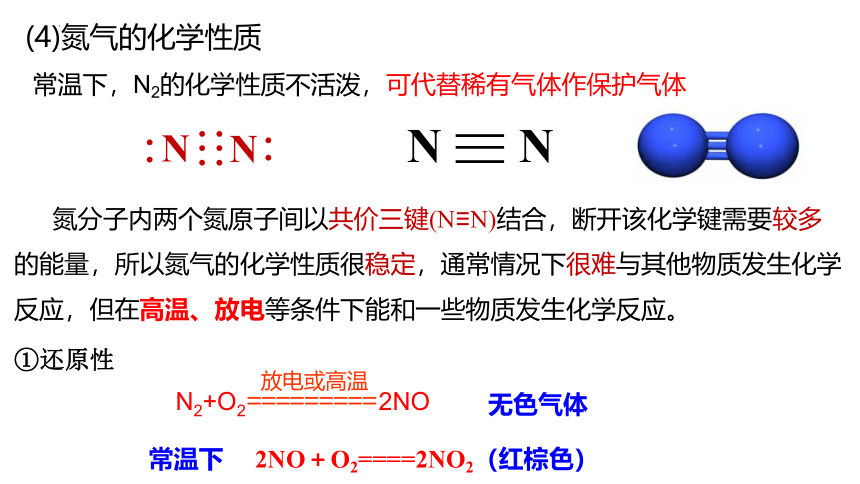
(4)氮气的化学性质
氮分子内两个氮原子间以共价三键(N≡N)结合,断开该化学键需要较多的能量,所以氮气的化学性质很稳定,通常情况下很难与其他物质发生化学反应,但在高温、放电等条件下能和一些物质发生化学反应。
①还原性
放电或高温
=========
N2+O2 2NO
无色气体
常温下 2NO+O2====2NO2(红棕色)
常温下,N2的化学性质不活泼,可代替稀有气体作保护气体
N
N
N
N
②氧化性
a.N2与H2反应生成NH3
高温、高压
催化剂
N2+3H2 2NH3
b.在点燃条件下与金属镁反应
(工业合成氨)
点燃
N2+3Mg Mg3N2
====
思考:镁在空气中燃烧现象?反应有哪些?
据说在新疆与青海两省区交界处有一狭长山谷,这里经常在风和日丽的晴天顷刻电闪雷鸣,下起雷雨,奇怪的是这里牧草茂盛,四季常青,被当地牧民称为“魔鬼谷”。为什么魔鬼谷牧草旺盛
有句谚语“雷雨发庄稼”,
你明白其中的化学道理吗
现在你可以解释魔鬼谷草木茂盛的原因吗?
N2 + O2 =========== 2NO
放电或高温
2NO + O2 == 2NO2
3NO2 + H2O == 2HNO3 + NO
硝酸与土壤中矿物质作用形成可溶性硝酸盐,成为氮肥被植物吸收 .
氮元素是一切动植物的生长都需要的营养元素。大气中含有大量的氮气,但是不能被多数生物直接吸收,多数生物只能吸收含氮元素的化合物。
将空气中游离的氮转变为氮的化合物的方法叫做氮的固定。
氮的固定
概念:将大气中游离态的氮转化为氮的化合物的过程
分类
自然固氮
高能固氮(如雷雨天气N2转化为NO)
生物固氮(如豆科植物的根瘤菌固氮)
人工固氮
合成氨(工业上合成氨)
仿生固氮(某些金属有机化合物可起到根瘤菌的作用)
2. 氮的固定
3.自然界中氮的循环
自然循环
自然界中氮的循环
人类活动的影响
(1)通过化学方法把空气中的氮气转化成氨,再转化成其他含氮化合物(如铵盐、硝酸等)。
(2)燃烧反应产生的氮氧化物参与氮的循环。
空气(气态)
空气(液态)
低温 加压
N2(气态)沸点-196
O2(液态)沸点-183
4. 氮的制备和用途
(1) 工业制氮气
工业上由液态空气分馏来获得纯度为99%的氮气
(2) 氮气的用途:
(1)合成氨气
(2)惰性保护气:
瓜果、食品、粮仓、灯泡等填充气
(3)冷冻剂:
速冻和食品运输、低温超导、低温麻醉、低温保存生物组织等
1.判断正误(正确的打“√”,错误的打“×”)
(1)氮元素有多种化合价,其最高正价为+5价( )
(2)氮原子与其他原子只能形成共价键,不能形成离子键( )
(3)氮气常用作焊接金属、填充灯泡、保存食品的保护气( )
(4)氮的固定中氮元素一定被氧化( )
(5)豆科植物的根瘤菌固氮属于自然固氮中的高能固氮( )
(6)工业上将NH3转化为其他铵态化肥属于人工固氮( )
√
√
×
×
×
×
(7)N2和O2在放电条件下会生成NO2( )
(8)N2中N元素价态为0价,处于中间价态,因此既有氧化性,又有还原性
( )
(9)空气中N2的体积分数约为78%。( )
(10)N2在高温条件下与O2发生燃烧生成NO。( )
(11)豆科植物通过根瘤菌吸收空气中的氮属于氮的固定,是化学变化( )
√
√
√
×
×
2.下列叙述中与氮的固定无关的是( )
A.工业合成氨
B.工业上将氨转化成硝酸和其他氮的氧化物
C.豆科植物的根瘤菌吸收空气中的氮气使之转化成植物蛋白质
D.电闪雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收
解析:氮的固定过程是使游离态的氮转化为化合态的氮,B项,NH3转化为HNO3不符合要求。
B
3.下列有关氮气的说法正确的是( )
A.氮气是由氮原子构成的双原子分子,所以化学性质不活泼
B.医学上常用液氮做冷冻剂,在冷冻麻醉条件下做手术,是利用氮气化学性质的不活泼性
C.H2与N2在一定条件下反应生成NH3,反应中N2体现氧化性
D.电闪雷鸣的雨天,雨水中会含有一定量的硝酸,其中可能发生的反应有N2+2O2 2NO2
C
解析:A项,氮气性质稳定的原因是两个氮原子之间的作用力比较强,破坏这种作用力时需要很高的能量;B项,液氮汽化时需要吸收大量的能量,使周围环境温度降低,与其化学性质的不活泼无关;C项,反应的化学方程式为
N2+3H2 2NH3,反应中氮元素化合价降低,氮气做氧化剂;D项,N2和O2在放电条件下生成NO,不能直接生成NO2。
4.下列关于氮气性质的说法中,错误的是( )
A.通常情况下,氮气性质很不活泼
B.可在氧气中燃烧,生成一氧化氮
C.通常情况下,氮气在水中的溶解度很小
D.跟氢气在一定条件下发生反应时,氮气是氧化剂
解析:N2不能在O2中燃烧,与O2在放电条件下反应生成NO,B错;氮气与氢气反应时,氮元素的化合价降低,氮气做氧化剂,D对。
B
5.下列属于人工固氮的化学反应是( )
A.N2与H2在一定条件下合成NH3
B.NO与O2反应生成NO2
C.NH3被O2氧化成NO和H2O
D.由NH3制备化肥NH4HCO3
解析:固氮的方式有自然固氮和人工固氮,工业合成氨为人工固氮,雷雨天气产生NO气体属于自然固氮。另外,豆科植物的根瘤菌能将空气中的氮气直接转化为植物体内的蛋白质,也属于自然固氮。
A
6.下列有关氮气的叙述中,错误的是( )
A.工业上,氮气常用作焊接金属的保护气
B.在雷雨天,空气中的N2和O2可反应生成NO
C.氮气既可做氧化剂又可做还原剂
D.向某容器中充入1 mol N2可与3 mol H2完全反应生成2 mol NH3
解析:N2与H2的反应属于可逆反应,1 mol N2和3 mol H2不可能完全反应生成2 mol NH3,故D项错误;因氮气的化学性质很不活泼,常用作焊接金属的保护气;N2中的氮元素为0价,处于中间价态,故N2既可做氧化剂,又可做还原剂。
D
1909年,德国化学家哈伯经过反复的实验研究后发现,在500~600℃、17.5~20.0MPa和锇为催化剂的条件下,反应后氨的含量可达到6%以上,具备了工业化生产的可能性。
哈伯
(F.Haber,1868-1934)
为了把哈伯合成氨的实验室方法转化为规模化的工业生产,德国工程师博施作出了重要贡献。由于合成氨工业生产的实现和相关研究对化学理论与技术发展的推动,哈伯和博施都获得了诺贝尔化学奖。
合成氨是人类科学技术发展史上的一项重大成就,为促进世界农业发展做出了重大贡献。
人 工 固 氮
合 成 氨
科学史话
第二节 氮及其化合物
第二节 氮及其化合物
氮气和氮的固定
N
原子结构
+7
2
5
氮元素位于元素周期表的第二周期,VA族。氮元素的非金属性比氧元素弱,比碳元素强,硝酸的酸性比磷酸强。氮原子的最外层有5个电子,既不容易得到3个电子,也不容易失去5个电子。一般通过共用电子对与其他原子结合。
1.氮气
(1)氮原子的结构
(2)氮元素在自然界中的存在:
自然界中,氮元素主要以氮气的形式存在于空气中。
游离态:以氮分子(N2)的形式存在于空气中。
化合态:存在于土壤、海洋里的硝酸盐和铵盐中及动植物体内的蛋白质中。
空气中氮气的体积分数约为78%
(3)氮气的物理性质
颜色 状态 气味 密度 溶解性
无色 气体 无味 密度与空气接近 难溶于水
收集氮气时用排水法不用排空法
常温下无色、无味的气体有:H2、O2、N2、CO、CO2、NO、CH4。
直接排入空气的有: O2、N2、CO2
难溶于水的有 : O2、N2、H2、CO、NO、CH4。
物质类别
化合价
氢化物
单质
氧化物
酸
盐
-3
0
+2
+5
+4
N2
HNO3
NO
NO2
NH3
NaNO3
被氧化
被还原
(4)氮气的化学性质
氮分子内两个氮原子间以共价三键(N≡N)结合,断开该化学键需要较多的能量,所以氮气的化学性质很稳定,通常情况下很难与其他物质发生化学反应,但在高温、放电等条件下能和一些物质发生化学反应。
①还原性
放电或高温
=========
N2+O2 2NO
无色气体
常温下 2NO+O2====2NO2(红棕色)
常温下,N2的化学性质不活泼,可代替稀有气体作保护气体
N
N
N
N
②氧化性
a.N2与H2反应生成NH3
高温、高压
催化剂
N2+3H2 2NH3
b.在点燃条件下与金属镁反应
(工业合成氨)
点燃
N2+3Mg Mg3N2
====
思考:镁在空气中燃烧现象?反应有哪些?
据说在新疆与青海两省区交界处有一狭长山谷,这里经常在风和日丽的晴天顷刻电闪雷鸣,下起雷雨,奇怪的是这里牧草茂盛,四季常青,被当地牧民称为“魔鬼谷”。为什么魔鬼谷牧草旺盛
有句谚语“雷雨发庄稼”,
你明白其中的化学道理吗
现在你可以解释魔鬼谷草木茂盛的原因吗?
N2 + O2 =========== 2NO
放电或高温
2NO + O2 == 2NO2
3NO2 + H2O == 2HNO3 + NO
硝酸与土壤中矿物质作用形成可溶性硝酸盐,成为氮肥被植物吸收 .
氮元素是一切动植物的生长都需要的营养元素。大气中含有大量的氮气,但是不能被多数生物直接吸收,多数生物只能吸收含氮元素的化合物。
将空气中游离的氮转变为氮的化合物的方法叫做氮的固定。
氮的固定
概念:将大气中游离态的氮转化为氮的化合物的过程
分类
自然固氮
高能固氮(如雷雨天气N2转化为NO)
生物固氮(如豆科植物的根瘤菌固氮)
人工固氮
合成氨(工业上合成氨)
仿生固氮(某些金属有机化合物可起到根瘤菌的作用)
2. 氮的固定
3.自然界中氮的循环
自然循环
自然界中氮的循环
人类活动的影响
(1)通过化学方法把空气中的氮气转化成氨,再转化成其他含氮化合物(如铵盐、硝酸等)。
(2)燃烧反应产生的氮氧化物参与氮的循环。
空气(气态)
空气(液态)
低温 加压
N2(气态)沸点-196
O2(液态)沸点-183
4. 氮的制备和用途
(1) 工业制氮气
工业上由液态空气分馏来获得纯度为99%的氮气
(2) 氮气的用途:
(1)合成氨气
(2)惰性保护气:
瓜果、食品、粮仓、灯泡等填充气
(3)冷冻剂:
速冻和食品运输、低温超导、低温麻醉、低温保存生物组织等
1.判断正误(正确的打“√”,错误的打“×”)
(1)氮元素有多种化合价,其最高正价为+5价( )
(2)氮原子与其他原子只能形成共价键,不能形成离子键( )
(3)氮气常用作焊接金属、填充灯泡、保存食品的保护气( )
(4)氮的固定中氮元素一定被氧化( )
(5)豆科植物的根瘤菌固氮属于自然固氮中的高能固氮( )
(6)工业上将NH3转化为其他铵态化肥属于人工固氮( )
√
√
×
×
×
×
(7)N2和O2在放电条件下会生成NO2( )
(8)N2中N元素价态为0价,处于中间价态,因此既有氧化性,又有还原性
( )
(9)空气中N2的体积分数约为78%。( )
(10)N2在高温条件下与O2发生燃烧生成NO。( )
(11)豆科植物通过根瘤菌吸收空气中的氮属于氮的固定,是化学变化( )
√
√
√
×
×
2.下列叙述中与氮的固定无关的是( )
A.工业合成氨
B.工业上将氨转化成硝酸和其他氮的氧化物
C.豆科植物的根瘤菌吸收空气中的氮气使之转化成植物蛋白质
D.电闪雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收
解析:氮的固定过程是使游离态的氮转化为化合态的氮,B项,NH3转化为HNO3不符合要求。
B
3.下列有关氮气的说法正确的是( )
A.氮气是由氮原子构成的双原子分子,所以化学性质不活泼
B.医学上常用液氮做冷冻剂,在冷冻麻醉条件下做手术,是利用氮气化学性质的不活泼性
C.H2与N2在一定条件下反应生成NH3,反应中N2体现氧化性
D.电闪雷鸣的雨天,雨水中会含有一定量的硝酸,其中可能发生的反应有N2+2O2 2NO2
C
解析:A项,氮气性质稳定的原因是两个氮原子之间的作用力比较强,破坏这种作用力时需要很高的能量;B项,液氮汽化时需要吸收大量的能量,使周围环境温度降低,与其化学性质的不活泼无关;C项,反应的化学方程式为
N2+3H2 2NH3,反应中氮元素化合价降低,氮气做氧化剂;D项,N2和O2在放电条件下生成NO,不能直接生成NO2。
4.下列关于氮气性质的说法中,错误的是( )
A.通常情况下,氮气性质很不活泼
B.可在氧气中燃烧,生成一氧化氮
C.通常情况下,氮气在水中的溶解度很小
D.跟氢气在一定条件下发生反应时,氮气是氧化剂
解析:N2不能在O2中燃烧,与O2在放电条件下反应生成NO,B错;氮气与氢气反应时,氮元素的化合价降低,氮气做氧化剂,D对。
B
5.下列属于人工固氮的化学反应是( )
A.N2与H2在一定条件下合成NH3
B.NO与O2反应生成NO2
C.NH3被O2氧化成NO和H2O
D.由NH3制备化肥NH4HCO3
解析:固氮的方式有自然固氮和人工固氮,工业合成氨为人工固氮,雷雨天气产生NO气体属于自然固氮。另外,豆科植物的根瘤菌能将空气中的氮气直接转化为植物体内的蛋白质,也属于自然固氮。
A
6.下列有关氮气的叙述中,错误的是( )
A.工业上,氮气常用作焊接金属的保护气
B.在雷雨天,空气中的N2和O2可反应生成NO
C.氮气既可做氧化剂又可做还原剂
D.向某容器中充入1 mol N2可与3 mol H2完全反应生成2 mol NH3
解析:N2与H2的反应属于可逆反应,1 mol N2和3 mol H2不可能完全反应生成2 mol NH3,故D项错误;因氮气的化学性质很不活泼,常用作焊接金属的保护气;N2中的氮元素为0价,处于中间价态,故N2既可做氧化剂,又可做还原剂。
D
1909年,德国化学家哈伯经过反复的实验研究后发现,在500~600℃、17.5~20.0MPa和锇为催化剂的条件下,反应后氨的含量可达到6%以上,具备了工业化生产的可能性。
哈伯
(F.Haber,1868-1934)
为了把哈伯合成氨的实验室方法转化为规模化的工业生产,德国工程师博施作出了重要贡献。由于合成氨工业生产的实现和相关研究对化学理论与技术发展的推动,哈伯和博施都获得了诺贝尔化学奖。
合成氨是人类科学技术发展史上的一项重大成就,为促进世界农业发展做出了重大贡献。
人 工 固 氮
合 成 氨
科学史话
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
