化学人教版(2019)必修第二册5.1.2 硫酸(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.1.2 硫酸(共20张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 24.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 09:22:19 | ||
图片预览








文档简介
(共20张PPT)
高中化学必修第二册
第1节 硫及其化合物
第五章化工生产中的重要非金属元素
(2)硫酸
学习目标
1、通过实验探究浓硫酸的吸水性、脱水性和强氧化性,。
2、能运用氧化还原反应知识理解浓硫酸的氧化性。
3、认识硫酸在相关反应中体现的性质。
新课导入
在上一节课中,我们主要学习了硫和硫的氧化物SO2,其中应用之一就是制备硫酸,这节课学习——硫酸。
1.硫酸
⒈硫酸
⒈应用-硫酸是重要的化工原料
①化肥、
②农药、
③炸药、
④染料、
⑤盐类。
⒈硫酸
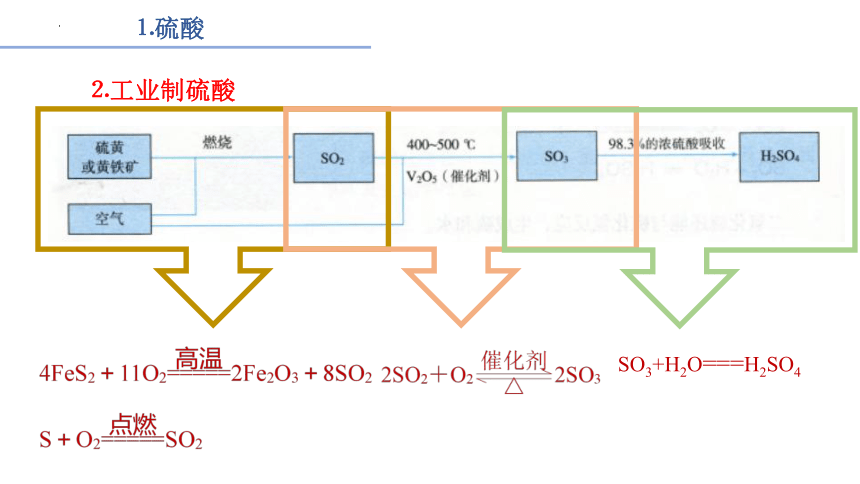
⒉工业制硫酸
SO3+H2O===H2SO4
⒈硫酸
⒊物理性质
①纯硫酸——无色、粘稠的油状液体
②沸点:338 ℃
③密度:1.84 g / cm3
④稀释时放出大量热
⒈硫酸
⒋化学性质
⑴ 稀硫酸
① 完全电离
H2SO4===2H++ SO42-
② 具有酸的通性
与指示剂反应;
与活泼金属反应;与金属氧化物反应;
与盐的反应;与碱的反应。
⒈硫酸
⑵ 浓硫酸
① 吸水性-吸收存在于周围环境中的水分(做干燥剂)
干燥中性和酸性气体,如:O2、H2、N2、Cl2、CO2、SO2
不能干燥的气体有:碱性气体—NH3 、还原性气体—H2S、HBr、HI
② 脱水性-将有机物中的氢、氧元素按2:1的比例脱去。
⒈硫酸
现象:蔗糖变黑,体积膨胀,形成 疏松多孔的海绵状的炭,并有刺激性气味的气体产生。
C12H22O11 ===== 12 C + 11H2O
浓硫酸
⒈硫酸
③ 氧化性-能氧化大部分金属单质和部分非金属单质
a、与金属单质(除Au和Pt)反应
现象:
a、铜丝表面变黑
b、有气体产生
c、品红溶液褪色
d、石蕊溶液变红
e、冷却后将溶液倒入少量的水中,溶液呈蓝色
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
结论:
⒈硫酸
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
0 +6 +2 +4
在上述反应中,硫酸表现出了________和_____。
强氧化性
酸性
还原剂 氧化剂
氧化
产物
还原
产物
⒈硫酸
?
?
通过可抽动的铜丝来控制反应的发生或停止。
吸收多余的SO2,以防止污染环境。
⒈硫酸
1、足量Cu 与浓硫酸反应,硫酸能否完全反应?为什么?
思考:
2、平时如何运输浓硫酸?
冷的浓硫酸能使Fe、Al发生钝化,故用铁槽车或铝槽车运输浓硫酸。
否,因为浓硫酸消耗变为稀硫酸,稀硫酸不反应
运浓硫酸的铁罐车
⒈硫酸
b、与非金属单质反应
C+2H2SO4(浓) === CO2+2SO2↑+2H2O
还原剂 氧化剂
如何用实验方法证明木炭与浓硫酸反应的产物?
思考:
产物检验顺序
1、无水硫酸铜——检验H2O
2、品红溶液——检验SO2
3、澄清石灰水——检验CO2
⒈硫酸
检验H2O
检验SO2
检验CO2
?
?
除尽SO2
检验SO2
是否除尽
C + 2H2SO4 (浓) ===== 2SO2 ↑ + CO2 ↑ +2H2O
△
2H2SO4(浓) + Cu==== CuSO4 + SO2 ↑ + 2H2O
△
金属 + H2SO4 (浓) ===== (高价)金属硫酸盐+ SO2 ↑ +H2O
△
△
非金属 + H2SO4 (浓) ===== 非金属酸/气体氧化物+ SO2 ↑ +H2O
例如:
S + 2H2SO4(浓) ===
3SO2↑+ 2H2O
⒈硫酸
⒈硫酸
⒌生产生活中的硫酸盐
熟石膏
2CaSO4·H2O
石膏
CaSO4·2H2O
加热150℃
加水
钡餐透影
BaSO4
CuSO4·5H2O
(俗称胆矾)
CuSO4
(无水硫酸铜)
加水
无水硫酸铜用于检测水的存在
高中化学必修第二册
第1节 硫及其化合物
第五章化工生产中的重要非金属元素
(2)硫酸
学习目标
1、通过实验探究浓硫酸的吸水性、脱水性和强氧化性,。
2、能运用氧化还原反应知识理解浓硫酸的氧化性。
3、认识硫酸在相关反应中体现的性质。
新课导入
在上一节课中,我们主要学习了硫和硫的氧化物SO2,其中应用之一就是制备硫酸,这节课学习——硫酸。
1.硫酸
⒈硫酸
⒈应用-硫酸是重要的化工原料
①化肥、
②农药、
③炸药、
④染料、
⑤盐类。
⒈硫酸
⒉工业制硫酸
SO3+H2O===H2SO4
⒈硫酸
⒊物理性质
①纯硫酸——无色、粘稠的油状液体
②沸点:338 ℃
③密度:1.84 g / cm3
④稀释时放出大量热
⒈硫酸
⒋化学性质
⑴ 稀硫酸
① 完全电离
H2SO4===2H++ SO42-
② 具有酸的通性
与指示剂反应;
与活泼金属反应;与金属氧化物反应;
与盐的反应;与碱的反应。
⒈硫酸
⑵ 浓硫酸
① 吸水性-吸收存在于周围环境中的水分(做干燥剂)
干燥中性和酸性气体,如:O2、H2、N2、Cl2、CO2、SO2
不能干燥的气体有:碱性气体—NH3 、还原性气体—H2S、HBr、HI
② 脱水性-将有机物中的氢、氧元素按2:1的比例脱去。
⒈硫酸
现象:蔗糖变黑,体积膨胀,形成 疏松多孔的海绵状的炭,并有刺激性气味的气体产生。
C12H22O11 ===== 12 C + 11H2O
浓硫酸
⒈硫酸
③ 氧化性-能氧化大部分金属单质和部分非金属单质
a、与金属单质(除Au和Pt)反应
现象:
a、铜丝表面变黑
b、有气体产生
c、品红溶液褪色
d、石蕊溶液变红
e、冷却后将溶液倒入少量的水中,溶液呈蓝色
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
结论:
⒈硫酸
Cu+2H2SO4(浓) === CuSO4+SO2↑+2H2O
0 +6 +2 +4
在上述反应中,硫酸表现出了________和_____。
强氧化性
酸性
还原剂 氧化剂
氧化
产物
还原
产物
⒈硫酸
?
?
通过可抽动的铜丝来控制反应的发生或停止。
吸收多余的SO2,以防止污染环境。
⒈硫酸
1、足量Cu 与浓硫酸反应,硫酸能否完全反应?为什么?
思考:
2、平时如何运输浓硫酸?
冷的浓硫酸能使Fe、Al发生钝化,故用铁槽车或铝槽车运输浓硫酸。
否,因为浓硫酸消耗变为稀硫酸,稀硫酸不反应
运浓硫酸的铁罐车
⒈硫酸
b、与非金属单质反应
C+2H2SO4(浓) === CO2+2SO2↑+2H2O
还原剂 氧化剂
如何用实验方法证明木炭与浓硫酸反应的产物?
思考:
产物检验顺序
1、无水硫酸铜——检验H2O
2、品红溶液——检验SO2
3、澄清石灰水——检验CO2
⒈硫酸
检验H2O
检验SO2
检验CO2
?
?
除尽SO2
检验SO2
是否除尽
C + 2H2SO4 (浓) ===== 2SO2 ↑ + CO2 ↑ +2H2O
△
2H2SO4(浓) + Cu==== CuSO4 + SO2 ↑ + 2H2O
△
金属 + H2SO4 (浓) ===== (高价)金属硫酸盐+ SO2 ↑ +H2O
△
△
非金属 + H2SO4 (浓) ===== 非金属酸/气体氧化物+ SO2 ↑ +H2O
例如:
S + 2H2SO4(浓) ===
3SO2↑+ 2H2O
⒈硫酸
⒈硫酸
⒌生产生活中的硫酸盐
熟石膏
2CaSO4·H2O
石膏
CaSO4·2H2O
加热150℃
加水
钡餐透影
BaSO4
CuSO4·5H2O
(俗称胆矾)
CuSO4
(无水硫酸铜)
加水
无水硫酸铜用于检测水的存在
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
