化学人教版(2019)必修第一册2.2氯及其化合物的性质及应用(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.2氯及其化合物的性质及应用(共21张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 907.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 00:00:00 | ||
图片预览




文档简介
(共21张PPT)
氯及其化合物
一、氯气的性质
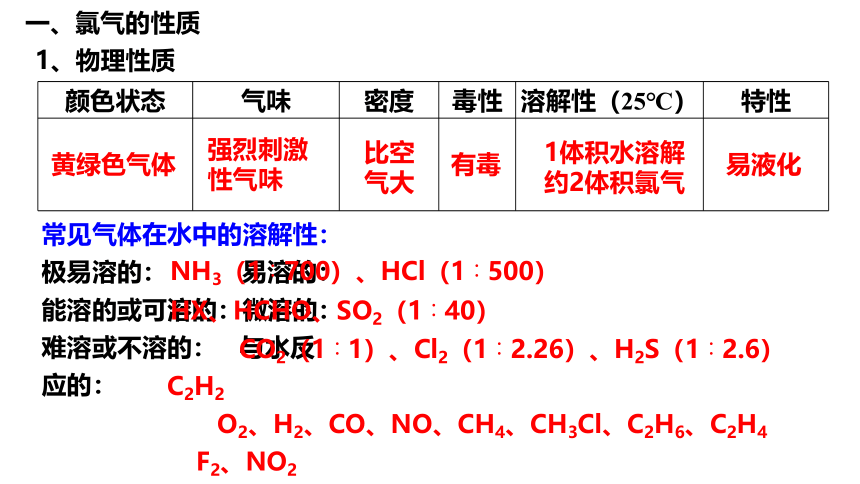
1、物理性质
颜色状态 气味 密度 毒性 溶解性(25℃) 特性
黄绿色气体
易液化
强烈刺激性气味
比空气大
有毒
1体积水溶解约2体积氯气
常见气体在水中的溶解性:
极易溶的: 易溶的: 能溶的或可溶的:微溶的: 难溶或不溶的: 与水反应的:
NH3(1∶700)、HCl(1∶500)
HX、HCHO、SO2(1∶40)
CO2(1∶1)、Cl2(1∶2.26)、H2S(1∶2.6)
C2H2
O2、H2、CO、NO、CH4、CH3Cl、C2H6、C2H4
F2、NO2
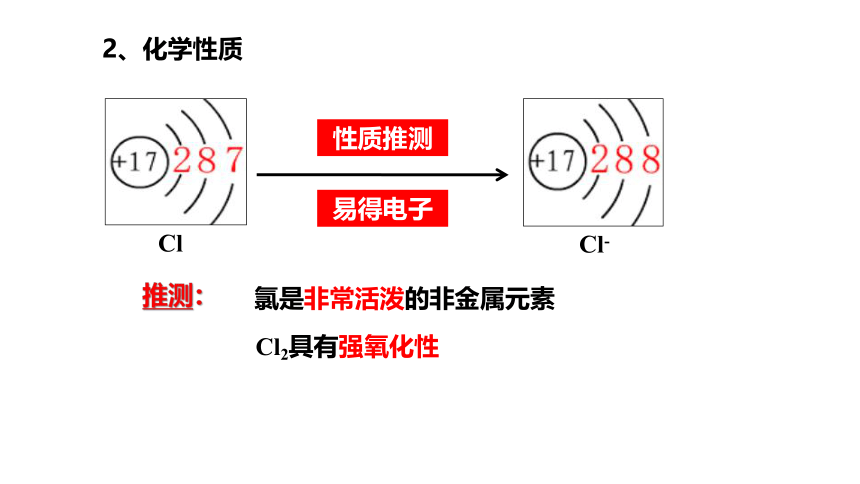
Cl
Cl-
性质推测
易得电子
Cl2具有强氧化性
氯是非常活泼的非金属元素
推测:
2、化学性质
Cl2
KI
FeCl2
SO2+H2O
NH3
Na
Fe
Cu
H2
P
H2O
NaOH
Ca(OH)2
CH4
C2H4
C6H6
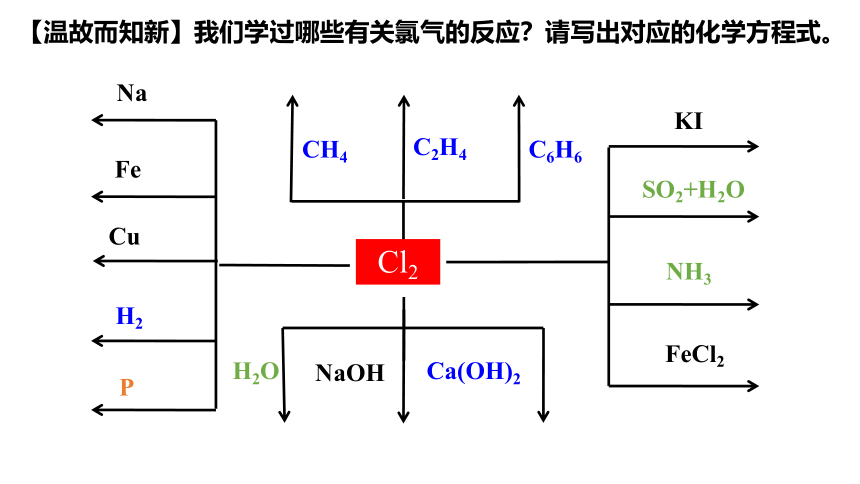
【温故而知新】我们学过哪些有关氯气的反应?请写出对应的化学方程式。
①与金属反应:与变价金属反应生成高价金属氯化物。
棕褐色烟
棕黄色烟
②与非金属反应
心有疑问 常温下工业上常把干燥的液氯储存在钢瓶中,为什么?
H2+Cl2 = 2HCl
点燃或光照
点燃:安静地燃烧,发出苍白色火焰,瓶口有白雾
光照:剧烈反应,发生爆炸,瓶口有白雾
③与水或碱反应(填写化学方程式)
④能与某些还原性物质反应(填写离子方程式)
与水反应
与烧碱溶液反应
与碘化钾溶液
与SO2水溶液
与FeCl2溶液
Cl2+2I-=I2+2Cl-
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+H2O HCl+HClO
3Cl2+6NaOH = 5NaCl+NaClO3+3H2O
Cl2+SO2+2H2O=4H++SO42-+2Cl-
Cl2+2Fe2+=2Fe3++2Cl-
【夯实基础】
(1)过量的铁粉在少量氯气中加热,充分反应后产物为FeCl2 ( )
氯气可以使湿润的有色布条褪色,所以氯气具有漂白性 ( )
Cl2具有很强的氧化性,在化学反应中只能作氧化剂 ( )
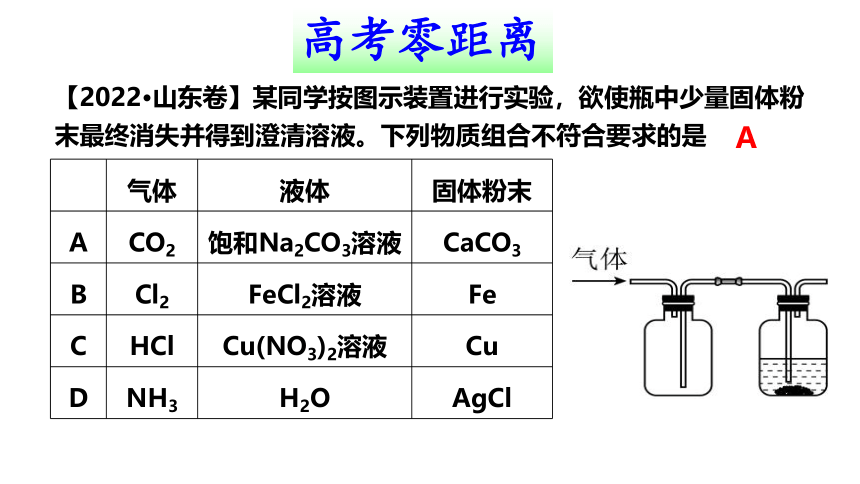
【2022·山东卷】某同学按图示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液。下列物质组合不符合要求的是
气体 液体 固体粉末
A CO2 饱和Na2CO3溶液 CaCO3
B Cl2 FeCl2溶液 Fe
C HCl Cu(NO3)2溶液 Cu
D NH3 H2O AgCl
A
高考零距离
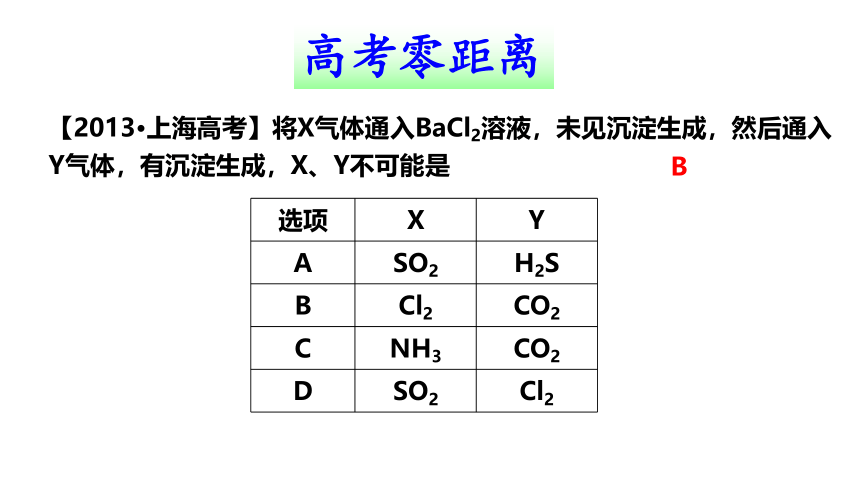
【2013·上海高考】将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是
选项 X Y
A SO2 H2S
B Cl2 CO2
C NH3 CO2
D SO2 Cl2
B
高考零距离
【2012·上海】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
对实验现象的“解释或结论”正确的是( )
选项 实验现象 解释或结论
A a处变蓝,b处变红棕色 氧化性:Cl2>Br2>I2
B c处先变红,后褪色 氯气与水生成了酸性物质
C d处立即褪色 氯气与水生成了漂白性物质
D e处变红色 氧化性:Cl2 > Fe3+
D
高考零距离
从平衡角度理解氯水的多元性
氯水成分的多样性
1、氯水中存在的三个平衡关系
二、氯水的成分及性质
2、氯水性质的多重性
【温故而知新】新制氯水主要有哪些化学性质?这些性质是什么微粒体现出来的?
根据氯水的性质完成下表
编号 实验事实 起作用的粒子 结合方程式解释
1 新制的氯水呈黄绿色
2 饮用水用氯气消毒
3 氯水使湿润的淀粉-KI试纸变蓝
4 FeCl2溶液中滴入KSCN溶液,不变色,再滴入氯水,溶液变成红色
5 氯水应密封保存在棕色试剂瓶中,放置于避光阴暗处
Cl2
HClO
HClO
Cl2
Cl2+H2O HCl+HClO
2HClO == 2HCl+O2↑
光照
Cl2+2I— =I2+2Cl—
———————
Cl2的浓度比HClO大得多
2Fe2++Cl2 =2Fe3++2Cl—
Cl2
【难点突破】
根据氯水的性质完成下表
编号 实验事实 起作用的粒子 结合方程式解释
6 用自来水配制AgNO3溶液,溶液浑浊
7 碳酸钙粉末中滴加氯水后产生气泡
Cl—
Ag++Cl- = AgCl↓
H+
CaCO3+2H+=
Ca2++H2O+CO2↑
【难点突破】
(2016·上海高考真题)向新制氯水中加入少量下列物质,能增强溶液漂白能力的是( )
A.碳酸钙粉末 B.稀硫酸
C.氯化钙溶液 D.二氧化硫水溶液
A
Cl2+H2O H++Cl-+HClO平衡移动的应用
向氯水中 加入的物质 浓度变化 平衡移 动的方向 应 用
可溶性 氯化物
浓盐酸
碱
光照
碳酸钙
c(Cl-)增大
c(HClO)减小
c(H+)和
c(Cl-)增大
c(H+)减小
c(HClO)减小
c(HClO)增大
左移
左移
右移
右移
右移
①用饱和食盐水除Cl2中的HCl
②用排饱和食盐水法收集Cl2
洁厕剂和“84”消毒液不宜混用
①用NaOH吸收尾气Cl2
②漂白粉的制备
氯水应避光保存或现用现配
制取次氯酸浓度较大的氯水,(漂白性增强)
【难点突破】
3、液氯、新制氯水、久置氯水的比较
液氯 新制氯水 久置氯水
分类
颜色
性质
粒子种类
纯净物
混合物
混合物
黄绿色
浅黄绿色
无色
氧化性
酸性、氧化性、漂白性
酸性
Cl2
Cl2、HClO、H2O、H+、Cl-、ClO-、OH-
H2O、H+、Cl-、OH-
【夯实基础】
在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是 ( )
B
三、次氯酸
1、弱酸性
酸性:H2CO3>HClO>HCO-
【试一试】向NaClO溶液中通入少量CO2,离子方程式为:
次氯酸要现用现配、保存在棕色试剂瓶中
2、不稳定性
【温故而知新】次氯酸有哪些化学性质?
HClO和ClO-都具有强氧化性,无论酸性、碱性条件下都可以和亚铁盐、碘化物、硫化物等发生氧化还原反应
3、强氧化性
ClO-+CO2+H2O=HCO3-+HClO
2HClO = 2HCl+O2↑
光照
四、次氯酸盐
1、漂白液(“84”消毒液)
有效成分:
制备原理:
用途:
主要化学性质:
NaClO
2NaOH+Cl2+H2O=NaCl+NaClO+H2O
水溶液呈碱性、强氧化性
杀菌、消毒
B
【2015·北京高考真题】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A.该消毒液可用NaOH溶液吸收Cl2制备:
Cl2 +2OH-=Cl-+ ClO-+ H2O
B.该消毒液的pH约为12:ClO-+ H2O HClO+ OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:
2H++ Cl-+ ClO-= Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:
CH3COOH+ ClO-= HClO+CH3COO—
2、漂白粉
成分:
制备原理:
失效原因:
化学性质:
主要成分:Ca(ClO)2、CaCl2,有效成分:Ca(ClO)2
2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
水溶液呈碱性、强氧化性
2Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
2HClO = 2HCl+O2↑
光照
【夯实基础】
下列说法不正确的是 ( )A.次氯酸盐具有氧化性,漂白粉能漂白织物B.Cl2能使淀粉 KI溶液变蓝,证明其具有氧化性C.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3D.漂白粉在空气中久置变质,是因为漂白粉中的Ca(ClO)2与空气中的O2发生了反应
CD
氯及其化合物
一、氯气的性质
1、物理性质
颜色状态 气味 密度 毒性 溶解性(25℃) 特性
黄绿色气体
易液化
强烈刺激性气味
比空气大
有毒
1体积水溶解约2体积氯气
常见气体在水中的溶解性:
极易溶的: 易溶的: 能溶的或可溶的:微溶的: 难溶或不溶的: 与水反应的:
NH3(1∶700)、HCl(1∶500)
HX、HCHO、SO2(1∶40)
CO2(1∶1)、Cl2(1∶2.26)、H2S(1∶2.6)
C2H2
O2、H2、CO、NO、CH4、CH3Cl、C2H6、C2H4
F2、NO2
Cl
Cl-
性质推测
易得电子
Cl2具有强氧化性
氯是非常活泼的非金属元素
推测:
2、化学性质
Cl2
KI
FeCl2
SO2+H2O
NH3
Na
Fe
Cu
H2
P
H2O
NaOH
Ca(OH)2
CH4
C2H4
C6H6
【温故而知新】我们学过哪些有关氯气的反应?请写出对应的化学方程式。
①与金属反应:与变价金属反应生成高价金属氯化物。
棕褐色烟
棕黄色烟
②与非金属反应
心有疑问 常温下工业上常把干燥的液氯储存在钢瓶中,为什么?
H2+Cl2 = 2HCl
点燃或光照
点燃:安静地燃烧,发出苍白色火焰,瓶口有白雾
光照:剧烈反应,发生爆炸,瓶口有白雾
③与水或碱反应(填写化学方程式)
④能与某些还原性物质反应(填写离子方程式)
与水反应
与烧碱溶液反应
与碘化钾溶液
与SO2水溶液
与FeCl2溶液
Cl2+2I-=I2+2Cl-
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+H2O HCl+HClO
3Cl2+6NaOH = 5NaCl+NaClO3+3H2O
Cl2+SO2+2H2O=4H++SO42-+2Cl-
Cl2+2Fe2+=2Fe3++2Cl-
【夯实基础】
(1)过量的铁粉在少量氯气中加热,充分反应后产物为FeCl2 ( )
氯气可以使湿润的有色布条褪色,所以氯气具有漂白性 ( )
Cl2具有很强的氧化性,在化学反应中只能作氧化剂 ( )
【2022·山东卷】某同学按图示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液。下列物质组合不符合要求的是
气体 液体 固体粉末
A CO2 饱和Na2CO3溶液 CaCO3
B Cl2 FeCl2溶液 Fe
C HCl Cu(NO3)2溶液 Cu
D NH3 H2O AgCl
A
高考零距离
【2013·上海高考】将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是
选项 X Y
A SO2 H2S
B Cl2 CO2
C NH3 CO2
D SO2 Cl2
B
高考零距离
【2012·上海】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
对实验现象的“解释或结论”正确的是( )
选项 实验现象 解释或结论
A a处变蓝,b处变红棕色 氧化性:Cl2>Br2>I2
B c处先变红,后褪色 氯气与水生成了酸性物质
C d处立即褪色 氯气与水生成了漂白性物质
D e处变红色 氧化性:Cl2 > Fe3+
D
高考零距离
从平衡角度理解氯水的多元性
氯水成分的多样性
1、氯水中存在的三个平衡关系
二、氯水的成分及性质
2、氯水性质的多重性
【温故而知新】新制氯水主要有哪些化学性质?这些性质是什么微粒体现出来的?
根据氯水的性质完成下表
编号 实验事实 起作用的粒子 结合方程式解释
1 新制的氯水呈黄绿色
2 饮用水用氯气消毒
3 氯水使湿润的淀粉-KI试纸变蓝
4 FeCl2溶液中滴入KSCN溶液,不变色,再滴入氯水,溶液变成红色
5 氯水应密封保存在棕色试剂瓶中,放置于避光阴暗处
Cl2
HClO
HClO
Cl2
Cl2+H2O HCl+HClO
2HClO == 2HCl+O2↑
光照
Cl2+2I— =I2+2Cl—
———————
Cl2的浓度比HClO大得多
2Fe2++Cl2 =2Fe3++2Cl—
Cl2
【难点突破】
根据氯水的性质完成下表
编号 实验事实 起作用的粒子 结合方程式解释
6 用自来水配制AgNO3溶液,溶液浑浊
7 碳酸钙粉末中滴加氯水后产生气泡
Cl—
Ag++Cl- = AgCl↓
H+
CaCO3+2H+=
Ca2++H2O+CO2↑
【难点突破】
(2016·上海高考真题)向新制氯水中加入少量下列物质,能增强溶液漂白能力的是( )
A.碳酸钙粉末 B.稀硫酸
C.氯化钙溶液 D.二氧化硫水溶液
A
Cl2+H2O H++Cl-+HClO平衡移动的应用
向氯水中 加入的物质 浓度变化 平衡移 动的方向 应 用
可溶性 氯化物
浓盐酸
碱
光照
碳酸钙
c(Cl-)增大
c(HClO)减小
c(H+)和
c(Cl-)增大
c(H+)减小
c(HClO)减小
c(HClO)增大
左移
左移
右移
右移
右移
①用饱和食盐水除Cl2中的HCl
②用排饱和食盐水法收集Cl2
洁厕剂和“84”消毒液不宜混用
①用NaOH吸收尾气Cl2
②漂白粉的制备
氯水应避光保存或现用现配
制取次氯酸浓度较大的氯水,(漂白性增强)
【难点突破】
3、液氯、新制氯水、久置氯水的比较
液氯 新制氯水 久置氯水
分类
颜色
性质
粒子种类
纯净物
混合物
混合物
黄绿色
浅黄绿色
无色
氧化性
酸性、氧化性、漂白性
酸性
Cl2
Cl2、HClO、H2O、H+、Cl-、ClO-、OH-
H2O、H+、Cl-、OH-
【夯实基础】
在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是 ( )
B
三、次氯酸
1、弱酸性
酸性:H2CO3>HClO>HCO-
【试一试】向NaClO溶液中通入少量CO2,离子方程式为:
次氯酸要现用现配、保存在棕色试剂瓶中
2、不稳定性
【温故而知新】次氯酸有哪些化学性质?
HClO和ClO-都具有强氧化性,无论酸性、碱性条件下都可以和亚铁盐、碘化物、硫化物等发生氧化还原反应
3、强氧化性
ClO-+CO2+H2O=HCO3-+HClO
2HClO = 2HCl+O2↑
光照
四、次氯酸盐
1、漂白液(“84”消毒液)
有效成分:
制备原理:
用途:
主要化学性质:
NaClO
2NaOH+Cl2+H2O=NaCl+NaClO+H2O
水溶液呈碱性、强氧化性
杀菌、消毒
B
【2015·北京高考真题】某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A.该消毒液可用NaOH溶液吸收Cl2制备:
Cl2 +2OH-=Cl-+ ClO-+ H2O
B.该消毒液的pH约为12:ClO-+ H2O HClO+ OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:
2H++ Cl-+ ClO-= Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:
CH3COOH+ ClO-= HClO+CH3COO—
2、漂白粉
成分:
制备原理:
失效原因:
化学性质:
主要成分:Ca(ClO)2、CaCl2,有效成分:Ca(ClO)2
2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
水溶液呈碱性、强氧化性
2Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
2HClO = 2HCl+O2↑
光照
【夯实基础】
下列说法不正确的是 ( )A.次氯酸盐具有氧化性,漂白粉能漂白织物B.Cl2能使淀粉 KI溶液变蓝,证明其具有氧化性C.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3D.漂白粉在空气中久置变质,是因为漂白粉中的Ca(ClO)2与空气中的O2发生了反应
CD
