科粤版化学九年级下册:8.3酸和碱的反应 习题(含解析)
文档属性
| 名称 | 科粤版化学九年级下册:8.3酸和碱的反应 习题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 188.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-21 09:55:59 | ||
图片预览



文档简介
8.3酸和碱的反应
一、单选题,共15小题
1.下列说法中错误的是( )
A.印染厂的污水呈碱性,可以加入H2SO4进行中和
B.胃酸过多时,可以服用一些碱性药物来中和
C.熟石灰可用于降低土壤的酸性
D.要消除蚊虫在人皮肤内分泌的蚁酸,可以在皮肤上涂抹一些食用醋
2.下列属于中和反应的是( )
A.
B.
C.
D.
3.下列实际应用中,利用中和反应原理的是( )
①用氢氧化钠溶液洗去石油产品中的残余硫酸;②用稀硫酸除铁锈;③用熟石灰改良酸性土壤;④用稀氨水涂抹在被蚊虫叮咬处(分泌出蚁酸)止痒;⑤用生石灰作食品干燥剂。
A.①③⑤ B.③④⑤ C.①②④ D.①③④
4.如图是NaOH溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论正确的是( )
A.反应后溶液的pH=0
B.反应前两种溶液均能导电,反应后的溶液不导电
C.反应后溶液中的粒子只有Na+和Cl
D.反应前后各元素的化合价均无变化
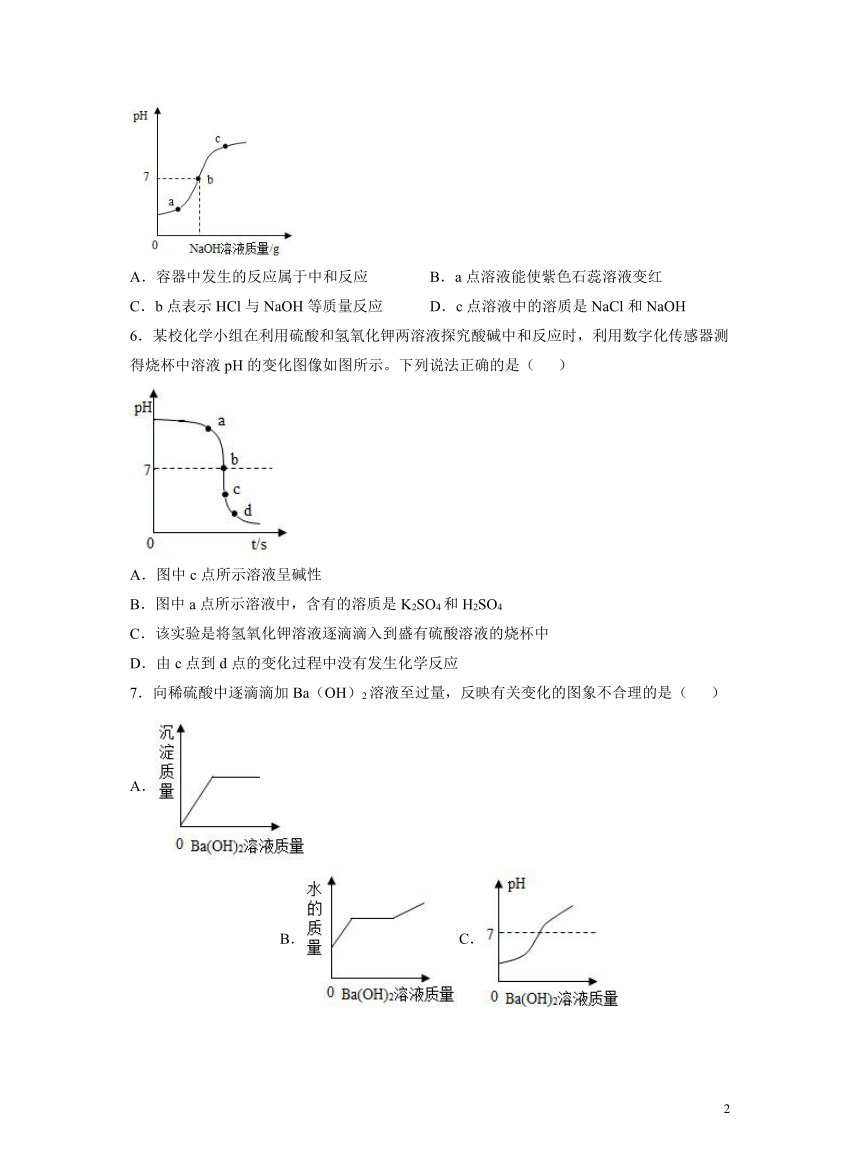
5.室温下,将氢氧化钠溶液滴加到盛有一定量稀盐酸的容器中,边滴边搅拌,用数字pH仪连接电脑实时测得pH变化曲线如图。下列相关叙述错误的是
A.容器中发生的反应属于中和反应 B.a点溶液能使紫色石蕊溶液变红
C.b点表示HCl与NaOH等质量反应 D.c点溶液中的溶质是NaCl和NaOH
6.某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是( )
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸溶液的烧杯中
D.由c点到d点的变化过程中没有发生化学反应
7.向稀硫酸中逐滴滴加Ba(OH)2溶液至过量,反映有关变化的图象不合理的是( )
A. B.C. D.
8.如图是室温下稀盐酸与氢氧化钠溶液反应过程中pH变化的曲线图,下列说法错误的是( )
A.图中x是氢氧化钠溶液
B.a点溶液中含有两种溶质
C.b点表示两溶液恰好完全反应
D.滴加方式是将稀盐酸滴入到氢氧化钠溶液中
9.一些食物pH 的近似值范围如下:橘子汁3.0~4.0;泡菜3.2~3.6;牛奶6.3~6.6;鸡蛋清7.6~8.0。下列说法中,不正确的是( )
A.鸡蛋清显碱性
B.胃酸过多的人应少吃泡菜
C.橘子汁能使紫色石蕊溶液变红
D.牛奶比橘子汁的酸性强
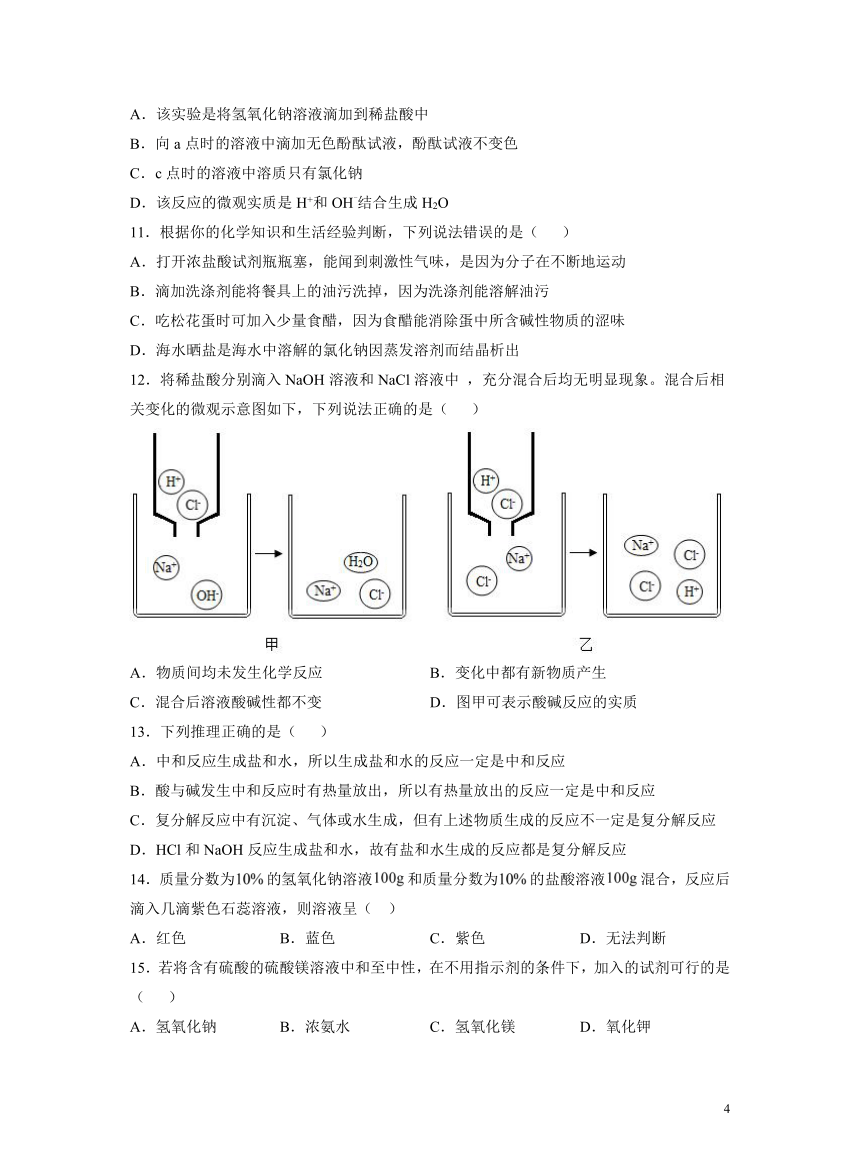
10.实验小组用pH传感器探究稀盐酸和氢氧化钠溶液的反应,实验中溶液pH的变化如图所示。下列说法正确的是( )
A.该实验是将氢氧化钠溶液滴加到稀盐酸中
B.向a点时的溶液中滴加无色酚酞试液,酚酞试液不变色
C.c点时的溶液中溶质只有氯化钠
D.该反应的微观实质是H+和OH-结合生成H2O
11.根据你的化学知识和生活经验判断,下列说法错误的是( )
A.打开浓盐酸试剂瓶瓶塞,能闻到刺激性气味,是因为分子在不断地运动
B.滴加洗涤剂能将餐具上的油污洗掉,因为洗涤剂能溶解油污
C.吃松花蛋时可加入少量食醋,因为食醋能消除蛋中所含碱性物质的涩味
D.海水晒盐是海水中溶解的氯化钠因蒸发溶剂而结晶析出
12.将稀盐酸分别滴入NaOH溶液和NaCl溶液中 ,充分混合后均无明显现象。混合后相关变化的微观示意图如下,下列说法正确的是( )
A.物质间均未发生化学反应 B.变化中都有新物质产生
C.混合后溶液酸碱性都不变 D.图甲可表示酸碱反应的实质
13.下列推理正确的是( )
A.中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
B.酸与碱发生中和反应时有热量放出,所以有热量放出的反应一定是中和反应
C.复分解反应中有沉淀、气体或水生成,但有上述物质生成的反应不一定是复分解反应
D.HCl和NaOH反应生成盐和水,故有盐和水生成的反应都是复分解反应
14.质量分数为的氢氧化钠溶液和质量分数为的盐酸溶液混合,反应后滴入几滴紫色石蕊溶液,则溶液呈( )
A.红色 B.蓝色 C.紫色 D.无法判断
15.若将含有硫酸的硫酸镁溶液中和至中性,在不用指示剂的条件下,加入的试剂可行的是( )
A.氢氧化钠 B.浓氨水 C.氢氧化镁 D.氧化钾
二、填空题,共6小题
16.复分解反应的实质就是酸碱盐解离出一些阴、阳离子相互结合生成难解离的水、气体或沉淀,根据下列部分碱盐的溶解性表 20℃,回答下列问题:
溶 溶 溶
溶 溶 不
溶 溶 不
溶 溶 溶
(1)H2SO4 在水中能解离出的离子是________(填离子符号)。
(2)向稀硫酸中滴入氢氧化钡溶液的化学反应方程式为________,该反应前后溶 液中数目发生变化的阴阳离子是________(填离子符号)。
(3)根据溶解性表及复分解反应的实质判断,将“硫酸、氯化钡、氢氧化钠、碳酸钾”四种物质的溶液两两混合,能发生的反应有________个。
17.盐酸是重要的化工原料,也是实验室中最常用的化学试剂之一。
(1)用质量分数为37%的浓盐酸配制1000 g质量分数为0.37%(pH约为1)的稀盐酸。
①所配稀盐酸中溶质的质量为________g,所需浓盐酸的质量为________g。
②已知浓盐酸密度为1.19 g/cm3,量取上述所需浓盐酸用到的仪器是_______(填标号)。
A.10 mL量筒
B.50 mL量筒
C.试管
D.胶头滴管
③测定所配稀盐酸的酸碱度,应将pH试纸放置在__________上。
(2)取少量氢氧化钙粉末于试管中,加入2 mL水,振荡,得到白色浑浊液,滴加1滴酚酞溶液,再滴加稀盐酸至反应完全,可观察到的现象是_________。
(3)取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸。
①铁与稀盐酸反应的化学方程式为________。
②下列示意图中,与实验结果相符的是_________(填标号)。
18.根据下图回答问题:
(1)加入稀盐酸至过量能观察到的现象是____________________。
(2)反应中,数目减少的离子是_____________(填离子符号);
(3)验证反应后溶液中稀盐酸有剩余,下列操作可行的是______________。
A.取样,加入CuO粉末
B.取样,滴加NaOH溶液
C.取样,加入CaCO3粉末
D.取样,滴加AgNO3溶液
19.A、B两烧杯中分别盛有质量和溶质质量分数都相同的盐酸和烧碱溶液。若将A烧杯中溶液注入B烧杯中,B烧杯中溶液的pH按图线①变化;若将B烧杯中溶液注入A烧杯A烧杯中溶液的pH按图线②变化。
(1)A烧杯中溶液为__________溶液。
(2)两种溶液混合后,所得溶液显__________(填“酸”“碱”或“中”)性。
(3)写出发生反应的化学方程式__________。
20.化学就在我们身边,人类的衣食住行都离不开化学。
(1)小明家有一个急救小药箱,其中一种药品是“斯达舒”,可用于缓解胃酸过多引起的胃痛,其主要成分之一是氢氧化铝。氢氧化铝与胃酸发生中和反应的化学方程式为_______。
(2)如图为Zn和NaHSO4溶液反应的微观示意图,回答下列问题:
①实际与Zn反应的粒子是_______。
②写出烧杯中发生反应的化学方程式_______。
21.如图是某化学小组向一定量稀盐酸中滴入氢氧化钠溶液时用pH传感器测得的pH变化图像。
(1)b点溶液中溶质的化学式为___________。
(2)若保持原稀盐酸的量不变,改用与n g原氢氧化钠溶液中溶质质量相等的熟石灰与其反应,则反应后的溶液的pH___________(填“>”“<”或“=”)。
(3)用实际参加化学反应的离子符号表示化学反应的式子叫离子方程式。请写出氢氧化钠和稀盐酸反应的离子方程式___________。
三、简答题,共2小题
22.如图是氢氧化钠与盐酸反应示意图。
(1)反应前后没有发生变化的离子有哪些?
(2)用实际参加反应的离子符号来表示反应的式子叫做离子方程式。请写出氢氧化钠与盐酸反应的离子方程式。
23.中和反应有着广泛应用。
(1)中和反应应用于医药卫生方面,当人体中胃酸过多时,通常服用_____性药物。一种胃药叫胃舒平,主要成分是,写出其与人体中胃酸反应的化学方程式:_____。
(2)中和反应可应用在农业改良土壤方面,改良酸性土壤通常用熟石灰,是因为熟石灰是_____性物质。某地土壤呈酸性是由于土壤中含有少量的硫酸,请写出用熟石灰改良该土壤时所发生反应的化学方程式:_____。
(3)据报道,某地一辆载着硫酸的罐车突然翻车,导致大量硫酸泄漏,赶到现场的消防官兵用大量的烧碱(NaOH)覆盖泄漏现场,此时所发生反应的化学方程式为_____,消防官兵运用的是_____反应的原理。
参考答案
1.D
【解析】
A.印染厂的污水呈碱性,可以加入H2SO4进行中和,故正确;
B.胃酸过多时,可以服用一些碱性药物来中和,故正确;
C.熟石灰显碱性,可用于降低土壤的酸性,故正确;
D.蚊虫叮咬皮肤时会分泌蚁酸引起皮肤肿痛,可在叮咬处涂抹碱性的肥皂水,中和蚁酸,而不能涂酸性的食醋,故错误。
故选:D。
2.C
【解析】
A.CO2+Ca(OH)2═CaCO3↓+H2O,该反应的反应物是非金属氧化物和碱,不属于中和反应,故选项错误;
B.,该反应的反应物是金属氧化物和酸,不属于中和反应,故选项错误;
C.,是酸与碱反应生成盐和水,属于中和反应,故选项正确;
D.,该反应的反应物是盐和酸,不属于中和反应,故选项错误。
故选:C。
【点睛】
中和反应是指酸和碱作用生成盐和水的反应,判断中和反应时一要看反应物是否是酸和碱,二是看生成物是否是盐和水,二者缺一不可。
3.D
【解析】
①氢氧化钠属于碱,硫酸属于酸,氢氧化钠与硫酸的反应属于中和反应,故与中和反应原理有关;
②铁锈的主要成分是氧化铁,氧化铁是金属氧化物,不是碱,故用稀硫酸除铁锈与中和反应原理无关;
③熟石灰为氢氧化钙,属于碱,用于改良酸性土壤属于酸和碱的反应,故与中和反应原理有关;
④蚊虫叮咬会分泌出的蚁酸等酸性物质,而氨水是碱性物质,可以中和其中的酸性物质,即利用了酸碱中和反应,故与中和反应原理有关;
⑤生石灰是碱性氧化物,不是碱,和水反应,水也不是酸,生石灰和水的反应不是中和反应,故与中和反应原理无关;
故选:D。
4.D
【解析】
A.根据反应后的容器中的离子可以看出,反应后的溶液中只有氯离子、钠离子、水分子,所以溶液显中性,pH等于7,故选项错误;
B.溶液导电是靠溶液中带电的离子导电的,反应后的溶液中存在带正电的钠离子和带负电的氯离子,所以反应后的溶液能导电,故选项错误;
C.反应后的溶液中除了钠离子和氯离子外,还有水分子,故选项错误;
D.钠元素、氢元素反应前后的化合价都是+1,氯元素反应前后的化合价是-1,氧元素的化合价都是-2,反应前后各元素的化合价均无变化,故选项正确。故选D。
5.C
【解析】
A.氢氧化钠是一种碱,盐酸是一种酸,酸碱作用生成盐和水的反应属于中和反应,选项说法正确;
B.a点所示溶液的,溶液显酸性,能使紫色的石蕊试液变红色,选项说法正确;
C.b点所示溶液的,呈中性,说明HCl与NaOH恰好完全反应,化学方程式以及物质间的质量关系为:
由此可知,恰好反应时,HCl与NaOH质量并不相等,选项说法错误;
D.c点所示溶液的,溶液呈碱性,即溶液中的溶质是氯化钠和氢氧化钠,选项说法正确。
故选:C。
6.D
【解析】
A.根据图示,c点所示溶液pH﹤7,呈酸性,选项A不正确;
B.从图中溶液的pH由大逐渐变小可知,该实验是将硫酸溶液逐滴滴入到盛有氢氧化钾溶液的烧杯中,图中a点所示溶液pH﹥7,呈碱性,溶液中氢氧化钾没有全部被反应,溶液中含有的溶质应该是K2SO4和KOH,选项B不正确;
C.根据图中溶液的pH变化情况,溶液的pH起点大于7,且随着试剂的加入pH由大逐渐变小,可见该实验是将硫酸溶液逐滴滴入到盛有氢氧化钾溶液的烧杯中,选项C不正确;
D.图中b点溶液的pH=7,此时硫酸和氢氧化钾恰好完全反应,继续加入稀硫酸,稀硫酸不和溶液中的其他物质反应,因此溶液的酸性逐渐增强,pH继续减小。根据分析,虽然由c点到d点的变化过程中溶液pH继续减小,但变化中没有生成新物质,没有发生化学反应,选项D正确。故选D。
7.B
【解析】
向稀硫酸中逐滴滴加Ba(OH)2溶液至过量,硫酸和氢氧化钡反应生成硫酸钡沉淀和水,最终氢氧化钡溶液过量。
A.随着反应进行沉淀量变多,反应完毕,沉淀质量恒定,合理;
B.两者生成水,氢氧化钡溶液中也含有溶剂水,所以水的质量一直在增加,不合理;
C.向稀硫酸中逐滴滴加Ba(OH)2溶液至过量,开始显酸性,PH小于7;恰好反应显中性,PH等于7;最终氢氧化钡溶液过量显碱性,PH大于7,合理;
D.向稀硫酸中逐滴滴加Ba(OH)2溶液至过量,开始溶液中溶质是硫酸,随反应硫酸减少,恰好反应时液体只有水,继续滴加氢氧化钡溶液,溶质变为过量的氢氧化钡,溶质质量增加,合理。
故选B
8.A
【解析】
稀盐酸和氢氧化钠反应生成氯化钠和水。
A.由图像可知,溶液的pH值由大于7变成小于7,则溶液是将稀盐酸通入到氢氧化钠溶液中,则图中x是稀盐酸,故A不正确;
B.a点溶液中溶质是氢氧化钠和稀盐酸与氢氧化钠反应生成的氯化钠,则含有两种溶质,故B正确;
C.b点溶液的pH=7,表示两溶液恰好完全反应,故C正确;
D.溶液的pH值由大于7变成小于7,则滴加方式是将稀盐酸滴入到氢氧化钠溶液中,故D正确。故选A。
9.D
【解析】
A.鸡蛋清的pH为7.6~8.0,呈弱碱性,正确;B.泡菜的pH为3.2~3.6,呈酸性,胃酸过多的人不宜多吃,正确;C.橘子汁呈酸性,石蕊试液在酸性溶液中变红,正确;D.牛奶和橘子汁的pH都小于7,显酸性,牛奶的pH比橘子汁的pH大,酸性比橘子汁弱,错误。故选D。
10.D
【解析】
A.由图象可知,pH值是开始时大于7逐渐减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钠溶液中,故A选项说法错误;
B.a点时的溶液的pH大于7,显碱性,滴加无色酚酞试液,酚酞试液变红色,故B选项说法错误;
C.c点时的溶液的pH小于7,显酸性,溶质有氯化钠、氯化氢,故C选项说法错误;
D.稀盐酸和氢氧化钠反应生成氯化钠和水,该反应的微观实质是H+和OH﹣结合生成H2O,故D选项说法正确。
故选D。
【点睛】
11.B
【解析】
A.打开浓盐酸试剂瓶瓶塞,能闻到刺激性气味,是因为氯化氢分子是在不断的运动的,正确;
B.滴加洗涤剂能将餐具上的油污洗掉,是因为洗涤剂有乳化作用,能将大的油珠分散成细小的油滴随水冲走,错误;
C.吃松花蛋时可加入少量食醋,因为食醋能与蛋中所含碱性物质发生反应,能消除蛋中所含碱性物质的涩味,正确;
D.海水晒盐是海水中溶解的氯化钠因蒸发溶剂而达到饱和结晶析出,正确。
故选B。
12.D
【解析】
A.稀盐酸与氯化钠未发生反应,氢氧化钠与稀盐酸反应生成了氯化钠和水,不符合题意;
B.氢氧化钠与稀盐酸反应生成了新物质氯化钠和水,氯化钠与稀盐酸未产生新物质,不符合题意;
C.氢氧化钠显碱性,加入稀盐酸后,生成了氯化钠和水,氯化钠显中性;氯化钠显中性,加入稀盐酸后,溶液显酸性,不符合题意;
D.图甲可表示酸碱反应的实质是氢离子与氢氧根离子结合生成水,符合题意。
故选D。
13.C
【解析】
A.中和反应生成盐和水,但是生成盐和水的反应不一定是中和反应,如酸和金属氧化物反应生成盐和水就不是中和反应,A错误;
B.酸与碱发生中和反应时有热量放出,但是有热量放出的反应不一定是中和反应,如氧化钙和水反应生成氢氧化钙就放热,但不是中和反应,B错误;
C.复分解反应中有沉淀、气体或水生成,但有上述物质生成的反应不一定是复分解反应,如酸和金属反应生成盐和氢气,C正确;
D.HCl和NaOH反应生成盐和水,但是有盐和水生成的反应不都是复分解反应,如酸和金属氧化物反应生成盐和水就不是中和反应,D错误。
故选:C。
14.A
【解析】
设100 g10%的氢氧化钠溶液与质量为x的氯化氢恰好完全反应,
100 g10%的盐酸中含有氯化氢的质量为100 g×10%=10 g>9.125 g,所以反应后盐酸有剩余,溶液呈酸性,能使石蕊试液变红,
故选A。
15.C
【解析】
A.硫酸和硫酸镁溶液均能与氢氧化钠反应,不但能把硫酸除去,也会把硫酸镁除去,且在不用指示剂的条件下,不好判断反应是否恰好进行,容易引入新的杂质氢氧化钠,故选项所采取的方法错误;
B.硫酸和硫酸镁溶液均能与浓氨水反应,不但能把硫酸除去,也会把硫酸镁除去,且在不用指示剂的条件下,不好判断反应是否恰好进行,容易引入新的杂质浓氨水,故选项所采取的方法错误;
C.硫酸能与氢氧化镁反应生成硫酸镁和水,再过滤除去过量的难溶于水的氢氧化镁,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确;
D.氧化钾与硫酸反应生成硫酸钾和水,氧化钾能与水反应生成氢氧化钾,生成的氢氧化钾能与硫酸镁反应生成氢氧化镁沉淀和硫酸钾,在不用指示剂的条件下,不好判断反应是否恰好进行,容易引入新的杂质氢氧化钾,故选项所采取的方法错误。
故选:C。
16. H+ SO42- H2SO4+Ba(OH)2═BaSO4↓+2H2O Ba2+、H+、OH-、SO42- 4
【解析】
(1)H2SO4在水中会解离出氢离子和硫酸根离子,两种离子的符号分别为H+、SO42-;
(2)硫酸和氢氧化钡反应生成物是硫酸钡和水,用观察法配平即可,所以方程式是:H2SO4+Ba(OH)2═BaSO4↓+2H2O;该反应前后溶液中数目发生变化的阴、阳离子是:H+、Ba2+、SO42-、OH-;
(3)硫酸与氯化钡可产生硫酸钡沉淀、与氢氧化钠可形成水、与碳酸钾可生成水与二氧化碳,氯化钡与碳酸钠可形成碳酸钡沉淀,符合复分解反应产生水或气体或沉淀的发生条件,而氯化钡与氢氧化钠、氢氧化钠与碳酸钠因不能形成气体、水或沉淀而不能发生复分解反应,因此“硫酸、氯化钡、氢氧化钠、碳酸钾”四种 物质的溶液两两混合,共能发生 4 个反应.
17.3.7 10 AD 玻璃片或白瓷板 溶液由红色变成无色 D
【解析】
(1)①所配稀盐酸中溶质的质量=1000 g×0.37%=3.7 g,所需浓盐酸的质量=3.7 g37%=
10 g;
②所需浓盐酸的体积=10 g1.19 g/cm3≈8.4 mL,应选用10 mL量筒和胶头滴管进行量取;
③测定所配稀盐酸的酸碱度,应将pH试纸放置在玻璃片或白瓷板上,用玻璃棒蘸取待测液滴到pH试纸上再与标准比色卡进行比较;
(2)氢氧化钙溶于水显碱性,滴加1滴酚酞溶液,溶液变红,再滴加稀盐酸至反应完全,盐酸和氢氧化钙反应生成氯化钙和水,溶液显中性,溶液由红色变成无色;
(3)①铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程为:;
②取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸,若铁过量或盐酸过量都会生成等质量的氢气,铁粉比铁片与盐酸的接触面积大,反应速率快,所用时间少,对比四个选项,只有D项正确。
18.溶解由红色变为无色 H+、OH- ABC
【解析】
(1)酚酞遇碱性溶液变为红色,遇酸性溶液或中性溶液不变色,因此向氢氧化钠溶液中滴加盐酸,溶液先呈碱性,使酚酞变红,而后变为中性至酸性,酚酞变为无色,因此现象为溶液由红色变为无色;
(2)发生中和反应,H+、OH-反应生成水,因此数目减少的离子是H+、OH-;
(3)A 取样,加入CuO粉末,氧化铜和稀盐酸反应生成氯化铜和水,溶液为蓝色则说明有稀盐酸,正确;B 取样,滴加NaOH溶液立即变红色说明没有稀盐酸,过一会变红色说明有稀盐酸,正确;C 取样,加入CaCO3粉末有气泡生成说明有稀盐酸,正确;D 取样,滴加AgNO3溶液,有白色沉淀生成只能说明有氯离子不能说明有稀盐酸剩余,因此选择ABC。
19.烧碱 酸
【解析】
氢氧化钠和盐酸反应生成氯化钠和水,氢氧化钠溶液显碱性,pH值大于7,盐酸显酸性,pH值小于7,
(1)分析A烧杯曲线pH的变化可知,A烧杯溶液的pH>7,将A烧杯中溶液注入B烧杯中,pH逐渐减小,所以A烧杯中的溶液为烧碱溶液;
(2)由化学方程式可知,
每36.5份质量的HCl与40份质量的NaOH恰好完全反应,所以质量和溶质质量分数都相同的盐酸和烧碱溶液反应后,盐酸过量,溶液中的溶质NaCl和HCl,所以两种溶液混合后,所得溶液显酸性;
(3)氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:。
20.Al(OH)3+3HCl═AlCl3+3H2O H+ Zn+2NaHSO4=ZnSO4+Na2SO4+H2↑
【解析】
(1)氢氧化铝与胃酸中的盐酸反应生成氯化铝和水,反应的化学方程式为:
Al(OH)3+3HCl═AlCl3+3H2O。故填:Al(OH)3+3HCl═AlCl3+3H2O;
(2)①反应前有某种粒子,反应后没有该粒子,则该粒子与与Zn发生了反应。由Zn和 NaHSO4溶液反应的微观示意图可知:实际与Zn反应的粒子是H+;故填:H+;
②烧杯中发生反应的化学方程式为:Zn+2NaHSO4=ZnSO4+Na2SO4+H2↑;故填:Zn+2NaHSO4=ZnSO4+Na2SO4+H2↑。
21.NaCl NaOH >
【解析】
盐酸与氢氧化钠反应生成氯化钠和水,反应的化学方程式为HCl+NaOH=NaCl+H2O。
(1)b点溶液显碱性,则氢氧化钠有剩余,故b点溶液中溶质为氯化钠和氢氧化钠,化学式为NaCl、NaOH;
(2)盐酸与氢氧化钙反应生成氯化钙和水,反应的化学方程式为2HCl+Ca(OH)2 =CaCl2+2H2O,即每73份质量的HCl与74份质量的氢氧化钙恰好完全反应,再根据盐酸与氢氧化钠反应的化学方程式,每36.5份质量的HCl与40份质量的氢氧化钠恰好完全反应,题中原稀盐酸的量不变,熟石灰的质量与n g原氢氧化钠溶液中溶质质量相等,则盐酸与氢氧化钙的反应中氢氧化钙有剩余,溶液显碱性,反应后的溶液的pH>7;
(3) 氢氧化钠在水溶液中电离出Na+和OH-,盐酸电离出H+和Cl-,反应后溶液中含有Na+、 Cl- 和水分子,故盐酸与氢氧化钠的反应实际上是H+ 和OH- 结合生成水分子的过程,故氢氧化钠和稀盐酸反应的离子方程式为H++OH-=H2O。
22.(1)钠离子和氯离子;(2)H++OH﹣═H2O
【解析】
氢氧化钠与盐酸反应生成氯化钠和水,实际参加反应的离子是氢离子和氢氧根离子,生成水分子。
(1)由氢氧化钠与盐酸反应示意图,反应前后没有发生变化的离子是钠离子和氯离子。
(2)氢氧化钠与盐酸反应生成氯化钠和水,实际参加反应的离子是氢离子和氢氧根离子,生成水分子,反应的离子方程式为。
23.碱 碱 中和
【解析】
根据中和反应的实质进行分析。
(1)胃酸显酸性,当人体中胃酸过多时,通常服用碱性药物。一种胃药叫胃舒平,主要成分是,与人体中胃酸反应,生成氯化铝和水,化学方程式:。
(2)改良酸性土壤通常用熟石灰,是因为熟石灰是碱性物质。某地土壤呈酸性是由于土壤中含有少量的硫酸,用熟石灰改良该土壤时发生反应生成硫酸钙和水,化学方程式:
(3)烧碱(NaOH)覆盖泄漏现场,所发生反应生成中性的硫酸钠和水,化学方程式为,消防官兵运用的中和反应的原理。
答案第1页,共2页
1
一、单选题,共15小题
1.下列说法中错误的是( )
A.印染厂的污水呈碱性,可以加入H2SO4进行中和
B.胃酸过多时,可以服用一些碱性药物来中和
C.熟石灰可用于降低土壤的酸性
D.要消除蚊虫在人皮肤内分泌的蚁酸,可以在皮肤上涂抹一些食用醋
2.下列属于中和反应的是( )
A.
B.
C.
D.
3.下列实际应用中,利用中和反应原理的是( )
①用氢氧化钠溶液洗去石油产品中的残余硫酸;②用稀硫酸除铁锈;③用熟石灰改良酸性土壤;④用稀氨水涂抹在被蚊虫叮咬处(分泌出蚁酸)止痒;⑤用生石灰作食品干燥剂。
A.①③⑤ B.③④⑤ C.①②④ D.①③④
4.如图是NaOH溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论正确的是( )
A.反应后溶液的pH=0
B.反应前两种溶液均能导电,反应后的溶液不导电
C.反应后溶液中的粒子只有Na+和Cl
D.反应前后各元素的化合价均无变化
5.室温下,将氢氧化钠溶液滴加到盛有一定量稀盐酸的容器中,边滴边搅拌,用数字pH仪连接电脑实时测得pH变化曲线如图。下列相关叙述错误的是
A.容器中发生的反应属于中和反应 B.a点溶液能使紫色石蕊溶液变红
C.b点表示HCl与NaOH等质量反应 D.c点溶液中的溶质是NaCl和NaOH
6.某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是( )
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸溶液的烧杯中
D.由c点到d点的变化过程中没有发生化学反应
7.向稀硫酸中逐滴滴加Ba(OH)2溶液至过量,反映有关变化的图象不合理的是( )
A. B.C. D.
8.如图是室温下稀盐酸与氢氧化钠溶液反应过程中pH变化的曲线图,下列说法错误的是( )
A.图中x是氢氧化钠溶液
B.a点溶液中含有两种溶质
C.b点表示两溶液恰好完全反应
D.滴加方式是将稀盐酸滴入到氢氧化钠溶液中
9.一些食物pH 的近似值范围如下:橘子汁3.0~4.0;泡菜3.2~3.6;牛奶6.3~6.6;鸡蛋清7.6~8.0。下列说法中,不正确的是( )
A.鸡蛋清显碱性
B.胃酸过多的人应少吃泡菜
C.橘子汁能使紫色石蕊溶液变红
D.牛奶比橘子汁的酸性强
10.实验小组用pH传感器探究稀盐酸和氢氧化钠溶液的反应,实验中溶液pH的变化如图所示。下列说法正确的是( )
A.该实验是将氢氧化钠溶液滴加到稀盐酸中
B.向a点时的溶液中滴加无色酚酞试液,酚酞试液不变色
C.c点时的溶液中溶质只有氯化钠
D.该反应的微观实质是H+和OH-结合生成H2O
11.根据你的化学知识和生活经验判断,下列说法错误的是( )
A.打开浓盐酸试剂瓶瓶塞,能闻到刺激性气味,是因为分子在不断地运动
B.滴加洗涤剂能将餐具上的油污洗掉,因为洗涤剂能溶解油污
C.吃松花蛋时可加入少量食醋,因为食醋能消除蛋中所含碱性物质的涩味
D.海水晒盐是海水中溶解的氯化钠因蒸发溶剂而结晶析出
12.将稀盐酸分别滴入NaOH溶液和NaCl溶液中 ,充分混合后均无明显现象。混合后相关变化的微观示意图如下,下列说法正确的是( )
A.物质间均未发生化学反应 B.变化中都有新物质产生
C.混合后溶液酸碱性都不变 D.图甲可表示酸碱反应的实质
13.下列推理正确的是( )
A.中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
B.酸与碱发生中和反应时有热量放出,所以有热量放出的反应一定是中和反应
C.复分解反应中有沉淀、气体或水生成,但有上述物质生成的反应不一定是复分解反应
D.HCl和NaOH反应生成盐和水,故有盐和水生成的反应都是复分解反应
14.质量分数为的氢氧化钠溶液和质量分数为的盐酸溶液混合,反应后滴入几滴紫色石蕊溶液,则溶液呈( )
A.红色 B.蓝色 C.紫色 D.无法判断
15.若将含有硫酸的硫酸镁溶液中和至中性,在不用指示剂的条件下,加入的试剂可行的是( )
A.氢氧化钠 B.浓氨水 C.氢氧化镁 D.氧化钾
二、填空题,共6小题
16.复分解反应的实质就是酸碱盐解离出一些阴、阳离子相互结合生成难解离的水、气体或沉淀,根据下列部分碱盐的溶解性表 20℃,回答下列问题:
溶 溶 溶
溶 溶 不
溶 溶 不
溶 溶 溶
(1)H2SO4 在水中能解离出的离子是________(填离子符号)。
(2)向稀硫酸中滴入氢氧化钡溶液的化学反应方程式为________,该反应前后溶 液中数目发生变化的阴阳离子是________(填离子符号)。
(3)根据溶解性表及复分解反应的实质判断,将“硫酸、氯化钡、氢氧化钠、碳酸钾”四种物质的溶液两两混合,能发生的反应有________个。
17.盐酸是重要的化工原料,也是实验室中最常用的化学试剂之一。
(1)用质量分数为37%的浓盐酸配制1000 g质量分数为0.37%(pH约为1)的稀盐酸。
①所配稀盐酸中溶质的质量为________g,所需浓盐酸的质量为________g。
②已知浓盐酸密度为1.19 g/cm3,量取上述所需浓盐酸用到的仪器是_______(填标号)。
A.10 mL量筒
B.50 mL量筒
C.试管
D.胶头滴管
③测定所配稀盐酸的酸碱度,应将pH试纸放置在__________上。
(2)取少量氢氧化钙粉末于试管中,加入2 mL水,振荡,得到白色浑浊液,滴加1滴酚酞溶液,再滴加稀盐酸至反应完全,可观察到的现象是_________。
(3)取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸。
①铁与稀盐酸反应的化学方程式为________。
②下列示意图中,与实验结果相符的是_________(填标号)。
18.根据下图回答问题:
(1)加入稀盐酸至过量能观察到的现象是____________________。
(2)反应中,数目减少的离子是_____________(填离子符号);
(3)验证反应后溶液中稀盐酸有剩余,下列操作可行的是______________。
A.取样,加入CuO粉末
B.取样,滴加NaOH溶液
C.取样,加入CaCO3粉末
D.取样,滴加AgNO3溶液
19.A、B两烧杯中分别盛有质量和溶质质量分数都相同的盐酸和烧碱溶液。若将A烧杯中溶液注入B烧杯中,B烧杯中溶液的pH按图线①变化;若将B烧杯中溶液注入A烧杯A烧杯中溶液的pH按图线②变化。
(1)A烧杯中溶液为__________溶液。
(2)两种溶液混合后,所得溶液显__________(填“酸”“碱”或“中”)性。
(3)写出发生反应的化学方程式__________。
20.化学就在我们身边,人类的衣食住行都离不开化学。
(1)小明家有一个急救小药箱,其中一种药品是“斯达舒”,可用于缓解胃酸过多引起的胃痛,其主要成分之一是氢氧化铝。氢氧化铝与胃酸发生中和反应的化学方程式为_______。
(2)如图为Zn和NaHSO4溶液反应的微观示意图,回答下列问题:
①实际与Zn反应的粒子是_______。
②写出烧杯中发生反应的化学方程式_______。
21.如图是某化学小组向一定量稀盐酸中滴入氢氧化钠溶液时用pH传感器测得的pH变化图像。
(1)b点溶液中溶质的化学式为___________。
(2)若保持原稀盐酸的量不变,改用与n g原氢氧化钠溶液中溶质质量相等的熟石灰与其反应,则反应后的溶液的pH___________(填“>”“<”或“=”)。
(3)用实际参加化学反应的离子符号表示化学反应的式子叫离子方程式。请写出氢氧化钠和稀盐酸反应的离子方程式___________。
三、简答题,共2小题
22.如图是氢氧化钠与盐酸反应示意图。
(1)反应前后没有发生变化的离子有哪些?
(2)用实际参加反应的离子符号来表示反应的式子叫做离子方程式。请写出氢氧化钠与盐酸反应的离子方程式。
23.中和反应有着广泛应用。
(1)中和反应应用于医药卫生方面,当人体中胃酸过多时,通常服用_____性药物。一种胃药叫胃舒平,主要成分是,写出其与人体中胃酸反应的化学方程式:_____。
(2)中和反应可应用在农业改良土壤方面,改良酸性土壤通常用熟石灰,是因为熟石灰是_____性物质。某地土壤呈酸性是由于土壤中含有少量的硫酸,请写出用熟石灰改良该土壤时所发生反应的化学方程式:_____。
(3)据报道,某地一辆载着硫酸的罐车突然翻车,导致大量硫酸泄漏,赶到现场的消防官兵用大量的烧碱(NaOH)覆盖泄漏现场,此时所发生反应的化学方程式为_____,消防官兵运用的是_____反应的原理。
参考答案
1.D
【解析】
A.印染厂的污水呈碱性,可以加入H2SO4进行中和,故正确;
B.胃酸过多时,可以服用一些碱性药物来中和,故正确;
C.熟石灰显碱性,可用于降低土壤的酸性,故正确;
D.蚊虫叮咬皮肤时会分泌蚁酸引起皮肤肿痛,可在叮咬处涂抹碱性的肥皂水,中和蚁酸,而不能涂酸性的食醋,故错误。
故选:D。
2.C
【解析】
A.CO2+Ca(OH)2═CaCO3↓+H2O,该反应的反应物是非金属氧化物和碱,不属于中和反应,故选项错误;
B.,该反应的反应物是金属氧化物和酸,不属于中和反应,故选项错误;
C.,是酸与碱反应生成盐和水,属于中和反应,故选项正确;
D.,该反应的反应物是盐和酸,不属于中和反应,故选项错误。
故选:C。
【点睛】
中和反应是指酸和碱作用生成盐和水的反应,判断中和反应时一要看反应物是否是酸和碱,二是看生成物是否是盐和水,二者缺一不可。
3.D
【解析】
①氢氧化钠属于碱,硫酸属于酸,氢氧化钠与硫酸的反应属于中和反应,故与中和反应原理有关;
②铁锈的主要成分是氧化铁,氧化铁是金属氧化物,不是碱,故用稀硫酸除铁锈与中和反应原理无关;
③熟石灰为氢氧化钙,属于碱,用于改良酸性土壤属于酸和碱的反应,故与中和反应原理有关;
④蚊虫叮咬会分泌出的蚁酸等酸性物质,而氨水是碱性物质,可以中和其中的酸性物质,即利用了酸碱中和反应,故与中和反应原理有关;
⑤生石灰是碱性氧化物,不是碱,和水反应,水也不是酸,生石灰和水的反应不是中和反应,故与中和反应原理无关;
故选:D。
4.D
【解析】
A.根据反应后的容器中的离子可以看出,反应后的溶液中只有氯离子、钠离子、水分子,所以溶液显中性,pH等于7,故选项错误;
B.溶液导电是靠溶液中带电的离子导电的,反应后的溶液中存在带正电的钠离子和带负电的氯离子,所以反应后的溶液能导电,故选项错误;
C.反应后的溶液中除了钠离子和氯离子外,还有水分子,故选项错误;
D.钠元素、氢元素反应前后的化合价都是+1,氯元素反应前后的化合价是-1,氧元素的化合价都是-2,反应前后各元素的化合价均无变化,故选项正确。故选D。
5.C
【解析】
A.氢氧化钠是一种碱,盐酸是一种酸,酸碱作用生成盐和水的反应属于中和反应,选项说法正确;
B.a点所示溶液的,溶液显酸性,能使紫色的石蕊试液变红色,选项说法正确;
C.b点所示溶液的,呈中性,说明HCl与NaOH恰好完全反应,化学方程式以及物质间的质量关系为:
由此可知,恰好反应时,HCl与NaOH质量并不相等,选项说法错误;
D.c点所示溶液的,溶液呈碱性,即溶液中的溶质是氯化钠和氢氧化钠,选项说法正确。
故选:C。
6.D
【解析】
A.根据图示,c点所示溶液pH﹤7,呈酸性,选项A不正确;
B.从图中溶液的pH由大逐渐变小可知,该实验是将硫酸溶液逐滴滴入到盛有氢氧化钾溶液的烧杯中,图中a点所示溶液pH﹥7,呈碱性,溶液中氢氧化钾没有全部被反应,溶液中含有的溶质应该是K2SO4和KOH,选项B不正确;
C.根据图中溶液的pH变化情况,溶液的pH起点大于7,且随着试剂的加入pH由大逐渐变小,可见该实验是将硫酸溶液逐滴滴入到盛有氢氧化钾溶液的烧杯中,选项C不正确;
D.图中b点溶液的pH=7,此时硫酸和氢氧化钾恰好完全反应,继续加入稀硫酸,稀硫酸不和溶液中的其他物质反应,因此溶液的酸性逐渐增强,pH继续减小。根据分析,虽然由c点到d点的变化过程中溶液pH继续减小,但变化中没有生成新物质,没有发生化学反应,选项D正确。故选D。
7.B
【解析】
向稀硫酸中逐滴滴加Ba(OH)2溶液至过量,硫酸和氢氧化钡反应生成硫酸钡沉淀和水,最终氢氧化钡溶液过量。
A.随着反应进行沉淀量变多,反应完毕,沉淀质量恒定,合理;
B.两者生成水,氢氧化钡溶液中也含有溶剂水,所以水的质量一直在增加,不合理;
C.向稀硫酸中逐滴滴加Ba(OH)2溶液至过量,开始显酸性,PH小于7;恰好反应显中性,PH等于7;最终氢氧化钡溶液过量显碱性,PH大于7,合理;
D.向稀硫酸中逐滴滴加Ba(OH)2溶液至过量,开始溶液中溶质是硫酸,随反应硫酸减少,恰好反应时液体只有水,继续滴加氢氧化钡溶液,溶质变为过量的氢氧化钡,溶质质量增加,合理。
故选B
8.A
【解析】
稀盐酸和氢氧化钠反应生成氯化钠和水。
A.由图像可知,溶液的pH值由大于7变成小于7,则溶液是将稀盐酸通入到氢氧化钠溶液中,则图中x是稀盐酸,故A不正确;
B.a点溶液中溶质是氢氧化钠和稀盐酸与氢氧化钠反应生成的氯化钠,则含有两种溶质,故B正确;
C.b点溶液的pH=7,表示两溶液恰好完全反应,故C正确;
D.溶液的pH值由大于7变成小于7,则滴加方式是将稀盐酸滴入到氢氧化钠溶液中,故D正确。故选A。
9.D
【解析】
A.鸡蛋清的pH为7.6~8.0,呈弱碱性,正确;B.泡菜的pH为3.2~3.6,呈酸性,胃酸过多的人不宜多吃,正确;C.橘子汁呈酸性,石蕊试液在酸性溶液中变红,正确;D.牛奶和橘子汁的pH都小于7,显酸性,牛奶的pH比橘子汁的pH大,酸性比橘子汁弱,错误。故选D。
10.D
【解析】
A.由图象可知,pH值是开始时大于7逐渐减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钠溶液中,故A选项说法错误;
B.a点时的溶液的pH大于7,显碱性,滴加无色酚酞试液,酚酞试液变红色,故B选项说法错误;
C.c点时的溶液的pH小于7,显酸性,溶质有氯化钠、氯化氢,故C选项说法错误;
D.稀盐酸和氢氧化钠反应生成氯化钠和水,该反应的微观实质是H+和OH﹣结合生成H2O,故D选项说法正确。
故选D。
【点睛】
11.B
【解析】
A.打开浓盐酸试剂瓶瓶塞,能闻到刺激性气味,是因为氯化氢分子是在不断的运动的,正确;
B.滴加洗涤剂能将餐具上的油污洗掉,是因为洗涤剂有乳化作用,能将大的油珠分散成细小的油滴随水冲走,错误;
C.吃松花蛋时可加入少量食醋,因为食醋能与蛋中所含碱性物质发生反应,能消除蛋中所含碱性物质的涩味,正确;
D.海水晒盐是海水中溶解的氯化钠因蒸发溶剂而达到饱和结晶析出,正确。
故选B。
12.D
【解析】
A.稀盐酸与氯化钠未发生反应,氢氧化钠与稀盐酸反应生成了氯化钠和水,不符合题意;
B.氢氧化钠与稀盐酸反应生成了新物质氯化钠和水,氯化钠与稀盐酸未产生新物质,不符合题意;
C.氢氧化钠显碱性,加入稀盐酸后,生成了氯化钠和水,氯化钠显中性;氯化钠显中性,加入稀盐酸后,溶液显酸性,不符合题意;
D.图甲可表示酸碱反应的实质是氢离子与氢氧根离子结合生成水,符合题意。
故选D。
13.C
【解析】
A.中和反应生成盐和水,但是生成盐和水的反应不一定是中和反应,如酸和金属氧化物反应生成盐和水就不是中和反应,A错误;
B.酸与碱发生中和反应时有热量放出,但是有热量放出的反应不一定是中和反应,如氧化钙和水反应生成氢氧化钙就放热,但不是中和反应,B错误;
C.复分解反应中有沉淀、气体或水生成,但有上述物质生成的反应不一定是复分解反应,如酸和金属反应生成盐和氢气,C正确;
D.HCl和NaOH反应生成盐和水,但是有盐和水生成的反应不都是复分解反应,如酸和金属氧化物反应生成盐和水就不是中和反应,D错误。
故选:C。
14.A
【解析】
设100 g10%的氢氧化钠溶液与质量为x的氯化氢恰好完全反应,
100 g10%的盐酸中含有氯化氢的质量为100 g×10%=10 g>9.125 g,所以反应后盐酸有剩余,溶液呈酸性,能使石蕊试液变红,
故选A。
15.C
【解析】
A.硫酸和硫酸镁溶液均能与氢氧化钠反应,不但能把硫酸除去,也会把硫酸镁除去,且在不用指示剂的条件下,不好判断反应是否恰好进行,容易引入新的杂质氢氧化钠,故选项所采取的方法错误;
B.硫酸和硫酸镁溶液均能与浓氨水反应,不但能把硫酸除去,也会把硫酸镁除去,且在不用指示剂的条件下,不好判断反应是否恰好进行,容易引入新的杂质浓氨水,故选项所采取的方法错误;
C.硫酸能与氢氧化镁反应生成硫酸镁和水,再过滤除去过量的难溶于水的氢氧化镁,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确;
D.氧化钾与硫酸反应生成硫酸钾和水,氧化钾能与水反应生成氢氧化钾,生成的氢氧化钾能与硫酸镁反应生成氢氧化镁沉淀和硫酸钾,在不用指示剂的条件下,不好判断反应是否恰好进行,容易引入新的杂质氢氧化钾,故选项所采取的方法错误。
故选:C。
16. H+ SO42- H2SO4+Ba(OH)2═BaSO4↓+2H2O Ba2+、H+、OH-、SO42- 4
【解析】
(1)H2SO4在水中会解离出氢离子和硫酸根离子,两种离子的符号分别为H+、SO42-;
(2)硫酸和氢氧化钡反应生成物是硫酸钡和水,用观察法配平即可,所以方程式是:H2SO4+Ba(OH)2═BaSO4↓+2H2O;该反应前后溶液中数目发生变化的阴、阳离子是:H+、Ba2+、SO42-、OH-;
(3)硫酸与氯化钡可产生硫酸钡沉淀、与氢氧化钠可形成水、与碳酸钾可生成水与二氧化碳,氯化钡与碳酸钠可形成碳酸钡沉淀,符合复分解反应产生水或气体或沉淀的发生条件,而氯化钡与氢氧化钠、氢氧化钠与碳酸钠因不能形成气体、水或沉淀而不能发生复分解反应,因此“硫酸、氯化钡、氢氧化钠、碳酸钾”四种 物质的溶液两两混合,共能发生 4 个反应.
17.3.7 10 AD 玻璃片或白瓷板 溶液由红色变成无色 D
【解析】
(1)①所配稀盐酸中溶质的质量=1000 g×0.37%=3.7 g,所需浓盐酸的质量=3.7 g37%=
10 g;
②所需浓盐酸的体积=10 g1.19 g/cm3≈8.4 mL,应选用10 mL量筒和胶头滴管进行量取;
③测定所配稀盐酸的酸碱度,应将pH试纸放置在玻璃片或白瓷板上,用玻璃棒蘸取待测液滴到pH试纸上再与标准比色卡进行比较;
(2)氢氧化钙溶于水显碱性,滴加1滴酚酞溶液,溶液变红,再滴加稀盐酸至反应完全,盐酸和氢氧化钙反应生成氯化钙和水,溶液显中性,溶液由红色变成无色;
(3)①铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程为:;
②取等质量的铁片和铁粉放入两支试管中,分别加入相同体积相同浓度的稀盐酸,若铁过量或盐酸过量都会生成等质量的氢气,铁粉比铁片与盐酸的接触面积大,反应速率快,所用时间少,对比四个选项,只有D项正确。
18.溶解由红色变为无色 H+、OH- ABC
【解析】
(1)酚酞遇碱性溶液变为红色,遇酸性溶液或中性溶液不变色,因此向氢氧化钠溶液中滴加盐酸,溶液先呈碱性,使酚酞变红,而后变为中性至酸性,酚酞变为无色,因此现象为溶液由红色变为无色;
(2)发生中和反应,H+、OH-反应生成水,因此数目减少的离子是H+、OH-;
(3)A 取样,加入CuO粉末,氧化铜和稀盐酸反应生成氯化铜和水,溶液为蓝色则说明有稀盐酸,正确;B 取样,滴加NaOH溶液立即变红色说明没有稀盐酸,过一会变红色说明有稀盐酸,正确;C 取样,加入CaCO3粉末有气泡生成说明有稀盐酸,正确;D 取样,滴加AgNO3溶液,有白色沉淀生成只能说明有氯离子不能说明有稀盐酸剩余,因此选择ABC。
19.烧碱 酸
【解析】
氢氧化钠和盐酸反应生成氯化钠和水,氢氧化钠溶液显碱性,pH值大于7,盐酸显酸性,pH值小于7,
(1)分析A烧杯曲线pH的变化可知,A烧杯溶液的pH>7,将A烧杯中溶液注入B烧杯中,pH逐渐减小,所以A烧杯中的溶液为烧碱溶液;
(2)由化学方程式可知,
每36.5份质量的HCl与40份质量的NaOH恰好完全反应,所以质量和溶质质量分数都相同的盐酸和烧碱溶液反应后,盐酸过量,溶液中的溶质NaCl和HCl,所以两种溶液混合后,所得溶液显酸性;
(3)氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:。
20.Al(OH)3+3HCl═AlCl3+3H2O H+ Zn+2NaHSO4=ZnSO4+Na2SO4+H2↑
【解析】
(1)氢氧化铝与胃酸中的盐酸反应生成氯化铝和水,反应的化学方程式为:
Al(OH)3+3HCl═AlCl3+3H2O。故填:Al(OH)3+3HCl═AlCl3+3H2O;
(2)①反应前有某种粒子,反应后没有该粒子,则该粒子与与Zn发生了反应。由Zn和 NaHSO4溶液反应的微观示意图可知:实际与Zn反应的粒子是H+;故填:H+;
②烧杯中发生反应的化学方程式为:Zn+2NaHSO4=ZnSO4+Na2SO4+H2↑;故填:Zn+2NaHSO4=ZnSO4+Na2SO4+H2↑。
21.NaCl NaOH >
【解析】
盐酸与氢氧化钠反应生成氯化钠和水,反应的化学方程式为HCl+NaOH=NaCl+H2O。
(1)b点溶液显碱性,则氢氧化钠有剩余,故b点溶液中溶质为氯化钠和氢氧化钠,化学式为NaCl、NaOH;
(2)盐酸与氢氧化钙反应生成氯化钙和水,反应的化学方程式为2HCl+Ca(OH)2 =CaCl2+2H2O,即每73份质量的HCl与74份质量的氢氧化钙恰好完全反应,再根据盐酸与氢氧化钠反应的化学方程式,每36.5份质量的HCl与40份质量的氢氧化钠恰好完全反应,题中原稀盐酸的量不变,熟石灰的质量与n g原氢氧化钠溶液中溶质质量相等,则盐酸与氢氧化钙的反应中氢氧化钙有剩余,溶液显碱性,反应后的溶液的pH>7;
(3) 氢氧化钠在水溶液中电离出Na+和OH-,盐酸电离出H+和Cl-,反应后溶液中含有Na+、 Cl- 和水分子,故盐酸与氢氧化钠的反应实际上是H+ 和OH- 结合生成水分子的过程,故氢氧化钠和稀盐酸反应的离子方程式为H++OH-=H2O。
22.(1)钠离子和氯离子;(2)H++OH﹣═H2O
【解析】
氢氧化钠与盐酸反应生成氯化钠和水,实际参加反应的离子是氢离子和氢氧根离子,生成水分子。
(1)由氢氧化钠与盐酸反应示意图,反应前后没有发生变化的离子是钠离子和氯离子。
(2)氢氧化钠与盐酸反应生成氯化钠和水,实际参加反应的离子是氢离子和氢氧根离子,生成水分子,反应的离子方程式为。
23.碱 碱 中和
【解析】
根据中和反应的实质进行分析。
(1)胃酸显酸性,当人体中胃酸过多时,通常服用碱性药物。一种胃药叫胃舒平,主要成分是,与人体中胃酸反应,生成氯化铝和水,化学方程式:。
(2)改良酸性土壤通常用熟石灰,是因为熟石灰是碱性物质。某地土壤呈酸性是由于土壤中含有少量的硫酸,用熟石灰改良该土壤时发生反应生成硫酸钙和水,化学方程式:
(3)烧碱(NaOH)覆盖泄漏现场,所发生反应生成中性的硫酸钠和水,化学方程式为,消防官兵运用的中和反应的原理。
答案第1页,共2页
1
