第四章物质结构元素周期律单元测试卷(含答案)2022-2023学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 第四章物质结构元素周期律单元测试卷(含答案)2022-2023学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 09:41:01 | ||
图片预览



文档简介
第四章 物质结构 元素周期律 单元测试题
一、选择题
1.类推是一种经常采用的科研和学习方法,下列类推结论合理的是
A.由钠在空气中燃烧产物是 Na2O2,推出锂在空气中燃烧产物是 Li2O2
B.由卤素单质熔点从上到下逐渐升高,推出碱金属元素单质熔点从上到下逐渐升高
C.由金属 Na 在常温下与水剧烈反应,推出金属 Cs 在常温下也能与水剧烈反应
D.由Cl2与水反应生成 HCl 和 HClO,推出F2 与水反应生成 HF 和 HFO
2.短周期主族元素X、Y、Z和W的原子序数依次增大,其形成的一种离子化合物的结构如下图所示。Y、Z位于同一周期,W形成的单质易溶于Y、W形成的一种溶剂中。下列说法错误的是
A.原子半径:W>Z>Y>X
B.元素的第一电离能:Z>Y
C.Z的最高价氧化物对应水化物的浓溶液需保存在棕色细口瓶中
D.常温下,W的气态氢化物与其某种氧化物反应可生成黄色固体
3.如图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是
A.最高价氧化物对应的水化物的碱性:Z<M
B.R单质可以从Y的盐溶液中置换出Y的单质
C.X、Y两种元素简单气态氢化物的稳定性:X<Y
D.简单离子的半径:Z>Y>X
4.五种短周期元素X、Y、Z、M、W的原子序数与其常见化合价的关系如图所示,则下列有关的叙述中,错误的是
A.元素X可能为锂 B.原子半径大小:r(M)>r(W)
C.X2W中各原子均达到8电子稳定结构 D.元素最高价氧化物对应水化物的酸性:W>M
5.短周期主族元素X、Y、Z、W的原子序数依次增大。X的原子半径小于Y的原子半径,Y是地壳中含量最高的元素,Z与X同主族,W的最外层电子数等于Y与Z的最外层电子数之和。下列有关说法错误的是
A.由Y、Z、W形成的化合物中溶于水可能有漂白性
B.原子半径的大小顺序为W>Y>Z>X
C.Y、Z可以形成电子层结构相同的离子,且离子半径前者大于后者
D.仅由X、Y两种元素可形成分别含有10e-和18e-的化合物
6.X、Y、Z、W为原子序数小于18的四种元素的原子。已知X的核外电子总数等于其电子层数;Y的最外层电子数是其次外层电子数的两倍;是空气的主要成分之一,是最常见的助燃剂;与氖原子核外电子排布相同。下列说法不正确的是
A.离子半径:
B.化合物WZX的水溶液是强碱
C.元素X、Z之间可以形成和两种共价化合物
D.的水溶液能导电,所以化合物属于电解质
7.X、Y、Z为第三周期元素,X的最高价与Z的最低价的绝对值相等,Y的简单离子半径在同周期离子中最小,X、Y、Z可以形成形式的化合物。下列说法错误的是
A.原子半径:Y>X>Z
B.同周期元素中,X元素的氢氧化物碱性最强
C.同周期元素形成的单质中,氧化性最强
D.离子中Y原子满足8电子结构
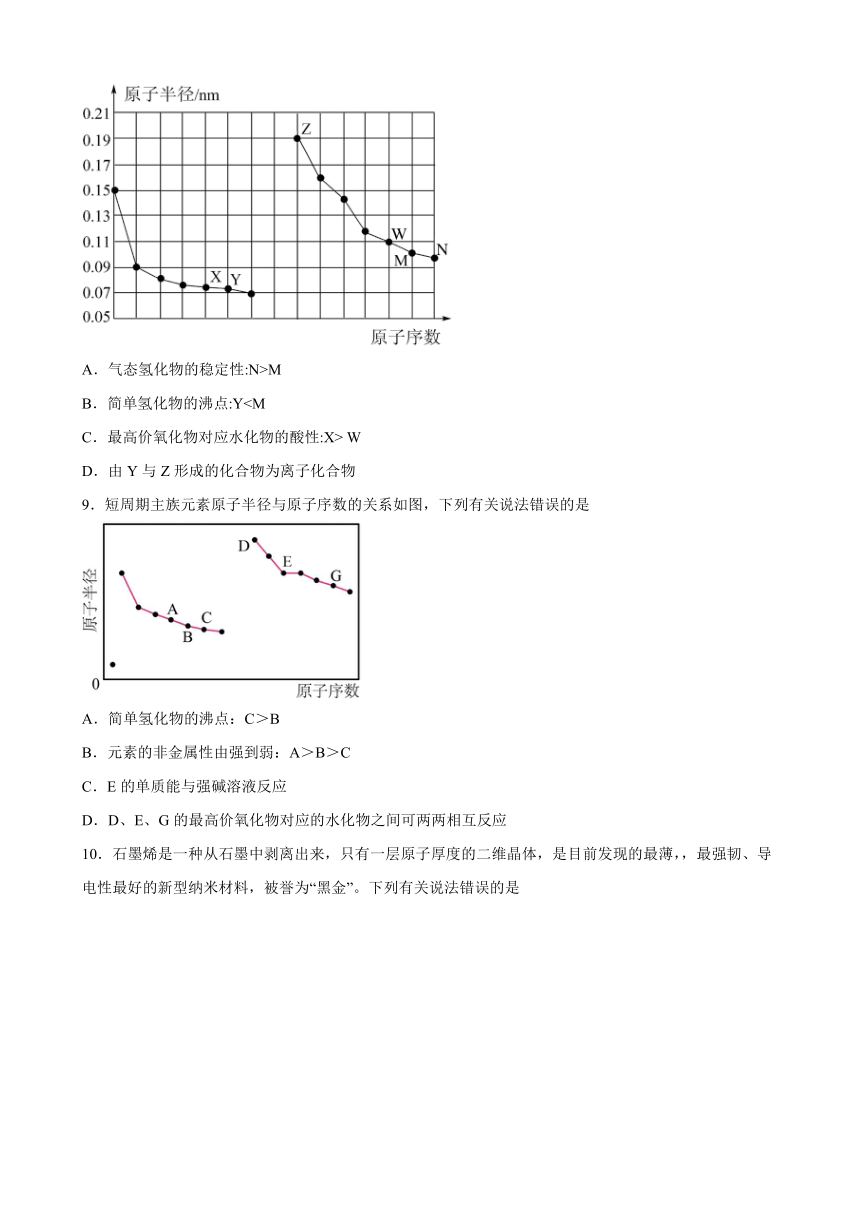
8.如图是部分短周期主族元素原子半径与原子序数的关系图。下列说法错误的是
A.气态氢化物的稳定性:N>M
B.简单氢化物的沸点:YC.最高价氧化物对应水化物的酸性:X> W
D.由Y与Z形成的化合物为离子化合物
9.短周期主族元素原子半径与原子序数的关系如图,下列有关说法错误的是
A.简单氢化物的沸点:C>B
B.元素的非金属性由强到弱:A>B>C
C.E的单质能与强碱溶液反应
D.D、E、G的最高价氧化物对应的水化物之间可两两相互反应
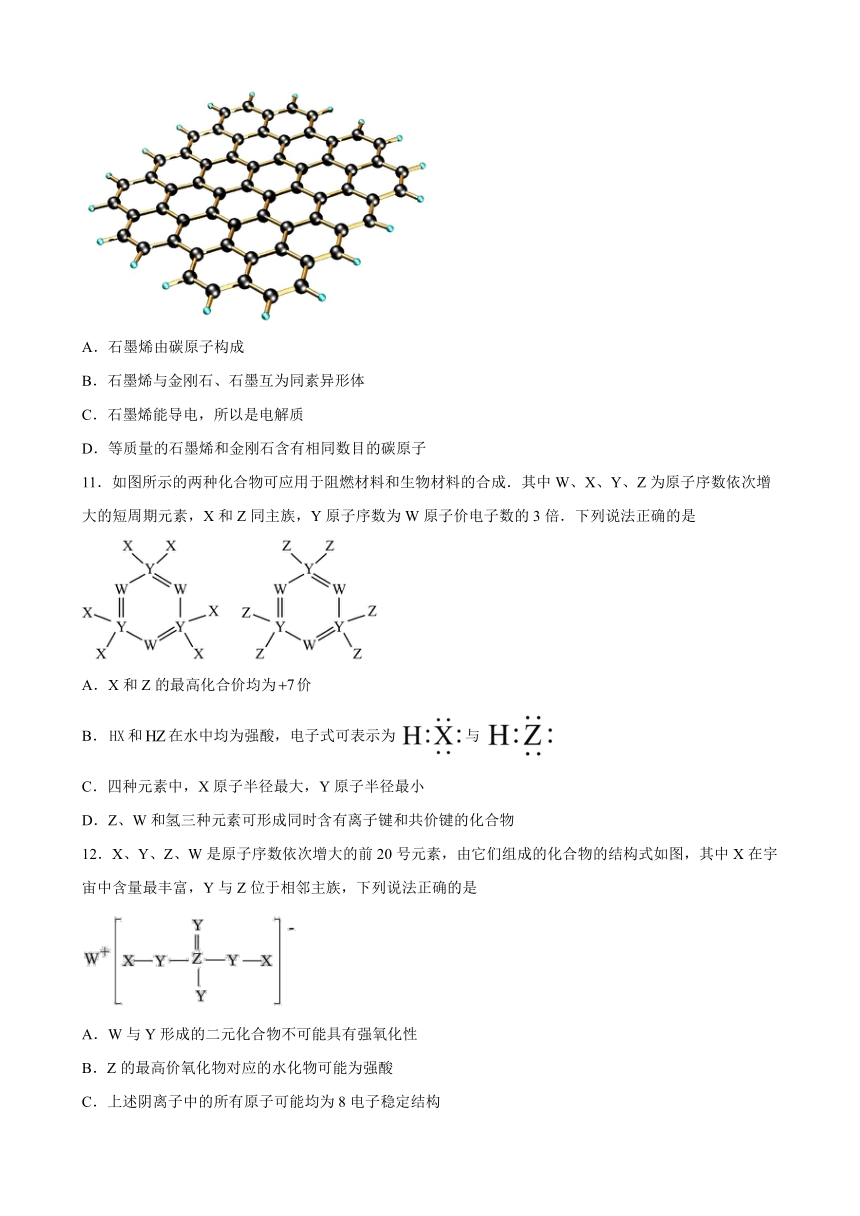
10.石墨烯是一种从石墨中剥离出来,只有一层原子厚度的二维晶体,是目前发现的最薄,,最强韧、导电性最好的新型纳米材料,被誉为“黑金”。下列有关说法错误的是
A.石墨烯由碳原子构成
B.石墨烯与金刚石、石墨互为同素异形体
C.石墨烯能导电,所以是电解质
D.等质量的石墨烯和金刚石含有相同数目的碳原子
11.如图所示的两种化合物可应用于阻燃材料和生物材料的合成.其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍.下列说法正确的是
A.X和Z的最高化合价均为价
B.和在水中均为强酸,电子式可表示为与
C.四种元素中,X原子半径最大,Y原子半径最小
D.Z、W和氢三种元素可形成同时含有离子键和共价键的化合物
12.X、Y、Z、W是原子序数依次增大的前20号元素,由它们组成的化合物的结构式如图,其中X在宇宙中含量最丰富,Y与Z位于相邻主族,下列说法正确的是
A.W与Y形成的二元化合物不可能具有强氧化性
B.Z的最高价氧化物对应的水化物可能为强酸
C.上述阴离子中的所有原子可能均为8电子稳定结构
D.X和Y组成的化合物可用于实验室制取Y的单质
13.短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径是短周期元素中最小的,Y是短周期中金属性最强的元素,元素Z的最高正价与最低负价代数和为4,下列说法正确的是
A.原子半径:W>Z> Y
B.简单离子的还原性:W >Z
C.最高价氧化物对应水化物的酸性:Z>W
D.X与Y形成化合物的水溶液可使红色石蕊试纸变蓝
14.四种短周期元素X、Y、Z和W在周期表中的位置如图所示,Z的原子序数是Y的两倍。下列说法不正确的是
X Y
Z W
A.Y和Z可形成共价化合物
B.原子半径:Z>W
C.最低价单核阴离子的还原性:Y>Z
D.氧化物对应的水化物的酸性:W>Z
二、填空题
15.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表列出了A-R九种元素在元素周期表中的位置,试用元素符号或化学式回答下列问题:
周期 主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 F
3 A C D E G R
4 B H
(1)B的离子结构示意图为___________,AD两最高价氧化物对应的的水化物反应的离子方程式是___________。
(2)在AC、D、F这些元素形成的最简单离子中,离子半径由大到小的顺序是___________(填离子符号),AC、D最高价氧化物对应水化物的碱性由强到弱为___________。
(3)由元素AF形成的一种杀菌消毒剂中存在的化学键有___________。
(4)由元素E和G形成的某种化合物可表示为(其中各原子均满足8电子稳定结构),写出的电子式:___________。
(5)已知常温下氯酸钾与浓盐酸反应放出气体,现按如图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是___________。
① ② ③ ④
A 黄绿色 橙色 蓝色 无色
B 无色 橙色 紫色 白色
C 黄绿色 橙色 蓝色 白色
D 黄绿色 无色 紫色 白色
A.A B.B C.C D.D
(6)G元素和H元素两者核电荷数之差是___________。
16.为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:
(1)据汞的原子结构示意图,汞在第_______周期。
(2)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断不正确的是_______。
a.硒元素的最低负化合价为-2
b.二氧化硒()具有还原性
c.硒的氧化物对应的水化物属于强酸
(3)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是,它的中子数为_______。
②已知与的性质相似,则对性质的推测不正确的是_______(填序号)。
a.含有离子键和共价键
b.能与溶液反应
c.与加热充分分解产物的种类完全一样
③下列关于第ⅤA族元素及其化合物的说法不正确的是_______(填字母)。
a.热稳定性: b.酸性:
c.的氧化物的水化物是强碱 d.形成的简单离子半径随着原子序数递增而增大
(4)砷酸()可用于制造杀虫剂、药物。溶于稀硝酸中可得砷酸,此反应的化学方程式:_______。
17.图是依据一定的分类标准,对某些物质与水反应情况进行分类:
(1)根据物质与水反应的情况,分成A、B组的分类依据是____________。
(2)A组中的CaO经常用作食品包装袋中的干燥剂,CaO所属物质类别为______(填序号)。
①金属氧化物 ②酸性氧化物 ③碱性氧化物 ④两性氧化物
(3)B组物质中,可用作潜水艇供氧剂的是______(填化学式)。B组→E组反应的离子方程式为______。
(4)工业上常用D组中的______(填化学式)消除C组中物质对大气的污染。
(5)实验室用制备时,可选择上述物质中某一物质的水溶液,该过程涉及的离子反应方程式为_______。
(6)C组中某一物质可使酸性溶液褪色,用离子方程式表示溶液褪色的原因____________。
(7)F组中,与水反应氧化剂与还原剂物质的量之比为1:1的物质是____________(填化学式)。
18.金属性与非金属性比较
金属性强弱判断依据
(1)元素周期表位置
①同周期从左到右,金属性_________。
②同主族从上到下,金属性_________。
(2)单质及化合物相关性质
①金属单质与水或酸反应越_________,元素金属性_________。
②___________________________的碱性越强,元素金属性_________。
③离子的氧化性_________,对应金属元素的金属性_________。
(3)金属活动顺序表
非金属性强弱判断依据
(4)元素周期表位置
①同周期从左到右,非金属性________。
②同主族从上到下,非金属性________。
(5)单质及化合物相关性质
①单质越易跟H2化合,生成的氢化物也就越____,氢化物的还原性____,其非金属性也就____。
②最高价氧化物对应水化物的____越强,其非金属性越____。
③非金属单质间的置换反应,非金属____的单质能置换出非金属性____的单质,如卤素。
④元素的原子对应阴离子的还原性越强,元素的非金属性就_______,如卤素。
⑤与同一可变价金属反应,金属元素在该产物中价态越高,该非金属元素的非金属性_______。如S、Cl元素。
19.同周期的元素性质递变规律
(1)钠、镁与水的反应
钠 镁
实验操作 实验① 实验②
实验现象 钠熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红 加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为粉红色
反应原理 ____________ ____________
结论 钠、镁均能与水反应,钠比镁活泼,金属性:_____________。
(2)Al(OH)3的制备与性质
实验探究:
①向AlCl3溶液中加入足量氨水,现象为__________,反应的离子方程式为__________;
②将①实验得到的沉淀分装两支试管中,一支试管中加入盐酸,现象为__________,离子方程式为_________;另一支试管中加入NaOH溶液,现象为________,离子方程式为______________。
③向MgCl2溶液加入过量NaOH溶液,现象_________,离子方程式为_____________。
两性氢氧化物:既能与酸反应又能与强碱反应,且均生成盐和水的氢氧化物。如 Al(OH)3。
(3)第三周期递变规律
①第三周期的Na、Mg、Al的金属性逐渐__________,NaOH、Mg(OH)2、Al(OH)3的碱性逐渐__________,NaOH为强碱,Mg(OH)2为中强碱,Al(OH)3为两性氢氧化物。
②第三周期的Si、P、S、Cl的非金属性逐渐__________,H3SiO3、H3PO4、H2SO4、HClO4的酸性逐渐__________。HClO4是最强的含氧酸,H2SiO3为难溶的弱酸,H3PO4为中强酸,H2SO4为强酸。
③同一周期从左到右,原子半径逐渐__________,失电子能力逐渐__________,得电子能力逐渐__________,金属性逐渐__________,非金属性逐渐__________。
三、元素或物质推断题
20.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题。
族 周期 ⅠA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③
3 ④ ⑤ ⑥ ⑦ ⑧ ⑨
(1)元素⑧的符号是_______。
(2)元素⑤和⑨形成的化合物的电子式是_______。
(3)元素③、⑤形成的简单离子中,半径较大的离子是_______。
(4)元素②、⑦形成的简单氢化物分子中稳定性较强的分子是_______。
(5)元素①、③、④形成的化合物中含有的化学键类型有_______。
(6)元素④的最高价氧化物对应水化物与元素⑥的最高价氧化物反应的化学方程式为_______。
21.X、Y、Z和Q是原子序数依次增大的4种短周期主族元素,其中Y、Z、Q在同一周期,其原子半径和最外层电子数之间的关系如图所示。
回答下列问题:
(1)X在元素周期表中的位置为_______。
(2)简单氢化物的稳定性:X_______Z(填“>”或“<”),X的简单氢化物从液态转化为气态时,需要克服的作用力有_______ (填序号)。
A.范德华力 B.极性共价键 C.离子键 D.氢键
(3)Y与X形成的一种化合物M为淡黄色固体,M与CO2反应的化学方程式为_______,由该反应原理可知M的一种用途为_______。
(4)Q单质及其化合物均是重要的化工原料,在疫情防控、污水处理等方面发挥着重要的作用。
①YQX溶液能有效地灭杀新冠病毒,常用于环境的消毒,YQX的电子式为_______。
②氨氮废水(含,中N元素为-3价)的处理是当前科学研究的热点问题之一。工业上常用Q的单质将酸性氨氮废水中转化为无毒无害的气体和水,发生反应的离子方程式是_______。
22.A、B、C、D、E、F是短周期主族元素,且原子序数依次增大。A元素的一种核素不含中子,D+与Ne核外电子排布相同,B的简单氢化物的水溶液呈碱性,C、E同主族,形成的化合物为EC2、EC3.回答下列问题:
(1)E在元素周期表中的位置为_______。F离子结构示意图为_______。
(2)比较B与C简单氢化物的热稳定性:_______>_______(填化学式),B、C、D三种元素简单离子的离子半径由大到小的顺序(用离子符号表示)_______。
(3)D、C两元素组成的化合物D2C2其电子式为_______,与水反应的化学方程式为_______。A与C两元素形成的1∶1的化合物的结构式为_______。
(4)用电子式表示化合物D2E的形成过程_______。
(5)比较E与F最高价氧化物对应水化物的酸性_______>_______(填化学式)。
参考答案:
1.C
【详解】A.锂在空气中燃烧产物只有 Li2O,A错误;
B.碱金属元素单质熔点从上到下呈降低趋势,B错误;
C.由金属 Na 在常温下与水剧烈反应,推出金属 Cs 在常温下也能与水剧烈反应,C正确;
D. F2 与水反应生成 HF 和 O2,D错误;
故选C。
2.A
【分析】根据价键理论可知,X为第ⅠA元素或第ⅦA元素,Y为第ⅣA元素,Z为第ⅤA元素,W为ⅥA元素,再结合原子序数依次增大,且W形成的单质易溶于Y、W形成的一种溶剂中,可推断X为H、Y为C、Z为N、W为S。
【详解】A.原子半径为S>C>N>H,A错误;
B.元素的电离能:N>C,B正确;
C.浓需保存在棕色细口瓶中,C正确;
D.常温下,与反应生成单质硫,D正确;
故选A。
3.C
【分析】同周期自左而右原子半径减小,同主族自上而下原子半径增大,则前7种元素处于第二周期,后7种元素处于第三周期,结合原子序数可知,X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素;则X为O,Y为F,Z为Na,M为Al,N为Si,R为Cl。
【详解】A.同周期元素从左到右,元素的金属性逐渐减弱,金属性越强对应的最高价氧化物对应水化物的碱性越强,金属性,则最高价氧化物对应水化物的碱性,A错误;
B.R的非金属性弱于Y,R的单质不能置换出,B错误;
C.X(O)、Y(F)同期,且F的非金属性大于O,则气态氢化物的稳定性:,C正确;
D.、和离子电子层结构相同,核电荷数越大离子半径越小。则简单离子的半径,D错误;
答案选C。
4.C
【分析】Z的原子序数大于Y,Y的常见化合价为+5,Z的常见化合价为+4,则Y是第二周期元素、Z是第三周期元素,Y是N元素、Z是Si元素,M常见化合价为-3,M为P元素、W常见化合价为-2,W是S元素。
【详解】A.X原子序数小于N,常见化合价为+1,元素X可能为锂或氢,故A正确;
B.同周期元素从左到右原子半径减小,原子半径r(P)>r(S),故B正确;
C.H2S中H原子未达到8电子稳定结构,故C错误;
D.同周期元素从左到右,非金属性增强,最高价氧化物对应水化物的酸性增强,酸性H2SO4>H3PO4,故D正确;
选C。
5.B
【分析】Y是地壳中含量最高的元素,则Y为O;短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径小于Y的原子半径,且Z与X同主族,则X为第一周期元素H、Z为第三周期元素Na;W的最外层电子数等于Y与Z的最外层电子数之和,则W为Cl,据此分析解答。
【详解】A.由Y、Z、W形成的化合物可能为NaClO,次氯酸钠具有强氧化性,溶于水有漂白性,故A正确;
B.电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;X为H,Y为O,W为Cl,Z为Na,它们原子半径的大小顺序为Na >Cl>O>H,故B错误;
C.根据上述分析可知:Y为O, Z为Na,Y、Z可以形成电子层结构相同的10电子的离子,原子序数越大,半径越小,故离子半径前者大于后者,故C正确;
D.根据上述分析可知:X为H,Y为O,它们可以形成H2O 为的化合物;H2O2为的化合物,故D正确;
故选B。
6.D
【分析】X、Y、Z、W均为原子序数小于18的四种元素的原子,已知X的核外电子总数等于其电子层数,则X为H;Y最外层电子数是次外层电子数的两倍,Y有2个电子层符合电子排布规律,最外层电子数为4,则Y为C;Z2是空气的主要成分之一,是最常见的助燃剂,则Z为O;W+与氖原子核外电子排布相同,则W为Na,以此来解答。
【详解】A.W为Na,Z为O,O2-和Na+电子结构一致,O2-半径大,故A正确;
B.化合物WZX为NaOH,NaOH水溶液是强碱,故B正确;
C.元素X、Z之间可以形成H2O,H2O2两种共价化合物,故C正确;
D.为CO2,其水溶液能导电是CO2因为溶于水生成了碳酸,碳酸电离使溶液导电,但CO2属于非电解质,故D错误;
故答案选D。
7.A
【分析】X的最高价与Z的最低价的绝对值相等,且X、Y、Z为第三周期元素,X、Y、Z可以形成形式的化合物,则X为Na,Z为Cl,电子层数相同的原子序数越大离子半径越小,Y的简单离子半径在同周期离子中最小则Y为Al;
【详解】A.由分析可知,X、Y、Z分别为Na、Al、Cl,同周期主族元素从左到右原子半径逐渐变小,则原子半径:Na>Al>Cl,A错误;
B.同周期主族元素从左到右金属性逐渐减弱,第三周期元素中Na元素金属性最强,则NaOH的碱性最强,B正确;
C.同周期主族元素从左到右非金属性逐渐增强,第三周期元素中Cl元素非金属性最强,则Cl2氧化性最强,C正确;
D.判断阳离子满足8电子结构的方法:次外层电子数+最外层电子数-化合价,离子中Al原子满足8+3-3=8电子结构,D正确;
故选:A。
8.B
【分析】由原子半径随原子序数的变化规律可知,X、Y、Z、W、M、N依次为N、O、Na、P、S、Cl。
【详解】A.元素非金属性越强,其气态氢化物越稳定,所以气态氢化物的稳定性:HCl> H2S,A项正确;
B.O、S的简单氢化物沸点:H2O>H2S,B项错误;
C.元素非金属性越强,其最高价氧化物对应水化物的酸性越强,故酸性:HNO3>H3PO4,C项正确;
D.Na与O可形成两种化合物:Na2O、Na2O2,均为离子化合物,D项正确;
答案选B。
9.B
【分析】短周期部分元素原子半径与原子序数的关系如图,电子层越多原子半径越大,则A、B、C位于第二周期,D、E、G位于第三周期,再结合原子序数大小可知,A为C,B为N,C为O,D为Na,E为A1,G为S元素,据此分析作答。
【详解】A.B为N,C为O,元素形成的简单氢化物分别是NH3、H2O,由于水、氨气中存在氢键,且在通常条件下NH3为气态,H2O为液态,故物质的沸点:C(H2O)>B(NH3),A正确;
B.A为C,B为N,C为O,它们是同一周期元素,原子序数越大,元素的非金属性就越强,所以元素的非金属性由强到弱: C(O)>B(N)>A(C),B错误;
C.E为A1,其单质金属Al能够与NaOH溶液反应产生NaAlO2、H2,C正确;
D.D为Na,E为A1,G为S元素,它们的最高价氧化物对应的水化物分别是NaOH、Al(OH)3、H2SO4,NaOH是强碱,能够与两性氢氧化物Al(OH)3及强酸H2SO4反应;强酸H2SO4也可以与两性氢氧化物Al(OH)3及强碱NaOH反应,故D、E、G的最高价氧化物对应的水化物之间可两两相互反应,D正确;
故合理选项是B。
10.C
【详解】A.根据题目信息,石墨烯是一种从石墨中剥离出来,只有一层原子厚度的二维晶体,所以石墨烯也是由碳元素形成的,A正确;
B.石墨烯、金刚石、石墨是碳元素形成的不同单质,三者互为同素异形体,B正确;
C.石墨烯是能导电的单质,电解质必须是化合物,所以石墨烯不是电解质,C错误;
D.石墨烯和金刚石均是.由碳元素形成的单质,等质量的二者含有相同数目的碳原子,D正确;
故选C。
11.D
【分析】由图可知,Y元素能形成五个共价键,且W、X、Y、Z为原子序数依次增大的短周期元素,所以Y为P元素;Y原子序数为W原子价电子数的3倍,所以W为N元素;X和Z均能和P生成共价键,且X和Z同主族,所以X为F,Z为Cl,据此分析解题。
【详解】A.X和Z分别是F、,F无正价,故A错误;
B.和分别是和,在水中不是强酸,故B错误;
C.四种元素中,Y原子半径在这四种元素中最大,X原子半径在这四种元素中最小,故C错误;
D.和氢三种元素可形成氯化铵,属于同时含有离子键和共价键的化合物,故D正确;
故答案选D。
12.D
【分析】“X在宇宙中含量最丰富”说明X是氢元素,根据结构式,Y能形成两个共价键,其最外层电子数为6,位于第ⅥA族(结构式图下方的Y原子因为得到了W失去的1个电子而只形成1个共价键),“Y与Z位于相邻主族”,Z能形成5个共价键,因此Z位于第ⅤA族,由于Z原子序数大于Y,因此Y位于第二周期,Z位于第三周期,故Y是氧元素,Z是磷元素,W易失去1个电子,原子序数比Z大,应是第四周期第ⅠA族的钾元素,题目据此解答。
【详解】A.W与Y形成的二元化合物有K2O、K2O2、KO2、KO3几种,除K2O外,其余都具有强氧化性,A错误;
B.Z的最高价氧化物对应的水化物是H3PO4,为中强酸,B错误;
C.X的阴离子为,其结构是只有一个电子层的两电子结构,C错误;
D.X与Y组成的化合物有H2O、H2O2,其中实验室通常用分解H2O2的方法制备氧气,D正确;
故选D。
13.D
【分析】短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径是短周期元素中最小的,则X为H元素;Y是短周期中金属性最强的元素,则Y为Na元素;元素Z的最高正价与最低负价代数和为4,则Z为S元素、W为Cl元素。
【详解】A.同周期元素,从左到右原子半径依次减小,则硫原子的原子半径大于氯原子,故A错误;
B.同周期元素,从左到右元素的非金属性依次增强,对应简单离子的还原性依次减弱,则硫离子的还原性强于氯离子,故B错误;
C.同周期元素,从左到右元素的非金属性依次增强,最高价氧化物对应水化物的酸性依次增强,则硫酸的酸性弱于高氯酸,故C错误;
D.X与Y形成的化合物为氢化钠,氢化钠与水反应生成氢氧化钠和氢气,氢氧化钠溶液可使红色石蕊试纸变蓝,故D正确;
故选D。
14.CD
【分析】由四种短周期元素X、Y、Z和W在周期表中的位置可知,Z位于第三周期,Y、Z同主族,Z的原子序数是Y的两倍,则Z为S、Y为O;结合位置可知X为N、W为Cl,以此来解答。
【详解】由上述分析可知,X为N、Y为O、Z为S、W为Cl。
A.O和S可形成共价化合物二氧化硫等,故A正确;
B.同周期从左向右原子半径减小,则r(S)>r(Cl),故B正确;
C.非金属性O大于S,则S的最低价单核阴离子的还原性比O的强,故C错误;
D.Cl的非金属性比S的强,所以Cl的最高价氧化物对应的水化物酸性比S的强,不是最高价含氧酸无此规律,故D错误;
故选CD。
15.(1)
(2)
(3)共价键、离子键
(4)
(5)A
(6)18
【分析】根据元素在周期表中的位置,A是Na元素;B是K元素;C是Mg元素;D是Al元素; E是S元素;F是O元素;G是Cl元素;H是Br元素、R是Ar元素。
【详解】(1)B是K元素,K+核外有18个电子,结构示意图为,A、D最高价氧化物对应的的水化物分别是NaOH、Al(OH)3,NaOH、Al(OH)3反应生成偏铝酸钠和水,反应的离子方程式是。
(2)电子层数相同,质子数越多半径越小,Na+、Mg2+、Al3+、O2-半径由大到小的顺序是;同周期元素从左到右,金属性依次减弱,Na、Mg、Al最高价氧化物对应水化物的碱性由强到弱为。
(3)由元素Na、O形成的一种杀菌消毒剂是Na2O2,存在的化学键有离子键、共价键;
(4)化合物中各原子均满足8电子稳定结构,根据价键规律,S原子之间形成1对共用电子对,S原子与Cl原子之间形成1对共用电子对,其电子式为;
(5)常温下氯酸钾与浓盐酸反应放出气体Cl2,①处充满黄绿色;氯气进入玻璃管后与②处NaBr溶液发生置换反应生成,白色棉球变为橙色;氯气和③处KI溶液反应置换出,遇淀粉变蓝;④处利用氯气与碱液反应进行的尾气吸收,尽管反应生成的物质均为无色,但棉球本身是白色的,所以④处的颜色为白色,故A正确;
(6)G元素是Cl元素,核电荷数为17,H是Br元素,核电荷数为35,两者核电荷数之差是18。
16.(1)六
(2)c
(3) 42 c c
(4)
【详解】(1)原子的电子层数=周期序数,Hg原子有6个电子层,故位于元素周期表第六周期。
(2)a. 硒(Se)与硫位于同一主族,最外层均有6个电子,且均为非金属元素,最低价均为-2价,a正确;
b. 硒(Se)的最高价为+6价,最低价为-2价,SeO2中Se的化合价为+4价,处于中间价态,既有氧化性又有还原性,b正确;
c. 硒的氧化物对应的水化物有H2SeO3和H2SeO4,属于酸,Se的非金属性弱于硫,因此酸性大小关系为:H2SO3>H2SeO3,H2SO4>H2SeO4,即H2SeO3和H2SeO4均为弱酸,c错误;
故选c;
(3)①砷为第33号元素,质子数为33,中子数为75-33=42。
②a.NH4I是离子化合物,PH4I与之性质相似,因此也属于离子化合物,与之间存在离子键,内P与H之间存在共价键,a正确;
b.NH4I能与NaOH反应生成NH3,因此PH4I也能与NaOH反应,b正确;
c.PH4I加热分解生成PH3和HI,HI不稳定,加热时也分解,生成H2和I2,因此与NH4Cl加热分解产物种类不一样,c错误;
故选c。
③a.非金属性越强,氢化物稳定性越强,N的非金属性比P强,因此稳定性大小关系为NH3>PH3,a正确;
b.非金属性越强,最高价氧化物水化物酸性越强,N的非金属性比As强,因此酸性强弱关系为HNO3>H 3AsO4,b正确;
c.As为非金属元素,其氧化物的水化物属于酸,c错误;
d.第VA族元素随原子序数增大,其简单离子电子层数依次增多,离子半径依次增大,d正确;
故选c。
(4)As2O3中As化合价为+3价,H2AsO4中As化合价为+5价,因此As2O3与稀HNO3发生氧化还原反应,反应的化学方程式为:。
17.(1)是否属于氧化还原反应或是否有电子转移
(2)①③
(3)
(4)CaO
(5)
(6)
(7)、
【详解】(1)A组物质与水反应,元素化合价没有发生变化,属于非氧化还原反应,B组物质与水反应,元素化合价发生变化,属于氧化还原反应,所以分成A、B组的分类依据为:是否属于氧化还原反应或是否有电子转移;
(2)CaO能与水反应生成氢氧化钙,CaO所属物质类别为金属氧化物、碱性氧化物,答案选①③;
(3)能与二氧化碳反应生成碳酸钠和O2,故可用作潜水艇供氧剂。B组中能和水反应,且水做氧化剂的物质是Na,其反应方程式为:2Na+2H2O=2Na++2OH +H2↑,故答案为:;2Na+2H2O=2Na++2OH +H2↑;
(4)NH3、CaO与水反应后溶液呈碱性为D组物质,SO2与水反应后溶液呈酸性为C组物质,CaO与SO2反应生成CaSO3,进一步氧化为CaSO4,所以工业上常用CaO消除SO2对大气的污染。故答案为:CaO;
(5)氢氧化铝不溶于过量氨水,故实验室用与氨水反应制备,反应的离子反应方程式为:;
(6)SO2具有强还原性,可使酸性溶液褪色,反应的离子方程式为:;
(7)F组中,氯气与水发生歧化反应生成HCl和HClO,过氧化钠与水发生歧化反应生成氢氧化钠和氧气,这两个反应中氧化剂与还原剂物质的量之比为1:1,故答案为:、。
18. 减弱 增强 剧烈 越强 最高价氧化物对应水化物 越强 越强 越弱 增强 减弱 稳定 越弱 越强 酸性 强 强 弱 越弱 越强
【详解】(1)比较金属性的强弱,实质是看元素原子失电子的难易程度,越易失电子,金属性越强。
①同周期从左到右,原子越难失去电子,金属性减弱;
②同主族从上到下,随着电子层数的增多,原子越容易失去电子,金属性增强。
(2)①金属单质与水或酸反应越剧烈,说明金属越容易失去电子,还原性越强,元素金属性越强;
②最高价氧化物对应水化物的碱性越强,元素金属性越强;如碱性:NaOH>Mg(OH)2,则金属性:Na>Mg;
③离子的氧化性越强,表示离子得电子能力强,如氧化性:Cu2+>Zn2+,对应金属为Cu和Zn,其金属性:Cu(4)①同周期从左到右,原子半径越来越小,原子得电子能力越来越强,非金属性越强;
②同主族从上到下,原子半径越来越大,原子得电子能力越来越弱,非金属性越弱。
(5)①单质越易跟H2化合,可知单质的氧化性越强,与氢气化合生成的氢化物也就越稳定。氢化物的还原性其实质是阴离子的失电子能力的比较,如氢化物:HCl、HBr、HI的还原性由Cl-、Br-、I-的失电子能力决定,氢化物的还原性越弱,其非金属性也就越强。
②元素非金属性越强说明元素的电负性越强,其吸引电子的能力也越强,其对应的最高价氧化物对应的水化物的酸性越强。
③非金属单质间的置换反应,非金属强的单质能置换出非金属性弱的单质,如:。
④元素的原子对应阴离子的还原性越强,元素的非金属性就越弱。如:。
⑤与同一可变价金属反应,金属元素在该产物中价态越高,该非金属元素的非金属性越强。如:,,说明非金属性Cl>S。
19.(1) 2Na+2H2O=2NaOH+H2↑ Mg+2H2OMg(OH)2↓+H2↑ 金属性:Na>Mg
(2) 产生白色沉淀 Al3++3NH3·H2O=Al(OH)3↓+3NH 白色沉淀逐渐溶解 Al(OH)3+3H+=Al3++3H2O 白色沉淀逐渐溶解 Al(OH)3+OH-=AlO+2H2O 产生白色沉淀 Mg2++2OH-=Mg(OH)2↓
(3) 减弱 减弱 增强 增强 减小 减弱 增强 减弱 增强
【详解】(1)钠和水常温下剧烈反应生成碱和气体,化学方程式2Na+2H2O=2NaOH+H2↑,镁常温下和水不反应,加热时剧烈反应,生成碱和气体,化学方程式Mg+2H2OMg(OH)2↓+H2↑,金属单质和水或酸反应越剧烈,金属的金属性越强,所以金属性:Na>Mg,答案:2Na+2H2O=2NaOH+H2↑;Mg+2H2OMg(OH)2↓+H2↑;金属性:Na>Mg;
(2)向AlCl3溶液中加入足量氨水,生成白色沉淀,Al3++3NH3·H2O=Al(OH)3↓+3 ,氢氧化铝不溶于氨水。实验得到的沉淀分装两支试管中,一支试管中加入盐酸,白色沉淀逐渐溶解,生成盐和水,离子方程式为Al(OH)3+3H+=Al3++3H2O;另一支试管中加入NaOH溶液,白色沉淀逐渐溶解,生成偏铝酸盐和水,离子方程式为Al(OH)3+OH-=AlO+2H2O。向MgCl2溶液加入过量NaOH溶液,产生白色沉淀,离子方程式为Mg2++2OH-=Mg(OH)2↓。答案:产生白色沉淀;Al3++3NH3·H2O=Al(OH)3↓+3NH;白色沉淀逐渐溶解;Al(OH)3+3H+=Al3++3H2O;白色沉淀逐渐溶解;Al(OH)3+OH-=AlO+2H2O;产生白色沉淀;Mg2++2OH-=Mg(OH)2↓;
(3)第三周期的Na、Mg、Al的金属性逐渐减弱,最高价氧化物的水化物NaOH、Mg(OH)2、Al(OH)3的碱性逐渐减弱,NaOH为强碱,Mg(OH)2为中强碱,Al(OH)3为两性氢氧化物。第三周期的Si、P、S、Cl的非金属性逐渐增强,最高价氧化物的水化物H2SiO3、H3PO4、H2SO4、HClO4的酸性逐渐增强。HClO4是最强的含氧酸,H2SiO3为难溶的弱酸,H3PO4为中强酸,H2SO4为强酸。同一周期从左到右,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。答案:减弱;减弱;增强;增强;减小;减弱;增强;减弱; 增强。
20.(1)P
(2)
(3)O2-
(4)CH4
(5)离子键、极性共价键
(6)NaOH+Al(OH)3=NaAlO2+2H2O
【分析】根据元素在周期表的位置可知:①是H,②是C,③是O,④是Na,⑤是Mg,⑥是Al,⑦是Si,⑧是P,⑨是Cl元素,然后利用元素的性质与原子结构及位置的关系分析解答。
【详解】(1)根据上述分析可知元素⑧是磷,该元素的元素符号是P;
(2)元素⑤是Mg,元素⑨是Cl,二者反应产生MgCl2是离子化合物,2个Cl-与Mg2+之间以离子键结合,则二者形成的化合物的电子式是;
(3)③是O,⑤是Mg,二者形成的简单离子O2-、Mg2+核外电子排布都是2、8,二者电子层结构相同,离子的核电荷数越大,离子半径就越小,故离子半径:O2->Mg2+,即O2-半径较大;
(4)元素②是C,⑦是Si,二者是同一主族元素,元素的原子序数越大,元素的非金属性就越弱,其形成的简单氢化物稳定性就越差,故两种元素形成的简单氢化物分子中稳定性较强的分子是CH4;
(5)①是H,③是O,④是Na,三种元素形成的化合物NaOH是离子化合物,Na+与OH-之间以离子键结合,在阴离子OH-中H、O原子之间以极性共价键结合,故NaOH中含有的化学键类型有离子键、极性共价键;
(6)④是Na,⑥是Al,两种元素形成的最高价氧化物对应的水化物的化学式分别是NaOH、Al(OH)3,其中Al(OH)3是两性氢氧化物,能够与强碱NaOH反应产生NaAlO2、H2O,该反应的化学方程式为:NaOH+Al(OH)3=NaAlO2+2H2O。
21.(1)第二周期第Ⅵ族
(2) > AD
(3) 2Na2O2+2CO2=2Na2CO3+O2 作供氧剂
(4) 3Cl2+2=6Cl-+N2+8H+
【分析】由题给信息可推知X为O元素,Y为Na元素,Z为S元素,Q为Cl元素;
【详解】(1)由分析可知,X为O元素,则O元素位于元素周期表中的第二周期第VIA族;
(2)由分析可知X为O元素,Z为S元素,非金属性:,故简单氢化物的稳定性:H2O>H2S;H2O从液态转化为气态时,需要克服的作用力有范德华力和氢键,故答案为:>;AD;
(3)由分析可知,X为O元素,Y为Na元素,与反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;可在呼吸面具或潜水艇中作为O2的来源;故答案为:2Na2O2+2CO2=2Na2CO3+O2;作供氧剂;
(4)由分析可知,X为O元素,Y为Na元素,Q为Cl元素,则①NaClO的电子式为;
②Cl2将酸性氨氮废水中转化为N2和H2O的离子方程式为3Cl2+2=6Cl-+N2+8H+。
22.(1) 第三周期第VIA族
(2) H2O NH3 N3->O2->Na+
(3) 2Na2O2+2H2O=4NaOH+O2↑ H—O—O—H
(4)
(5) HClO4 H2SO4
【分析】A、B、C、D、E、F是短周期主族元素,且原子序数依次增大。A元素的一种核素不含中子,则A为H,D+与Ne核外电子排布相同,则D为Na,B的简单氢化物的水溶液呈碱性,则B为N,C、E同主族,形成的化合物为EC2、EC3,则C为O,E为S,则F为Cl。
【详解】(1)E为S,E在元素周期表中的位置为第三周期第VIA族。F离子即氯离子的结构示意图为。
(2)B为N, C为O,非金属性O>N,非金属性越强,简单氢化物越稳定,则比较B与C简单氢化物的热稳定性:H2O>NH3;具有相同电子排布的离子,原子序数大的离子半径小,B、C、D三种元素简单离子均为10电子结构,其离子半径由大到小的顺序(用离子符号表示) N3->O2->Na+。
(3)D、C两元素组成的化合物D2C2即Na2O2,属于离子化合物,其电子式为,与水反应生成NaOH和O2,化学方程式为2Na2O2+2H2O=4NaOH+O2↑。A与C两元素形成的1∶1的化合物为H2O2,属于共价分子,结构式为H—O—O—H。
(4)D2E即硫化钠,属于离子化合物,用电子式表示化合物D2E的形成过程为。
(5)同周期从左到右元素非金属性递增,非金属性越强,最高价氧化物对应水化物的酸性越强,则E与F最高价氧化物对应水化物的酸性为HClO4>H2SO4。
一、选择题
1.类推是一种经常采用的科研和学习方法,下列类推结论合理的是
A.由钠在空气中燃烧产物是 Na2O2,推出锂在空气中燃烧产物是 Li2O2
B.由卤素单质熔点从上到下逐渐升高,推出碱金属元素单质熔点从上到下逐渐升高
C.由金属 Na 在常温下与水剧烈反应,推出金属 Cs 在常温下也能与水剧烈反应
D.由Cl2与水反应生成 HCl 和 HClO,推出F2 与水反应生成 HF 和 HFO
2.短周期主族元素X、Y、Z和W的原子序数依次增大,其形成的一种离子化合物的结构如下图所示。Y、Z位于同一周期,W形成的单质易溶于Y、W形成的一种溶剂中。下列说法错误的是
A.原子半径:W>Z>Y>X
B.元素的第一电离能:Z>Y
C.Z的最高价氧化物对应水化物的浓溶液需保存在棕色细口瓶中
D.常温下,W的气态氢化物与其某种氧化物反应可生成黄色固体
3.如图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是
A.最高价氧化物对应的水化物的碱性:Z<M
B.R单质可以从Y的盐溶液中置换出Y的单质
C.X、Y两种元素简单气态氢化物的稳定性:X<Y
D.简单离子的半径:Z>Y>X
4.五种短周期元素X、Y、Z、M、W的原子序数与其常见化合价的关系如图所示,则下列有关的叙述中,错误的是
A.元素X可能为锂 B.原子半径大小:r(M)>r(W)
C.X2W中各原子均达到8电子稳定结构 D.元素最高价氧化物对应水化物的酸性:W>M
5.短周期主族元素X、Y、Z、W的原子序数依次增大。X的原子半径小于Y的原子半径,Y是地壳中含量最高的元素,Z与X同主族,W的最外层电子数等于Y与Z的最外层电子数之和。下列有关说法错误的是
A.由Y、Z、W形成的化合物中溶于水可能有漂白性
B.原子半径的大小顺序为W>Y>Z>X
C.Y、Z可以形成电子层结构相同的离子,且离子半径前者大于后者
D.仅由X、Y两种元素可形成分别含有10e-和18e-的化合物
6.X、Y、Z、W为原子序数小于18的四种元素的原子。已知X的核外电子总数等于其电子层数;Y的最外层电子数是其次外层电子数的两倍;是空气的主要成分之一,是最常见的助燃剂;与氖原子核外电子排布相同。下列说法不正确的是
A.离子半径:
B.化合物WZX的水溶液是强碱
C.元素X、Z之间可以形成和两种共价化合物
D.的水溶液能导电,所以化合物属于电解质
7.X、Y、Z为第三周期元素,X的最高价与Z的最低价的绝对值相等,Y的简单离子半径在同周期离子中最小,X、Y、Z可以形成形式的化合物。下列说法错误的是
A.原子半径:Y>X>Z
B.同周期元素中,X元素的氢氧化物碱性最强
C.同周期元素形成的单质中,氧化性最强
D.离子中Y原子满足8电子结构
8.如图是部分短周期主族元素原子半径与原子序数的关系图。下列说法错误的是
A.气态氢化物的稳定性:N>M
B.简单氢化物的沸点:Y
D.由Y与Z形成的化合物为离子化合物
9.短周期主族元素原子半径与原子序数的关系如图,下列有关说法错误的是
A.简单氢化物的沸点:C>B
B.元素的非金属性由强到弱:A>B>C
C.E的单质能与强碱溶液反应
D.D、E、G的最高价氧化物对应的水化物之间可两两相互反应
10.石墨烯是一种从石墨中剥离出来,只有一层原子厚度的二维晶体,是目前发现的最薄,,最强韧、导电性最好的新型纳米材料,被誉为“黑金”。下列有关说法错误的是
A.石墨烯由碳原子构成
B.石墨烯与金刚石、石墨互为同素异形体
C.石墨烯能导电,所以是电解质
D.等质量的石墨烯和金刚石含有相同数目的碳原子
11.如图所示的两种化合物可应用于阻燃材料和生物材料的合成.其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍.下列说法正确的是
A.X和Z的最高化合价均为价
B.和在水中均为强酸,电子式可表示为与
C.四种元素中,X原子半径最大,Y原子半径最小
D.Z、W和氢三种元素可形成同时含有离子键和共价键的化合物
12.X、Y、Z、W是原子序数依次增大的前20号元素,由它们组成的化合物的结构式如图,其中X在宇宙中含量最丰富,Y与Z位于相邻主族,下列说法正确的是
A.W与Y形成的二元化合物不可能具有强氧化性
B.Z的最高价氧化物对应的水化物可能为强酸
C.上述阴离子中的所有原子可能均为8电子稳定结构
D.X和Y组成的化合物可用于实验室制取Y的单质
13.短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径是短周期元素中最小的,Y是短周期中金属性最强的元素,元素Z的最高正价与最低负价代数和为4,下列说法正确的是
A.原子半径:W>Z> Y
B.简单离子的还原性:W >Z
C.最高价氧化物对应水化物的酸性:Z>W
D.X与Y形成化合物的水溶液可使红色石蕊试纸变蓝
14.四种短周期元素X、Y、Z和W在周期表中的位置如图所示,Z的原子序数是Y的两倍。下列说法不正确的是
X Y
Z W
A.Y和Z可形成共价化合物
B.原子半径:Z>W
C.最低价单核阴离子的还原性:Y>Z
D.氧化物对应的水化物的酸性:W>Z
二、填空题
15.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表列出了A-R九种元素在元素周期表中的位置,试用元素符号或化学式回答下列问题:
周期 主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 F
3 A C D E G R
4 B H
(1)B的离子结构示意图为___________,AD两最高价氧化物对应的的水化物反应的离子方程式是___________。
(2)在AC、D、F这些元素形成的最简单离子中,离子半径由大到小的顺序是___________(填离子符号),AC、D最高价氧化物对应水化物的碱性由强到弱为___________。
(3)由元素AF形成的一种杀菌消毒剂中存在的化学键有___________。
(4)由元素E和G形成的某种化合物可表示为(其中各原子均满足8电子稳定结构),写出的电子式:___________。
(5)已知常温下氯酸钾与浓盐酸反应放出气体,现按如图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是___________。
① ② ③ ④
A 黄绿色 橙色 蓝色 无色
B 无色 橙色 紫色 白色
C 黄绿色 橙色 蓝色 白色
D 黄绿色 无色 紫色 白色
A.A B.B C.C D.D
(6)G元素和H元素两者核电荷数之差是___________。
16.为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:
(1)据汞的原子结构示意图,汞在第_______周期。
(2)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断不正确的是_______。
a.硒元素的最低负化合价为-2
b.二氧化硒()具有还原性
c.硒的氧化物对应的水化物属于强酸
(3)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是,它的中子数为_______。
②已知与的性质相似,则对性质的推测不正确的是_______(填序号)。
a.含有离子键和共价键
b.能与溶液反应
c.与加热充分分解产物的种类完全一样
③下列关于第ⅤA族元素及其化合物的说法不正确的是_______(填字母)。
a.热稳定性: b.酸性:
c.的氧化物的水化物是强碱 d.形成的简单离子半径随着原子序数递增而增大
(4)砷酸()可用于制造杀虫剂、药物。溶于稀硝酸中可得砷酸,此反应的化学方程式:_______。
17.图是依据一定的分类标准,对某些物质与水反应情况进行分类:
(1)根据物质与水反应的情况,分成A、B组的分类依据是____________。
(2)A组中的CaO经常用作食品包装袋中的干燥剂,CaO所属物质类别为______(填序号)。
①金属氧化物 ②酸性氧化物 ③碱性氧化物 ④两性氧化物
(3)B组物质中,可用作潜水艇供氧剂的是______(填化学式)。B组→E组反应的离子方程式为______。
(4)工业上常用D组中的______(填化学式)消除C组中物质对大气的污染。
(5)实验室用制备时,可选择上述物质中某一物质的水溶液,该过程涉及的离子反应方程式为_______。
(6)C组中某一物质可使酸性溶液褪色,用离子方程式表示溶液褪色的原因____________。
(7)F组中,与水反应氧化剂与还原剂物质的量之比为1:1的物质是____________(填化学式)。
18.金属性与非金属性比较
金属性强弱判断依据
(1)元素周期表位置
①同周期从左到右,金属性_________。
②同主族从上到下,金属性_________。
(2)单质及化合物相关性质
①金属单质与水或酸反应越_________,元素金属性_________。
②___________________________的碱性越强,元素金属性_________。
③离子的氧化性_________,对应金属元素的金属性_________。
(3)金属活动顺序表
非金属性强弱判断依据
(4)元素周期表位置
①同周期从左到右,非金属性________。
②同主族从上到下,非金属性________。
(5)单质及化合物相关性质
①单质越易跟H2化合,生成的氢化物也就越____,氢化物的还原性____,其非金属性也就____。
②最高价氧化物对应水化物的____越强,其非金属性越____。
③非金属单质间的置换反应,非金属____的单质能置换出非金属性____的单质,如卤素。
④元素的原子对应阴离子的还原性越强,元素的非金属性就_______,如卤素。
⑤与同一可变价金属反应,金属元素在该产物中价态越高,该非金属元素的非金属性_______。如S、Cl元素。
19.同周期的元素性质递变规律
(1)钠、镁与水的反应
钠 镁
实验操作 实验① 实验②
实验现象 钠熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红 加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为粉红色
反应原理 ____________ ____________
结论 钠、镁均能与水反应,钠比镁活泼,金属性:_____________。
(2)Al(OH)3的制备与性质
实验探究:
①向AlCl3溶液中加入足量氨水,现象为__________,反应的离子方程式为__________;
②将①实验得到的沉淀分装两支试管中,一支试管中加入盐酸,现象为__________,离子方程式为_________;另一支试管中加入NaOH溶液,现象为________,离子方程式为______________。
③向MgCl2溶液加入过量NaOH溶液,现象_________,离子方程式为_____________。
两性氢氧化物:既能与酸反应又能与强碱反应,且均生成盐和水的氢氧化物。如 Al(OH)3。
(3)第三周期递变规律
①第三周期的Na、Mg、Al的金属性逐渐__________,NaOH、Mg(OH)2、Al(OH)3的碱性逐渐__________,NaOH为强碱,Mg(OH)2为中强碱,Al(OH)3为两性氢氧化物。
②第三周期的Si、P、S、Cl的非金属性逐渐__________,H3SiO3、H3PO4、H2SO4、HClO4的酸性逐渐__________。HClO4是最强的含氧酸,H2SiO3为难溶的弱酸,H3PO4为中强酸,H2SO4为强酸。
③同一周期从左到右,原子半径逐渐__________,失电子能力逐渐__________,得电子能力逐渐__________,金属性逐渐__________,非金属性逐渐__________。
三、元素或物质推断题
20.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题。
族 周期 ⅠA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③
3 ④ ⑤ ⑥ ⑦ ⑧ ⑨
(1)元素⑧的符号是_______。
(2)元素⑤和⑨形成的化合物的电子式是_______。
(3)元素③、⑤形成的简单离子中,半径较大的离子是_______。
(4)元素②、⑦形成的简单氢化物分子中稳定性较强的分子是_______。
(5)元素①、③、④形成的化合物中含有的化学键类型有_______。
(6)元素④的最高价氧化物对应水化物与元素⑥的最高价氧化物反应的化学方程式为_______。
21.X、Y、Z和Q是原子序数依次增大的4种短周期主族元素,其中Y、Z、Q在同一周期,其原子半径和最外层电子数之间的关系如图所示。
回答下列问题:
(1)X在元素周期表中的位置为_______。
(2)简单氢化物的稳定性:X_______Z(填“>”或“<”),X的简单氢化物从液态转化为气态时,需要克服的作用力有_______ (填序号)。
A.范德华力 B.极性共价键 C.离子键 D.氢键
(3)Y与X形成的一种化合物M为淡黄色固体,M与CO2反应的化学方程式为_______,由该反应原理可知M的一种用途为_______。
(4)Q单质及其化合物均是重要的化工原料,在疫情防控、污水处理等方面发挥着重要的作用。
①YQX溶液能有效地灭杀新冠病毒,常用于环境的消毒,YQX的电子式为_______。
②氨氮废水(含,中N元素为-3价)的处理是当前科学研究的热点问题之一。工业上常用Q的单质将酸性氨氮废水中转化为无毒无害的气体和水,发生反应的离子方程式是_______。
22.A、B、C、D、E、F是短周期主族元素,且原子序数依次增大。A元素的一种核素不含中子,D+与Ne核外电子排布相同,B的简单氢化物的水溶液呈碱性,C、E同主族,形成的化合物为EC2、EC3.回答下列问题:
(1)E在元素周期表中的位置为_______。F离子结构示意图为_______。
(2)比较B与C简单氢化物的热稳定性:_______>_______(填化学式),B、C、D三种元素简单离子的离子半径由大到小的顺序(用离子符号表示)_______。
(3)D、C两元素组成的化合物D2C2其电子式为_______,与水反应的化学方程式为_______。A与C两元素形成的1∶1的化合物的结构式为_______。
(4)用电子式表示化合物D2E的形成过程_______。
(5)比较E与F最高价氧化物对应水化物的酸性_______>_______(填化学式)。
参考答案:
1.C
【详解】A.锂在空气中燃烧产物只有 Li2O,A错误;
B.碱金属元素单质熔点从上到下呈降低趋势,B错误;
C.由金属 Na 在常温下与水剧烈反应,推出金属 Cs 在常温下也能与水剧烈反应,C正确;
D. F2 与水反应生成 HF 和 O2,D错误;
故选C。
2.A
【分析】根据价键理论可知,X为第ⅠA元素或第ⅦA元素,Y为第ⅣA元素,Z为第ⅤA元素,W为ⅥA元素,再结合原子序数依次增大,且W形成的单质易溶于Y、W形成的一种溶剂中,可推断X为H、Y为C、Z为N、W为S。
【详解】A.原子半径为S>C>N>H,A错误;
B.元素的电离能:N>C,B正确;
C.浓需保存在棕色细口瓶中,C正确;
D.常温下,与反应生成单质硫,D正确;
故选A。
3.C
【分析】同周期自左而右原子半径减小,同主族自上而下原子半径增大,则前7种元素处于第二周期,后7种元素处于第三周期,结合原子序数可知,X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素;则X为O,Y为F,Z为Na,M为Al,N为Si,R为Cl。
【详解】A.同周期元素从左到右,元素的金属性逐渐减弱,金属性越强对应的最高价氧化物对应水化物的碱性越强,金属性,则最高价氧化物对应水化物的碱性,A错误;
B.R的非金属性弱于Y,R的单质不能置换出,B错误;
C.X(O)、Y(F)同期,且F的非金属性大于O,则气态氢化物的稳定性:,C正确;
D.、和离子电子层结构相同,核电荷数越大离子半径越小。则简单离子的半径,D错误;
答案选C。
4.C
【分析】Z的原子序数大于Y,Y的常见化合价为+5,Z的常见化合价为+4,则Y是第二周期元素、Z是第三周期元素,Y是N元素、Z是Si元素,M常见化合价为-3,M为P元素、W常见化合价为-2,W是S元素。
【详解】A.X原子序数小于N,常见化合价为+1,元素X可能为锂或氢,故A正确;
B.同周期元素从左到右原子半径减小,原子半径r(P)>r(S),故B正确;
C.H2S中H原子未达到8电子稳定结构,故C错误;
D.同周期元素从左到右,非金属性增强,最高价氧化物对应水化物的酸性增强,酸性H2SO4>H3PO4,故D正确;
选C。
5.B
【分析】Y是地壳中含量最高的元素,则Y为O;短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径小于Y的原子半径,且Z与X同主族,则X为第一周期元素H、Z为第三周期元素Na;W的最外层电子数等于Y与Z的最外层电子数之和,则W为Cl,据此分析解答。
【详解】A.由Y、Z、W形成的化合物可能为NaClO,次氯酸钠具有强氧化性,溶于水有漂白性,故A正确;
B.电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;X为H,Y为O,W为Cl,Z为Na,它们原子半径的大小顺序为Na >Cl>O>H,故B错误;
C.根据上述分析可知:Y为O, Z为Na,Y、Z可以形成电子层结构相同的10电子的离子,原子序数越大,半径越小,故离子半径前者大于后者,故C正确;
D.根据上述分析可知:X为H,Y为O,它们可以形成H2O 为的化合物;H2O2为的化合物,故D正确;
故选B。
6.D
【分析】X、Y、Z、W均为原子序数小于18的四种元素的原子,已知X的核外电子总数等于其电子层数,则X为H;Y最外层电子数是次外层电子数的两倍,Y有2个电子层符合电子排布规律,最外层电子数为4,则Y为C;Z2是空气的主要成分之一,是最常见的助燃剂,则Z为O;W+与氖原子核外电子排布相同,则W为Na,以此来解答。
【详解】A.W为Na,Z为O,O2-和Na+电子结构一致,O2-半径大,故A正确;
B.化合物WZX为NaOH,NaOH水溶液是强碱,故B正确;
C.元素X、Z之间可以形成H2O,H2O2两种共价化合物,故C正确;
D.为CO2,其水溶液能导电是CO2因为溶于水生成了碳酸,碳酸电离使溶液导电,但CO2属于非电解质,故D错误;
故答案选D。
7.A
【分析】X的最高价与Z的最低价的绝对值相等,且X、Y、Z为第三周期元素,X、Y、Z可以形成形式的化合物,则X为Na,Z为Cl,电子层数相同的原子序数越大离子半径越小,Y的简单离子半径在同周期离子中最小则Y为Al;
【详解】A.由分析可知,X、Y、Z分别为Na、Al、Cl,同周期主族元素从左到右原子半径逐渐变小,则原子半径:Na>Al>Cl,A错误;
B.同周期主族元素从左到右金属性逐渐减弱,第三周期元素中Na元素金属性最强,则NaOH的碱性最强,B正确;
C.同周期主族元素从左到右非金属性逐渐增强,第三周期元素中Cl元素非金属性最强,则Cl2氧化性最强,C正确;
D.判断阳离子满足8电子结构的方法:次外层电子数+最外层电子数-化合价,离子中Al原子满足8+3-3=8电子结构,D正确;
故选:A。
8.B
【分析】由原子半径随原子序数的变化规律可知,X、Y、Z、W、M、N依次为N、O、Na、P、S、Cl。
【详解】A.元素非金属性越强,其气态氢化物越稳定,所以气态氢化物的稳定性:HCl> H2S,A项正确;
B.O、S的简单氢化物沸点:H2O>H2S,B项错误;
C.元素非金属性越强,其最高价氧化物对应水化物的酸性越强,故酸性:HNO3>H3PO4,C项正确;
D.Na与O可形成两种化合物:Na2O、Na2O2,均为离子化合物,D项正确;
答案选B。
9.B
【分析】短周期部分元素原子半径与原子序数的关系如图,电子层越多原子半径越大,则A、B、C位于第二周期,D、E、G位于第三周期,再结合原子序数大小可知,A为C,B为N,C为O,D为Na,E为A1,G为S元素,据此分析作答。
【详解】A.B为N,C为O,元素形成的简单氢化物分别是NH3、H2O,由于水、氨气中存在氢键,且在通常条件下NH3为气态,H2O为液态,故物质的沸点:C(H2O)>B(NH3),A正确;
B.A为C,B为N,C为O,它们是同一周期元素,原子序数越大,元素的非金属性就越强,所以元素的非金属性由强到弱: C(O)>B(N)>A(C),B错误;
C.E为A1,其单质金属Al能够与NaOH溶液反应产生NaAlO2、H2,C正确;
D.D为Na,E为A1,G为S元素,它们的最高价氧化物对应的水化物分别是NaOH、Al(OH)3、H2SO4,NaOH是强碱,能够与两性氢氧化物Al(OH)3及强酸H2SO4反应;强酸H2SO4也可以与两性氢氧化物Al(OH)3及强碱NaOH反应,故D、E、G的最高价氧化物对应的水化物之间可两两相互反应,D正确;
故合理选项是B。
10.C
【详解】A.根据题目信息,石墨烯是一种从石墨中剥离出来,只有一层原子厚度的二维晶体,所以石墨烯也是由碳元素形成的,A正确;
B.石墨烯、金刚石、石墨是碳元素形成的不同单质,三者互为同素异形体,B正确;
C.石墨烯是能导电的单质,电解质必须是化合物,所以石墨烯不是电解质,C错误;
D.石墨烯和金刚石均是.由碳元素形成的单质,等质量的二者含有相同数目的碳原子,D正确;
故选C。
11.D
【分析】由图可知,Y元素能形成五个共价键,且W、X、Y、Z为原子序数依次增大的短周期元素,所以Y为P元素;Y原子序数为W原子价电子数的3倍,所以W为N元素;X和Z均能和P生成共价键,且X和Z同主族,所以X为F,Z为Cl,据此分析解题。
【详解】A.X和Z分别是F、,F无正价,故A错误;
B.和分别是和,在水中不是强酸,故B错误;
C.四种元素中,Y原子半径在这四种元素中最大,X原子半径在这四种元素中最小,故C错误;
D.和氢三种元素可形成氯化铵,属于同时含有离子键和共价键的化合物,故D正确;
故答案选D。
12.D
【分析】“X在宇宙中含量最丰富”说明X是氢元素,根据结构式,Y能形成两个共价键,其最外层电子数为6,位于第ⅥA族(结构式图下方的Y原子因为得到了W失去的1个电子而只形成1个共价键),“Y与Z位于相邻主族”,Z能形成5个共价键,因此Z位于第ⅤA族,由于Z原子序数大于Y,因此Y位于第二周期,Z位于第三周期,故Y是氧元素,Z是磷元素,W易失去1个电子,原子序数比Z大,应是第四周期第ⅠA族的钾元素,题目据此解答。
【详解】A.W与Y形成的二元化合物有K2O、K2O2、KO2、KO3几种,除K2O外,其余都具有强氧化性,A错误;
B.Z的最高价氧化物对应的水化物是H3PO4,为中强酸,B错误;
C.X的阴离子为,其结构是只有一个电子层的两电子结构,C错误;
D.X与Y组成的化合物有H2O、H2O2,其中实验室通常用分解H2O2的方法制备氧气,D正确;
故选D。
13.D
【分析】短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径是短周期元素中最小的,则X为H元素;Y是短周期中金属性最强的元素,则Y为Na元素;元素Z的最高正价与最低负价代数和为4,则Z为S元素、W为Cl元素。
【详解】A.同周期元素,从左到右原子半径依次减小,则硫原子的原子半径大于氯原子,故A错误;
B.同周期元素,从左到右元素的非金属性依次增强,对应简单离子的还原性依次减弱,则硫离子的还原性强于氯离子,故B错误;
C.同周期元素,从左到右元素的非金属性依次增强,最高价氧化物对应水化物的酸性依次增强,则硫酸的酸性弱于高氯酸,故C错误;
D.X与Y形成的化合物为氢化钠,氢化钠与水反应生成氢氧化钠和氢气,氢氧化钠溶液可使红色石蕊试纸变蓝,故D正确;
故选D。
14.CD
【分析】由四种短周期元素X、Y、Z和W在周期表中的位置可知,Z位于第三周期,Y、Z同主族,Z的原子序数是Y的两倍,则Z为S、Y为O;结合位置可知X为N、W为Cl,以此来解答。
【详解】由上述分析可知,X为N、Y为O、Z为S、W为Cl。
A.O和S可形成共价化合物二氧化硫等,故A正确;
B.同周期从左向右原子半径减小,则r(S)>r(Cl),故B正确;
C.非金属性O大于S,则S的最低价单核阴离子的还原性比O的强,故C错误;
D.Cl的非金属性比S的强,所以Cl的最高价氧化物对应的水化物酸性比S的强,不是最高价含氧酸无此规律,故D错误;
故选CD。
15.(1)
(2)
(3)共价键、离子键
(4)
(5)A
(6)18
【分析】根据元素在周期表中的位置,A是Na元素;B是K元素;C是Mg元素;D是Al元素; E是S元素;F是O元素;G是Cl元素;H是Br元素、R是Ar元素。
【详解】(1)B是K元素,K+核外有18个电子,结构示意图为,A、D最高价氧化物对应的的水化物分别是NaOH、Al(OH)3,NaOH、Al(OH)3反应生成偏铝酸钠和水,反应的离子方程式是。
(2)电子层数相同,质子数越多半径越小,Na+、Mg2+、Al3+、O2-半径由大到小的顺序是;同周期元素从左到右,金属性依次减弱,Na、Mg、Al最高价氧化物对应水化物的碱性由强到弱为。
(3)由元素Na、O形成的一种杀菌消毒剂是Na2O2,存在的化学键有离子键、共价键;
(4)化合物中各原子均满足8电子稳定结构,根据价键规律,S原子之间形成1对共用电子对,S原子与Cl原子之间形成1对共用电子对,其电子式为;
(5)常温下氯酸钾与浓盐酸反应放出气体Cl2,①处充满黄绿色;氯气进入玻璃管后与②处NaBr溶液发生置换反应生成,白色棉球变为橙色;氯气和③处KI溶液反应置换出,遇淀粉变蓝;④处利用氯气与碱液反应进行的尾气吸收,尽管反应生成的物质均为无色,但棉球本身是白色的,所以④处的颜色为白色,故A正确;
(6)G元素是Cl元素,核电荷数为17,H是Br元素,核电荷数为35,两者核电荷数之差是18。
16.(1)六
(2)c
(3) 42 c c
(4)
【详解】(1)原子的电子层数=周期序数,Hg原子有6个电子层,故位于元素周期表第六周期。
(2)a. 硒(Se)与硫位于同一主族,最外层均有6个电子,且均为非金属元素,最低价均为-2价,a正确;
b. 硒(Se)的最高价为+6价,最低价为-2价,SeO2中Se的化合价为+4价,处于中间价态,既有氧化性又有还原性,b正确;
c. 硒的氧化物对应的水化物有H2SeO3和H2SeO4,属于酸,Se的非金属性弱于硫,因此酸性大小关系为:H2SO3>H2SeO3,H2SO4>H2SeO4,即H2SeO3和H2SeO4均为弱酸,c错误;
故选c;
(3)①砷为第33号元素,质子数为33,中子数为75-33=42。
②a.NH4I是离子化合物,PH4I与之性质相似,因此也属于离子化合物,与之间存在离子键,内P与H之间存在共价键,a正确;
b.NH4I能与NaOH反应生成NH3,因此PH4I也能与NaOH反应,b正确;
c.PH4I加热分解生成PH3和HI,HI不稳定,加热时也分解,生成H2和I2,因此与NH4Cl加热分解产物种类不一样,c错误;
故选c。
③a.非金属性越强,氢化物稳定性越强,N的非金属性比P强,因此稳定性大小关系为NH3>PH3,a正确;
b.非金属性越强,最高价氧化物水化物酸性越强,N的非金属性比As强,因此酸性强弱关系为HNO3>H 3AsO4,b正确;
c.As为非金属元素,其氧化物的水化物属于酸,c错误;
d.第VA族元素随原子序数增大,其简单离子电子层数依次增多,离子半径依次增大,d正确;
故选c。
(4)As2O3中As化合价为+3价,H2AsO4中As化合价为+5价,因此As2O3与稀HNO3发生氧化还原反应,反应的化学方程式为:。
17.(1)是否属于氧化还原反应或是否有电子转移
(2)①③
(3)
(4)CaO
(5)
(6)
(7)、
【详解】(1)A组物质与水反应,元素化合价没有发生变化,属于非氧化还原反应,B组物质与水反应,元素化合价发生变化,属于氧化还原反应,所以分成A、B组的分类依据为:是否属于氧化还原反应或是否有电子转移;
(2)CaO能与水反应生成氢氧化钙,CaO所属物质类别为金属氧化物、碱性氧化物,答案选①③;
(3)能与二氧化碳反应生成碳酸钠和O2,故可用作潜水艇供氧剂。B组中能和水反应,且水做氧化剂的物质是Na,其反应方程式为:2Na+2H2O=2Na++2OH +H2↑,故答案为:;2Na+2H2O=2Na++2OH +H2↑;
(4)NH3、CaO与水反应后溶液呈碱性为D组物质,SO2与水反应后溶液呈酸性为C组物质,CaO与SO2反应生成CaSO3,进一步氧化为CaSO4,所以工业上常用CaO消除SO2对大气的污染。故答案为:CaO;
(5)氢氧化铝不溶于过量氨水,故实验室用与氨水反应制备,反应的离子反应方程式为:;
(6)SO2具有强还原性,可使酸性溶液褪色,反应的离子方程式为:;
(7)F组中,氯气与水发生歧化反应生成HCl和HClO,过氧化钠与水发生歧化反应生成氢氧化钠和氧气,这两个反应中氧化剂与还原剂物质的量之比为1:1,故答案为:、。
18. 减弱 增强 剧烈 越强 最高价氧化物对应水化物 越强 越强 越弱 增强 减弱 稳定 越弱 越强 酸性 强 强 弱 越弱 越强
【详解】(1)比较金属性的强弱,实质是看元素原子失电子的难易程度,越易失电子,金属性越强。
①同周期从左到右,原子越难失去电子,金属性减弱;
②同主族从上到下,随着电子层数的增多,原子越容易失去电子,金属性增强。
(2)①金属单质与水或酸反应越剧烈,说明金属越容易失去电子,还原性越强,元素金属性越强;
②最高价氧化物对应水化物的碱性越强,元素金属性越强;如碱性:NaOH>Mg(OH)2,则金属性:Na>Mg;
③离子的氧化性越强,表示离子得电子能力强,如氧化性:Cu2+>Zn2+,对应金属为Cu和Zn,其金属性:Cu
②同主族从上到下,原子半径越来越大,原子得电子能力越来越弱,非金属性越弱。
(5)①单质越易跟H2化合,可知单质的氧化性越强,与氢气化合生成的氢化物也就越稳定。氢化物的还原性其实质是阴离子的失电子能力的比较,如氢化物:HCl、HBr、HI的还原性由Cl-、Br-、I-的失电子能力决定,氢化物的还原性越弱,其非金属性也就越强。
②元素非金属性越强说明元素的电负性越强,其吸引电子的能力也越强,其对应的最高价氧化物对应的水化物的酸性越强。
③非金属单质间的置换反应,非金属强的单质能置换出非金属性弱的单质,如:。
④元素的原子对应阴离子的还原性越强,元素的非金属性就越弱。如:。
⑤与同一可变价金属反应,金属元素在该产物中价态越高,该非金属元素的非金属性越强。如:,,说明非金属性Cl>S。
19.(1) 2Na+2H2O=2NaOH+H2↑ Mg+2H2OMg(OH)2↓+H2↑ 金属性:Na>Mg
(2) 产生白色沉淀 Al3++3NH3·H2O=Al(OH)3↓+3NH 白色沉淀逐渐溶解 Al(OH)3+3H+=Al3++3H2O 白色沉淀逐渐溶解 Al(OH)3+OH-=AlO+2H2O 产生白色沉淀 Mg2++2OH-=Mg(OH)2↓
(3) 减弱 减弱 增强 增强 减小 减弱 增强 减弱 增强
【详解】(1)钠和水常温下剧烈反应生成碱和气体,化学方程式2Na+2H2O=2NaOH+H2↑,镁常温下和水不反应,加热时剧烈反应,生成碱和气体,化学方程式Mg+2H2OMg(OH)2↓+H2↑,金属单质和水或酸反应越剧烈,金属的金属性越强,所以金属性:Na>Mg,答案:2Na+2H2O=2NaOH+H2↑;Mg+2H2OMg(OH)2↓+H2↑;金属性:Na>Mg;
(2)向AlCl3溶液中加入足量氨水,生成白色沉淀,Al3++3NH3·H2O=Al(OH)3↓+3 ,氢氧化铝不溶于氨水。实验得到的沉淀分装两支试管中,一支试管中加入盐酸,白色沉淀逐渐溶解,生成盐和水,离子方程式为Al(OH)3+3H+=Al3++3H2O;另一支试管中加入NaOH溶液,白色沉淀逐渐溶解,生成偏铝酸盐和水,离子方程式为Al(OH)3+OH-=AlO+2H2O。向MgCl2溶液加入过量NaOH溶液,产生白色沉淀,离子方程式为Mg2++2OH-=Mg(OH)2↓。答案:产生白色沉淀;Al3++3NH3·H2O=Al(OH)3↓+3NH;白色沉淀逐渐溶解;Al(OH)3+3H+=Al3++3H2O;白色沉淀逐渐溶解;Al(OH)3+OH-=AlO+2H2O;产生白色沉淀;Mg2++2OH-=Mg(OH)2↓;
(3)第三周期的Na、Mg、Al的金属性逐渐减弱,最高价氧化物的水化物NaOH、Mg(OH)2、Al(OH)3的碱性逐渐减弱,NaOH为强碱,Mg(OH)2为中强碱,Al(OH)3为两性氢氧化物。第三周期的Si、P、S、Cl的非金属性逐渐增强,最高价氧化物的水化物H2SiO3、H3PO4、H2SO4、HClO4的酸性逐渐增强。HClO4是最强的含氧酸,H2SiO3为难溶的弱酸,H3PO4为中强酸,H2SO4为强酸。同一周期从左到右,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。答案:减弱;减弱;增强;增强;减小;减弱;增强;减弱; 增强。
20.(1)P
(2)
(3)O2-
(4)CH4
(5)离子键、极性共价键
(6)NaOH+Al(OH)3=NaAlO2+2H2O
【分析】根据元素在周期表的位置可知:①是H,②是C,③是O,④是Na,⑤是Mg,⑥是Al,⑦是Si,⑧是P,⑨是Cl元素,然后利用元素的性质与原子结构及位置的关系分析解答。
【详解】(1)根据上述分析可知元素⑧是磷,该元素的元素符号是P;
(2)元素⑤是Mg,元素⑨是Cl,二者反应产生MgCl2是离子化合物,2个Cl-与Mg2+之间以离子键结合,则二者形成的化合物的电子式是;
(3)③是O,⑤是Mg,二者形成的简单离子O2-、Mg2+核外电子排布都是2、8,二者电子层结构相同,离子的核电荷数越大,离子半径就越小,故离子半径:O2->Mg2+,即O2-半径较大;
(4)元素②是C,⑦是Si,二者是同一主族元素,元素的原子序数越大,元素的非金属性就越弱,其形成的简单氢化物稳定性就越差,故两种元素形成的简单氢化物分子中稳定性较强的分子是CH4;
(5)①是H,③是O,④是Na,三种元素形成的化合物NaOH是离子化合物,Na+与OH-之间以离子键结合,在阴离子OH-中H、O原子之间以极性共价键结合,故NaOH中含有的化学键类型有离子键、极性共价键;
(6)④是Na,⑥是Al,两种元素形成的最高价氧化物对应的水化物的化学式分别是NaOH、Al(OH)3,其中Al(OH)3是两性氢氧化物,能够与强碱NaOH反应产生NaAlO2、H2O,该反应的化学方程式为:NaOH+Al(OH)3=NaAlO2+2H2O。
21.(1)第二周期第Ⅵ族
(2) > AD
(3) 2Na2O2+2CO2=2Na2CO3+O2 作供氧剂
(4) 3Cl2+2=6Cl-+N2+8H+
【分析】由题给信息可推知X为O元素,Y为Na元素,Z为S元素,Q为Cl元素;
【详解】(1)由分析可知,X为O元素,则O元素位于元素周期表中的第二周期第VIA族;
(2)由分析可知X为O元素,Z为S元素,非金属性:,故简单氢化物的稳定性:H2O>H2S;H2O从液态转化为气态时,需要克服的作用力有范德华力和氢键,故答案为:>;AD;
(3)由分析可知,X为O元素,Y为Na元素,与反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;可在呼吸面具或潜水艇中作为O2的来源;故答案为:2Na2O2+2CO2=2Na2CO3+O2;作供氧剂;
(4)由分析可知,X为O元素,Y为Na元素,Q为Cl元素,则①NaClO的电子式为;
②Cl2将酸性氨氮废水中转化为N2和H2O的离子方程式为3Cl2+2=6Cl-+N2+8H+。
22.(1) 第三周期第VIA族
(2) H2O NH3 N3->O2->Na+
(3) 2Na2O2+2H2O=4NaOH+O2↑ H—O—O—H
(4)
(5) HClO4 H2SO4
【分析】A、B、C、D、E、F是短周期主族元素,且原子序数依次增大。A元素的一种核素不含中子,则A为H,D+与Ne核外电子排布相同,则D为Na,B的简单氢化物的水溶液呈碱性,则B为N,C、E同主族,形成的化合物为EC2、EC3,则C为O,E为S,则F为Cl。
【详解】(1)E为S,E在元素周期表中的位置为第三周期第VIA族。F离子即氯离子的结构示意图为。
(2)B为N, C为O,非金属性O>N,非金属性越强,简单氢化物越稳定,则比较B与C简单氢化物的热稳定性:H2O>NH3;具有相同电子排布的离子,原子序数大的离子半径小,B、C、D三种元素简单离子均为10电子结构,其离子半径由大到小的顺序(用离子符号表示) N3->O2->Na+。
(3)D、C两元素组成的化合物D2C2即Na2O2,属于离子化合物,其电子式为,与水反应生成NaOH和O2,化学方程式为2Na2O2+2H2O=4NaOH+O2↑。A与C两元素形成的1∶1的化合物为H2O2,属于共价分子,结构式为H—O—O—H。
(4)D2E即硫化钠,属于离子化合物,用电子式表示化合物D2E的形成过程为。
(5)同周期从左到右元素非金属性递增,非金属性越强,最高价氧化物对应水化物的酸性越强,则E与F最高价氧化物对应水化物的酸性为HClO4>H2SO4。
