人教版(2019)必修第二册 第七章 第二节 乙烯与有机高分子材料 第一课时 乙烯 课件(共42张PPT)
文档属性
| 名称 | 人教版(2019)必修第二册 第七章 第二节 乙烯与有机高分子材料 第一课时 乙烯 课件(共42张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 09:59:26 | ||
图片预览










文档简介
(共42张PPT)
第七章 第二节 乙烯与有机高分子材料
一、乙 烯
高一年级 化学
学习目标
1.能描述乙烯分子的结构特征。
2.能描述乙烯的主要化学性质及相应性质的实验现象,能书写相关的反应式,能利用这些物质的主要性质进行鉴别。
引入
为了促进香蕉成熟,可在密封袋子中放一些成熟的苹果
乙烯是石油化学工业重要的基本原料,通过一系列化学反应,可以从乙烯得到有机高分子材料、药物等成千上万种有用的物质。乙烯的用途广泛,其产量可以用来衡量一个国家石油化学工业的发展水平。
引入
一、乙烯的物理性质
乙烯是一种无色,稍有气味的气体
密度比空气略小
难溶于水
用排水法收集
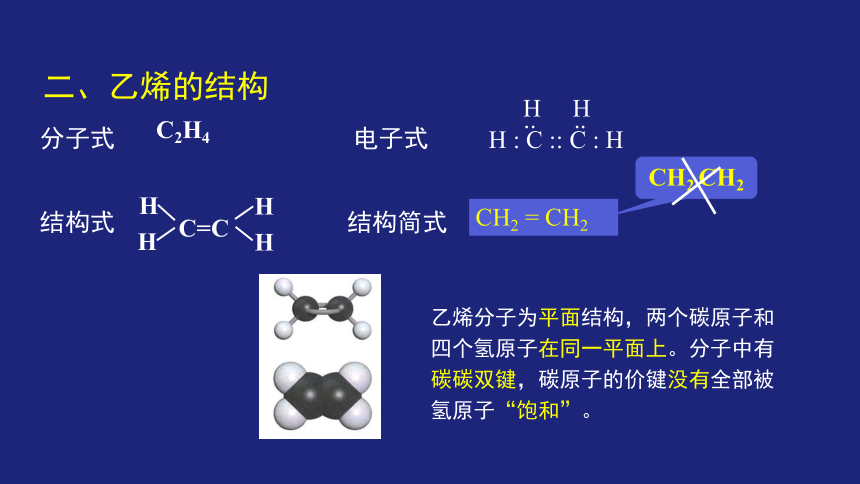
分子式 电子式
结构式 结构简式
C2H4
CH2 = CH2
H : C :: C : H
.. ..
H H
CH2 CH2
二、乙烯的结构
乙烯分子为平面结构,两个碳原子和四个氢原子在同一平面上。分子中有碳碳双键,碳原子的价键没有全部被氢原子“饱和”。
C=C
H
H
H
H
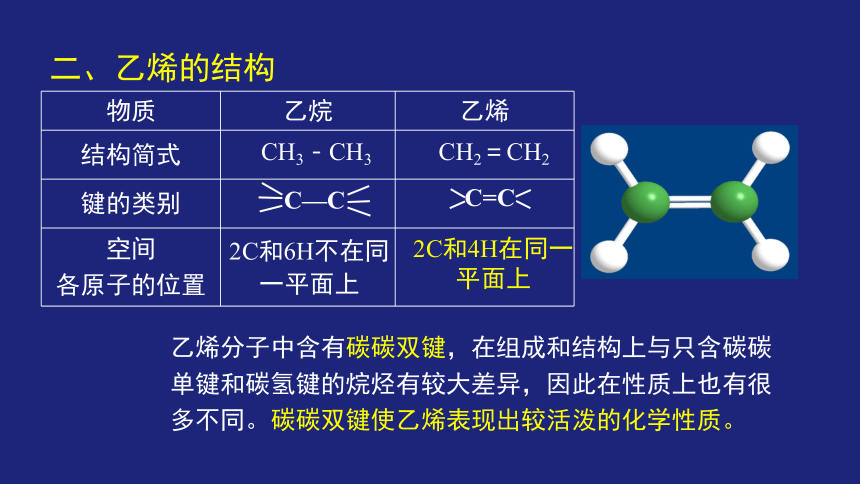
物质 乙烷 乙烯
结构简式
键的类别
空间 各原子的位置
2C和4H在同一平面上
2C和6H不在同一平面上
CH2=CH2
CH3-CH3
C—C
C=C
二、乙烯的结构
乙烯分子中含有碳碳双键,在组成和结构上与只含碳碳单键和碳氢键的烷烃有较大差异,因此在性质上也有很多不同。碳碳双键使乙烯表现出较活泼的化学性质。
例:下列关于乙烯和乙烷的说法中错误的是( )
A.乙烯是不饱和结构,乙烷是饱和结构。
B.乙烯分子中的两个碳原子在同一条直线上,乙
烷分子中的两个碳原子也在同一条直线上。
C.乙烯分子中含有碳碳双键,乙烯比乙烷稳定。
D.乙烯分子为平面结构,乙烷分子为立体结构。
【典型例题】
C
解析:
A项,乙烯含有碳碳双键,是不饱和结构,乙烷属于饱和结构,
正确;
B项,两点决定一条直线,所以分子中的两个碳原子一定在同一
条直线上,正确;
C项,乙烯分子含有碳碳双键,其中一个键容易断裂,结构不稳
定,错误;
D项,乙烯分子为平面结构,所有原子都处在同一平面上;乙烷
分子可以看作是甲烷分子中的一个H原子被-CH3取代的产
物,所以乙烷分子中所有原子不可能在同一平面上,为立
体结构,正确。
【典型例题】
三、乙烯的化学性质
【实验7-2】
(1)点燃纯净的乙烯,观察燃烧时的现象。
(2)将乙烯通入盛有酸性高锰酸钾溶液的试管中,观察现象。
1.氧化反应
C2H4
+
3O2
点燃
2CO2 + 2H2O
① 燃烧
现象:火焰明亮并伴有黑烟
三、乙烯的化学性质
1.氧化反应
三、乙烯的化学性质
现象:溶液的紫色褪去
应用:鉴别乙烯(与烷烃比较)
【思考】能不能用酸性KMnO4溶液除去烷烃中的乙烯?
② 被酸性KMnO4溶液氧化
不能
三、乙烯的化学性质
【实验7-3】
将乙烯通入盛有溴的四氯化碳溶液的试管中,观察现象。
三、乙烯的化学性质
【实验7-3】
将乙烯通入盛有溴的四氯化碳溶液的试管中,观察现象。
现象:乙烯使溴的四氯化碳溶液褪色
2.加成反应
三、乙烯的化学性质
碳碳双键中有一个键易断
有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应。
1,2-二溴乙烷(液态)
应用:既可用于乙烯与烷烃的鉴别又可用于除去烷烃中的乙烯
我是
溴分子
加成反应机理
三、乙烯的化学性质
加成反应机理
三、乙烯的化学性质
加成反应机理
三、乙烯的化学性质
加成反应机理
三、乙烯的化学性质
加成反应机理
三、乙烯的化学性质
加成反应机理
三、乙烯的化学性质
加成反应机理
三、乙烯的化学性质
2.加成反应
三、乙烯的化学性质
乙烯不仅可以与溴发生加成反应,在一定条件下,还可以与
氯气、氢气、氯化氢和水等物质发生加成反应。
CH2=CH2 + H2
催化剂
△
CH2=CH2 + H—OH
催化剂
加热、加压
CH3—CH3 (乙烷)
CH3—CH2—OH(乙醇)
工业上可以利用乙烯与水的加成反应制取乙醇
3.聚合反应
三、乙烯的化学性质
在适当的温度、压强和催化剂存在的条件下,乙烯分子中碳碳双键中的一个键断裂,分子间通过碳原子相互结合形成很长的碳链,生成相对分子质量很大的聚合物----聚乙烯。
3.聚合反应
三、乙烯的化学性质
聚合度:链节的数目n
单体:合成高分子的小分子物质 CH2=CH2
链节:重复的结构单元“-CH2-CH2-”
3.聚合反应
三、乙烯的化学性质
像这样,由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应叫做聚合反应。
乙烯的聚合反应同时也是加成反应,这样的反应又被称为加成聚合反应,简称加聚反应。
例:下列过程中发生了加成反应的是( )
A.C2H4使酸性高锰酸钾溶液褪色
B.C2H4使溴的CCl4溶液褪色
C.C2H4燃烧生成二氧化碳和水
D.CH4和Cl2的混合气体在光照条件下逐渐褪色
【典型例题】
【解析】A项,酸性高锰酸钾溶液与C2H4发生氧化反应;
B项,C2H4与溴发生加成反应;
C项,C2H4燃烧属于氧化反应;
D项,属于取代反应。
B
【典型例题】
例:某课外活动小组设计了以下四种方案除去乙烷中混
有的少量乙烯,并得到纯净干燥的乙烷,合理的是
A.①②④ B.①②③
C.②③④ D.①②③④
D
溴的四氯化碳溶液
溴的四氯化碳溶液
解析:
①和②C2H4与Br2发生加成反应生成液态1,2- 二溴乙烷而除去C2H4,①NaOH溶液除去挥发出来的Br2蒸气,浓硫酸除去水蒸气,②碱石灰除去挥发出来的Br2蒸气和水蒸气,①和②均正确;
③和④酸性KMnO4溶液将C2H4氧化为CO2,③NaOH溶液能吸收CO2,浓硫酸吸收水蒸气,④碱石灰可吸收CO2和水蒸气,③和④也正确。
【典型例题】
溴的四氯化碳溶液
溴的四氯化碳溶液
1.重要的化工原料
2.植物生长调节剂,催熟剂等
四、乙烯的用途
信息搜索
除了被用作化工原料,乙烯还是一种植物生长调节剂,可用于催熟果实。在两个透明的塑料袋中各放一个未成熟的水果,向其中的一个袋子里再放一个成熟的水果,将袋口密封,观察并比较水果的变化。请查阅资料,与同学交流,解释以上现象。
【课堂练习】
B
练习:下列关于乙烯的结构与性质的叙述,错误的是
A.乙烯分子中6个原子都在同一平面内
B.乙烯与酸性KMnO4溶液发生加成反应能使其褪色
C.乙烯与溴的四氯化碳溶液发生加成反应能使其褪色
D.乙烯分子的一氯代物只有一种结构
氧化
练习:甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,可
依次将其通过下列哪组试剂的洗气瓶( )
A.澄清石灰水,浓硫酸
B.溴的四氯化碳溶液,浓硫酸
C.酸性高锰酸钾溶液,浓硫酸
D.浓硫酸,酸性高锰酸钾溶液
B
【课堂练习】
练习:长途运输水果时,常常将浸泡有高锰酸钾溶液的硅
藻土放置在盛放水果的容器中,其目的是( )
A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变
B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂
C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟
D.利用高锰酸钾溶液的氧化性,催熟水果
C
【课堂练习】
练习:下列物质不可能是乙烯加成产物的是( )
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
B
【解析】A项,CH2=CH2和H2加成可生成CH3CH3
B项,两个氯原子在同一个碳原子上,从
结构上看,并非是乙烯加成的产物
C项,CH2=CH2和H2O加成可生成CH3CH2OH
D项,CH2=CH2和HBr加成可生成CH3CH2Br
【课堂练习】
练习:能证明乙烯分子中含有一个碳碳双键的事实是( )
A.乙烯分子中碳、氢原子的个数比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯易与溴发生加成反应,且1 mol乙烯完全加
成需消耗1 mol溴单质
D.乙烯能使酸性KMnO4溶液褪色
C
【课堂练习】
解析:
A项,碳氢原子个数比为1∶2,是对乙烯的组成分析,而
不能证明存在碳碳双键,A错误;
B项,根据生成的CO2和H2O的物质的量相等,只能推出碳、
氢原子个数比为1∶2,B错误;
C项,加成反应是不饱和烃的特征性质,1 mol乙烯完全加成
需要消耗 1 mol溴,说明乙烯分子中含有一个碳碳双
键,C正确;
D项,能够使酸性高锰酸钾溶液褪色,并不能说明一定含
有碳碳双键,D错误。
【课堂练习】
练习:含有碳碳双键的有机物很多,其性质和乙烯相似,写出
下列要求的方程式。
(1)丙烯与溴的四氯化碳溶液反应:
(2)丙烯在一定条件下加聚生成聚丙烯:
【课堂练习】
归纳小结
1.乙烯分子的结构特征:
乙烯分子为平面结构,两个碳原子和四个氢原子在同一平面上。分子中含有碳碳双键。
2.乙烯的化学性质:
氧化反应(燃烧、被酸性高锰酸钾溶液氧化)
加成反应
加聚反应
课后作业
1.课本76页练习与应用1、2、3、5、6题
2.通过本节课的学习,你已经掌握了乙烯的结构和性质,乙烯在生产生活中有着非常重要的用途,请你查阅相关资料,完成一篇关于乙烯用途的小论文吧(字数200字左右)。
同学们再见
第七章 第二节 乙烯与有机高分子材料
一、乙 烯
高一年级 化学
学习目标
1.能描述乙烯分子的结构特征。
2.能描述乙烯的主要化学性质及相应性质的实验现象,能书写相关的反应式,能利用这些物质的主要性质进行鉴别。
引入
为了促进香蕉成熟,可在密封袋子中放一些成熟的苹果
乙烯是石油化学工业重要的基本原料,通过一系列化学反应,可以从乙烯得到有机高分子材料、药物等成千上万种有用的物质。乙烯的用途广泛,其产量可以用来衡量一个国家石油化学工业的发展水平。
引入
一、乙烯的物理性质
乙烯是一种无色,稍有气味的气体
密度比空气略小
难溶于水
用排水法收集
分子式 电子式
结构式 结构简式
C2H4
CH2 = CH2
H : C :: C : H
.. ..
H H
CH2 CH2
二、乙烯的结构
乙烯分子为平面结构,两个碳原子和四个氢原子在同一平面上。分子中有碳碳双键,碳原子的价键没有全部被氢原子“饱和”。
C=C
H
H
H
H
物质 乙烷 乙烯
结构简式
键的类别
空间 各原子的位置
2C和4H在同一平面上
2C和6H不在同一平面上
CH2=CH2
CH3-CH3
C—C
C=C
二、乙烯的结构
乙烯分子中含有碳碳双键,在组成和结构上与只含碳碳单键和碳氢键的烷烃有较大差异,因此在性质上也有很多不同。碳碳双键使乙烯表现出较活泼的化学性质。
例:下列关于乙烯和乙烷的说法中错误的是( )
A.乙烯是不饱和结构,乙烷是饱和结构。
B.乙烯分子中的两个碳原子在同一条直线上,乙
烷分子中的两个碳原子也在同一条直线上。
C.乙烯分子中含有碳碳双键,乙烯比乙烷稳定。
D.乙烯分子为平面结构,乙烷分子为立体结构。
【典型例题】
C
解析:
A项,乙烯含有碳碳双键,是不饱和结构,乙烷属于饱和结构,
正确;
B项,两点决定一条直线,所以分子中的两个碳原子一定在同一
条直线上,正确;
C项,乙烯分子含有碳碳双键,其中一个键容易断裂,结构不稳
定,错误;
D项,乙烯分子为平面结构,所有原子都处在同一平面上;乙烷
分子可以看作是甲烷分子中的一个H原子被-CH3取代的产
物,所以乙烷分子中所有原子不可能在同一平面上,为立
体结构,正确。
【典型例题】
三、乙烯的化学性质
【实验7-2】
(1)点燃纯净的乙烯,观察燃烧时的现象。
(2)将乙烯通入盛有酸性高锰酸钾溶液的试管中,观察现象。
1.氧化反应
C2H4
+
3O2
点燃
2CO2 + 2H2O
① 燃烧
现象:火焰明亮并伴有黑烟
三、乙烯的化学性质
1.氧化反应
三、乙烯的化学性质
现象:溶液的紫色褪去
应用:鉴别乙烯(与烷烃比较)
【思考】能不能用酸性KMnO4溶液除去烷烃中的乙烯?
② 被酸性KMnO4溶液氧化
不能
三、乙烯的化学性质
【实验7-3】
将乙烯通入盛有溴的四氯化碳溶液的试管中,观察现象。
三、乙烯的化学性质
【实验7-3】
将乙烯通入盛有溴的四氯化碳溶液的试管中,观察现象。
现象:乙烯使溴的四氯化碳溶液褪色
2.加成反应
三、乙烯的化学性质
碳碳双键中有一个键易断
有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应。
1,2-二溴乙烷(液态)
应用:既可用于乙烯与烷烃的鉴别又可用于除去烷烃中的乙烯
我是
溴分子
加成反应机理
三、乙烯的化学性质
加成反应机理
三、乙烯的化学性质
加成反应机理
三、乙烯的化学性质
加成反应机理
三、乙烯的化学性质
加成反应机理
三、乙烯的化学性质
加成反应机理
三、乙烯的化学性质
加成反应机理
三、乙烯的化学性质
2.加成反应
三、乙烯的化学性质
乙烯不仅可以与溴发生加成反应,在一定条件下,还可以与
氯气、氢气、氯化氢和水等物质发生加成反应。
CH2=CH2 + H2
催化剂
△
CH2=CH2 + H—OH
催化剂
加热、加压
CH3—CH3 (乙烷)
CH3—CH2—OH(乙醇)
工业上可以利用乙烯与水的加成反应制取乙醇
3.聚合反应
三、乙烯的化学性质
在适当的温度、压强和催化剂存在的条件下,乙烯分子中碳碳双键中的一个键断裂,分子间通过碳原子相互结合形成很长的碳链,生成相对分子质量很大的聚合物----聚乙烯。
3.聚合反应
三、乙烯的化学性质
聚合度:链节的数目n
单体:合成高分子的小分子物质 CH2=CH2
链节:重复的结构单元“-CH2-CH2-”
3.聚合反应
三、乙烯的化学性质
像这样,由相对分子质量小的化合物分子互相结合成相对分子质量大的聚合物的反应叫做聚合反应。
乙烯的聚合反应同时也是加成反应,这样的反应又被称为加成聚合反应,简称加聚反应。
例:下列过程中发生了加成反应的是( )
A.C2H4使酸性高锰酸钾溶液褪色
B.C2H4使溴的CCl4溶液褪色
C.C2H4燃烧生成二氧化碳和水
D.CH4和Cl2的混合气体在光照条件下逐渐褪色
【典型例题】
【解析】A项,酸性高锰酸钾溶液与C2H4发生氧化反应;
B项,C2H4与溴发生加成反应;
C项,C2H4燃烧属于氧化反应;
D项,属于取代反应。
B
【典型例题】
例:某课外活动小组设计了以下四种方案除去乙烷中混
有的少量乙烯,并得到纯净干燥的乙烷,合理的是
A.①②④ B.①②③
C.②③④ D.①②③④
D
溴的四氯化碳溶液
溴的四氯化碳溶液
解析:
①和②C2H4与Br2发生加成反应生成液态1,2- 二溴乙烷而除去C2H4,①NaOH溶液除去挥发出来的Br2蒸气,浓硫酸除去水蒸气,②碱石灰除去挥发出来的Br2蒸气和水蒸气,①和②均正确;
③和④酸性KMnO4溶液将C2H4氧化为CO2,③NaOH溶液能吸收CO2,浓硫酸吸收水蒸气,④碱石灰可吸收CO2和水蒸气,③和④也正确。
【典型例题】
溴的四氯化碳溶液
溴的四氯化碳溶液
1.重要的化工原料
2.植物生长调节剂,催熟剂等
四、乙烯的用途
信息搜索
除了被用作化工原料,乙烯还是一种植物生长调节剂,可用于催熟果实。在两个透明的塑料袋中各放一个未成熟的水果,向其中的一个袋子里再放一个成熟的水果,将袋口密封,观察并比较水果的变化。请查阅资料,与同学交流,解释以上现象。
【课堂练习】
B
练习:下列关于乙烯的结构与性质的叙述,错误的是
A.乙烯分子中6个原子都在同一平面内
B.乙烯与酸性KMnO4溶液发生加成反应能使其褪色
C.乙烯与溴的四氯化碳溶液发生加成反应能使其褪色
D.乙烯分子的一氯代物只有一种结构
氧化
练习:甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,可
依次将其通过下列哪组试剂的洗气瓶( )
A.澄清石灰水,浓硫酸
B.溴的四氯化碳溶液,浓硫酸
C.酸性高锰酸钾溶液,浓硫酸
D.浓硫酸,酸性高锰酸钾溶液
B
【课堂练习】
练习:长途运输水果时,常常将浸泡有高锰酸钾溶液的硅
藻土放置在盛放水果的容器中,其目的是( )
A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变
B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂
C.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟
D.利用高锰酸钾溶液的氧化性,催熟水果
C
【课堂练习】
练习:下列物质不可能是乙烯加成产物的是( )
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
B
【解析】A项,CH2=CH2和H2加成可生成CH3CH3
B项,两个氯原子在同一个碳原子上,从
结构上看,并非是乙烯加成的产物
C项,CH2=CH2和H2O加成可生成CH3CH2OH
D项,CH2=CH2和HBr加成可生成CH3CH2Br
【课堂练习】
练习:能证明乙烯分子中含有一个碳碳双键的事实是( )
A.乙烯分子中碳、氢原子的个数比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯易与溴发生加成反应,且1 mol乙烯完全加
成需消耗1 mol溴单质
D.乙烯能使酸性KMnO4溶液褪色
C
【课堂练习】
解析:
A项,碳氢原子个数比为1∶2,是对乙烯的组成分析,而
不能证明存在碳碳双键,A错误;
B项,根据生成的CO2和H2O的物质的量相等,只能推出碳、
氢原子个数比为1∶2,B错误;
C项,加成反应是不饱和烃的特征性质,1 mol乙烯完全加成
需要消耗 1 mol溴,说明乙烯分子中含有一个碳碳双
键,C正确;
D项,能够使酸性高锰酸钾溶液褪色,并不能说明一定含
有碳碳双键,D错误。
【课堂练习】
练习:含有碳碳双键的有机物很多,其性质和乙烯相似,写出
下列要求的方程式。
(1)丙烯与溴的四氯化碳溶液反应:
(2)丙烯在一定条件下加聚生成聚丙烯:
【课堂练习】
归纳小结
1.乙烯分子的结构特征:
乙烯分子为平面结构,两个碳原子和四个氢原子在同一平面上。分子中含有碳碳双键。
2.乙烯的化学性质:
氧化反应(燃烧、被酸性高锰酸钾溶液氧化)
加成反应
加聚反应
课后作业
1.课本76页练习与应用1、2、3、5、6题
2.通过本节课的学习,你已经掌握了乙烯的结构和性质,乙烯在生产生活中有着非常重要的用途,请你查阅相关资料,完成一篇关于乙烯用途的小论文吧(字数200字左右)。
同学们再见
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
