人教版(2019)必修 第二册 第七章 有机化合物 第四节 基本营养物质(共35张PPT)
文档属性
| 名称 | 人教版(2019)必修 第二册 第七章 有机化合物 第四节 基本营养物质(共35张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 10:05:03 | ||
图片预览











文档简介
(共35张PPT)
高一年级 化学
第七章 有机化合物 第四节 基本营养物质
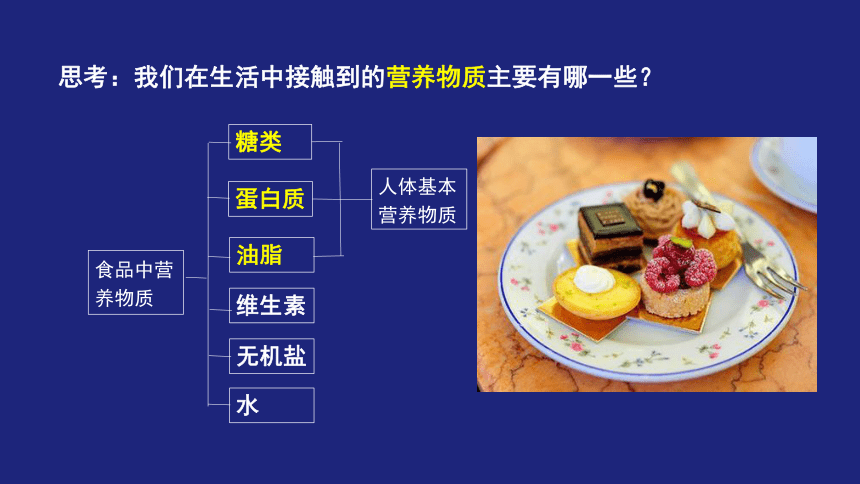
思考:我们在生活中接触到的营养物质主要有哪一些?
糖类
蛋白质
油脂
食品中营养物质
维生素
无机盐
水
人体基本营养物质
学习目标
1.掌握葡萄糖、淀粉、蛋白质、油脂的主要性质与结构的关系。
2.掌握葡萄糖的性质实验。
3.掌握蛋白质的变性、显色反应实验。
4.了解糖类、油脂、蛋白质在人体内的转化。
5.体会有机合成在生产生活中的重要应用。
一、糖类
1.组成
糖类是由 、 、 三种元素组成
可用通式 表示,也称为 。
碳 氢 氧
Cn(H2O)m
碳水化合物
一、糖类
2.分类 依据:是否水解及水解产物的不同进行分类
一、糖类
2.分类 依据:是否水解及水解产物的不同进行分类
类别 单糖 二糖 多糖
特点 不能再水解成更简单的糖 一分子二糖能水解成 单糖 一分子多糖能水解成 单糖
代表物 、_____ 、 、乳糖 、_______
代表物分子式
两分子
多分子
葡萄糖
果糖
蔗糖 麦芽糖
淀粉 纤维素
C6H12O6
C12H22O11
(C6H10O5)n
是否为同分异构体
是
是
不是
一、糖类
3.葡萄糖
(1) 结构:分子式: ;
结构简式:
。或CH2OH(CHOH)4CHO。官能团为 。
(2)物理性质:葡萄糖是一种有 的 晶体, 溶于水。
C6H12O6
CH2OH—CHOH—CHOH—CHOH—CHOH—CHO
羟基、醛基
有甜味
无色
能
【实验7-7】
(1) 在试管中加入 2 mL 10% NaOH溶液,滴加 5 滴5% CuSO4溶液,得到新制的Cu(OH)2。再加入 2 mL 10%葡萄糖溶液,加热,观察现象。
(2) 在洁净的试管中加入 1 mL 2% AgNO3溶液,然后一边振荡试管,一边逐滴加入 2% 稀氨水,直到最初产生的沉淀恰好溶解为止,得到银氨溶液。再加入 1 mL 10% 葡萄糖溶液,振荡,然后放在水浴中加热,观察现象。
一、糖类
3.葡萄糖
(3)化学性质
葡萄糖
新制的Cu(OH)2,加热
砖红色沉淀( Cu2O )
银氨溶液,加热
光亮的银镜( Ag)
检验
葡萄糖
醛基
一、糖类
4.蔗糖
(1)组成
蔗糖分子式为 ,与麦芽糖、乳糖互为 。
C12H22O11
同分异构体
一、糖类
4.蔗糖
(2)化学性质
C12H22O11 + H2O
C6H12O6+C6H12O6
催化剂
蔗糖
葡萄糖
果糖
蔗糖水解:
一、糖类
5.淀粉
(1)组成
通式为 ,属于天然高分子化合物。
(C6H10O5)n
【实验7-8】
(1)回忆生物课中学习的检验淀粉的方法。将碘溶液滴到一片馒头或土豆上,观察现象。
一、糖类
5.淀粉
(2)化学性质
a.特征反应:淀粉遇单质碘变蓝。
【实验7-8】
(1)回忆生物课中学习的检验淀粉的方法。将碘溶液滴到一片馒头或土豆上,观察现象。
(2) 在试管中加入 0.5g 淀粉和4mL 2mol/L H2SO4溶液加热。待溶液冷却后向其中加入NaOH溶液,将溶液调至碱性,再加入少量新制的Cu(OH)2,加热。观察并解释实验现象。
【实验探究】
实验操作
实验现象 最终有 生成
实验结论 淀粉水解生成的 ,与新制的Cu(OH)2共热生成
淀粉水解的化学反应方程式
砖红色沉淀
葡萄糖
氧化亚铜
(C6H10O5)n+nH2O
nC6H12O6
催化剂
淀粉(或纤维素)
葡萄糖
一、糖类
5.淀粉
(2)化学性质
a.特征反应:淀粉遇单质碘变蓝。
b.淀粉水解反应:
(C6H10O5)n+nH2O
nC6H12O6
催化剂
淀粉(或纤维素)
葡萄糖
6.糖类的主要用途
(2)人体内,无纤维素酶,但纤维素能刺激肠道蠕动
促进 和 。
消化 排泄
淀粉
纤维素
一、糖类
(1) 淀粉为人体提供能量
(3)以富含 的农作物为原料酿酒,以富含
的植物秸秆为原料生产燃料乙醇。
C6H12O6
2C2H5OH+2CO2↑
酶
葡萄糖
二、蛋白质
1. 蛋白质的存在和组成
(1)存在:蛋白质是构成 的基本物质,存在于各类生物体内。
(2)组成:由 等元素组成,是一类非常复杂的 。
2. 蛋白质性质
(1) 蛋白质的水解反应
细胞
碳、氢、氧、氮、硫
天然有机高分子
蛋白质
酸、碱或酶等催化剂
水解反应
多肽
水解反应
氨基酸(最终产物)
【思考与讨论】
观察甘氨酸和苯丙氨酸的结构简式,辨认其中的官能团,并说明其结构的共同点。
氨基酸分子中都含有氨基(一NH2)和羧基。
我国科学家于1965年在世界上首次完成了具有生命活力的蛋白质——结晶牛胰岛素的合成,对蛋白质的研究做出了重要贡献。
【实验探究】
【实验7-9】
(1) 向盛有鸡蛋清溶液的试管中加入几滴醋酸铅溶液,观察现象。
二、蛋白质
2. 蛋白质性质
(2) 蛋白质的变性
变性:蛋白质在一些化学试剂或一些物理因素作用下,失去生理活性,溶解度下降而析出的过程。
变性条件:重金属的盐类、强酸、强碱、乙醇、加热、紫外线等。
【实验探究】
【实验7-9】
(2) 向盛有鸡蛋清溶液的试管中滴入几滴浓硝酸,加热,观察现象。
(3) 在酒精灯的火焰上分别灼烧一小段头发和丝织品,小心地闻气味。
二、蛋白质
2. 蛋白质性质
(3) 特征反应
浓硝酸,加热
灼烧
现象: ,又称显色反应
有 的气味
变黄
烧焦羽毛
二、蛋白质
3. 蛋白质在生产、生活中的作用
(1)蛋白质存在于一切细胞中,是人类必需的营养物质。
(2)毛和蚕丝的成分都为蛋白质,可以制作服装。
(3)从动物皮、骨中提取的明胶可作食品增稠剂,阿胶可作中药材等。
(4)绝大多数酶也是蛋白质,是重要的催化剂。
三、油脂
1.油脂的组成、分类及结构
(1) 组成元素: 。
(2) 分类:根据室温下油脂状态,油脂分为 和 。
碳、氢、氧
油 脂肪
常温下状态 代表物 代表物分子组成特点
油 _____ 植物油脂 较多不饱和高级脂肪酸甘油酯
脂肪 _____ 动物油脂 较多饱和高级脂肪酸甘油酯
液态
固态
三、油脂
1.油脂的组成、分类及结构
(3)结构
油酸:____________
亚油酸:____________
C17H33COOH
C17H31COOH
不饱和脂肪酸
硬脂酸:____________
软脂酸:____________
C17H35COOH
C15H31COOH
饱和脂肪酸
酯基
三、油脂
2.油脂的性质
(1) 物理性质:在室温下,植物油脂通常呈液态,动物油脂通常呈固态,密度比水小,黏度较大,触摸时有明显的滑腻感,难溶于水,易溶于有机溶剂。
三、油脂
2.油脂的性质
(2) 化学性质:
a.加成反应
b. 水解反应
不饱和高级脂肪酸甘油酯+ H2
饱和高级脂肪酸甘油酯
一定条件
(氢化反应)
油脂+ H2O
高级脂肪酸+甘油
酸或酶
油脂+ H2O
高级脂肪酸盐+甘油
碱性条件
(皂化反应)
三、油脂
3.油脂在生产、生活中的应用
油脂
是产生能量最高的营养物质
具有保持体温和保护内脏器官的作用
能增加食物的滋味,增进食欲,保证机体的正常生理功能
工业上生产高级脂肪酸和甘油,制肥皂等
作业布置
1.P89 研究与实践
2.P90 练习与应用
3.根据今天的学习内容,查阅资料,为
自己和家人制定一份“周健康食谱”
同学们再见
高一年级 化学
第七章 有机化合物 第四节 基本营养物质
思考:我们在生活中接触到的营养物质主要有哪一些?
糖类
蛋白质
油脂
食品中营养物质
维生素
无机盐
水
人体基本营养物质
学习目标
1.掌握葡萄糖、淀粉、蛋白质、油脂的主要性质与结构的关系。
2.掌握葡萄糖的性质实验。
3.掌握蛋白质的变性、显色反应实验。
4.了解糖类、油脂、蛋白质在人体内的转化。
5.体会有机合成在生产生活中的重要应用。
一、糖类
1.组成
糖类是由 、 、 三种元素组成
可用通式 表示,也称为 。
碳 氢 氧
Cn(H2O)m
碳水化合物
一、糖类
2.分类 依据:是否水解及水解产物的不同进行分类
一、糖类
2.分类 依据:是否水解及水解产物的不同进行分类
类别 单糖 二糖 多糖
特点 不能再水解成更简单的糖 一分子二糖能水解成 单糖 一分子多糖能水解成 单糖
代表物 、_____ 、 、乳糖 、_______
代表物分子式
两分子
多分子
葡萄糖
果糖
蔗糖 麦芽糖
淀粉 纤维素
C6H12O6
C12H22O11
(C6H10O5)n
是否为同分异构体
是
是
不是
一、糖类
3.葡萄糖
(1) 结构:分子式: ;
结构简式:
。或CH2OH(CHOH)4CHO。官能团为 。
(2)物理性质:葡萄糖是一种有 的 晶体, 溶于水。
C6H12O6
CH2OH—CHOH—CHOH—CHOH—CHOH—CHO
羟基、醛基
有甜味
无色
能
【实验7-7】
(1) 在试管中加入 2 mL 10% NaOH溶液,滴加 5 滴5% CuSO4溶液,得到新制的Cu(OH)2。再加入 2 mL 10%葡萄糖溶液,加热,观察现象。
(2) 在洁净的试管中加入 1 mL 2% AgNO3溶液,然后一边振荡试管,一边逐滴加入 2% 稀氨水,直到最初产生的沉淀恰好溶解为止,得到银氨溶液。再加入 1 mL 10% 葡萄糖溶液,振荡,然后放在水浴中加热,观察现象。
一、糖类
3.葡萄糖
(3)化学性质
葡萄糖
新制的Cu(OH)2,加热
砖红色沉淀( Cu2O )
银氨溶液,加热
光亮的银镜( Ag)
检验
葡萄糖
醛基
一、糖类
4.蔗糖
(1)组成
蔗糖分子式为 ,与麦芽糖、乳糖互为 。
C12H22O11
同分异构体
一、糖类
4.蔗糖
(2)化学性质
C12H22O11 + H2O
C6H12O6+C6H12O6
催化剂
蔗糖
葡萄糖
果糖
蔗糖水解:
一、糖类
5.淀粉
(1)组成
通式为 ,属于天然高分子化合物。
(C6H10O5)n
【实验7-8】
(1)回忆生物课中学习的检验淀粉的方法。将碘溶液滴到一片馒头或土豆上,观察现象。
一、糖类
5.淀粉
(2)化学性质
a.特征反应:淀粉遇单质碘变蓝。
【实验7-8】
(1)回忆生物课中学习的检验淀粉的方法。将碘溶液滴到一片馒头或土豆上,观察现象。
(2) 在试管中加入 0.5g 淀粉和4mL 2mol/L H2SO4溶液加热。待溶液冷却后向其中加入NaOH溶液,将溶液调至碱性,再加入少量新制的Cu(OH)2,加热。观察并解释实验现象。
【实验探究】
实验操作
实验现象 最终有 生成
实验结论 淀粉水解生成的 ,与新制的Cu(OH)2共热生成
淀粉水解的化学反应方程式
砖红色沉淀
葡萄糖
氧化亚铜
(C6H10O5)n+nH2O
nC6H12O6
催化剂
淀粉(或纤维素)
葡萄糖
一、糖类
5.淀粉
(2)化学性质
a.特征反应:淀粉遇单质碘变蓝。
b.淀粉水解反应:
(C6H10O5)n+nH2O
nC6H12O6
催化剂
淀粉(或纤维素)
葡萄糖
6.糖类的主要用途
(2)人体内,无纤维素酶,但纤维素能刺激肠道蠕动
促进 和 。
消化 排泄
淀粉
纤维素
一、糖类
(1) 淀粉为人体提供能量
(3)以富含 的农作物为原料酿酒,以富含
的植物秸秆为原料生产燃料乙醇。
C6H12O6
2C2H5OH+2CO2↑
酶
葡萄糖
二、蛋白质
1. 蛋白质的存在和组成
(1)存在:蛋白质是构成 的基本物质,存在于各类生物体内。
(2)组成:由 等元素组成,是一类非常复杂的 。
2. 蛋白质性质
(1) 蛋白质的水解反应
细胞
碳、氢、氧、氮、硫
天然有机高分子
蛋白质
酸、碱或酶等催化剂
水解反应
多肽
水解反应
氨基酸(最终产物)
【思考与讨论】
观察甘氨酸和苯丙氨酸的结构简式,辨认其中的官能团,并说明其结构的共同点。
氨基酸分子中都含有氨基(一NH2)和羧基。
我国科学家于1965年在世界上首次完成了具有生命活力的蛋白质——结晶牛胰岛素的合成,对蛋白质的研究做出了重要贡献。
【实验探究】
【实验7-9】
(1) 向盛有鸡蛋清溶液的试管中加入几滴醋酸铅溶液,观察现象。
二、蛋白质
2. 蛋白质性质
(2) 蛋白质的变性
变性:蛋白质在一些化学试剂或一些物理因素作用下,失去生理活性,溶解度下降而析出的过程。
变性条件:重金属的盐类、强酸、强碱、乙醇、加热、紫外线等。
【实验探究】
【实验7-9】
(2) 向盛有鸡蛋清溶液的试管中滴入几滴浓硝酸,加热,观察现象。
(3) 在酒精灯的火焰上分别灼烧一小段头发和丝织品,小心地闻气味。
二、蛋白质
2. 蛋白质性质
(3) 特征反应
浓硝酸,加热
灼烧
现象: ,又称显色反应
有 的气味
变黄
烧焦羽毛
二、蛋白质
3. 蛋白质在生产、生活中的作用
(1)蛋白质存在于一切细胞中,是人类必需的营养物质。
(2)毛和蚕丝的成分都为蛋白质,可以制作服装。
(3)从动物皮、骨中提取的明胶可作食品增稠剂,阿胶可作中药材等。
(4)绝大多数酶也是蛋白质,是重要的催化剂。
三、油脂
1.油脂的组成、分类及结构
(1) 组成元素: 。
(2) 分类:根据室温下油脂状态,油脂分为 和 。
碳、氢、氧
油 脂肪
常温下状态 代表物 代表物分子组成特点
油 _____ 植物油脂 较多不饱和高级脂肪酸甘油酯
脂肪 _____ 动物油脂 较多饱和高级脂肪酸甘油酯
液态
固态
三、油脂
1.油脂的组成、分类及结构
(3)结构
油酸:____________
亚油酸:____________
C17H33COOH
C17H31COOH
不饱和脂肪酸
硬脂酸:____________
软脂酸:____________
C17H35COOH
C15H31COOH
饱和脂肪酸
酯基
三、油脂
2.油脂的性质
(1) 物理性质:在室温下,植物油脂通常呈液态,动物油脂通常呈固态,密度比水小,黏度较大,触摸时有明显的滑腻感,难溶于水,易溶于有机溶剂。
三、油脂
2.油脂的性质
(2) 化学性质:
a.加成反应
b. 水解反应
不饱和高级脂肪酸甘油酯+ H2
饱和高级脂肪酸甘油酯
一定条件
(氢化反应)
油脂+ H2O
高级脂肪酸+甘油
酸或酶
油脂+ H2O
高级脂肪酸盐+甘油
碱性条件
(皂化反应)
三、油脂
3.油脂在生产、生活中的应用
油脂
是产生能量最高的营养物质
具有保持体温和保护内脏器官的作用
能增加食物的滋味,增进食欲,保证机体的正常生理功能
工业上生产高级脂肪酸和甘油,制肥皂等
作业布置
1.P89 研究与实践
2.P90 练习与应用
3.根据今天的学习内容,查阅资料,为
自己和家人制定一份“周健康食谱”
同学们再见
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
