6.1《化学反应与能量变化——化学反应与与热能》(第1课时)课件(共35张PPT)
文档属性
| 名称 | 6.1《化学反应与能量变化——化学反应与与热能》(第1课时)课件(共35张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 00:00:00 | ||
图片预览









文档简介
(共35张PPT)
第一课时 化学反应与与热能
第六章
化学反应与能量
第一节 化学反应与能量变化
选择性必修一
1st
【引入】
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到学科研究等)都离不开能量,而许多能量的利用与化学反应中能量变化密切相关。从煤、石油、天然气等提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的。
化石燃料燃烧会释放大量的热。除了燃烧,其他化学反应也伴随这放热或吸热现象。
化工生产中的重要非金属元素
核心素养
1、通过实验和已有知识、经验感受化学反应中的能量变化,知道常见的吸热反应和放热反应,树立物质变化中伴随能量变化的观念。
2、能从反应物与生成物所具有的能量、化学键的断裂与形成两个角度理解化学反应中能量变化的主要原因,提升证据推理能力。
3、通过多种渠道了解人类对化学反应中能量的利用情况,了解节能的意义和方法,感受化学学科的社会价值,培养科学态度与社会责任。
一、化学反应与热能
实验探究一:镁和稀盐酸的反应
实验现象:
有气泡产生,用温度计测量,水银柱上升。
离子方程式:
实验结论:
该反应放出热量
1、放热反应与吸热反应
一、化学反应与热能
实验现象:
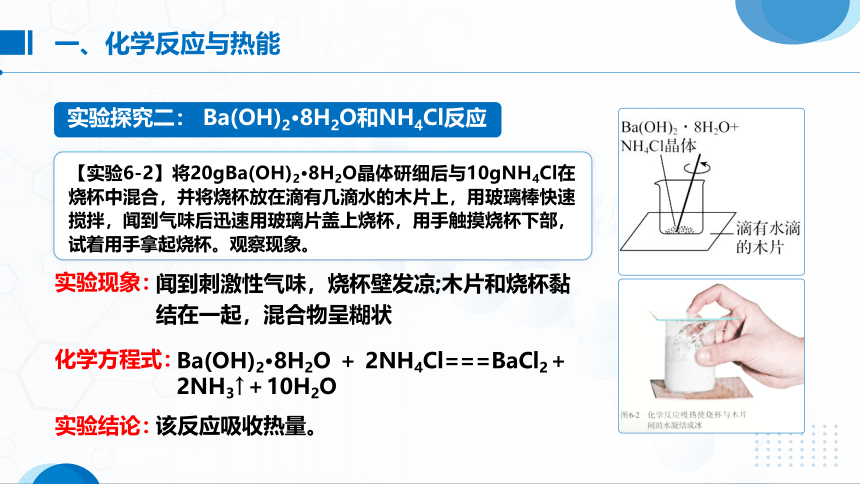
闻到刺激性气味,烧杯壁发凉;木片和烧杯黏结在一起,混合物呈糊状
化学方程式:
实验结论:
该反应吸收热量。
Ba(OH)2·8H2O + 2NH4Cl===BaCl2+2NH3↑+10H2O
【实验6-2】将20gBa(OH)2 8H2O晶体研细后与10gNH4Cl在烧杯中混合,并将烧杯放在滴有几滴水的木片上,用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸烧杯下部,试着用手拿起烧杯。观察现象。
实验探究二: Ba(OH)2·8H2O和NH4Cl反应
一、化学反应与热能
吸热反应: 热量的化学反应;
放热反应: 热量的化学反应。
吸收
释放
★ 两个基本自然规律——“质量守恒”和“能量守恒”
(1)质量守恒定律:自然界中的物质发生转化时总质量保持不变。
(2)能量守恒定律:不同形式的能量发生转换时总能量保持不变。
(1) 定义
一、化学反应与热能
(2)几种典型的放热和吸热反应
①放热反应:
燃烧反应、金属和水或酸的反应、酸碱中和反应、
部分化合反应(如生石灰和水反应)、物质的缓慢氧化等。
放热过程:浓硫酸稀释、氢氧化钠固体溶解等。
②吸热反应:
部分化合反应(如:C和CO2反应)、C和H2以及CO为还原剂的反应、
Ba(OH)2·8H2O和NH4Cl反应、大部分分解反应如煅烧石灰石。
吸热过程:大多数铵盐溶于水。
一、化学反应与热能
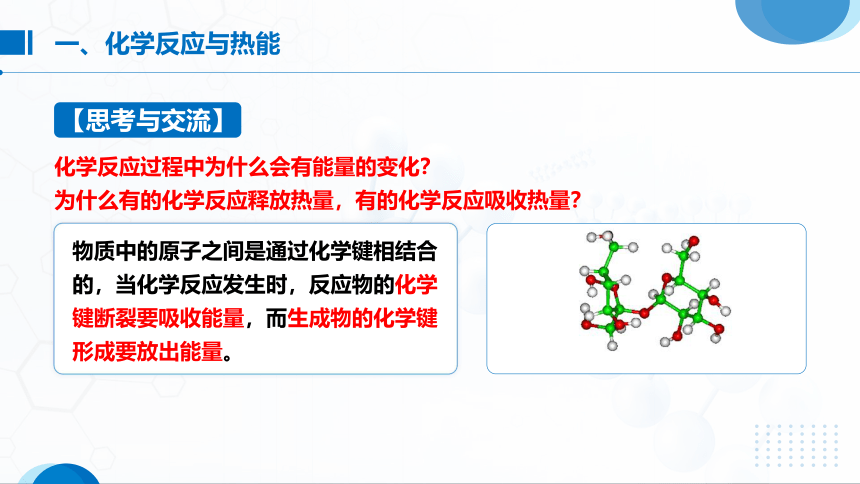
【思考与交流】
化学反应过程中为什么会有能量的变化?
为什么有的化学反应释放热量,有的化学反应吸收热量?
物质中的原子之间是通过化学键相结合的,当化学反应发生时,反应物的化学键断裂要吸收能量,而生成物的化学键形成要放出能量。
一、化学反应的速率
2、化学反应中能量变化的原因
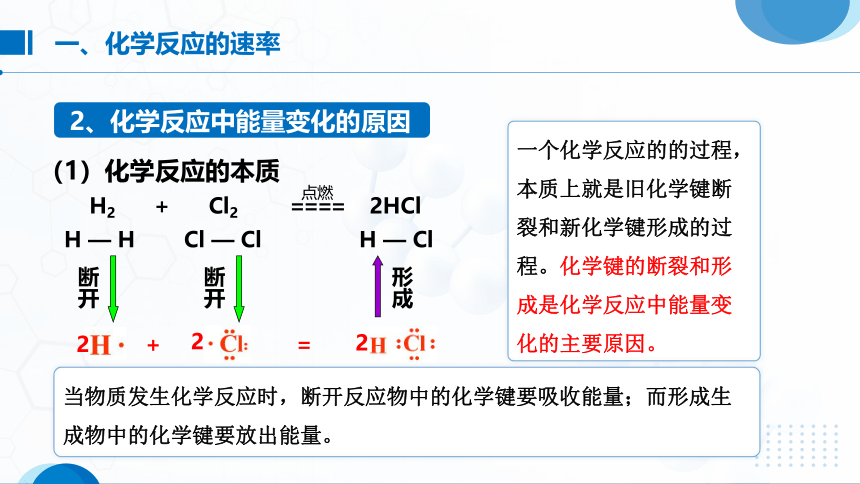
(1)化学反应的本质
H2 + Cl2 ==== 2HCl
点燃
H — H
Cl — Cl
H — Cl
断开
断开
形成
2
2
2
+ =
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。化学键的断裂和形成是化学反应中能量变化的主要原因。
当物质发生化学反应时,断开反应物中的化学键要吸收能量;而形成生成物中的化学键要放出能量。
一、化学反应的速率
①断键:断开1 mol H2中的H—H键要______436 kJ能量,断开1 mol Cl2中的Cl—Cl键要_______243 kJ的能量。则断键共需吸收______ kJ的能量。
②成键:形成2 mol HCl中的H—Cl键要______862 kJ的能量。
③结论:断键吸收的总能量______成键释放的能量,所以发生了______反应。
因此:化学键的__________________是物质在化学反应中发生能量变化的主要原因。
吸收
吸收
679
释放
小于
放热
断裂和形成
实例:H2(g) + Cl2(g) = 2HCl(g)。(25℃,101kPa)
一、化学反应的速率
化学反应的实质
旧键断裂
新键形成
吸热
放热
化学键的断裂和形成是化学反应中能量变化的主要原因。
吸收能量E1>释放能量E2 该反应为吸热反应
吸收能量E1<释放能量E2 该反应为放热反应
2、化学反应中能量变化的原因
(1)化学反应的本质
一、化学反应的速率
各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。放热反应可以看成是反应物所具有的化学能转化为热能释放出来,吸热反应可以看成是热能转化为化学能被生成物所“储存”。
2、化学反应中能量变化的原因
(2)能量变化的决定因素
一、化学反应的速率
反应物的总能量>生成物的总能量
化学反应放出能量
2、化学反应中能量变化的原因
(2)能量变化的决定因素
反应物的总能量高
生成物的总能量低
化学反应
释放能量
反应物的总能量
生成物的总能量
能量的释放
一、化学反应的速率
反应物的总能量<生成物的总能量
化学反应吸收能量
2、化学反应中能量变化的原因
(2)能量变化的决定因素
反应物的总能量高
生成物的总能量低
化学反应
吸收能量
反应物的总能量
生成物的总能量
能量的吸收
反应物的总能量<生成物的总能量
化学反应吸收能量
反应物的总能量
生成物的总能量
能量的吸收
一、化学反应的速率
2、化学反应中能量变化的原因
(2)能量变化的决定因素
反应物的总能量高
生成物的总能量低
化学反应
放出能量
反应物的能量之和
E反
生成物的能量之和
E生
若E反> E生,放出能量。发生放热反应
若E反< E生,吸收能量。发生吸热反应
放热反应
吸热反应
结论:化学反应中的能量变化决定于反应物的总能量与生成物的总能量的相对大小。
反应物的总能量高
生成物的总能量低
化学反应
吸收能量
一、化学反应的速率
放热反应
吸热反应
一、化学反应的速率
思考:有化学键断裂或形成的变化是否一定是化学变化?
不一定。如HCl溶于水发生电离断键,或从浓盐酸中挥发出氯化氢气体有化学键形成,但这些变化都是物理变化。
一、化学反应的速率
(1)“三个不一定”
①需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;
②放热反应常温下不一定容易发生,如铝热反应;
③吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
2.关于吸热反应和放热反应的易错点
(2)吸热反应和放热反应都是化学变化
NaOH固体溶于水是放热过程,但不是放热反应;
升华、蒸发等过程是吸热过程,但不是吸热反应。
一、化学反应的速率
3、人类利用能源的历史
(1)人类利用能源的三个阶段 :
柴草时期
化石能源时期
柴草时期
杂草
煤、石油、_______
_____能、风能、 _____能、海洋能和_____能等
天然气
太阳
地热
氢
一、化学反应的速率
3、人类利用能源的历史
(1)人类利用能源的三个阶段 :
时期、 时期和 时期。
柴草
化石能源
新能源
利用过程中面临两个问题
一是其短期内不可再生,储量有限,随着能源消费需求的不断增加,能源消费量与储量之间的矛盾日益突显;
二是煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
一、化学反应的速率
3、人类利用能源的历史
(2) 为了改善人类的生存环境,促进社会可持续发展,节能和寻找清洁能源成为人类的必然选择。节能不是简单地减少能源的使用,更重要是充分有效地利用能源,提高能源利用率。
一、化学反应的速率
解决办法
节能
寻找新能源
一个是燃料燃烧阶段,可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率;
另一个环节是能量利用阶段,可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率。
太阳能、风能、地热能、海洋能和氢能等。
【思考与讨论】
煤、汽油和柴油等作为燃料大量使用会造成空气污染,但不使用它们又会严重影响现代社会的生产和生活。对此,请从社会不同人群的角度,提出你的想法或建议,并与同学讨论。
【课堂小结】
能量变化
化学能转化为热能
放热 反应
吸热 反应
类型
反应物的总能量大于生成物的总能量
反应物的总能量小于生成物的总能量
遵循能量守恒原 理
能量 利用
燃料充分燃烧
新能源的开发
减少污染
能量变化
遵循能量守恒原理
类型
能量利用
放热反应
吸热反应
燃料充分燃烧
新能源的开发
减少污染
反应物的总能量大于生成物的总能量
反应物的总能量小于生成物的总能量
化学能转化为热能
课堂练习
1、有专家指出,如果对燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。如图所示:
在此构想的物质循环中太阳能最终转化为( )
A.化学能 B.热能
C.生物质能 D.电能
B
课堂练习
C
2. 下列反应既属于氧化还原反应,又属于吸热反应的是( )
A. 铝片与稀盐酸的反应
B. Ba(OH)2·8H2O和NH4Cl的反应
C. 灼热的炭与CO2的反应
D. 甲烷在氧气中的燃烧反应
课堂练习
3、下列说法中正确的是( )
①需要加热方能发生的反应一定是吸热反应
②放热反应在常温下一定很容易发生
③反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 ④放热反应加热到一定温度引发后,停止加热反应也能继续进行
A.只有③④ B.只有①②
C.①②③④ D.只有②③④
A
课堂练习
4.断开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要吸收的能量为436 kJ、391 kJ、946 kJ。求:
(1)1 mol N2完全反应生成NH3需 (填“吸收”或“放出”)能量 kJ。
放出
92
(2)1 mol H2完全反应生成NH3需 (填“吸收”或“放出”)能量 kJ(不考虑可逆反应)。
放出
30.67
课堂练习
CD
2. 下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了反应结果是放热还是吸热
D.吸热反应在一定条件下也能发生反应
课堂练习
5、将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。
然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可知( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.NH4HCO3的能量一定低于NH4Cl的能量
B
课堂练习
D
6、 下列说法正确的是 ( )
A.干冰升华需吸收大量的热,这个变化是吸热反应
B.已知反应:X+Y===M+N为放热反应,则X的能量一定高于
M的能量
C.分解反应一定是吸热反应
D.用氢氧焰可以加热软化玻璃,生产各种玻璃器皿,主要是利用
了氢气和氧气化合时放出的热量
课堂练习
7、 如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是___________________
(2)产生上述现象的原因是___________________
(3)写出有关反应的离子方程式___________________
(4)由实验推知,MgCl2溶液和H2的总能量________
(填“大于”、“小于”、“等于”)镁片和盐酸的总能量.
课堂练习
【答案】
(1)镁片上有大量气泡产生;镁片逐渐溶解;烧杯中析出晶体,溶液变浑浊
(2)镁与盐酸反应产生氢气,该反应为放热反应;Ca(OH)2在水中的溶解度随温度的升高而减小,故析出Ca(OH)2晶体
(3) 小于
向奋斗在一线的老师致敬
课堂小结
感谢您的观看
选择性必修一
THS
第一课时 化学反应与与热能
第六章
化学反应与能量
第一节 化学反应与能量变化
选择性必修一
1st
【引入】
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到学科研究等)都离不开能量,而许多能量的利用与化学反应中能量变化密切相关。从煤、石油、天然气等提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的。
化石燃料燃烧会释放大量的热。除了燃烧,其他化学反应也伴随这放热或吸热现象。
化工生产中的重要非金属元素
核心素养
1、通过实验和已有知识、经验感受化学反应中的能量变化,知道常见的吸热反应和放热反应,树立物质变化中伴随能量变化的观念。
2、能从反应物与生成物所具有的能量、化学键的断裂与形成两个角度理解化学反应中能量变化的主要原因,提升证据推理能力。
3、通过多种渠道了解人类对化学反应中能量的利用情况,了解节能的意义和方法,感受化学学科的社会价值,培养科学态度与社会责任。
一、化学反应与热能
实验探究一:镁和稀盐酸的反应
实验现象:
有气泡产生,用温度计测量,水银柱上升。
离子方程式:
实验结论:
该反应放出热量
1、放热反应与吸热反应
一、化学反应与热能
实验现象:
闻到刺激性气味,烧杯壁发凉;木片和烧杯黏结在一起,混合物呈糊状
化学方程式:
实验结论:
该反应吸收热量。
Ba(OH)2·8H2O + 2NH4Cl===BaCl2+2NH3↑+10H2O
【实验6-2】将20gBa(OH)2 8H2O晶体研细后与10gNH4Cl在烧杯中混合,并将烧杯放在滴有几滴水的木片上,用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸烧杯下部,试着用手拿起烧杯。观察现象。
实验探究二: Ba(OH)2·8H2O和NH4Cl反应
一、化学反应与热能
吸热反应: 热量的化学反应;
放热反应: 热量的化学反应。
吸收
释放
★ 两个基本自然规律——“质量守恒”和“能量守恒”
(1)质量守恒定律:自然界中的物质发生转化时总质量保持不变。
(2)能量守恒定律:不同形式的能量发生转换时总能量保持不变。
(1) 定义
一、化学反应与热能
(2)几种典型的放热和吸热反应
①放热反应:
燃烧反应、金属和水或酸的反应、酸碱中和反应、
部分化合反应(如生石灰和水反应)、物质的缓慢氧化等。
放热过程:浓硫酸稀释、氢氧化钠固体溶解等。
②吸热反应:
部分化合反应(如:C和CO2反应)、C和H2以及CO为还原剂的反应、
Ba(OH)2·8H2O和NH4Cl反应、大部分分解反应如煅烧石灰石。
吸热过程:大多数铵盐溶于水。
一、化学反应与热能
【思考与交流】
化学反应过程中为什么会有能量的变化?
为什么有的化学反应释放热量,有的化学反应吸收热量?
物质中的原子之间是通过化学键相结合的,当化学反应发生时,反应物的化学键断裂要吸收能量,而生成物的化学键形成要放出能量。
一、化学反应的速率
2、化学反应中能量变化的原因
(1)化学反应的本质
H2 + Cl2 ==== 2HCl
点燃
H — H
Cl — Cl
H — Cl
断开
断开
形成
2
2
2
+ =
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。化学键的断裂和形成是化学反应中能量变化的主要原因。
当物质发生化学反应时,断开反应物中的化学键要吸收能量;而形成生成物中的化学键要放出能量。
一、化学反应的速率
①断键:断开1 mol H2中的H—H键要______436 kJ能量,断开1 mol Cl2中的Cl—Cl键要_______243 kJ的能量。则断键共需吸收______ kJ的能量。
②成键:形成2 mol HCl中的H—Cl键要______862 kJ的能量。
③结论:断键吸收的总能量______成键释放的能量,所以发生了______反应。
因此:化学键的__________________是物质在化学反应中发生能量变化的主要原因。
吸收
吸收
679
释放
小于
放热
断裂和形成
实例:H2(g) + Cl2(g) = 2HCl(g)。(25℃,101kPa)
一、化学反应的速率
化学反应的实质
旧键断裂
新键形成
吸热
放热
化学键的断裂和形成是化学反应中能量变化的主要原因。
吸收能量E1>释放能量E2 该反应为吸热反应
吸收能量E1<释放能量E2 该反应为放热反应
2、化学反应中能量变化的原因
(1)化学反应的本质
一、化学反应的速率
各种物质都具有能量,物质的组成、结构与状态不同,所具有的能量也不同。放热反应可以看成是反应物所具有的化学能转化为热能释放出来,吸热反应可以看成是热能转化为化学能被生成物所“储存”。
2、化学反应中能量变化的原因
(2)能量变化的决定因素
一、化学反应的速率
反应物的总能量>生成物的总能量
化学反应放出能量
2、化学反应中能量变化的原因
(2)能量变化的决定因素
反应物的总能量高
生成物的总能量低
化学反应
释放能量
反应物的总能量
生成物的总能量
能量的释放
一、化学反应的速率
反应物的总能量<生成物的总能量
化学反应吸收能量
2、化学反应中能量变化的原因
(2)能量变化的决定因素
反应物的总能量高
生成物的总能量低
化学反应
吸收能量
反应物的总能量
生成物的总能量
能量的吸收
反应物的总能量<生成物的总能量
化学反应吸收能量
反应物的总能量
生成物的总能量
能量的吸收
一、化学反应的速率
2、化学反应中能量变化的原因
(2)能量变化的决定因素
反应物的总能量高
生成物的总能量低
化学反应
放出能量
反应物的能量之和
E反
生成物的能量之和
E生
若E反> E生,放出能量。发生放热反应
若E反< E生,吸收能量。发生吸热反应
放热反应
吸热反应
结论:化学反应中的能量变化决定于反应物的总能量与生成物的总能量的相对大小。
反应物的总能量高
生成物的总能量低
化学反应
吸收能量
一、化学反应的速率
放热反应
吸热反应
一、化学反应的速率
思考:有化学键断裂或形成的变化是否一定是化学变化?
不一定。如HCl溶于水发生电离断键,或从浓盐酸中挥发出氯化氢气体有化学键形成,但这些变化都是物理变化。
一、化学反应的速率
(1)“三个不一定”
①需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;
②放热反应常温下不一定容易发生,如铝热反应;
③吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
2.关于吸热反应和放热反应的易错点
(2)吸热反应和放热反应都是化学变化
NaOH固体溶于水是放热过程,但不是放热反应;
升华、蒸发等过程是吸热过程,但不是吸热反应。
一、化学反应的速率
3、人类利用能源的历史
(1)人类利用能源的三个阶段 :
柴草时期
化石能源时期
柴草时期
杂草
煤、石油、_______
_____能、风能、 _____能、海洋能和_____能等
天然气
太阳
地热
氢
一、化学反应的速率
3、人类利用能源的历史
(1)人类利用能源的三个阶段 :
时期、 时期和 时期。
柴草
化石能源
新能源
利用过程中面临两个问题
一是其短期内不可再生,储量有限,随着能源消费需求的不断增加,能源消费量与储量之间的矛盾日益突显;
二是煤和石油产品燃烧排放的粉尘、SO2、NOx、CO等是大气污染物的主要来源。
一、化学反应的速率
3、人类利用能源的历史
(2) 为了改善人类的生存环境,促进社会可持续发展,节能和寻找清洁能源成为人类的必然选择。节能不是简单地减少能源的使用,更重要是充分有效地利用能源,提高能源利用率。
一、化学反应的速率
解决办法
节能
寻找新能源
一个是燃料燃烧阶段,可通过改进锅炉的炉型和燃料空气比、清理积灰等方法提高燃料的燃烧效率;
另一个环节是能量利用阶段,可通过使用节能灯,改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率。
太阳能、风能、地热能、海洋能和氢能等。
【思考与讨论】
煤、汽油和柴油等作为燃料大量使用会造成空气污染,但不使用它们又会严重影响现代社会的生产和生活。对此,请从社会不同人群的角度,提出你的想法或建议,并与同学讨论。
【课堂小结】
能量变化
化学能转化为热能
放热 反应
吸热 反应
类型
反应物的总能量大于生成物的总能量
反应物的总能量小于生成物的总能量
遵循能量守恒原 理
能量 利用
燃料充分燃烧
新能源的开发
减少污染
能量变化
遵循能量守恒原理
类型
能量利用
放热反应
吸热反应
燃料充分燃烧
新能源的开发
减少污染
反应物的总能量大于生成物的总能量
反应物的总能量小于生成物的总能量
化学能转化为热能
课堂练习
1、有专家指出,如果对燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。如图所示:
在此构想的物质循环中太阳能最终转化为( )
A.化学能 B.热能
C.生物质能 D.电能
B
课堂练习
C
2. 下列反应既属于氧化还原反应,又属于吸热反应的是( )
A. 铝片与稀盐酸的反应
B. Ba(OH)2·8H2O和NH4Cl的反应
C. 灼热的炭与CO2的反应
D. 甲烷在氧气中的燃烧反应
课堂练习
3、下列说法中正确的是( )
①需要加热方能发生的反应一定是吸热反应
②放热反应在常温下一定很容易发生
③反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 ④放热反应加热到一定温度引发后,停止加热反应也能继续进行
A.只有③④ B.只有①②
C.①②③④ D.只有②③④
A
课堂练习
4.断开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要吸收的能量为436 kJ、391 kJ、946 kJ。求:
(1)1 mol N2完全反应生成NH3需 (填“吸收”或“放出”)能量 kJ。
放出
92
(2)1 mol H2完全反应生成NH3需 (填“吸收”或“放出”)能量 kJ(不考虑可逆反应)。
放出
30.67
课堂练习
CD
2. 下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了反应结果是放热还是吸热
D.吸热反应在一定条件下也能发生反应
课堂练习
5、将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。
然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可知( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.NH4HCO3的能量一定低于NH4Cl的能量
B
课堂练习
D
6、 下列说法正确的是 ( )
A.干冰升华需吸收大量的热,这个变化是吸热反应
B.已知反应:X+Y===M+N为放热反应,则X的能量一定高于
M的能量
C.分解反应一定是吸热反应
D.用氢氧焰可以加热软化玻璃,生产各种玻璃器皿,主要是利用
了氢气和氧气化合时放出的热量
课堂练习
7、 如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是___________________
(2)产生上述现象的原因是___________________
(3)写出有关反应的离子方程式___________________
(4)由实验推知,MgCl2溶液和H2的总能量________
(填“大于”、“小于”、“等于”)镁片和盐酸的总能量.
课堂练习
【答案】
(1)镁片上有大量气泡产生;镁片逐渐溶解;烧杯中析出晶体,溶液变浑浊
(2)镁与盐酸反应产生氢气,该反应为放热反应;Ca(OH)2在水中的溶解度随温度的升高而减小,故析出Ca(OH)2晶体
(3) 小于
向奋斗在一线的老师致敬
课堂小结
感谢您的观看
选择性必修一
THS
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
