第六章《化学反应与能量》(第1课时)复习课件(共54张PPT)
文档属性
| 名称 | 第六章《化学反应与能量》(第1课时)复习课件(共54张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 17:40:58 | ||
图片预览








文档简介
(共54张PPT)
第1课时 化学反应与能量变化
第六章
化学反应与能量
Click here to enter your text, change the color or size of the text. You can also format the appropriate text and adjust the line spacing of the text.
专题复习
选择性必修一
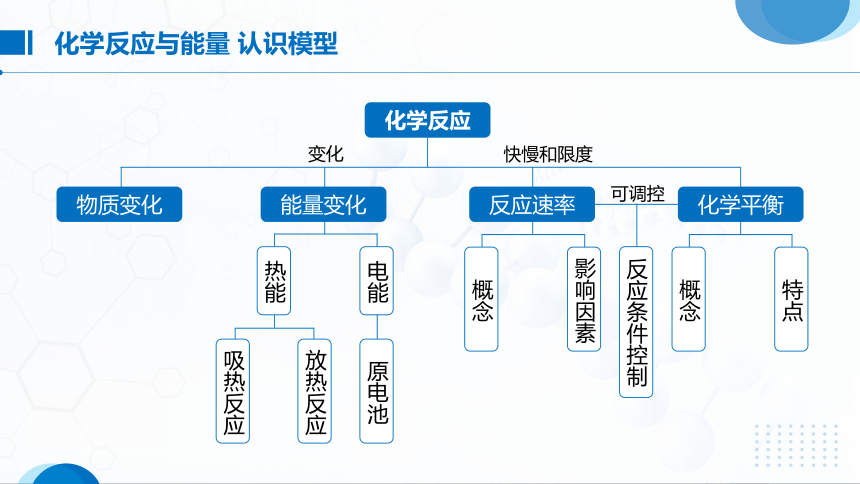
化学反应与能量 认识模型
化学反应
变化
快慢和限度
化学平衡
反应速率
能量变化
物质变化
可调控
概念
特点
反应条件控制
热能
电能
吸热反应
放热反应
原电池
概念
影响因素
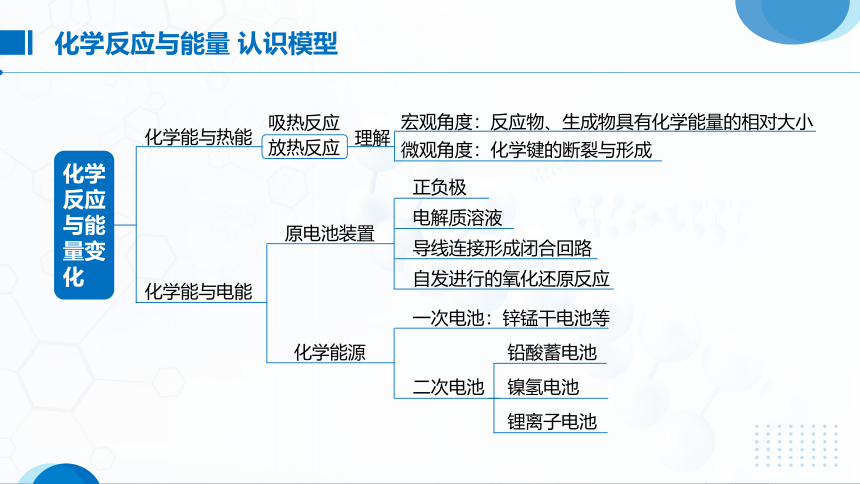
化学反应与能量 认识模型
宏观角度:反应物、生成物具有化学能量的相对大小
微观角度:化学键的断裂与形成
正负极
电解质溶液
导线连接形成闭合回路
自发进行的氧化还原反应
一次电池:锌锰干电池等
铅酸蓄电池
镍氢电池
锂离子电池
二次电池
化学能源
原电池装置
化学能与电能
化学能与热能
放热反应
吸热反应
理解
化学反应与能量变化
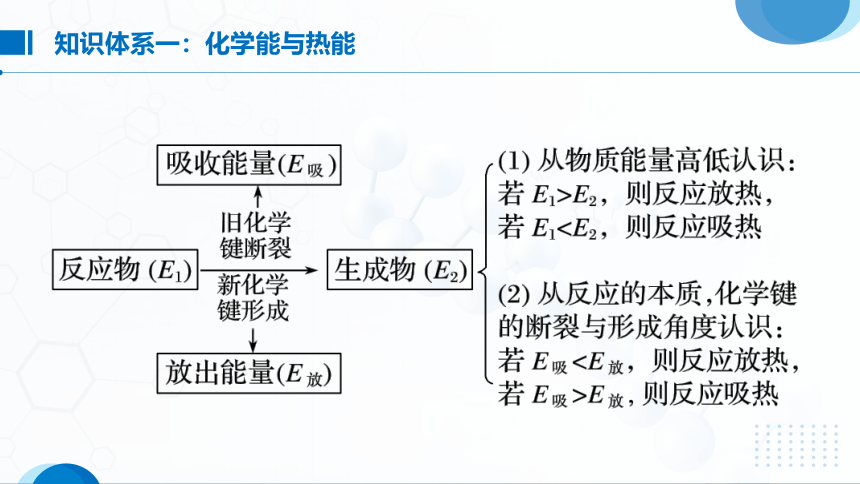
知识体系一:化学能与热能
归纳整理1:吸热反应与放热反应的判断
根据反应物和生成物的总能量大小判断:
反应物的总能量大于生成物的总能量的反应为放热反应,反之为吸热反应。
根据化学键断裂和形成时能量变化大小的关系推断:
破坏反应物中化学键吸收的能量大于形成生成物中化学键放出的能量的反应为吸热反应,反之为放热反应。
根据生成物和反应物的相对稳定性判断:
由稳定的物质生成不稳定的物质的反应为吸热反应,反之为放热反应。
归纳整理1:吸热反应与放热反应的判断
根据经验规律判断
用常见吸热和放热的反应类型来判断。
反应类型 放热反应 吸热反应
常见实例 ①金属与水或酸的反应; ②金属氧化物与水或酸的反应; ③可燃物的燃烧反应及缓慢氧化; ④酸与碱的中和反应; ⑤大部分化合反应。 ①大部分分解反应;
②Ba(OH)2·8H2O和NH4Cl反应;
③高温下焦炭与水的反应。
对点训练1
已知:①1 mol H2分子中化学键断裂时需吸收436 kJ 的能量;②1 mol Cl2分子中化学键断裂时需吸收243 kJ的能量;③由氢原子和氯原子形成1 mol HCl分子时释放 431 kJ 的能量。则1 mol H2和1 mol Cl2反应生成氯化氢气体时的能量变化为( )
A.放出能量183 kJ B.吸收能量183 kJ
C.吸收能量248 kJ D.吸收能量862 kJ
A
对点训练2
下列反应属于氧化还原反应,且能量变化如图所示的是( )
A.锌粒和稀硫酸反应
B.灼热的木炭与CO2反应
C.甲烷在空气中燃烧的反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
B
解析 由图像可知,反应物总能量低于生成物总能量,所以该反应是吸热反应。
A、C项反应为放热反应,不符合题意;
D项反应为吸热反应,但不是氧化还原反应,不符合题意;
B项反应既是氧化还原反应又是吸热反应,符合题意。
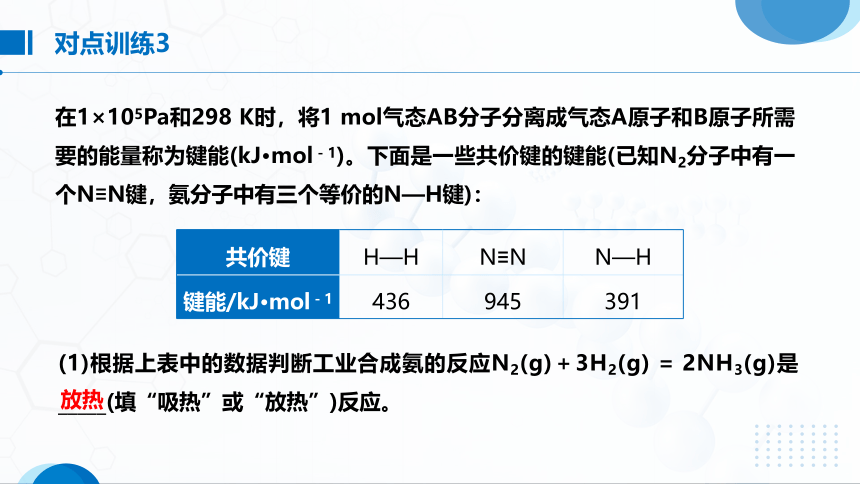
对点训练3
在1×105Pa和298 K时,将1 mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能(已知N2分子中有一个N≡N键,氨分子中有三个等价的N—H键):
共价键 H—H N≡N N—H
键能/kJ·mol-1 436 945 391
(1)根据上表中的数据判断工业合成氨的反应N2(g)+3H2(g) = 2NH3(g)是_____(填“吸热”或“放热”)反应。
放热
对点训练3
解析 化学反应的实质就是反应物中化学键断裂、生成物中化学键形成的过程,断裂化学键
吸收能量,形成化学键放出能量。N2(g)+3H2(g) = 2NH3(g)的反应中断裂化学键
共吸收的能量为945 kJ+3×436 kJ=2253 kJ,形成化学键共放出的能量为
2×3×391 kJ=2346 kJ,所以该反应为放热反应。
(2)在298 K时,取1 mol氮气和3 mol氢气放入一密闭容器中,在催化剂存在下进行反应。理论上(假设完全反应生成2 mol NH3)放出或吸收的热量为Q1,则Q1的数值为_____ kJ。
93
解析 理论上放出的热量为2346 kJ-2253 kJ=93 kJ。
归纳整理2:吸热反应和放热反应的计算
对点训练1
解析
对放热反应:A+B===C+D,以下说法一定正确的是(EA、EB、EC、ED分别表示物质A、B、C、D所具有的能量) ( )
A.EA+EB>EC+ED B.EA>EB+EC
C.EA>EB D.EA+EB<EC+ED
反应A+B===C+D是放热反应,则反应物A、B的总能量大于生成物C、D的总能量,即EA+EB>EC+ED。
A
对点训练2
已知某化学反应A2(g)+2B2(g)===2AB2(g)(A2、B2、AB2的结构式分别为A==A、B—B、B—A—B),反应过程中的能量变化如图所示,下列有关叙述正确的是 ( )
A.该反应的进行一定需要加热或点燃
B.该反应若生成2 mol AB2(g),则放出的热量为
(E1-E2)kJ
C.该反应断开化学键消耗的总能量大于形成化学键
释放的总能量
D.生成2 mol B—A键放出E2 kJ能量
A
对点训练2
解析
根据图示可知,该反应断开化学键消耗的总能量大于形成化学键释放的总能量,为吸热反应;若生成2 mol AB2(g),则吸收热量为(E1-E2)kJ,C项正确,B项错误;
该反应的进行不一定需要加热或点燃,A项错误;
生成4 mol B—A键放出E2 kJ能量,D项错误。
对点训练3
已知拆开1 mol H—H、1 mol O=O、H—O分别需要吸收的能量为436 kJ/mol、496 kJ/mol、463 kJ/mol。则2 mol H2和
1 mol O2反应生成2 mol H2O时会________(填“吸收”或“释放”)热量________kJ,化学反应中,是将________转化为________。
热能
释放
484
化学能
对点训练4
H2与O2、F2均能发生反应,如图为H2与F2发生反应生成HF过程中的能量变化示意图。请回答下列问题:
(1)完成转化Ⅰ、Ⅱ_____(填“吸收”或“放出”,下同)能量,完成转化Ⅲ_____能量。
吸收
放出
对点训练4
解析
A
(2)H2和F2反应的能量变化图可用_____(填“A”或“B”)表示。
由图可知,H2和F2生成HF的反应能量变化为154 kJ·mol-1+436 kJ·mol-1-2×565 kJ·mol-1=-540 kJ·mol-1,是放热反应,则反应物的总能量大于生成物的总能量,A正确。
对点训练4
解析
(3)H2在O2中燃烧的过程主要是_______能转化为_____能的过程。
化学
氢气在氧气中燃烧是放热反应,主要是化学能转化为热能的过程。
热
知识体系二:化学能与电能
归纳整理3:原电池的工作原理和应用
原电池是由两个活动性不同的电极、电解质溶液构成的闭合回路,也就是说原电池的构造是:①两个活动性不同的电极;②电解质溶液;③闭合回路,④存在自发的氧化还原反应。如下图。
u
1.原电池的构成
归纳整理3:原电池的工作原理和应用
u
2.原电池的本质
锌为负极,发生氧化反应:Zn-2e-===Zn2+,
铜为正极,发生还原反应:2H++2e-===H2↑
原电池实质上是将氧化反应和还原反应分到了两个电极上进行,使其分别成为一个“半反应”,因此,根据氧化还原反应方程式可以很容易地设计原电池装置。
归纳整理3:原电池的工作原理和应用
3. 原电池的工作原理
归纳整理3:原电池的工作原理和应用
3. 原电池的工作原理
负极 正极
电极材料 活泼性较强的金属 活泼性较弱的金属或能
导电的非金属
电子流向 电子流出极 电子流入极
离子移动方向 阴离子移向的极 阳离子移向的极
反应类型 氧化反应 还原反应
反应现象 溶解的极 增重或有气泡放出的极
电极反应式 还原剂-ne-===氧化产物 氧化剂+ne-===还原产物
对点训练1
如图所示,电流表的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
C
A. B极为原电池的正极
B. A、B、C分别可以为Zn、Cu和稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
对点训练1
解析
原电池中,负极金属失去电子,发生氧化反应而溶解,质量减小,故A极为负极,B极为正极,A、D项正确;
A、B、C分别为Zn、Cu和稀盐酸时,可以构成原电池,且现象符合题意,B项正确;
电解质溶液中阳离子移向正极,C项错误。
对点训练2
汽车的启动电源常用铅蓄电池。放电时的电池反应为PbO2+Pb+2H2SO4===2PbSO4+2H2O,根据此反应判断下列说法正确的是( )
A
A.负极反应式:Pb-2e-+ ===PbSO4
B.电池放电时,溶液的酸性增强
C.PbO2得电子,被氧化
D.PbO2是电池的负极
对点训练2
解析
Pb失电子作负极,反应式为Pb+ -2e-===PbSO4,故A正确;
放电时,硫酸参加反应,导致溶液中氢离子浓度减小,则溶液的酸性减弱,故B错误;
PbO2得电子,被还原,故C错误;
根据电池反应式知,PbO2在反应中得电子,化合价由+4价变为+2价,所以二氧化铅作正极,故D错误。
对点训练3
为将反应2Al+6H+===2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去了氧化膜) ( )
C
对点训练3
解析
A、B、C三项中的装置均能将化学能转化为电能,A项,反应为2Al+2OH-+2H2O=== +3H2↑,错误;
B项,Al与H2SO4反应产生铝盐和H2,正确;
C项,反应为Al和稀硝酸反应生成NO,错误;
D项,两电极全是Al,因而不能构成原电池,即不能将化学能转化为电能,错误。
对点训练4
有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置
部分实验现象
由此可判断这四种金属的活动顺序是
A. a>b>c>d B. b>c>d>a C. d>a>b>c D. a>b>d>c
a极质量减小;
b极质量增加
b极有气体产生;
c极无变化
d极溶解;
c极有气体产生
电流从a极
流向d极
对点训练4
解析
把四个实验从左到右分别编号为①、②、③、④,则由实验①可知,a作原电池负极,b作原电池正极,金属活动性:a>b;由实验②可知,b极有气体产生,c极无变化,则活动性:b>c;由实验③可知,d极溶解,则d作原电池负极,c作正极,活动性:d>c;由实验④可知,电流从a极流向d极,则d极为原电池负极,a极为原电池正极,活动性:d>a。综上所述可知活动性:d>a>b>c。
实验装置
部分实验现象
a极质量减小;
b极质量增加
b极有气体产生;
c极无变化
d极溶解;
c极有气体产生
电流从a极
流向d极
归纳整理4:原电池正负极的判断
1. 根据电极材料判断
一般是活泼性较强的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
2. 根据电流方向或电子流动方向判断
电流由正极流向负极;电子由负极流向正极。
3. 根据原电池里电解质溶液中离子的移动方向
在原电池的电解质溶液中,阳离子移向的极为正极,阴离子移向的极为负极。
归纳整理4:原电池正负极的判断
4. 根据原电池两极发生的变化判断
原电池的负极发生失电子的氧化反应,正极发生得电子的还原反应。
5. 根据现象判断
溶解的一极为负极,增重或有气泡放出的一极为正极。
特别提示 在判断原电池正、负极时,不要只根据金属活动性的相对强弱,有时还与电解质溶液有关,因此要根据具体情况来判断正、负极。
归纳整理4:原电池正负极的判断
对点训练1
人造地球卫星上使用的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-==ZnO+H2O,Ag2O+H2O+2e-==2Ag+2OH-。据此判断Ag2O是( )
A.负极,被氧化 B.正极,被还原
C.负极,被还原 D.正极,被氧化
B
对点训练2
将用导线连接的电极X、Y插入装有硫酸铜溶液的烧杯中(外电路中电子流向如图所示)。据此判断下列说法正确的是( )
A.外电路中电流方向为X→Y
B.若电极材料分别为锌片和铜片,则Y为锌片
C.X极上发生还原反应
D.若电极材料都是金属,则金属活动性:X>Y
D
解析 A项,原电池中电子由负极经外电路流向正极,外电路中电流方向与电子流向相反,故电流方向为Y→外电路→X,错误;
B项,若电极材料分别为锌片和铜片,则锌为负极,即X为锌片,错误;
C项,X极是负极,发生氧化反应,错误;
D项,若电极材料都是金属,则负极金属活动性大于正极,金属活动性:X>Y,正确。
对点训练3
锌-空气电池具有蓄电量大、循环次数多等优点。下列说法正确的是( )
A
A.电池放电时Zn电极逐渐溶解
B.石墨为负极
C.电子由石墨经导线流向Zn片
D.电池放电时实现了电能向化学能的转化
对点训练3
解析 锌为负极,碱性条件下被氧化生成 而溶解,故A正确;
石墨为正极,正极上氧气得电子被还原,故B错误;
锌为负极,石墨为正极,电子由锌片经导线流向石墨,故C错误;
电池放电时为原电池反应,实现了化学能向电能的转化,故D错误。
对点训练4
一种铁-空气二次电池放电时的工作原理如图所示,电池反应为2Fe+O2+2H2O===2Fe(OH)2。下列有关该电池放电时的说法正确的是( )
D
A.能量由电能转变为化学能
B.a极质量不变
C.b极为电池负极
D.电子由a极经负载流向b极
对点训练4
解析
解析 电池放电时,化学能转化为电能,故A项错误;
a极为负极,铁失去电子生成Fe2+,Fe2+与OH-结合生成Fe(OH)2,电极质量减小,故B项错误;
b极为电池正极,故C项错误;
a极为负极,电子由a极经负载流向b极,故D项正确。
归纳整理5:原电池电极反应式的书写
书写电极反应式的基本类型
1.电极反应式的书写
(1)原电池负极反应式的书写。
①较活泼金属作负极时,电极本身被氧化。
若生成的金属阳离子与电解质溶液反应,其电极反应为两反应合并后的反应。如铅酸蓄电池负极反应为Pb+SO-2e-===PbSO4。
若生成的阳离子不与电解质溶液反应,其产物可直接写为金属阳离子,如Zn-2e-===Zn2+,Cu-2e-===Cu2+。
书写电极反应式的基本类型
1.电极反应式的书写
②负极本身不反应。
氢氧(酸性)燃料电池,负极反应为H2-2e-===2H+;氢氧(碱性)燃料电池,负极反应为H2+2OH--2e-==2H2O。
(2)原电池正极反应式的书写。
书写时总的原则是首先根据化合价变化或氧化性强弱判断得电子的微粒;
其次确定该微粒得电子后生成什么物质。
如氢氧(酸性)燃料电池,正极反应为O2+4H++4e-===2H2O;
氢氧(碱性)燃料电池,正极反应为O2+2H2O+4e-===4OH-。
书写电极反应式的基本类型
1.电极反应式的书写
(3)书写复杂电极反应式的方法——加减法。
①写出总反应。如Li+LiMn2O4==Li2Mn2O4。
②写出其中容易写出的一个半反应(正极或负极)。
如Li-e-==Li+(负极)。
③利用总反应与上述的一极反应相减,即得另一个电极的反应式,即
LiMn2O4+Li++e-==Li2Mn2O4(正极)。
书写电极反应式的基本类型
2.书写电极反应式的基本类型
类型一 题目给定原电池的装置图,未给总反应式
①首先找出原电池的正、负极,即分别找出氧化剂和还原剂。
②结合电解质判断出还原产物和氧化产物。
③遵循氧化还原反应离子方程式配平原则,写出电极反应式。(注意:电极产物能否与电解质溶液共存,如铅蓄电池的负极铅失电子变为Pb2+,但Pb2+与硫酸溶液中的 不共存,因而负极电极反应式为Pb-2e-+
=PbSO4)
④将两电极反应式相加(注意两极得失电子数相等)可得电池总反应式。
书写电极反应式的基本类型
2.书写电极反应式的基本类型
类型二 题目给出原电池的总反应式
①分析原电池总反应式中各元素的化合价变化情况,找出氧化剂及其对应的还原产物,氧化剂发生的反应即为正极反应;找出还原剂及其对应的氧化产物,还原剂发生的反应即为负极反应。
②当氧化剂、还原剂、氧化产物、还原产物由多种元素组成时,还应考虑电解质是否参与了反应。
③若有一个电极反应式较难写出,可先写出较易写出的电极反应式,然后再用总反应式减去该电极反应式即得到另一电极反应式。
对点训练1
根据反应:2Ag++Cu===Cu2++2Ag,设计如图所示原电池,下列说法错误的是( )
A. X可以是银或石墨
B. Y是硫酸铜溶液
C. 电子从铜电极经外电路流向X电极
D. X极上的电极反应式为Ag++e-===Ag
B
对点训练2
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为2Fe+2H2O+O2===2Fe(OH)2。以下说法正确的是( )
A.负极发生的反应为Fe-2e-===Fe2+
B.正极发生的反应为2H2O+O2+2e-===4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易被腐蚀
A
对点训练1
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表。
锌片上发生的电极反应为 。
银片上发生的电极反应为 。
Zn-2e-===Zn2+
2H++2e-===H2↑
(2)电动汽车上用的铅蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。
放电时正极的电极反应式:_____________________________________________;
PbO2+2e-+SO2- 4H+ === PbSO4+2H2O
4
对点训练1
解析
依据放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,正极上PbO2得电子发生还原反应,生成难溶于水的PbSO4,故正极反应式为PbO2+2e-+ +4H+===PbSO4+2H2O。
SO2-
4
(2)电动汽车上用的铅蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。
放电时正极的电极反应式:_____________________________________________;
PbO2+2e-+SO2- 4H+ === PbSO4+2H2O
4
对点训练2
铝—空气燃料电池是一种新型的燃料电池,其工作原理如图所示,其中电解质溶液是KOH溶液,正极反应式为O2+2H2O+4e-===4OH-。试完成下列问题:
(1) 通入空气的电极是____(填“正”或“负”)极。
(2) Al电极是____(填“X”或“Y”)电极。
(3) 电池总反应式为________________________________________(写离子方程式)。
正
X
对点训练2
解析
该燃料电池中Al失电子作负极,O2得电子,则通入空气的电极作正极;电子由X电极流向Y电极,所以X电极为Al,作负极,Y电极为通入空气的电极,作正极,电池总反应式为
4Al+4OH-+3O2===4AlO2- +2H2O。
向奋斗在一线的老师致敬
课堂小结
感谢您的观看
选择性必修一
THS
第1课时 化学反应与能量变化
第六章
化学反应与能量
Click here to enter your text, change the color or size of the text. You can also format the appropriate text and adjust the line spacing of the text.
专题复习
选择性必修一
化学反应与能量 认识模型
化学反应
变化
快慢和限度
化学平衡
反应速率
能量变化
物质变化
可调控
概念
特点
反应条件控制
热能
电能
吸热反应
放热反应
原电池
概念
影响因素
化学反应与能量 认识模型
宏观角度:反应物、生成物具有化学能量的相对大小
微观角度:化学键的断裂与形成
正负极
电解质溶液
导线连接形成闭合回路
自发进行的氧化还原反应
一次电池:锌锰干电池等
铅酸蓄电池
镍氢电池
锂离子电池
二次电池
化学能源
原电池装置
化学能与电能
化学能与热能
放热反应
吸热反应
理解
化学反应与能量变化
知识体系一:化学能与热能
归纳整理1:吸热反应与放热反应的判断
根据反应物和生成物的总能量大小判断:
反应物的总能量大于生成物的总能量的反应为放热反应,反之为吸热反应。
根据化学键断裂和形成时能量变化大小的关系推断:
破坏反应物中化学键吸收的能量大于形成生成物中化学键放出的能量的反应为吸热反应,反之为放热反应。
根据生成物和反应物的相对稳定性判断:
由稳定的物质生成不稳定的物质的反应为吸热反应,反之为放热反应。
归纳整理1:吸热反应与放热反应的判断
根据经验规律判断
用常见吸热和放热的反应类型来判断。
反应类型 放热反应 吸热反应
常见实例 ①金属与水或酸的反应; ②金属氧化物与水或酸的反应; ③可燃物的燃烧反应及缓慢氧化; ④酸与碱的中和反应; ⑤大部分化合反应。 ①大部分分解反应;
②Ba(OH)2·8H2O和NH4Cl反应;
③高温下焦炭与水的反应。
对点训练1
已知:①1 mol H2分子中化学键断裂时需吸收436 kJ 的能量;②1 mol Cl2分子中化学键断裂时需吸收243 kJ的能量;③由氢原子和氯原子形成1 mol HCl分子时释放 431 kJ 的能量。则1 mol H2和1 mol Cl2反应生成氯化氢气体时的能量变化为( )
A.放出能量183 kJ B.吸收能量183 kJ
C.吸收能量248 kJ D.吸收能量862 kJ
A
对点训练2
下列反应属于氧化还原反应,且能量变化如图所示的是( )
A.锌粒和稀硫酸反应
B.灼热的木炭与CO2反应
C.甲烷在空气中燃烧的反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
B
解析 由图像可知,反应物总能量低于生成物总能量,所以该反应是吸热反应。
A、C项反应为放热反应,不符合题意;
D项反应为吸热反应,但不是氧化还原反应,不符合题意;
B项反应既是氧化还原反应又是吸热反应,符合题意。
对点训练3
在1×105Pa和298 K时,将1 mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能(已知N2分子中有一个N≡N键,氨分子中有三个等价的N—H键):
共价键 H—H N≡N N—H
键能/kJ·mol-1 436 945 391
(1)根据上表中的数据判断工业合成氨的反应N2(g)+3H2(g) = 2NH3(g)是_____(填“吸热”或“放热”)反应。
放热
对点训练3
解析 化学反应的实质就是反应物中化学键断裂、生成物中化学键形成的过程,断裂化学键
吸收能量,形成化学键放出能量。N2(g)+3H2(g) = 2NH3(g)的反应中断裂化学键
共吸收的能量为945 kJ+3×436 kJ=2253 kJ,形成化学键共放出的能量为
2×3×391 kJ=2346 kJ,所以该反应为放热反应。
(2)在298 K时,取1 mol氮气和3 mol氢气放入一密闭容器中,在催化剂存在下进行反应。理论上(假设完全反应生成2 mol NH3)放出或吸收的热量为Q1,则Q1的数值为_____ kJ。
93
解析 理论上放出的热量为2346 kJ-2253 kJ=93 kJ。
归纳整理2:吸热反应和放热反应的计算
对点训练1
解析
对放热反应:A+B===C+D,以下说法一定正确的是(EA、EB、EC、ED分别表示物质A、B、C、D所具有的能量) ( )
A.EA+EB>EC+ED B.EA>EB+EC
C.EA>EB D.EA+EB<EC+ED
反应A+B===C+D是放热反应,则反应物A、B的总能量大于生成物C、D的总能量,即EA+EB>EC+ED。
A
对点训练2
已知某化学反应A2(g)+2B2(g)===2AB2(g)(A2、B2、AB2的结构式分别为A==A、B—B、B—A—B),反应过程中的能量变化如图所示,下列有关叙述正确的是 ( )
A.该反应的进行一定需要加热或点燃
B.该反应若生成2 mol AB2(g),则放出的热量为
(E1-E2)kJ
C.该反应断开化学键消耗的总能量大于形成化学键
释放的总能量
D.生成2 mol B—A键放出E2 kJ能量
A
对点训练2
解析
根据图示可知,该反应断开化学键消耗的总能量大于形成化学键释放的总能量,为吸热反应;若生成2 mol AB2(g),则吸收热量为(E1-E2)kJ,C项正确,B项错误;
该反应的进行不一定需要加热或点燃,A项错误;
生成4 mol B—A键放出E2 kJ能量,D项错误。
对点训练3
已知拆开1 mol H—H、1 mol O=O、H—O分别需要吸收的能量为436 kJ/mol、496 kJ/mol、463 kJ/mol。则2 mol H2和
1 mol O2反应生成2 mol H2O时会________(填“吸收”或“释放”)热量________kJ,化学反应中,是将________转化为________。
热能
释放
484
化学能
对点训练4
H2与O2、F2均能发生反应,如图为H2与F2发生反应生成HF过程中的能量变化示意图。请回答下列问题:
(1)完成转化Ⅰ、Ⅱ_____(填“吸收”或“放出”,下同)能量,完成转化Ⅲ_____能量。
吸收
放出
对点训练4
解析
A
(2)H2和F2反应的能量变化图可用_____(填“A”或“B”)表示。
由图可知,H2和F2生成HF的反应能量变化为154 kJ·mol-1+436 kJ·mol-1-2×565 kJ·mol-1=-540 kJ·mol-1,是放热反应,则反应物的总能量大于生成物的总能量,A正确。
对点训练4
解析
(3)H2在O2中燃烧的过程主要是_______能转化为_____能的过程。
化学
氢气在氧气中燃烧是放热反应,主要是化学能转化为热能的过程。
热
知识体系二:化学能与电能
归纳整理3:原电池的工作原理和应用
原电池是由两个活动性不同的电极、电解质溶液构成的闭合回路,也就是说原电池的构造是:①两个活动性不同的电极;②电解质溶液;③闭合回路,④存在自发的氧化还原反应。如下图。
u
1.原电池的构成
归纳整理3:原电池的工作原理和应用
u
2.原电池的本质
锌为负极,发生氧化反应:Zn-2e-===Zn2+,
铜为正极,发生还原反应:2H++2e-===H2↑
原电池实质上是将氧化反应和还原反应分到了两个电极上进行,使其分别成为一个“半反应”,因此,根据氧化还原反应方程式可以很容易地设计原电池装置。
归纳整理3:原电池的工作原理和应用
3. 原电池的工作原理
归纳整理3:原电池的工作原理和应用
3. 原电池的工作原理
负极 正极
电极材料 活泼性较强的金属 活泼性较弱的金属或能
导电的非金属
电子流向 电子流出极 电子流入极
离子移动方向 阴离子移向的极 阳离子移向的极
反应类型 氧化反应 还原反应
反应现象 溶解的极 增重或有气泡放出的极
电极反应式 还原剂-ne-===氧化产物 氧化剂+ne-===还原产物
对点训练1
如图所示,电流表的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
C
A. B极为原电池的正极
B. A、B、C分别可以为Zn、Cu和稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
对点训练1
解析
原电池中,负极金属失去电子,发生氧化反应而溶解,质量减小,故A极为负极,B极为正极,A、D项正确;
A、B、C分别为Zn、Cu和稀盐酸时,可以构成原电池,且现象符合题意,B项正确;
电解质溶液中阳离子移向正极,C项错误。
对点训练2
汽车的启动电源常用铅蓄电池。放电时的电池反应为PbO2+Pb+2H2SO4===2PbSO4+2H2O,根据此反应判断下列说法正确的是( )
A
A.负极反应式:Pb-2e-+ ===PbSO4
B.电池放电时,溶液的酸性增强
C.PbO2得电子,被氧化
D.PbO2是电池的负极
对点训练2
解析
Pb失电子作负极,反应式为Pb+ -2e-===PbSO4,故A正确;
放电时,硫酸参加反应,导致溶液中氢离子浓度减小,则溶液的酸性减弱,故B错误;
PbO2得电子,被还原,故C错误;
根据电池反应式知,PbO2在反应中得电子,化合价由+4价变为+2价,所以二氧化铅作正极,故D错误。
对点训练3
为将反应2Al+6H+===2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去了氧化膜) ( )
C
对点训练3
解析
A、B、C三项中的装置均能将化学能转化为电能,A项,反应为2Al+2OH-+2H2O=== +3H2↑,错误;
B项,Al与H2SO4反应产生铝盐和H2,正确;
C项,反应为Al和稀硝酸反应生成NO,错误;
D项,两电极全是Al,因而不能构成原电池,即不能将化学能转化为电能,错误。
对点训练4
有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置
部分实验现象
由此可判断这四种金属的活动顺序是
A. a>b>c>d B. b>c>d>a C. d>a>b>c D. a>b>d>c
a极质量减小;
b极质量增加
b极有气体产生;
c极无变化
d极溶解;
c极有气体产生
电流从a极
流向d极
对点训练4
解析
把四个实验从左到右分别编号为①、②、③、④,则由实验①可知,a作原电池负极,b作原电池正极,金属活动性:a>b;由实验②可知,b极有气体产生,c极无变化,则活动性:b>c;由实验③可知,d极溶解,则d作原电池负极,c作正极,活动性:d>c;由实验④可知,电流从a极流向d极,则d极为原电池负极,a极为原电池正极,活动性:d>a。综上所述可知活动性:d>a>b>c。
实验装置
部分实验现象
a极质量减小;
b极质量增加
b极有气体产生;
c极无变化
d极溶解;
c极有气体产生
电流从a极
流向d极
归纳整理4:原电池正负极的判断
1. 根据电极材料判断
一般是活泼性较强的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
2. 根据电流方向或电子流动方向判断
电流由正极流向负极;电子由负极流向正极。
3. 根据原电池里电解质溶液中离子的移动方向
在原电池的电解质溶液中,阳离子移向的极为正极,阴离子移向的极为负极。
归纳整理4:原电池正负极的判断
4. 根据原电池两极发生的变化判断
原电池的负极发生失电子的氧化反应,正极发生得电子的还原反应。
5. 根据现象判断
溶解的一极为负极,增重或有气泡放出的一极为正极。
特别提示 在判断原电池正、负极时,不要只根据金属活动性的相对强弱,有时还与电解质溶液有关,因此要根据具体情况来判断正、负极。
归纳整理4:原电池正负极的判断
对点训练1
人造地球卫星上使用的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-==ZnO+H2O,Ag2O+H2O+2e-==2Ag+2OH-。据此判断Ag2O是( )
A.负极,被氧化 B.正极,被还原
C.负极,被还原 D.正极,被氧化
B
对点训练2
将用导线连接的电极X、Y插入装有硫酸铜溶液的烧杯中(外电路中电子流向如图所示)。据此判断下列说法正确的是( )
A.外电路中电流方向为X→Y
B.若电极材料分别为锌片和铜片,则Y为锌片
C.X极上发生还原反应
D.若电极材料都是金属,则金属活动性:X>Y
D
解析 A项,原电池中电子由负极经外电路流向正极,外电路中电流方向与电子流向相反,故电流方向为Y→外电路→X,错误;
B项,若电极材料分别为锌片和铜片,则锌为负极,即X为锌片,错误;
C项,X极是负极,发生氧化反应,错误;
D项,若电极材料都是金属,则负极金属活动性大于正极,金属活动性:X>Y,正确。
对点训练3
锌-空气电池具有蓄电量大、循环次数多等优点。下列说法正确的是( )
A
A.电池放电时Zn电极逐渐溶解
B.石墨为负极
C.电子由石墨经导线流向Zn片
D.电池放电时实现了电能向化学能的转化
对点训练3
解析 锌为负极,碱性条件下被氧化生成 而溶解,故A正确;
石墨为正极,正极上氧气得电子被还原,故B错误;
锌为负极,石墨为正极,电子由锌片经导线流向石墨,故C错误;
电池放电时为原电池反应,实现了化学能向电能的转化,故D错误。
对点训练4
一种铁-空气二次电池放电时的工作原理如图所示,电池反应为2Fe+O2+2H2O===2Fe(OH)2。下列有关该电池放电时的说法正确的是( )
D
A.能量由电能转变为化学能
B.a极质量不变
C.b极为电池负极
D.电子由a极经负载流向b极
对点训练4
解析
解析 电池放电时,化学能转化为电能,故A项错误;
a极为负极,铁失去电子生成Fe2+,Fe2+与OH-结合生成Fe(OH)2,电极质量减小,故B项错误;
b极为电池正极,故C项错误;
a极为负极,电子由a极经负载流向b极,故D项正确。
归纳整理5:原电池电极反应式的书写
书写电极反应式的基本类型
1.电极反应式的书写
(1)原电池负极反应式的书写。
①较活泼金属作负极时,电极本身被氧化。
若生成的金属阳离子与电解质溶液反应,其电极反应为两反应合并后的反应。如铅酸蓄电池负极反应为Pb+SO-2e-===PbSO4。
若生成的阳离子不与电解质溶液反应,其产物可直接写为金属阳离子,如Zn-2e-===Zn2+,Cu-2e-===Cu2+。
书写电极反应式的基本类型
1.电极反应式的书写
②负极本身不反应。
氢氧(酸性)燃料电池,负极反应为H2-2e-===2H+;氢氧(碱性)燃料电池,负极反应为H2+2OH--2e-==2H2O。
(2)原电池正极反应式的书写。
书写时总的原则是首先根据化合价变化或氧化性强弱判断得电子的微粒;
其次确定该微粒得电子后生成什么物质。
如氢氧(酸性)燃料电池,正极反应为O2+4H++4e-===2H2O;
氢氧(碱性)燃料电池,正极反应为O2+2H2O+4e-===4OH-。
书写电极反应式的基本类型
1.电极反应式的书写
(3)书写复杂电极反应式的方法——加减法。
①写出总反应。如Li+LiMn2O4==Li2Mn2O4。
②写出其中容易写出的一个半反应(正极或负极)。
如Li-e-==Li+(负极)。
③利用总反应与上述的一极反应相减,即得另一个电极的反应式,即
LiMn2O4+Li++e-==Li2Mn2O4(正极)。
书写电极反应式的基本类型
2.书写电极反应式的基本类型
类型一 题目给定原电池的装置图,未给总反应式
①首先找出原电池的正、负极,即分别找出氧化剂和还原剂。
②结合电解质判断出还原产物和氧化产物。
③遵循氧化还原反应离子方程式配平原则,写出电极反应式。(注意:电极产物能否与电解质溶液共存,如铅蓄电池的负极铅失电子变为Pb2+,但Pb2+与硫酸溶液中的 不共存,因而负极电极反应式为Pb-2e-+
=PbSO4)
④将两电极反应式相加(注意两极得失电子数相等)可得电池总反应式。
书写电极反应式的基本类型
2.书写电极反应式的基本类型
类型二 题目给出原电池的总反应式
①分析原电池总反应式中各元素的化合价变化情况,找出氧化剂及其对应的还原产物,氧化剂发生的反应即为正极反应;找出还原剂及其对应的氧化产物,还原剂发生的反应即为负极反应。
②当氧化剂、还原剂、氧化产物、还原产物由多种元素组成时,还应考虑电解质是否参与了反应。
③若有一个电极反应式较难写出,可先写出较易写出的电极反应式,然后再用总反应式减去该电极反应式即得到另一电极反应式。
对点训练1
根据反应:2Ag++Cu===Cu2++2Ag,设计如图所示原电池,下列说法错误的是( )
A. X可以是银或石墨
B. Y是硫酸铜溶液
C. 电子从铜电极经外电路流向X电极
D. X极上的电极反应式为Ag++e-===Ag
B
对点训练2
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为2Fe+2H2O+O2===2Fe(OH)2。以下说法正确的是( )
A.负极发生的反应为Fe-2e-===Fe2+
B.正极发生的反应为2H2O+O2+2e-===4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易被腐蚀
A
对点训练1
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表。
锌片上发生的电极反应为 。
银片上发生的电极反应为 。
Zn-2e-===Zn2+
2H++2e-===H2↑
(2)电动汽车上用的铅蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。
放电时正极的电极反应式:_____________________________________________;
PbO2+2e-+SO2- 4H+ === PbSO4+2H2O
4
对点训练1
解析
依据放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,正极上PbO2得电子发生还原反应,生成难溶于水的PbSO4,故正极反应式为PbO2+2e-+ +4H+===PbSO4+2H2O。
SO2-
4
(2)电动汽车上用的铅蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。
放电时正极的电极反应式:_____________________________________________;
PbO2+2e-+SO2- 4H+ === PbSO4+2H2O
4
对点训练2
铝—空气燃料电池是一种新型的燃料电池,其工作原理如图所示,其中电解质溶液是KOH溶液,正极反应式为O2+2H2O+4e-===4OH-。试完成下列问题:
(1) 通入空气的电极是____(填“正”或“负”)极。
(2) Al电极是____(填“X”或“Y”)电极。
(3) 电池总反应式为________________________________________(写离子方程式)。
正
X
对点训练2
解析
该燃料电池中Al失电子作负极,O2得电子,则通入空气的电极作正极;电子由X电极流向Y电极,所以X电极为Al,作负极,Y电极为通入空气的电极,作正极,电池总反应式为
4Al+4OH-+3O2===4AlO2- +2H2O。
向奋斗在一线的老师致敬
课堂小结
感谢您的观看
选择性必修一
THS
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
