实验活动6《化学能转化成电能》课件(共23张PPT)
文档属性
| 名称 | 实验活动6《化学能转化成电能》课件(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 17:45:50 | ||
图片预览





文档简介
(共23张PPT)
第六章
化学反应与能量
选择性必修一
化学能转化成电能
实验活动6
你认识的电池可能是。。。。
【学习目标】
1. 理解氧化还原反应在化学能转化成电能过程中的作用。
2. 认识原电池的构成要素及其作用。(重点)
【实验用品】
烧杯、导线、电流表。
锌片、铜片、石墨棒、稀硫酸。
一、电极材料的实验
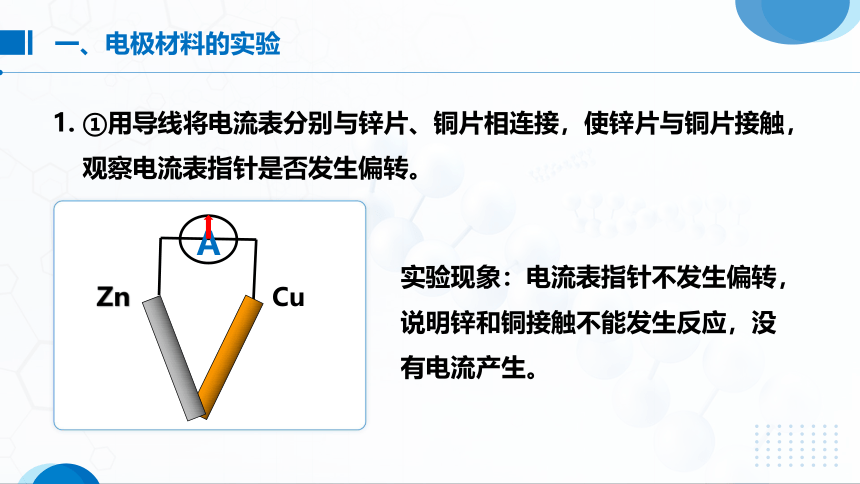
实验现象:电流表指针不发生偏转,说明锌和铜接触不能发生反应,没有电流产生。
A
Zn
Cu
1. ①用导线将电流表分别与锌片、铜片相连接,使锌片与铜片接触,
观察电流表指针是否发生偏转。
一、电极材料的实验
实验现象:电流表指针不发生偏转,说明没有电流,说明锌和石墨棒接触不能发生反应。
A
Zn
Cu
1. ②用导线将电流表分别与芯片、石墨棒相连接,使片与铜片接触,观察电流表指针是否发生偏转。
一、电极材料的实验
电极材料 电流表指针是 否发生偏转 解释
锌片、铜片 不偏转 两个相互连接的电极材料相互接触,并不能产生电流。
锌片、石墨棒 不偏转 实验结论:说明只有电极材料相互接触并不能产生电流。
实验结论
一、电极材料的实验
2. ①将锌片插入盛有稀硫酸的烧杯里,观察现象。
稀硫酸
Zn2+
e-
e-
Zn
实验现象:锌片逐渐溶解,锌片周围有气泡产生,锌和稀硫酸发生了反应。
Zn+H2SO4=ZnSO4+H2↑
一、电极材料的实验
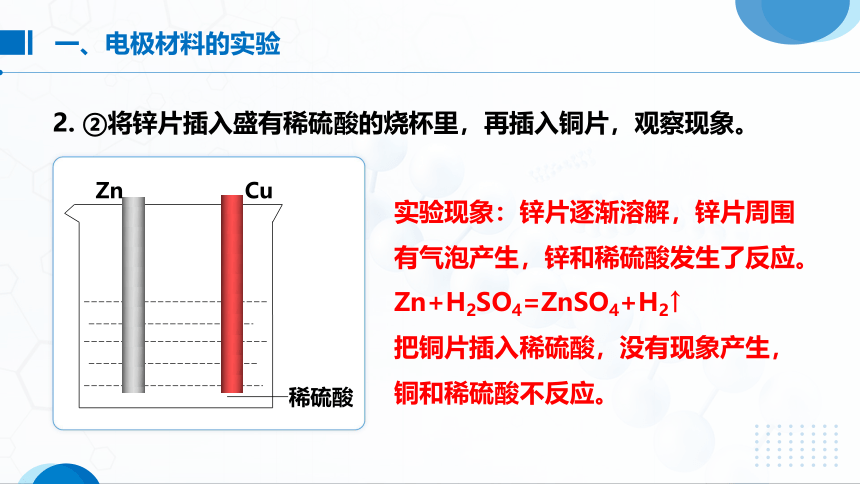
2. ②将锌片插入盛有稀硫酸的烧杯里,再插入铜片,观察现象。
实验现象:锌片逐渐溶解,锌片周围有气泡产生,锌和稀硫酸发生了反应。
Zn+H2SO4=ZnSO4+H2↑
把铜片插入稀硫酸,没有现象产生,铜和稀硫酸不反应。
稀硫酸
Zn
Cu
一、电极材料的实验
2. ③将锌片插入盛有稀硫酸的烧杯里,再插入石墨棒,观察现象。
实验现象:锌片逐渐溶解,锌片周围有气泡产生,锌和稀硫酸发生了反应。
Zn+H2SO4=ZnSO4+H2↑
把石墨棒插入稀硫酸,没有现象产生,石墨棒和稀硫酸不反应。
稀硫酸
Zn
石墨棒
一、电极材料的实验
实验结论:说明有电极材料和电解质溶液,但是不用导线连接,也不能产生电流。
实验结论
电极材料 实验现象 解释
锌片 锌片逐渐溶解,有气泡产生 Zn+H2SO4=ZnSO4+H2↑
锌片、铜片 锌片逐渐溶解,有气 泡产生、铜片无现象 Zn+H2SO4=ZnSO4+H2↑
锌片、石墨棒 锌片逐渐溶解,有气泡 产生,石墨棒无现象 Zn+H2SO4=ZnSO4+H2↑
二、原电池实验
1. 以Zn-Cu(稀硫酸)设计如图原电池,观察现象
e-
e-
e-
e-
e-
e-
e-
e-
稀硫酸
Zn2+
H+
H+
H2
H2
Zn
Cu
实验现象:锌片不断溶解,电流表指针发生偏转,铜四周不断产生气泡,说明产生了电流,形成了原电池。
锌片(负极):氧化反应 Zn-2e-=Zn2+
铜片(正极):还原反应 2H++2e-=H2↑
正极
负极
二、原电池实验
2. 以Zn-石墨棒(稀硫酸)设计如图原电池,观察现象
e-
e-
e-
e-
e-
e-
e-
e-
稀硫酸
Zn2+
H+
H+
H2
H2
Zn
Cu
实验现象:锌片不断溶解,电流表指针发生偏转,石墨棒四周不断产生气泡,说明产生了电流,形成了原电池。
锌片(负极):氧化反应 Zn-2e-=Zn2+
石墨棒(正极):还原反应 2H++2e-=H2↑
正极
负极
二、原电池实验
3. 以Zn-石墨棒(稀硫酸)设计如图原电池,观察现象
e-
e-
稀硫酸
Cu
石墨棒
实验现象:铜片无现象,电流表指针不发生偏转,石墨棒四周无现象,说明没有产生电流,不能形成原电池。
实验结论
电极材料 实验现象 解释
锌片 铜片
锌片 石墨棒
铜片 石墨棒
锌片不断溶解,电流表指针发生偏转,铜四周不断产生气泡,说明产生了电流,形成了原电池。
不能发生反应
锌片不断溶解,电流表指针发生偏转,石墨棒四周不断产生气泡,说明产生了电流,形成了原电池。
铜片无现象,电流表指针不发生偏转,石墨棒四周无现象,说明没有产生电流,不能形成原电池。
锌片:氧化反应 Zn-2e-=Zn2+
铜片:还原反应 2H++2e-=H2↑
锌片:氧化反应 Zn-2e-=Zn2+
石墨棒:还原反应 2H++2e-=H2↑
二、原电池实验
上面的三个实验表明,要构成原电池,需要满足以下条件:
①两种活泼性不同电极。
(活泼性不同的金属或一种金属和另一种非金属导体)
②电极必须插入电解质溶液 。
③能自发的发生氧化还原反应。
④电极用导线相连构成闭合回路。
小结:原电池形成的必须条件
二、原电池实验
【问题和讨论】
1.根据以上实验,说明原电池的工作原理和构成要素,以及组装原电池的操作
注意事项。
提示:原电池的工作原理:原电池在工作时,负极上失电子发生氧化反应,电子通过外电路输送到正极上,电解质溶液中具有氧化性的物质得到电子发生还原反应,氧化反应和还原反应不断发生,负极失去的电子通过导线不断地流向正极,电解质溶液中的阳离子不断地从负极移向正极,这样就形成了闭合回路,实现化学能向电能的转化。
二、原电池实验
原电池的构成要素
①电极材料由两种金属活动性不同的金属或由金属与其他导电的材料(非金属或某些氧化物等)组成;②电解质溶液:作反应介质,参与氧化还原反应,在溶液中构成闭合回路,起导电的作用;③两电极之间有导线连接或直接接触,形成闭合回路;④发生的反应是自发的氧化还原反应。
组装原电池的操作注意事项
①选择合适的电极材料;②能发生自发的氧化还原反应;③整个装置能形成闭合回路。
二、原电池实验
2.能否用铁片作为电极代替铜锌原电池中的锌片?为什么?
提示:可以用铁片代替锌片,因为铁比铜活泼,且能够与稀硫酸发生自发的氧化还原反应。
二、原电池实验
意大利伽伐尼解剖青蛙发现电火花
电池发展史
未来
小型
轻便
高能
绿色
1748
1859
1865
1899
1959
1980
1996-2018
1970
普兰特发明铅酸蓄电池--第一个可充电电池
荣格发明了碱性镉镍电池
克莱因和施托克尔研制成功镍氢电池
1800
伏特发明
伏打电池
勒克朗谢发明了锌锰干电池
培根等人研制成功氢氧燃料电池
锂离子电池
锂-空气电池
课堂训练
1.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
a极质量减小;b极质量增加
b极有气体产生;c极无变化
d极溶解;c极有气体产生
电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )。
A. a>b>c>d B. b>c>d>a C. d>a>b>c D. a>b>d>c
C
课堂训练
2.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(1)当a极为Al,b极为Cu,电解质溶液为稀硫酸时,正极的电极反应式为 , 当电路中有0.2 mol电子通过时,负极的质量减少 ______g。
(2)当a极为Al,b极为Mg,电解质溶液为氢氧化钠溶液时,该装置______
(填“能”或“不能”)形成原电池,若不能,请说明理由;若能,请指出正、负极: 。
2H++2e-=H2↑
1.8
能
正极: 镁; 负极: 铝
向奋斗在一线的老师致敬
课堂小结
感谢您的观看
选择性必修一
THS
第六章
化学反应与能量
选择性必修一
化学能转化成电能
实验活动6
你认识的电池可能是。。。。
【学习目标】
1. 理解氧化还原反应在化学能转化成电能过程中的作用。
2. 认识原电池的构成要素及其作用。(重点)
【实验用品】
烧杯、导线、电流表。
锌片、铜片、石墨棒、稀硫酸。
一、电极材料的实验
实验现象:电流表指针不发生偏转,说明锌和铜接触不能发生反应,没有电流产生。
A
Zn
Cu
1. ①用导线将电流表分别与锌片、铜片相连接,使锌片与铜片接触,
观察电流表指针是否发生偏转。
一、电极材料的实验
实验现象:电流表指针不发生偏转,说明没有电流,说明锌和石墨棒接触不能发生反应。
A
Zn
Cu
1. ②用导线将电流表分别与芯片、石墨棒相连接,使片与铜片接触,观察电流表指针是否发生偏转。
一、电极材料的实验
电极材料 电流表指针是 否发生偏转 解释
锌片、铜片 不偏转 两个相互连接的电极材料相互接触,并不能产生电流。
锌片、石墨棒 不偏转 实验结论:说明只有电极材料相互接触并不能产生电流。
实验结论
一、电极材料的实验
2. ①将锌片插入盛有稀硫酸的烧杯里,观察现象。
稀硫酸
Zn2+
e-
e-
Zn
实验现象:锌片逐渐溶解,锌片周围有气泡产生,锌和稀硫酸发生了反应。
Zn+H2SO4=ZnSO4+H2↑
一、电极材料的实验
2. ②将锌片插入盛有稀硫酸的烧杯里,再插入铜片,观察现象。
实验现象:锌片逐渐溶解,锌片周围有气泡产生,锌和稀硫酸发生了反应。
Zn+H2SO4=ZnSO4+H2↑
把铜片插入稀硫酸,没有现象产生,铜和稀硫酸不反应。
稀硫酸
Zn
Cu
一、电极材料的实验
2. ③将锌片插入盛有稀硫酸的烧杯里,再插入石墨棒,观察现象。
实验现象:锌片逐渐溶解,锌片周围有气泡产生,锌和稀硫酸发生了反应。
Zn+H2SO4=ZnSO4+H2↑
把石墨棒插入稀硫酸,没有现象产生,石墨棒和稀硫酸不反应。
稀硫酸
Zn
石墨棒
一、电极材料的实验
实验结论:说明有电极材料和电解质溶液,但是不用导线连接,也不能产生电流。
实验结论
电极材料 实验现象 解释
锌片 锌片逐渐溶解,有气泡产生 Zn+H2SO4=ZnSO4+H2↑
锌片、铜片 锌片逐渐溶解,有气 泡产生、铜片无现象 Zn+H2SO4=ZnSO4+H2↑
锌片、石墨棒 锌片逐渐溶解,有气泡 产生,石墨棒无现象 Zn+H2SO4=ZnSO4+H2↑
二、原电池实验
1. 以Zn-Cu(稀硫酸)设计如图原电池,观察现象
e-
e-
e-
e-
e-
e-
e-
e-
稀硫酸
Zn2+
H+
H+
H2
H2
Zn
Cu
实验现象:锌片不断溶解,电流表指针发生偏转,铜四周不断产生气泡,说明产生了电流,形成了原电池。
锌片(负极):氧化反应 Zn-2e-=Zn2+
铜片(正极):还原反应 2H++2e-=H2↑
正极
负极
二、原电池实验
2. 以Zn-石墨棒(稀硫酸)设计如图原电池,观察现象
e-
e-
e-
e-
e-
e-
e-
e-
稀硫酸
Zn2+
H+
H+
H2
H2
Zn
Cu
实验现象:锌片不断溶解,电流表指针发生偏转,石墨棒四周不断产生气泡,说明产生了电流,形成了原电池。
锌片(负极):氧化反应 Zn-2e-=Zn2+
石墨棒(正极):还原反应 2H++2e-=H2↑
正极
负极
二、原电池实验
3. 以Zn-石墨棒(稀硫酸)设计如图原电池,观察现象
e-
e-
稀硫酸
Cu
石墨棒
实验现象:铜片无现象,电流表指针不发生偏转,石墨棒四周无现象,说明没有产生电流,不能形成原电池。
实验结论
电极材料 实验现象 解释
锌片 铜片
锌片 石墨棒
铜片 石墨棒
锌片不断溶解,电流表指针发生偏转,铜四周不断产生气泡,说明产生了电流,形成了原电池。
不能发生反应
锌片不断溶解,电流表指针发生偏转,石墨棒四周不断产生气泡,说明产生了电流,形成了原电池。
铜片无现象,电流表指针不发生偏转,石墨棒四周无现象,说明没有产生电流,不能形成原电池。
锌片:氧化反应 Zn-2e-=Zn2+
铜片:还原反应 2H++2e-=H2↑
锌片:氧化反应 Zn-2e-=Zn2+
石墨棒:还原反应 2H++2e-=H2↑
二、原电池实验
上面的三个实验表明,要构成原电池,需要满足以下条件:
①两种活泼性不同电极。
(活泼性不同的金属或一种金属和另一种非金属导体)
②电极必须插入电解质溶液 。
③能自发的发生氧化还原反应。
④电极用导线相连构成闭合回路。
小结:原电池形成的必须条件
二、原电池实验
【问题和讨论】
1.根据以上实验,说明原电池的工作原理和构成要素,以及组装原电池的操作
注意事项。
提示:原电池的工作原理:原电池在工作时,负极上失电子发生氧化反应,电子通过外电路输送到正极上,电解质溶液中具有氧化性的物质得到电子发生还原反应,氧化反应和还原反应不断发生,负极失去的电子通过导线不断地流向正极,电解质溶液中的阳离子不断地从负极移向正极,这样就形成了闭合回路,实现化学能向电能的转化。
二、原电池实验
原电池的构成要素
①电极材料由两种金属活动性不同的金属或由金属与其他导电的材料(非金属或某些氧化物等)组成;②电解质溶液:作反应介质,参与氧化还原反应,在溶液中构成闭合回路,起导电的作用;③两电极之间有导线连接或直接接触,形成闭合回路;④发生的反应是自发的氧化还原反应。
组装原电池的操作注意事项
①选择合适的电极材料;②能发生自发的氧化还原反应;③整个装置能形成闭合回路。
二、原电池实验
2.能否用铁片作为电极代替铜锌原电池中的锌片?为什么?
提示:可以用铁片代替锌片,因为铁比铜活泼,且能够与稀硫酸发生自发的氧化还原反应。
二、原电池实验
意大利伽伐尼解剖青蛙发现电火花
电池发展史
未来
小型
轻便
高能
绿色
1748
1859
1865
1899
1959
1980
1996-2018
1970
普兰特发明铅酸蓄电池--第一个可充电电池
荣格发明了碱性镉镍电池
克莱因和施托克尔研制成功镍氢电池
1800
伏特发明
伏打电池
勒克朗谢发明了锌锰干电池
培根等人研制成功氢氧燃料电池
锂离子电池
锂-空气电池
课堂训练
1.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
a极质量减小;b极质量增加
b极有气体产生;c极无变化
d极溶解;c极有气体产生
电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )。
A. a>b>c>d B. b>c>d>a C. d>a>b>c D. a>b>d>c
C
课堂训练
2.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(1)当a极为Al,b极为Cu,电解质溶液为稀硫酸时,正极的电极反应式为 , 当电路中有0.2 mol电子通过时,负极的质量减少 ______g。
(2)当a极为Al,b极为Mg,电解质溶液为氢氧化钠溶液时,该装置______
(填“能”或“不能”)形成原电池,若不能,请说明理由;若能,请指出正、负极: 。
2H++2e-=H2↑
1.8
能
正极: 镁; 负极: 铝
向奋斗在一线的老师致敬
课堂小结
感谢您的观看
选择性必修一
THS
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
