实验活动7《化学反应速率的影响因素》课件(共26张PPT)
文档属性
| 名称 | 实验活动7《化学反应速率的影响因素》课件(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 17:46:51 | ||
图片预览







文档简介
(共26张PPT)
实验活动7 化学反应速率的影响因素
第六章
化学反应与能量
第二节 化学反应的速率与限度
选择性必修一
2st
【实验目的】
1.体验浓度、温度和催化剂对化学反应速率的影响。
2.理解改变反应条件可以调控化学反应的速率。
【实验原理】
1.硫代硫酸钠与硫酸的反应
硫代硫酸钠与硫酸反应会生成不溶于水的硫:Na2S2O3+H2SO4===
Na2SO4+SO2↑+S↓+H2O,反应生成的硫使溶液出现乳白色浑浊,比较浑浊现象出现所需时间的长短,可以判断该反应进行的快慢。在不同浓度和温度条件下分别进行上述反应,并比较其反应快慢,可以看出反应物浓度和温度对该反应速率的影响。
【实验原理】
2.过氧化氢分解会产生氧气,在有或无催化剂存在下进行对比实验,通过观察氧气产生的快慢可以看出催化剂对该反应速率的影响。
【实验用品】
烧杯、试管、量筒、试管架、胶头滴管、温度计、药匙、秒表。
0.1 mol/L Na2S2O3溶液、0.1 mol/L H2SO4溶液、10% H2O2
溶液、1 mol/L FeCl3溶液、MnO2粉末、蒸馏水。
方法指导
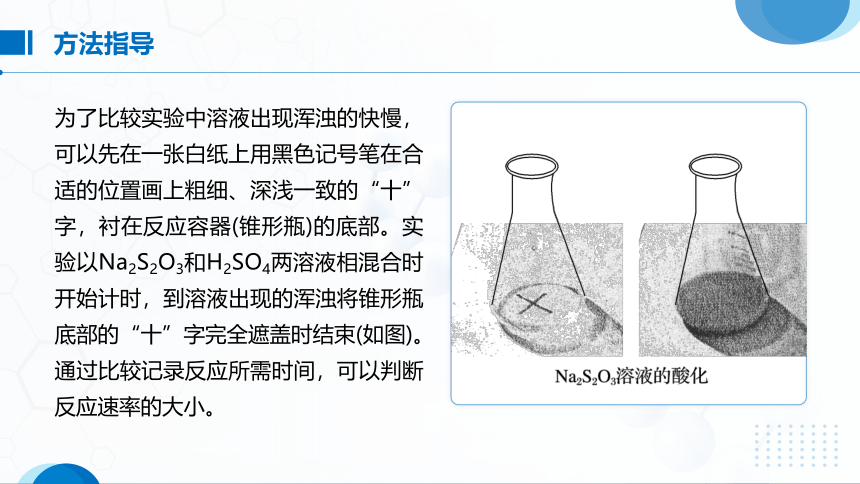
为了比较实验中溶液出现浑浊的快慢,可以先在一张白纸上用黑色记号笔在合适的位置画上粗细、深浅一致的“十”字,衬在反应容器(锥形瓶)的底部。实验以Na2S2O3和H2SO4两溶液相混合时开始计时,到溶液出现的浑浊将锥形瓶底部的“十”字完全遮盖时结束(如图)。通过比较记录反应所需时间,可以判断反应速率的大小。
实验步骤
1.探究浓度对反应速率的影响
取两个50 mL锥形瓶,编为1、2号。向1号锥形瓶中加入10 mL 0.1 mol·L-1 Na2S2O3溶液,向2号锥形瓶中加入5 mL 0.1 mol·L-1 Na2S2O3溶液和5 mL蒸馏水。
另取两支试管,各加入10 mL 0.1 mol·L-1 H2SO4溶液,然后同时将该溶液分别倒入1、2号锥形瓶中,记录反应所需的时间。
记录与结论
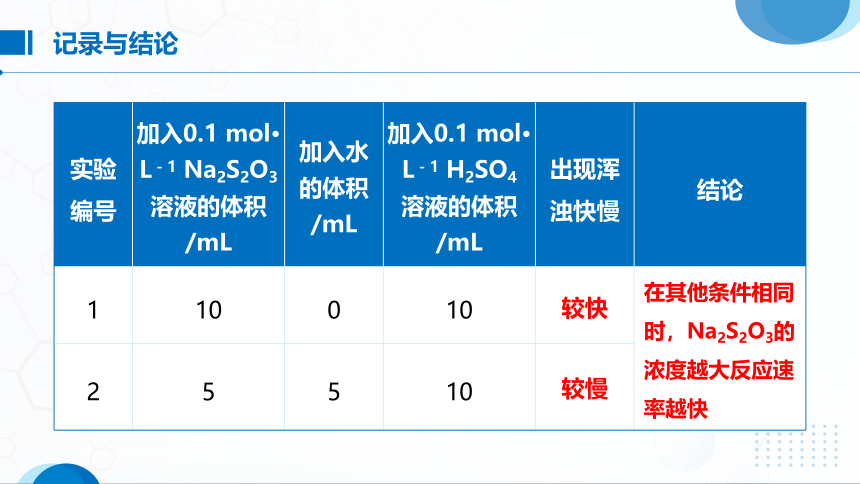
实验 编号 加入0.1 mol· L-1 Na2S2O3 溶液的体积 /mL 加入水 的体积 /mL 加入0.1 mol· L-1 H2SO4 溶液的体积 /mL 出现浑 浊快慢 结论
1 10 0 10
2 5 5 10 较快
较慢
在其他条件相同时,Na2S2O3的浓度越大反应速率越快
实验步骤
2.探究温度对反应速率的影响
取一个50 mL锥形瓶,编为3号,向其中加入10 mL 0.1 mol·L-1 Na2S2O3溶液,向另一支试管中加入10 mL 0.1 mol·L-1 H2SO4溶液,同时放入盛有热水的烧杯中,片刻后将锥形瓶和试管取出,将H2SO4溶液加到Na2S2O3溶液中,记录溶液的温度和反应所需的时间。
记录与结论
实验 编号 加入0.1 mol· L-1 Na2S2O3 溶液的体积 /mL 加入0.1 mol· L-1 H2SO4 溶液的体积 /mL 反应 温度 出现浑浊的快慢 结论
1 10 10 室温
2 10 10 热水 较慢
较快
在其条件相同时,升高温度,反应速率加快。
实验步骤
3.催化剂对化学反应速率的影响
向三支大小相同的试管中各加入2 mL 10% H2O2溶液,再向其中的两支试管中分别加入少量MnO2粉末和2滴1 mol·L-1 FeCl3溶液。观察、比较三支试管中气泡出现的快慢。
记录与结论
现象 结论
加入MnO2 气泡冒出速率增大 MnO2能 反应速率
加入FeCl3 气泡冒出速率增大 FeCl3能 反应速率
不加其他 试剂 有气泡冒出,较慢 无催化剂_________
加快
加快
反应较慢
实验结论
1.其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。
2.其他条件相同时,升高温度,化学反应速率增大;降低温度,化学反应速率减小。
3.催化剂可以改变化学反应速率。
【实验注意事项】
1.做对比实验时除了要对比的因素不同外,其他能影响实验结果的因素应该完全相同。
2.本实验所需要的过氧化氢的浓度不能太大,原因是浓度太大,反应太剧烈,影响现象的观察。
【问题和讨论】
提示:红热的铁和水蒸气具有较高的温度,温度越高,化学反应速率越快,反应越容易发生。
在通常情况下,铁与冷水或热水都不发生反应,但红热的铁与水蒸气则可发生反应,生成Fe3O4和H2。试从反应条件的角度思考并解释这一事实。
【巩固练习】
1.在不同浓度(c )、温度(T )条件下,蔗糖水解的瞬时速率(v )如下表。下列判断不正确的是( )
A.a= 6.00
B.同时改变反应温度和蔗糖
的浓度,v可能不变
C.b< 318.2
D.不同温度时,蔗糖浓度减
少一半所需的时间相同
D
【巩固练习】
A项,分析题表中数据可知,在同一温度下,反应的瞬时速率与浓度在数值上成正比,当T=328.2 K时,v=15c,故a=15×0.400=6.00,正确。
B项,分析题表中数据可知升高温度,水解速率增大,增大浓度,水解速率也增大,若同时增大(减小)反应物的浓度和降低(升高)反应的温度,则对反应速率的影响因素相互抵消,反应速率可能不变,正确。
C项,在物质的浓度不变时,升高温度,水解速率增大,降低温度,水解速率减小,由于在物质的浓度为0.600 mol·L-1时,温度由318.2 K变为b,反应速率减小,则b<318.2,正确。
D项,不同温度时,反应速率不相同,则蔗糖浓度减少一半所需的时间不同,错误。
【巩固练习】
2.探究温度和浓度对反应速率的影响
实验原理及方案:在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO-+5SO2-+2H+===I2+5SO2-+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
3
3
实验序号 0.01 mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL 0.01 mol·L-1 Na2SO3溶液的体积/mL 水的体积/mL 实验温度/℃ 出现蓝色的时间/s
① 5 5 V1 0
② 5 5 40 25
③ 5 V2 35 25
则V1=________mL、V2=________mL。
40
10
【巩固练习】
解析
①和②温度不同,应该是探究温度对反应速率的影响,因此浓度需相同,即溶液的总体积相同,则V1+5+5=5+5+40,得V1=40;②和③温度相同,应该是探究浓度对反应速率的影响,表中KIO3酸性溶液的体积相同,可知亚硫酸钠的浓度应不同,溶液的总体积相同,5+V2+35=5+5+40,得V2=10。
【巩固练习】
【巩固练习】
3.某实验小组学习化学反应速率后,联想到H2O2分解制备氧气,设计如下实验方案探究外界条件对反应速率的影响。
编号 温度 反应物 催化剂
甲 25 ℃ 试管中加入3 mL 5% H2O2溶液 1 mL蒸馏水
乙 25 ℃ 试管中加入3 mL 5% H2O2溶液 1 mL 0.1 mol·L-1 FeCl3溶液
丙 40 ℃ 试管中加入3 mL 5% H2O2溶液 1 mL蒸馏水
(1)实验乙中发生反应的化学方程式为________________________________。
2H2O2 ====== 2H2O+O2↑
催化剂
【巩固练习】
(2) 实验甲和实验乙的实验目的是________________________________。
实验甲和实验丙的实验目的是________________________________。
探究催化剂对反应速率的影响
探究温度对反应速率的影响
解析 由表可知实验甲和实验乙除催化剂不同外其他条件都相同,所以实验甲和实验乙是探究催化剂对反应速率的影响;实验甲和实验丙除温度不同外其他条件均相同,则实验甲和实验丙是探究温度对反应速率的影响。
编号 温度 反应物 催化剂
甲 25 ℃ 试管中加入3 mL 5% H2O2溶液 1 mL蒸馏水
乙 25 ℃ 试管中加入3 mL 5% H2O2溶液 1 mL 0.1 mol·L-1 FeCl3溶液
丙 40 ℃ 试管中加入3 mL 5% H2O2溶液 1 mL蒸馏水
【巩固练习】
(3)实验过程中该同学对实验乙中产生的气体进行收集,并在2 min内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s 20 40 60 80 100 120
气体体积/mL 实验乙 15.0 29.5 43.5 56.5 69.5 81.5
0~20 s的反应速率v1=_____ mL·s-1,100~120 s的反应速率v2=____ mL·s-1。
不考虑实验测量误差,二者速率存在差异的主要原因是_____________________
__________________________________________。
0.75
0.6
随反应的不断进行,
H2O2溶液的浓度逐渐降低,反应速率减小
解析
【巩固练习】
0~20 s的反应速率v1=0.75 mL·s-1,100~120 s的反应速率v2=0.6 mL·s-1,速率减小的原因是随反应的不断进行,H2O2溶液的浓度逐渐降低,反应速率减小。
向奋斗在一线的老师致敬
课堂小结
感谢您的观看
选择性必修一
THS
实验活动7 化学反应速率的影响因素
第六章
化学反应与能量
第二节 化学反应的速率与限度
选择性必修一
2st
【实验目的】
1.体验浓度、温度和催化剂对化学反应速率的影响。
2.理解改变反应条件可以调控化学反应的速率。
【实验原理】
1.硫代硫酸钠与硫酸的反应
硫代硫酸钠与硫酸反应会生成不溶于水的硫:Na2S2O3+H2SO4===
Na2SO4+SO2↑+S↓+H2O,反应生成的硫使溶液出现乳白色浑浊,比较浑浊现象出现所需时间的长短,可以判断该反应进行的快慢。在不同浓度和温度条件下分别进行上述反应,并比较其反应快慢,可以看出反应物浓度和温度对该反应速率的影响。
【实验原理】
2.过氧化氢分解会产生氧气,在有或无催化剂存在下进行对比实验,通过观察氧气产生的快慢可以看出催化剂对该反应速率的影响。
【实验用品】
烧杯、试管、量筒、试管架、胶头滴管、温度计、药匙、秒表。
0.1 mol/L Na2S2O3溶液、0.1 mol/L H2SO4溶液、10% H2O2
溶液、1 mol/L FeCl3溶液、MnO2粉末、蒸馏水。
方法指导
为了比较实验中溶液出现浑浊的快慢,可以先在一张白纸上用黑色记号笔在合适的位置画上粗细、深浅一致的“十”字,衬在反应容器(锥形瓶)的底部。实验以Na2S2O3和H2SO4两溶液相混合时开始计时,到溶液出现的浑浊将锥形瓶底部的“十”字完全遮盖时结束(如图)。通过比较记录反应所需时间,可以判断反应速率的大小。
实验步骤
1.探究浓度对反应速率的影响
取两个50 mL锥形瓶,编为1、2号。向1号锥形瓶中加入10 mL 0.1 mol·L-1 Na2S2O3溶液,向2号锥形瓶中加入5 mL 0.1 mol·L-1 Na2S2O3溶液和5 mL蒸馏水。
另取两支试管,各加入10 mL 0.1 mol·L-1 H2SO4溶液,然后同时将该溶液分别倒入1、2号锥形瓶中,记录反应所需的时间。
记录与结论
实验 编号 加入0.1 mol· L-1 Na2S2O3 溶液的体积 /mL 加入水 的体积 /mL 加入0.1 mol· L-1 H2SO4 溶液的体积 /mL 出现浑 浊快慢 结论
1 10 0 10
2 5 5 10 较快
较慢
在其他条件相同时,Na2S2O3的浓度越大反应速率越快
实验步骤
2.探究温度对反应速率的影响
取一个50 mL锥形瓶,编为3号,向其中加入10 mL 0.1 mol·L-1 Na2S2O3溶液,向另一支试管中加入10 mL 0.1 mol·L-1 H2SO4溶液,同时放入盛有热水的烧杯中,片刻后将锥形瓶和试管取出,将H2SO4溶液加到Na2S2O3溶液中,记录溶液的温度和反应所需的时间。
记录与结论
实验 编号 加入0.1 mol· L-1 Na2S2O3 溶液的体积 /mL 加入0.1 mol· L-1 H2SO4 溶液的体积 /mL 反应 温度 出现浑浊的快慢 结论
1 10 10 室温
2 10 10 热水 较慢
较快
在其条件相同时,升高温度,反应速率加快。
实验步骤
3.催化剂对化学反应速率的影响
向三支大小相同的试管中各加入2 mL 10% H2O2溶液,再向其中的两支试管中分别加入少量MnO2粉末和2滴1 mol·L-1 FeCl3溶液。观察、比较三支试管中气泡出现的快慢。
记录与结论
现象 结论
加入MnO2 气泡冒出速率增大 MnO2能 反应速率
加入FeCl3 气泡冒出速率增大 FeCl3能 反应速率
不加其他 试剂 有气泡冒出,较慢 无催化剂_________
加快
加快
反应较慢
实验结论
1.其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。
2.其他条件相同时,升高温度,化学反应速率增大;降低温度,化学反应速率减小。
3.催化剂可以改变化学反应速率。
【实验注意事项】
1.做对比实验时除了要对比的因素不同外,其他能影响实验结果的因素应该完全相同。
2.本实验所需要的过氧化氢的浓度不能太大,原因是浓度太大,反应太剧烈,影响现象的观察。
【问题和讨论】
提示:红热的铁和水蒸气具有较高的温度,温度越高,化学反应速率越快,反应越容易发生。
在通常情况下,铁与冷水或热水都不发生反应,但红热的铁与水蒸气则可发生反应,生成Fe3O4和H2。试从反应条件的角度思考并解释这一事实。
【巩固练习】
1.在不同浓度(c )、温度(T )条件下,蔗糖水解的瞬时速率(v )如下表。下列判断不正确的是( )
A.a= 6.00
B.同时改变反应温度和蔗糖
的浓度,v可能不变
C.b< 318.2
D.不同温度时,蔗糖浓度减
少一半所需的时间相同
D
【巩固练习】
A项,分析题表中数据可知,在同一温度下,反应的瞬时速率与浓度在数值上成正比,当T=328.2 K时,v=15c,故a=15×0.400=6.00,正确。
B项,分析题表中数据可知升高温度,水解速率增大,增大浓度,水解速率也增大,若同时增大(减小)反应物的浓度和降低(升高)反应的温度,则对反应速率的影响因素相互抵消,反应速率可能不变,正确。
C项,在物质的浓度不变时,升高温度,水解速率增大,降低温度,水解速率减小,由于在物质的浓度为0.600 mol·L-1时,温度由318.2 K变为b,反应速率减小,则b<318.2,正确。
D项,不同温度时,反应速率不相同,则蔗糖浓度减少一半所需的时间不同,错误。
【巩固练习】
2.探究温度和浓度对反应速率的影响
实验原理及方案:在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO-+5SO2-+2H+===I2+5SO2-+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
3
3
实验序号 0.01 mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL 0.01 mol·L-1 Na2SO3溶液的体积/mL 水的体积/mL 实验温度/℃ 出现蓝色的时间/s
① 5 5 V1 0
② 5 5 40 25
③ 5 V2 35 25
则V1=________mL、V2=________mL。
40
10
【巩固练习】
解析
①和②温度不同,应该是探究温度对反应速率的影响,因此浓度需相同,即溶液的总体积相同,则V1+5+5=5+5+40,得V1=40;②和③温度相同,应该是探究浓度对反应速率的影响,表中KIO3酸性溶液的体积相同,可知亚硫酸钠的浓度应不同,溶液的总体积相同,5+V2+35=5+5+40,得V2=10。
【巩固练习】
【巩固练习】
3.某实验小组学习化学反应速率后,联想到H2O2分解制备氧气,设计如下实验方案探究外界条件对反应速率的影响。
编号 温度 反应物 催化剂
甲 25 ℃ 试管中加入3 mL 5% H2O2溶液 1 mL蒸馏水
乙 25 ℃ 试管中加入3 mL 5% H2O2溶液 1 mL 0.1 mol·L-1 FeCl3溶液
丙 40 ℃ 试管中加入3 mL 5% H2O2溶液 1 mL蒸馏水
(1)实验乙中发生反应的化学方程式为________________________________。
2H2O2 ====== 2H2O+O2↑
催化剂
【巩固练习】
(2) 实验甲和实验乙的实验目的是________________________________。
实验甲和实验丙的实验目的是________________________________。
探究催化剂对反应速率的影响
探究温度对反应速率的影响
解析 由表可知实验甲和实验乙除催化剂不同外其他条件都相同,所以实验甲和实验乙是探究催化剂对反应速率的影响;实验甲和实验丙除温度不同外其他条件均相同,则实验甲和实验丙是探究温度对反应速率的影响。
编号 温度 反应物 催化剂
甲 25 ℃ 试管中加入3 mL 5% H2O2溶液 1 mL蒸馏水
乙 25 ℃ 试管中加入3 mL 5% H2O2溶液 1 mL 0.1 mol·L-1 FeCl3溶液
丙 40 ℃ 试管中加入3 mL 5% H2O2溶液 1 mL蒸馏水
【巩固练习】
(3)实验过程中该同学对实验乙中产生的气体进行收集,并在2 min内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s 20 40 60 80 100 120
气体体积/mL 实验乙 15.0 29.5 43.5 56.5 69.5 81.5
0~20 s的反应速率v1=_____ mL·s-1,100~120 s的反应速率v2=____ mL·s-1。
不考虑实验测量误差,二者速率存在差异的主要原因是_____________________
__________________________________________。
0.75
0.6
随反应的不断进行,
H2O2溶液的浓度逐渐降低,反应速率减小
解析
【巩固练习】
0~20 s的反应速率v1=0.75 mL·s-1,100~120 s的反应速率v2=0.6 mL·s-1,速率减小的原因是随反应的不断进行,H2O2溶液的浓度逐渐降低,反应速率减小。
向奋斗在一线的老师致敬
课堂小结
感谢您的观看
选择性必修一
THS
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
