1.2《离子反应——离子方程式书正误判断》(第二课时)课件(共46张PPT)
文档属性
| 名称 | 1.2《离子反应——离子方程式书正误判断》(第二课时)课件(共46张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 18.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 00:00:00 | ||
图片预览







文档简介
(共46张PPT)
离子反应
Ion reaction
化学好课堂
第二课时
第二节 离子反应
——居里夫人
复分解反应的条件
离子方程式正误判断
01
03
05
02
04
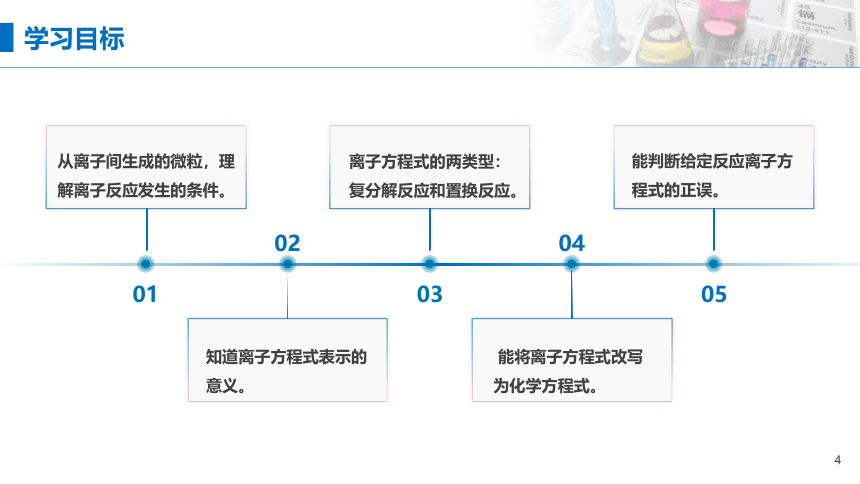
学习目标
从离子间生成的微粒,理解离子反应发生的条件。
知道离子方程式表示的意义。
离子方程式的两类型:复分解反应和置换反应。
能将离子方程式改写为化学方程式。
能判断给定反应离子方程式的正误。
复分解反应发生的条件
学习任务一
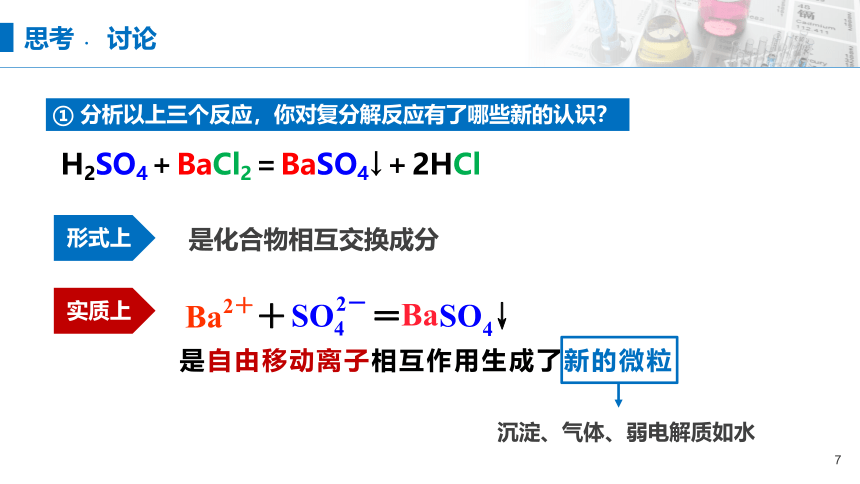
① 分析以上三个反应,你对复分解反应有了哪些新的认识?
② 你能解释复分解反应发生的条件吗?
请判断以上反应为何能发生?
思考﹒ 讨论
1.稀硫酸与氯化钡溶液
2.稀硫酸与纯碱溶液
3.稀盐酸与氢氧化钡溶液
① 分析以上三个反应,你对复分解反应有了哪些新的认识?
H2SO4+BaCl2=BaSO4↓+2HCl
是自由移动离子相互作用生成了新的微粒
沉淀、气体、弱电解质如水
思考﹒ 讨论
是化合物相互交换成分
形式上
实质上
溶液中某些离子之间发生反应——生成了
你认为硫酸钠溶液与氯化钾溶液能否发生反应?
思考﹒ 讨论
② 你能解释复分解反应发生的条件吗?
① 沉淀
② 气体
③ 弱电解质如水
新的
微粒
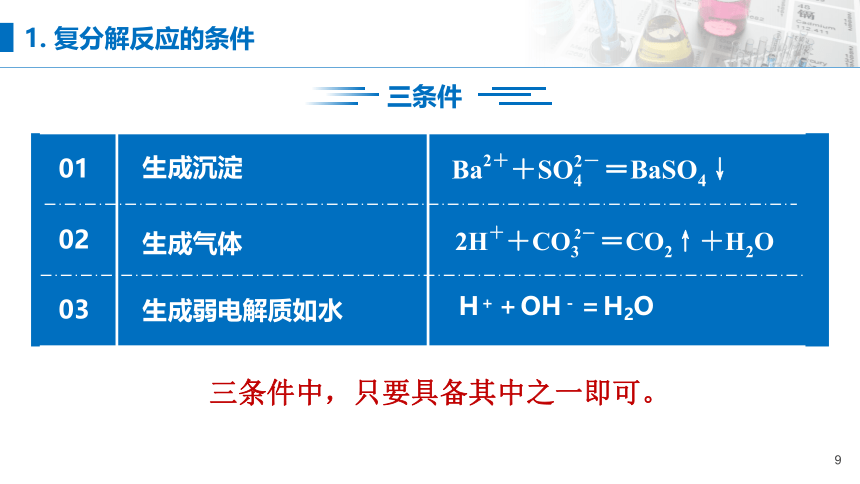
三条件
生成沉淀
生成气体
生成弱电解质如水
H++OH-=H2O
三条件中,只要具备其中之一即可。
1. 复分解反应的条件
01
02
03
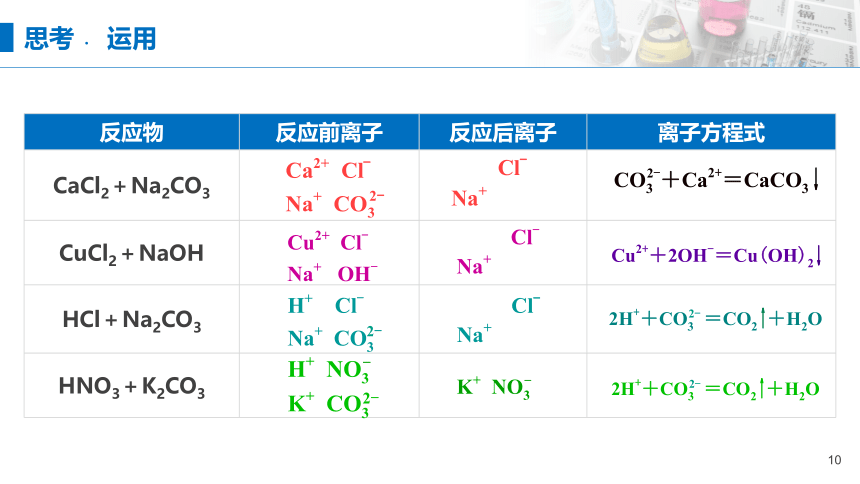
反应物 反应前离子 反应后离子 离子方程式
CaCl2+Na2CO3
CuCl2+NaOH
HCl+Na2CO3
HNO3+K2CO3
思考﹒ 运用
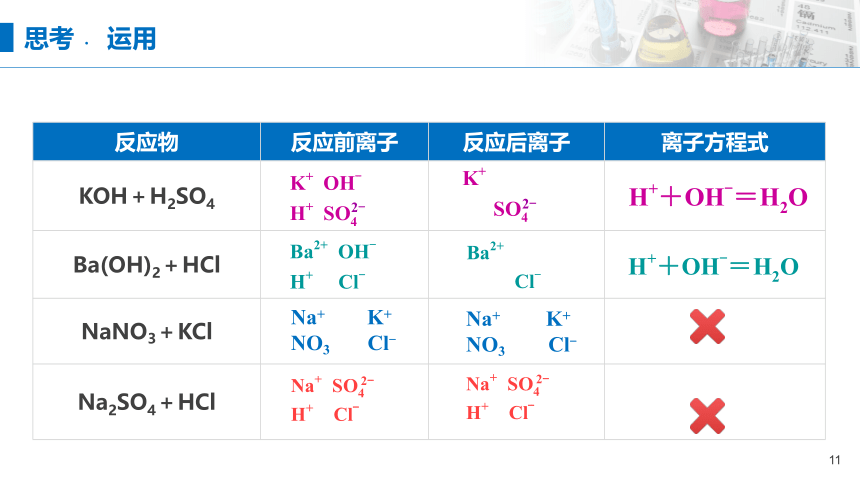
反应物 反应前离子 反应后离子 离子方程式
KOH+H2SO4
Ba(OH)2+HCl
NaNO3+KCl
Na2SO4+HCl
Na+ K+
NO3 Cl-
Na+ K+
NO3 Cl-
思考﹒ 运用
不同的反应可用同一离子方程式表示
这是为什么?
学习任务二
请写出AgNO3溶液分别与下列溶液反应的离子方程式
NaCl、KCl 、BaCl2、NH4Cl、HCl
看谁做得既准又快
2. 1 能揭示反应的实质
是何种微粒间的反应
2.离子方程式意义
2.2 不仅表示某个具体反应,还要表示同一类型的离子反应
请写出稀硫酸与氢氧化钡溶液反应的离子方程式。
感受﹒ 理解
① 滴定前氢氧化钡溶液中存在什么离子?
② 滴定前稀硫酸中存在什么离子?
③ 随硫酸加入,导电性怎样变化?此变化说明溶液中什么离子发生了什么变化?
④ 你认为硫酸和氢氧化钡反应是哪些微粒间的作用而发生的?
问题解决
Ba(OH)2 = Ba2++2OH-
H2SO4=2H++SO42-
问题解决
① 滴定前氢氧化钡溶液中存在什么离子?
② 滴定前稀硫酸中存在什么离子?
此变化说明溶液中什么离子发生了什么反应?
问题解决
③ 随硫酸加入,导电性怎样变化?
问题解决
恰好完全反应,电导率降至最低值,其值为零
请你写出反应的离子方程式
问题解决
④ 你认为硫酸和氢氧化钡反应是哪些微粒间的作用而发生的?
Ba(OH)2 = Ba2++2OH-
H2SO4=2H++SO42-
Ba2+
2H+
2OH-
BaSO4↓
2H2O
问题解决
离子方程式类型
学习任务三
化学与生活
烧水用的铝壶作用一段时间后,壶底上会形成组成为碳酸钙的水垢,可用稀盐酸或稀醋酸溶解的方法把水垢除去。
请写出水垢与稀盐酸、醋酸反应的离子方程式
CaCO3+2H+=Ca2++CO2↑ +2H2O
CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑ +2H2O
问题解决
除去水垢的反应,实验室制氢气的反应,分别属于哪种类型的反应?
请写出实验室制氢气的离子方程式。
Zn+2H+=Zn2++H2↑
CaCO3+2H+=Ca2++CO2↑+H2O
Zn+2H+=Zn2++H2↑
3.学与生活
3.1 离子方程式类型
3.2 置换反应
离子方程式的改写
学习任务四
离子反应式也可改写为化学方程式,即选定适当的试剂可实现某一类离子反应。
请思考:
对于离子方程式,哪些物质间的反应可实现以上反应
选用什么酸?
远用什么盐?
HCl、HNO3、H2SO4 、CH3COOH
Na2CO3、K2CO3、NaHCO3、CaCO3、BaCO3
请你试一试
01
02
4.1.1 离子
是强酸、强碱、可溶的盐
4.1.2 化学式
是弱电解质如水或难溶物或气体
4. 离子方程式改写为化学方程式
4.1 微粒代表的物质
H++OH-=H2O
该反应生成的盐须是可溶的!
4. 离子方程式改写为化学方程式
4.2 生成物质含义
① Cu2++2OH-=Cu(OH)2↓
② Fe2O3+6H+=2Fe3+ +3H2O
③ Fe+Cu2+=Fe2++Cu
④ CO2+2OH-=CO32-+ H2O
你学会了吗?
写出实现下列变化的化学方程式:
如何判断给定反应的离子方程式正误
学习任务五
铁与盐酸:
看谁做得既准又快
判断下列离子方程式是否正确?
5.1.1 反应能否该生成物
5.1.2 生成物在所给的环境中能否存在!
5. 离子方程式判断
5.1 查反应是否失真
判断下列离子方程式是否正确?
碳酸钙与盐酸:
看谁做得既准又快
易溶于水且易电离,即
强酸、强碱、可溶盐
氢氧化铜溶于硫酸: H++OH-=H2O
5. 离子方程式判断
5.2 查是否拆错
能拆
判断下列离子方程式是否正确?
氯气通入氯化亚铁溶液中生成氯化铁:
Cl2+2FeCl2=2FeCl3
看谁做得既准又快
5. 离子方程式判断
5.3.1 电荷守恒
5.3 查二守恒
5.3.2 质量守恒
看谁做得既准又快
判断下列离子方程式是否正确?
氢氧化钡与硫酸铁:
有的反应中,4种离子均反应!
5. 离子方程式判断
5.4 查是否漏写离子反应
看谁做得既准又快
判断下列离子方程式是否正确?
硫酸与氢氧化钡:
约分时,所有微粒必须同时进行!
5. 离子方程式判断
5.5 局部计量数不能约分
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
课堂小结
三条件
生成沉淀
生成气体
生成弱电解质如水
课堂小结
五查离子方程式判断
失真
生成物是否正确
拆分
只有可溶的强电解质可拆
守恒
电荷守恒、质量守恒
漏写
有的反应4种离子均参加
约分
局部计量数不能约分
判断以下反应的离子方程式书写是否正确
① 硫酸与氢氧化钠溶液: H++OH-=H2O
② 碳酸钠溶液和氯化钡溶液:
Na2CO3+Ba2+=BaCO3↓+2Na+
③ 碳酸钠与氢氧化钙溶液反应:CO32-+Ca2+=CaCO3↓
④ 碳酸钡与盐酸:CO32-+2H+=CO2↑+H2O
⑤硫酸铜溶液和氢氧化钡溶液混合:
Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓
×
×
5. 离子方程式判断
离子方程式的书写与判断你必须掌握!
离子反应
Ion reaction
化学好课堂
第二课时
第二节 离子反应
——居里夫人
复分解反应的条件
离子方程式正误判断
01
03
05
02
04
学习目标
从离子间生成的微粒,理解离子反应发生的条件。
知道离子方程式表示的意义。
离子方程式的两类型:复分解反应和置换反应。
能将离子方程式改写为化学方程式。
能判断给定反应离子方程式的正误。
复分解反应发生的条件
学习任务一
① 分析以上三个反应,你对复分解反应有了哪些新的认识?
② 你能解释复分解反应发生的条件吗?
请判断以上反应为何能发生?
思考﹒ 讨论
1.稀硫酸与氯化钡溶液
2.稀硫酸与纯碱溶液
3.稀盐酸与氢氧化钡溶液
① 分析以上三个反应,你对复分解反应有了哪些新的认识?
H2SO4+BaCl2=BaSO4↓+2HCl
是自由移动离子相互作用生成了新的微粒
沉淀、气体、弱电解质如水
思考﹒ 讨论
是化合物相互交换成分
形式上
实质上
溶液中某些离子之间发生反应——生成了
你认为硫酸钠溶液与氯化钾溶液能否发生反应?
思考﹒ 讨论
② 你能解释复分解反应发生的条件吗?
① 沉淀
② 气体
③ 弱电解质如水
新的
微粒
三条件
生成沉淀
生成气体
生成弱电解质如水
H++OH-=H2O
三条件中,只要具备其中之一即可。
1. 复分解反应的条件
01
02
03
反应物 反应前离子 反应后离子 离子方程式
CaCl2+Na2CO3
CuCl2+NaOH
HCl+Na2CO3
HNO3+K2CO3
思考﹒ 运用
反应物 反应前离子 反应后离子 离子方程式
KOH+H2SO4
Ba(OH)2+HCl
NaNO3+KCl
Na2SO4+HCl
Na+ K+
NO3 Cl-
Na+ K+
NO3 Cl-
思考﹒ 运用
不同的反应可用同一离子方程式表示
这是为什么?
学习任务二
请写出AgNO3溶液分别与下列溶液反应的离子方程式
NaCl、KCl 、BaCl2、NH4Cl、HCl
看谁做得既准又快
2. 1 能揭示反应的实质
是何种微粒间的反应
2.离子方程式意义
2.2 不仅表示某个具体反应,还要表示同一类型的离子反应
请写出稀硫酸与氢氧化钡溶液反应的离子方程式。
感受﹒ 理解
① 滴定前氢氧化钡溶液中存在什么离子?
② 滴定前稀硫酸中存在什么离子?
③ 随硫酸加入,导电性怎样变化?此变化说明溶液中什么离子发生了什么变化?
④ 你认为硫酸和氢氧化钡反应是哪些微粒间的作用而发生的?
问题解决
Ba(OH)2 = Ba2++2OH-
H2SO4=2H++SO42-
问题解决
① 滴定前氢氧化钡溶液中存在什么离子?
② 滴定前稀硫酸中存在什么离子?
此变化说明溶液中什么离子发生了什么反应?
问题解决
③ 随硫酸加入,导电性怎样变化?
问题解决
恰好完全反应,电导率降至最低值,其值为零
请你写出反应的离子方程式
问题解决
④ 你认为硫酸和氢氧化钡反应是哪些微粒间的作用而发生的?
Ba(OH)2 = Ba2++2OH-
H2SO4=2H++SO42-
Ba2+
2H+
2OH-
BaSO4↓
2H2O
问题解决
离子方程式类型
学习任务三
化学与生活
烧水用的铝壶作用一段时间后,壶底上会形成组成为碳酸钙的水垢,可用稀盐酸或稀醋酸溶解的方法把水垢除去。
请写出水垢与稀盐酸、醋酸反应的离子方程式
CaCO3+2H+=Ca2++CO2↑ +2H2O
CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑ +2H2O
问题解决
除去水垢的反应,实验室制氢气的反应,分别属于哪种类型的反应?
请写出实验室制氢气的离子方程式。
Zn+2H+=Zn2++H2↑
CaCO3+2H+=Ca2++CO2↑+H2O
Zn+2H+=Zn2++H2↑
3.学与生活
3.1 离子方程式类型
3.2 置换反应
离子方程式的改写
学习任务四
离子反应式也可改写为化学方程式,即选定适当的试剂可实现某一类离子反应。
请思考:
对于离子方程式,哪些物质间的反应可实现以上反应
选用什么酸?
远用什么盐?
HCl、HNO3、H2SO4 、CH3COOH
Na2CO3、K2CO3、NaHCO3、CaCO3、BaCO3
请你试一试
01
02
4.1.1 离子
是强酸、强碱、可溶的盐
4.1.2 化学式
是弱电解质如水或难溶物或气体
4. 离子方程式改写为化学方程式
4.1 微粒代表的物质
H++OH-=H2O
该反应生成的盐须是可溶的!
4. 离子方程式改写为化学方程式
4.2 生成物质含义
① Cu2++2OH-=Cu(OH)2↓
② Fe2O3+6H+=2Fe3+ +3H2O
③ Fe+Cu2+=Fe2++Cu
④ CO2+2OH-=CO32-+ H2O
你学会了吗?
写出实现下列变化的化学方程式:
如何判断给定反应的离子方程式正误
学习任务五
铁与盐酸:
看谁做得既准又快
判断下列离子方程式是否正确?
5.1.1 反应能否该生成物
5.1.2 生成物在所给的环境中能否存在!
5. 离子方程式判断
5.1 查反应是否失真
判断下列离子方程式是否正确?
碳酸钙与盐酸:
看谁做得既准又快
易溶于水且易电离,即
强酸、强碱、可溶盐
氢氧化铜溶于硫酸: H++OH-=H2O
5. 离子方程式判断
5.2 查是否拆错
能拆
判断下列离子方程式是否正确?
氯气通入氯化亚铁溶液中生成氯化铁:
Cl2+2FeCl2=2FeCl3
看谁做得既准又快
5. 离子方程式判断
5.3.1 电荷守恒
5.3 查二守恒
5.3.2 质量守恒
看谁做得既准又快
判断下列离子方程式是否正确?
氢氧化钡与硫酸铁:
有的反应中,4种离子均反应!
5. 离子方程式判断
5.4 查是否漏写离子反应
看谁做得既准又快
判断下列离子方程式是否正确?
硫酸与氢氧化钡:
约分时,所有微粒必须同时进行!
5. 离子方程式判断
5.5 局部计量数不能约分
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
课堂小结
三条件
生成沉淀
生成气体
生成弱电解质如水
课堂小结
五查离子方程式判断
失真
生成物是否正确
拆分
只有可溶的强电解质可拆
守恒
电荷守恒、质量守恒
漏写
有的反应4种离子均参加
约分
局部计量数不能约分
判断以下反应的离子方程式书写是否正确
① 硫酸与氢氧化钠溶液: H++OH-=H2O
② 碳酸钠溶液和氯化钡溶液:
Na2CO3+Ba2+=BaCO3↓+2Na+
③ 碳酸钠与氢氧化钙溶液反应:CO32-+Ca2+=CaCO3↓
④ 碳酸钡与盐酸:CO32-+2H+=CO2↑+H2O
⑤硫酸铜溶液和氢氧化钡溶液混合:
Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓
×
×
5. 离子方程式判断
离子方程式的书写与判断你必须掌握!
