1.2《离子反应——电解质与非电解质 强弱电解质》(第一课时)课件(共62张PPT)
文档属性
| 名称 | 1.2《离子反应——电解质与非电解质 强弱电解质》(第一课时)课件(共62张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 23.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 17:50:32 | ||
图片预览








文档简介
(共62张PPT)
电解质与非电解质
Electrolyte and non-electrolyte
第二课时
第二节 离子反应
01
02
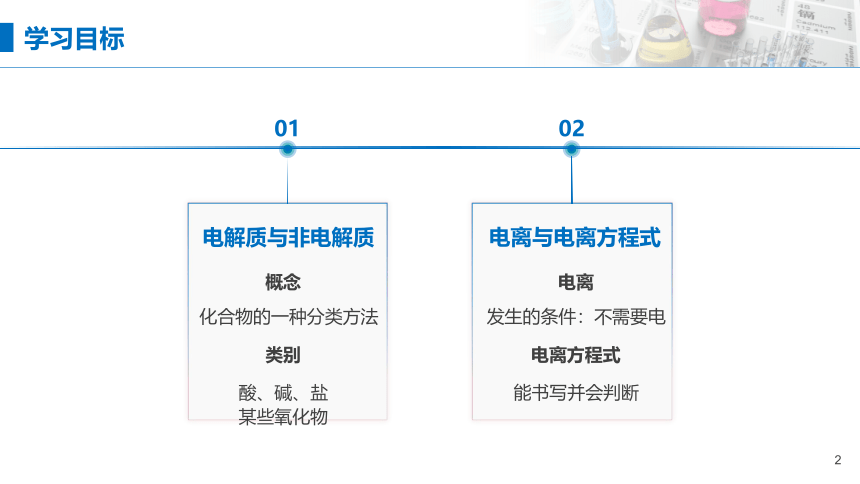
学习目标
电解质与非电解质
电离与电离方程式
概念
类别
酸、碱、盐
某些氧化物
电离
电离方程式
发生的条件:不需要电
能书写并会判断
化合物的一种分类方法
哪些物质能导电?
电解质
化学趣史
物质的导电与电解质、非电解质关系
01
铜在日常生活中可以用作导线,原因是什么?
通常情况下金属内部电子的运动是不固定的,但在外加电场的作用下会定向移动形成电流。
交流与研讨
氯化钠固体是由什么微粒构成的?它能导电吗?
氯化钠晶体
交流与研讨
灯泡不亮
NaCl
关闭电键
灯泡不亮
KNO3
关闭电键
灯泡不亮
H2O
关闭电键
实验探究
灯泡不亮
NaCl
关闭电键
向氯化钠
固体中加水
食盐水
关闭电键
灯泡明亮
试从微粒变化的角度,解释导电原因
NaCl改为KNO3如何
实验探究
实验探究
要想使紧密排列的Na+和Cl-能够自由移动,还有什么方法能克服两种离子间的静电作用?
无自由
移动离子
有自由
移动离子
有自由
移动离子
资料在线
食盐
蔗糖
构成物质的微粒除原子、离子外,还有分子。
由分子构成的物质,溶于水是否导电?
问题解决
从物质导电角度,你能否将其进行分类?
观察与思考
1.1 电解质
1.1.1 概念
条件
现象
类别
1.1.2 类别
CH3COOH、H2CO3
1. 电解质与非电解质
金属氧化物
在水溶液中或熔融状态下能导电的化合物
必须是化合物
能导电的物质不一定是电解质
导电条件
水溶液或熔融液
电解质不一定能导电
1.1 电解质
1. 电解质与非电解质
1.1.3 易错点
某些氧化物:CO2 SO2
某些氢化物:CH4 NH3
少数有机物:CH3CH2OH 蔗糖
1. 电解质与非电解质
1.2 非电解质
1.2.1 概念
条件
现象
类别
在水溶液中或熔融状态下不导电的化合物
1.2.2 类别
1. Cu能导电,所以Cu是电解质
×
单质既不是电解质,也不是非电解质
2. NaCl溶液导电,所以NaCl溶液是电解质
×
NaCl溶液,是混合物,不是电解质
3. 固体NaCl不导电,但NaCl是电解质
概念辨析
1. 能导电的物质一定是电解质吗?
不一定。
如Cu不是电解质,Cu为单质;NaCl溶液是混合物不是电解质。
2. 电解质一定导电吗?
不一定。
NaCl固体不导电,而熔融的NaCl却是导电的!
概念辨析
A.铝
B.石墨
C.熔融的氯化钾
D.硫酸溶液
电解质在水溶液中为何会导电?其过程如何表示?
考考自己
下列物质中,能导电且属于电解质的是
电离
02
阿伦尼乌斯在做了大量实验后,静静地躺在床上 ,顺着这个思路住下想:
“纯净的水不导电,纯净的固体食盐也不导电,把食盐溶解到水里,盐水就导电了。水在这里起了什么用?”
英国科学家法拉第1834年提出的一个观点:“只有在通电的条件下,电解质才会分解为带电的离子。”
阿伦尼乌斯坐起来,决定把这个问题搞清楚。 他想起——
是不是食盐溶解在水里就电离成为氯离子和钠离子了呢 这是一个非常大胆的设想!
化学史话
NaCl的水溶液为何会导电?
食盐溶解在水里就电离
因为法拉第认为:“只有电流才能产生离子。”可是现在食盐溶解在水里就能产生离子,与法拉第的观点不一样。
不要小看法拉第这个人,虽然1867年他已经去世了,但是他对物理上的一些观点在当时还是金科玉律。
1883年5月,阿伦尼乌斯带着论文回到乌普萨拉大学,向化学教授克莱夫请教。阿伦尼乌斯向他详细地解释了电离理论。
克莱夫听到阿累尼乌斯的解释,毫不掩饰他的不满,只说了一句:“这个理论纯粹是空想,我无法相信。”,说阿累尼乌斯的论点纯粹是胡说八道。
克莱夫是一位很有名望的实验化学家,他已经发现了两种化学元素:钬和铥。
化学史话
阿伦尼乌斯小心翼翼地准备着他的论文,既要坚持自己的观点,又不能过分与传统的理论对抗。
4小时的答辩终于过去了,阿伦尼乌斯如坐针毡,因为阿伦尼乌斯的材料和数据都很充分,教授们又查看了他大学读书时所有的成绩,他的生物学、物理学和数学的考试成绩都非常好,答辩委员会认为虽然论文不是很好,但仍然可以以“及格”的三等成绩“勉强获得博士学位”。
后来,在在奥斯特瓦尔德和范特霍夫的支持和帮助下,阿伦尼乌斯终于结束了电离理论的争端。
1903年因提出电离学说而荣获诺贝尔化学奖
(全世界第三位获得化学奖)
三分与五分
电解质的电离
NaCI加入水中
水分子与NaCI晶体作用
NaCI溶解并电离
蔗糖溶解的微观过程
蔗糖
分子
水分子
电解质在
水溶液中
或
熔融状态下
产生
自由移动的离子过程
2. 电离
2.1 概念
1.2.1 概念
水
熔融
电解质的电离,不需通电!
2. 电离
2.2 易错点
1.2.1 概念
1. CO2的水溶液导电,它是电解质吗?
不是。
CO2的水溶液能导电,是因为它们和水反应生成的电解质H2CO3发生电离,CO2本身不会电离,不属于电解质。
2. BaSO4的水溶液不导电,但是BaSO4是电解质
BaSO4=Ba2++SO42-
电解质与溶解度大小无关!
考考你自己
A. HCl→CO2→石墨→液氧
B. NaCl→乙醇→铁→空气
C. CuSO4 →蔗糖→氮气→生石灰
D. KCl→NaNO3→铜→碘酒
考考你自己
下列各物质按照电解质→非电解质→单质→混合物顺序排列的是
电离方程式
03
NaCI加入水中
水分子与NaCI晶体作用
NaCI溶解并电离
完全电离
电离方程式
问题解决
电解质的电离如何表示?
3. 电离方程式
3.1 概念
在水溶液中或熔融状态下,电离成自由移动离子的式子。
“=”的左边是电解质的化学式,右边是电离出的离子符号
3. 电离方程式
3.2 书写
法拉第将溶液中离子的来源归结于电流的作用。
拉乌尔由“盐溶液的凝固点下降值比同浓度的非电解质溶液高”的事实提出“盐电离不需要电流作用”,但这并未撼动法拉第的权威。
英国化学家尼科尔森和卡里斯尔在电解水后,认为水溶液中存在离子。
真正向旧观念提出挑战的是阿伦尼乌斯,他在完成了大量的实验后,与了“电解质的导电性研究”一文,提出电解质在水溶液中自发解离为正负离子,并用电离理论理论很好解释了沸点升高和凝固点下降的实验现象。
易错警示
通电
考考你的智慧
判断离子方程式书写是否正确:
3.2.1 正确书写离子符号
如镁离子是Mg2+,而不能写成Mg+2。
3. 电离方程式
3.2 书写
判断离子方程式书写是否正确
考考你的智慧
如镁离子是Mg2+,而不能写成Mg+2。
质量守恒
电离前后原子或离子个数相等
3. 电离方程式
3.2 注意点
3.2.1 正确书写离子符号
3.2.2 注意二守恒
考考你的智慧
3.2 注意点
判断离子方程式书写是否正确:
如镁离子是Mg2+,而不能写成Mg+2。
质量守恒
电离前后原子或离子个数相等
3.2.1 正确书写离子符号
3.2.2 注意二守恒
电荷守恒
右边阴、阳离子所带电荷总数相等
考考你的智慧
3.2 注意点
考考你的智慧
判断离子方程式书写是否正确:
如镁离子是Mg2+,而不能写成Mg+2。
质量守恒
电离前后原子或离子个数相等
3.2.1 正确书写离子符号
3.2.2 注意二守恒
电荷守恒
右边阴、阳离子所带电荷总数相等
考考你的智慧
3.2 注意点
有的原子团不能拆开写
不能写成
可拆为
① HCl、H2SO4、HNO3
② NaOH、KOH、Ca(OH)2
③ FeCl3、Na2SO4、NH4NO3
学以致用
写出下列物质的电离方程式
酸:电离时生成的阳离子全部是氢离子(H+)的化合物
碱:电离时生成的阴离子全部是氢氧根离子(OH-)的化合物
盐:电离时生成金属阳离子(包括NH4+)和酸根阴离子的化合物
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
NaOH = Na+ + OH-
KOH = K+ + OH-
Ca(OH)2= Ca2+ + 2OH-
FeCl3 = Fe3+ + 3Cl-
Na2SO4 = 2Na+ + SO42-
NH4NO3 = NH4+ + NO3-
3.电离方程式
3.3 从电离的角度理解酸、碱、盐
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
物质
混合物
纯净物
单质
化合物
电解质
酸
碱
盐
氧化物
课堂小结
电解质
在水溶液或熔融状态下,均能导电
在水溶液或熔融状态下,本身能电离
本质
现象
课堂小结
电解质
三要点
本质
条件
现象
类别
水溶液或熔融状态
导电
化合物
自身能否电离出离子
分类 电解质 非电解质
相同点 均为化合物 不同点 水溶液或熔融状态能导电 水溶液和熔融状态都不能导电
本质 区别 在水溶液里或熔融状态下自身能发生电离 在水溶液里和熔融状态下自身均不能发生电离
所含物 质类型 酸、碱、盐、活泼金属氧化物 非金属氧化物
非酸性气态氢化物
大多数有机物
课堂小结
常见的
非电解质
酸: HCl、HNO3、H2SO4 、H2CO3 等
碱: NaOH、KOH、NH3·H2O等
盐: NaCl、 AgNO3、BaSO4等
活泼金属的氧化物:Na2O、MgO、CaO等
水
非金属氧化物:CO、 CO2、SO3 等
非酸性气态氢化物: NH3等
部分有机化合物:CH4、蔗糖、酒精等
单质和混合物既不是电解质也不是非电解质
课堂小结
常见的
电解质
物质导电的原因
金属单质导电
有自由移动的电子
酸碱盐等电解质溶液导电(例:NaCl溶液 、NaOH溶液、稀硫酸 )
有自由移动的水合离子
课堂小结
盐中部分电解质溶化时导电(例: NaCl溶液、 KNO3固体 )
有自由移动的电子
非电解质形成的溶液(例:酒精溶液、蔗糖溶液)
没有自由移动的离子
1. 能导电的物质一定是电解质吗?
不一定。
如金属、石墨是单质,不是电解质。NaCl溶液导电,但NaCl溶液不是电解质。
2. 电解质本身一定导电吗?
不一定。如食盐晶体是电解质,但本身不导电。
电解质
水
熔融
电离
离子
定向移动
导电
自由移动
3. 溶于水能导电的化合物一定是电解质吗?
不一定。如SO3溶于水生成了H2SO4,SO3本身不会发生电离,SO3不是电解质。
考考你的智慧
A.H2SO4=H++SO42-
B.Fe2(SO4)3=2Fe2++3SO42 -
C.Ba(OH)2=Ba2++2OH-
D.K2CO3=2K++CO3-2
考考你的智慧
下列电离方程式正确的是
现有以下物质:
①NaCl晶体;②NaCl溶液 ; ③石墨;④汞;
⑤MgO;⑥酒精;⑦液态CO2 ;⑧熔融BaSO4
请回答下列问题(填相应的序号)。
考考你的智慧
(1)能导电的是
(2)属于电解质的是
导电物质:
①自由电子
②自由移动离子
考考你的智慧
现有以下物质:
①NaCl晶体;②NaCl溶液 ; ③石墨;④汞;
⑤MgO;⑥酒精;⑦液态CO2 ;⑧熔融BaSO4
(1)能导电的是
① 酸
② 碱
③ 盐
④ 氧化物
考考你的智慧
现有以下物质:
①NaCl晶体;②NaCl溶液 ; ③石墨;④汞;
⑤MgO;⑥酒精;⑦液态CO2 ;⑧熔融BaSO4
(2)属于电解质的是
金属
石墨
电解质溶于水
电解质熔融
均不是电解质
特别提醒
物质导电
自由电子
自由移动
离子
A.2种 B.3种
C.4种 D.5种
例题
在某溶液中有K+、H+、SO42-、NO3-,则溶液中溶质的种类最多为
A. NaOH固体溶于水后可以导电,所以NaOH是电解质
B. CO2的水溶液可以导电,所以CO2是电解质
C.液态的汞导电性良好,所以汞是电解质
D.FeCl3溶液能够导电,所以FeCl3溶液是电解质
成功体验
下列有关电解质说法正确的是
A.NaCl
B.H2SO4
C.Na2SO4
D.无水乙醇
考考你的智慧
下列化合物中,只有在水溶液中才能导电的电解质是
按要求找出一至二种物质。
①水溶液能导电,液态不能导电的化合物
HNO3、H2SO4
②溶于水,水溶液及熔融液能导电的化合物
NaCl、KNO3
③不溶于水,熔融液能导电的化合物
④液态不导电,溶于水能导电的化合物
AgCl、BaSO4
CO2、SO3
挑战自我
感谢观看
电解质与非电解质
Electrolyte and non-electrolyte
第二课时
第二节 离子反应
01
02
学习目标
电解质与非电解质
电离与电离方程式
概念
类别
酸、碱、盐
某些氧化物
电离
电离方程式
发生的条件:不需要电
能书写并会判断
化合物的一种分类方法
哪些物质能导电?
电解质
化学趣史
物质的导电与电解质、非电解质关系
01
铜在日常生活中可以用作导线,原因是什么?
通常情况下金属内部电子的运动是不固定的,但在外加电场的作用下会定向移动形成电流。
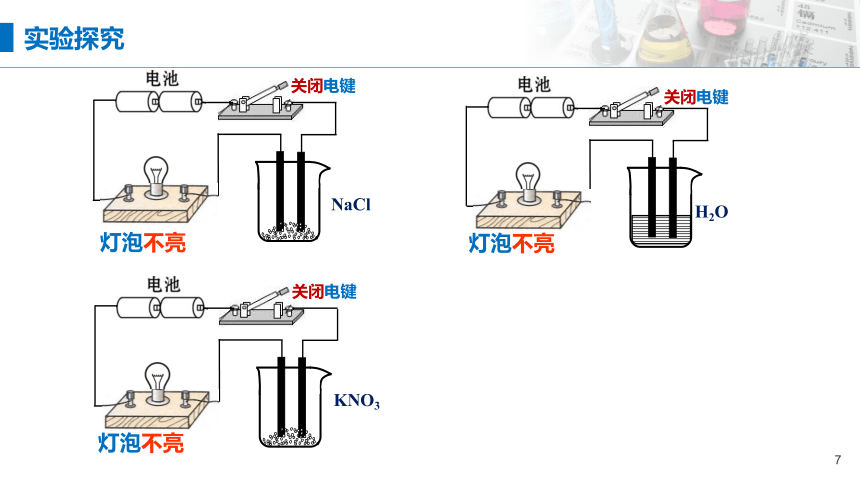
交流与研讨
氯化钠固体是由什么微粒构成的?它能导电吗?
氯化钠晶体
交流与研讨
灯泡不亮
NaCl
关闭电键
灯泡不亮
KNO3
关闭电键
灯泡不亮
H2O
关闭电键
实验探究
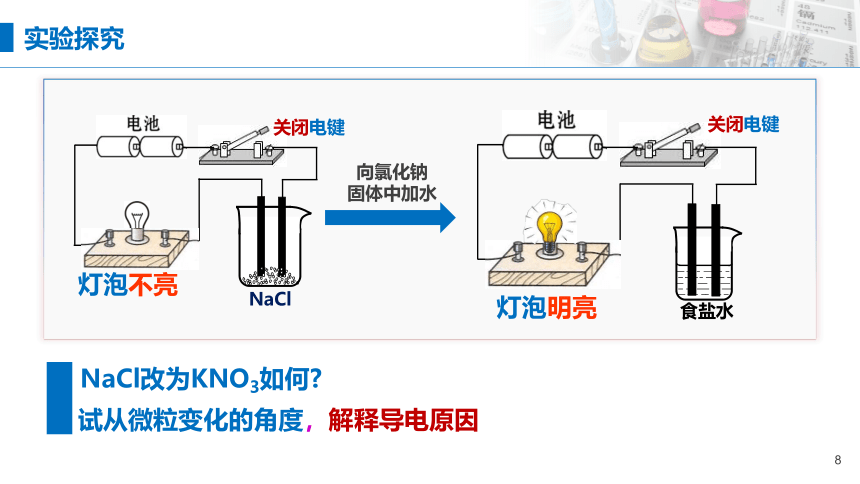
灯泡不亮
NaCl
关闭电键
向氯化钠
固体中加水
食盐水
关闭电键
灯泡明亮
试从微粒变化的角度,解释导电原因
NaCl改为KNO3如何
实验探究
实验探究
要想使紧密排列的Na+和Cl-能够自由移动,还有什么方法能克服两种离子间的静电作用?
无自由
移动离子
有自由
移动离子
有自由
移动离子
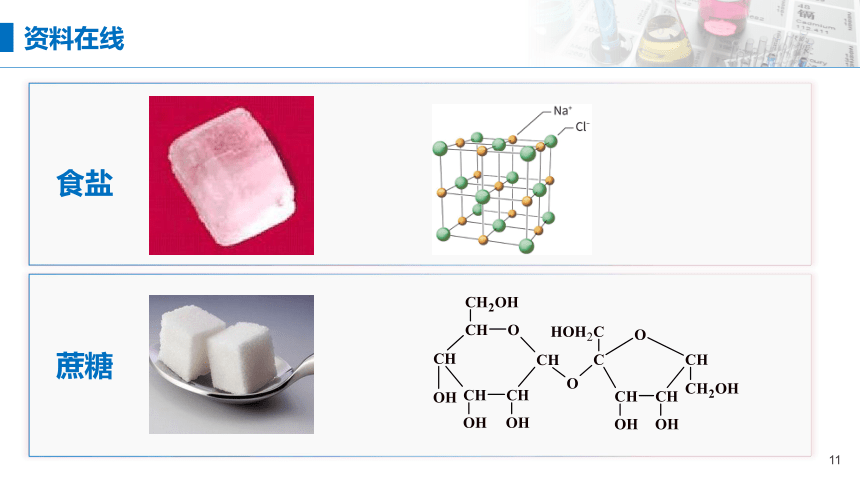
资料在线
食盐
蔗糖
构成物质的微粒除原子、离子外,还有分子。
由分子构成的物质,溶于水是否导电?
问题解决
从物质导电角度,你能否将其进行分类?
观察与思考
1.1 电解质
1.1.1 概念
条件
现象
类别
1.1.2 类别
CH3COOH、H2CO3
1. 电解质与非电解质
金属氧化物
在水溶液中或熔融状态下能导电的化合物
必须是化合物
能导电的物质不一定是电解质
导电条件
水溶液或熔融液
电解质不一定能导电
1.1 电解质
1. 电解质与非电解质
1.1.3 易错点
某些氧化物:CO2 SO2
某些氢化物:CH4 NH3
少数有机物:CH3CH2OH 蔗糖
1. 电解质与非电解质
1.2 非电解质
1.2.1 概念
条件
现象
类别
在水溶液中或熔融状态下不导电的化合物
1.2.2 类别
1. Cu能导电,所以Cu是电解质
×
单质既不是电解质,也不是非电解质
2. NaCl溶液导电,所以NaCl溶液是电解质
×
NaCl溶液,是混合物,不是电解质
3. 固体NaCl不导电,但NaCl是电解质
概念辨析
1. 能导电的物质一定是电解质吗?
不一定。
如Cu不是电解质,Cu为单质;NaCl溶液是混合物不是电解质。
2. 电解质一定导电吗?
不一定。
NaCl固体不导电,而熔融的NaCl却是导电的!
概念辨析
A.铝
B.石墨
C.熔融的氯化钾
D.硫酸溶液
电解质在水溶液中为何会导电?其过程如何表示?
考考自己
下列物质中,能导电且属于电解质的是
电离
02
阿伦尼乌斯在做了大量实验后,静静地躺在床上 ,顺着这个思路住下想:
“纯净的水不导电,纯净的固体食盐也不导电,把食盐溶解到水里,盐水就导电了。水在这里起了什么用?”
英国科学家法拉第1834年提出的一个观点:“只有在通电的条件下,电解质才会分解为带电的离子。”
阿伦尼乌斯坐起来,决定把这个问题搞清楚。 他想起——
是不是食盐溶解在水里就电离成为氯离子和钠离子了呢 这是一个非常大胆的设想!
化学史话
NaCl的水溶液为何会导电?
食盐溶解在水里就电离
因为法拉第认为:“只有电流才能产生离子。”可是现在食盐溶解在水里就能产生离子,与法拉第的观点不一样。
不要小看法拉第这个人,虽然1867年他已经去世了,但是他对物理上的一些观点在当时还是金科玉律。
1883年5月,阿伦尼乌斯带着论文回到乌普萨拉大学,向化学教授克莱夫请教。阿伦尼乌斯向他详细地解释了电离理论。
克莱夫听到阿累尼乌斯的解释,毫不掩饰他的不满,只说了一句:“这个理论纯粹是空想,我无法相信。”,说阿累尼乌斯的论点纯粹是胡说八道。
克莱夫是一位很有名望的实验化学家,他已经发现了两种化学元素:钬和铥。
化学史话
阿伦尼乌斯小心翼翼地准备着他的论文,既要坚持自己的观点,又不能过分与传统的理论对抗。
4小时的答辩终于过去了,阿伦尼乌斯如坐针毡,因为阿伦尼乌斯的材料和数据都很充分,教授们又查看了他大学读书时所有的成绩,他的生物学、物理学和数学的考试成绩都非常好,答辩委员会认为虽然论文不是很好,但仍然可以以“及格”的三等成绩“勉强获得博士学位”。
后来,在在奥斯特瓦尔德和范特霍夫的支持和帮助下,阿伦尼乌斯终于结束了电离理论的争端。
1903年因提出电离学说而荣获诺贝尔化学奖
(全世界第三位获得化学奖)
三分与五分
电解质的电离
NaCI加入水中
水分子与NaCI晶体作用
NaCI溶解并电离
蔗糖溶解的微观过程
蔗糖
分子
水分子
电解质在
水溶液中
或
熔融状态下
产生
自由移动的离子过程
2. 电离
2.1 概念
1.2.1 概念
水
熔融
电解质的电离,不需通电!
2. 电离
2.2 易错点
1.2.1 概念
1. CO2的水溶液导电,它是电解质吗?
不是。
CO2的水溶液能导电,是因为它们和水反应生成的电解质H2CO3发生电离,CO2本身不会电离,不属于电解质。
2. BaSO4的水溶液不导电,但是BaSO4是电解质
BaSO4=Ba2++SO42-
电解质与溶解度大小无关!
考考你自己
A. HCl→CO2→石墨→液氧
B. NaCl→乙醇→铁→空气
C. CuSO4 →蔗糖→氮气→生石灰
D. KCl→NaNO3→铜→碘酒
考考你自己
下列各物质按照电解质→非电解质→单质→混合物顺序排列的是
电离方程式
03
NaCI加入水中
水分子与NaCI晶体作用
NaCI溶解并电离
完全电离
电离方程式
问题解决
电解质的电离如何表示?
3. 电离方程式
3.1 概念
在水溶液中或熔融状态下,电离成自由移动离子的式子。
“=”的左边是电解质的化学式,右边是电离出的离子符号
3. 电离方程式
3.2 书写
法拉第将溶液中离子的来源归结于电流的作用。
拉乌尔由“盐溶液的凝固点下降值比同浓度的非电解质溶液高”的事实提出“盐电离不需要电流作用”,但这并未撼动法拉第的权威。
英国化学家尼科尔森和卡里斯尔在电解水后,认为水溶液中存在离子。
真正向旧观念提出挑战的是阿伦尼乌斯,他在完成了大量的实验后,与了“电解质的导电性研究”一文,提出电解质在水溶液中自发解离为正负离子,并用电离理论理论很好解释了沸点升高和凝固点下降的实验现象。
易错警示
通电
考考你的智慧
判断离子方程式书写是否正确:
3.2.1 正确书写离子符号
如镁离子是Mg2+,而不能写成Mg+2。
3. 电离方程式
3.2 书写
判断离子方程式书写是否正确
考考你的智慧
如镁离子是Mg2+,而不能写成Mg+2。
质量守恒
电离前后原子或离子个数相等
3. 电离方程式
3.2 注意点
3.2.1 正确书写离子符号
3.2.2 注意二守恒
考考你的智慧
3.2 注意点
判断离子方程式书写是否正确:
如镁离子是Mg2+,而不能写成Mg+2。
质量守恒
电离前后原子或离子个数相等
3.2.1 正确书写离子符号
3.2.2 注意二守恒
电荷守恒
右边阴、阳离子所带电荷总数相等
考考你的智慧
3.2 注意点
考考你的智慧
判断离子方程式书写是否正确:
如镁离子是Mg2+,而不能写成Mg+2。
质量守恒
电离前后原子或离子个数相等
3.2.1 正确书写离子符号
3.2.2 注意二守恒
电荷守恒
右边阴、阳离子所带电荷总数相等
考考你的智慧
3.2 注意点
有的原子团不能拆开写
不能写成
可拆为
① HCl、H2SO4、HNO3
② NaOH、KOH、Ca(OH)2
③ FeCl3、Na2SO4、NH4NO3
学以致用
写出下列物质的电离方程式
酸:电离时生成的阳离子全部是氢离子(H+)的化合物
碱:电离时生成的阴离子全部是氢氧根离子(OH-)的化合物
盐:电离时生成金属阳离子(包括NH4+)和酸根阴离子的化合物
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
NaOH = Na+ + OH-
KOH = K+ + OH-
Ca(OH)2= Ca2+ + 2OH-
FeCl3 = Fe3+ + 3Cl-
Na2SO4 = 2Na+ + SO42-
NH4NO3 = NH4+ + NO3-
3.电离方程式
3.3 从电离的角度理解酸、碱、盐
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
物质
混合物
纯净物
单质
化合物
电解质
酸
碱
盐
氧化物
课堂小结
电解质
在水溶液或熔融状态下,均能导电
在水溶液或熔融状态下,本身能电离
本质
现象
课堂小结
电解质
三要点
本质
条件
现象
类别
水溶液或熔融状态
导电
化合物
自身能否电离出离子
分类 电解质 非电解质
相同点 均为化合物 不同点 水溶液或熔融状态能导电 水溶液和熔融状态都不能导电
本质 区别 在水溶液里或熔融状态下自身能发生电离 在水溶液里和熔融状态下自身均不能发生电离
所含物 质类型 酸、碱、盐、活泼金属氧化物 非金属氧化物
非酸性气态氢化物
大多数有机物
课堂小结
常见的
非电解质
酸: HCl、HNO3、H2SO4 、H2CO3 等
碱: NaOH、KOH、NH3·H2O等
盐: NaCl、 AgNO3、BaSO4等
活泼金属的氧化物:Na2O、MgO、CaO等
水
非金属氧化物:CO、 CO2、SO3 等
非酸性气态氢化物: NH3等
部分有机化合物:CH4、蔗糖、酒精等
单质和混合物既不是电解质也不是非电解质
课堂小结
常见的
电解质
物质导电的原因
金属单质导电
有自由移动的电子
酸碱盐等电解质溶液导电(例:NaCl溶液 、NaOH溶液、稀硫酸 )
有自由移动的水合离子
课堂小结
盐中部分电解质溶化时导电(例: NaCl溶液、 KNO3固体 )
有自由移动的电子
非电解质形成的溶液(例:酒精溶液、蔗糖溶液)
没有自由移动的离子
1. 能导电的物质一定是电解质吗?
不一定。
如金属、石墨是单质,不是电解质。NaCl溶液导电,但NaCl溶液不是电解质。
2. 电解质本身一定导电吗?
不一定。如食盐晶体是电解质,但本身不导电。
电解质
水
熔融
电离
离子
定向移动
导电
自由移动
3. 溶于水能导电的化合物一定是电解质吗?
不一定。如SO3溶于水生成了H2SO4,SO3本身不会发生电离,SO3不是电解质。
考考你的智慧
A.H2SO4=H++SO42-
B.Fe2(SO4)3=2Fe2++3SO42 -
C.Ba(OH)2=Ba2++2OH-
D.K2CO3=2K++CO3-2
考考你的智慧
下列电离方程式正确的是
现有以下物质:
①NaCl晶体;②NaCl溶液 ; ③石墨;④汞;
⑤MgO;⑥酒精;⑦液态CO2 ;⑧熔融BaSO4
请回答下列问题(填相应的序号)。
考考你的智慧
(1)能导电的是
(2)属于电解质的是
导电物质:
①自由电子
②自由移动离子
考考你的智慧
现有以下物质:
①NaCl晶体;②NaCl溶液 ; ③石墨;④汞;
⑤MgO;⑥酒精;⑦液态CO2 ;⑧熔融BaSO4
(1)能导电的是
① 酸
② 碱
③ 盐
④ 氧化物
考考你的智慧
现有以下物质:
①NaCl晶体;②NaCl溶液 ; ③石墨;④汞;
⑤MgO;⑥酒精;⑦液态CO2 ;⑧熔融BaSO4
(2)属于电解质的是
金属
石墨
电解质溶于水
电解质熔融
均不是电解质
特别提醒
物质导电
自由电子
自由移动
离子
A.2种 B.3种
C.4种 D.5种
例题
在某溶液中有K+、H+、SO42-、NO3-,则溶液中溶质的种类最多为
A. NaOH固体溶于水后可以导电,所以NaOH是电解质
B. CO2的水溶液可以导电,所以CO2是电解质
C.液态的汞导电性良好,所以汞是电解质
D.FeCl3溶液能够导电,所以FeCl3溶液是电解质
成功体验
下列有关电解质说法正确的是
A.NaCl
B.H2SO4
C.Na2SO4
D.无水乙醇
考考你的智慧
下列化合物中,只有在水溶液中才能导电的电解质是
按要求找出一至二种物质。
①水溶液能导电,液态不能导电的化合物
HNO3、H2SO4
②溶于水,水溶液及熔融液能导电的化合物
NaCl、KNO3
③不溶于水,熔融液能导电的化合物
④液态不导电,溶于水能导电的化合物
AgCl、BaSO4
CO2、SO3
挑战自我
感谢观看
