2.2《氯及其化合物——氯气的制备》(第三课时)课件(共52张PPT)
文档属性
| 名称 | 2.2《氯及其化合物——氯气的制备》(第三课时)课件(共52张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 16.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 17:52:15 | ||
图片预览







文档简介
(共52张PPT)
世间最大的快乐,莫过于发现世人从未见过的新物质。
——舍勒
化学与生活
谁知道氯气还有哪些应用?
Preparation of chlorine gas
第三课时
第二章 第二节
氯气的制备
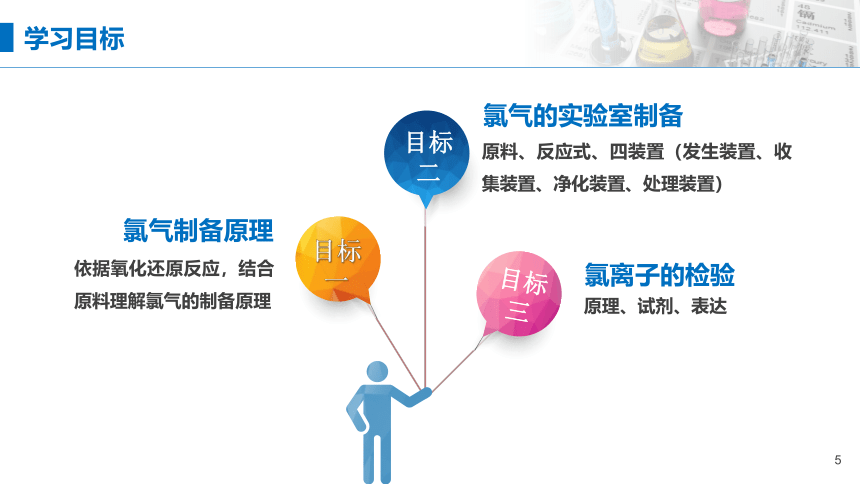
目标一
氯气制备原理
目标二
目标三
依据氧化还原反应,结合原料理解氯气的制备原理
氯气的实验室制备
原料、反应式、四装置(发生装置、收集装置、净化装置、处理装置)
氯离子的检验
原理、试剂、表达
学习目标
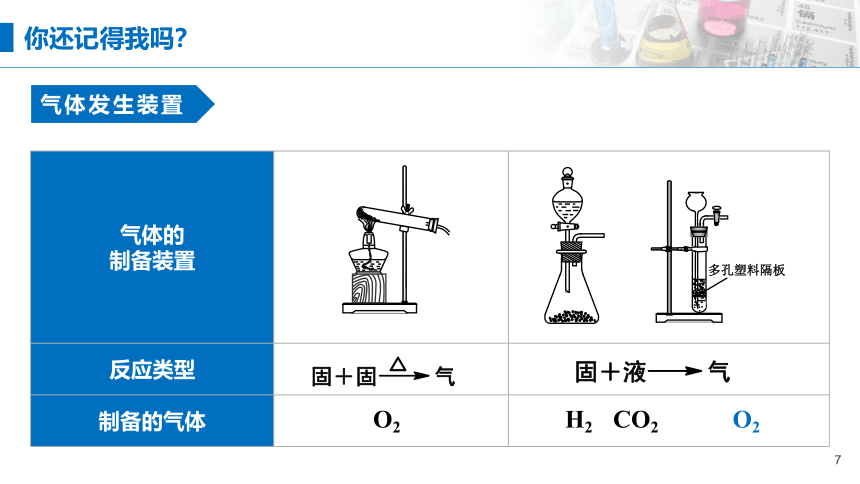
写出实验室制备O2、H2、CO2的化学方程式。
CaCO3+2HCl=CaCl2+H2O+CO2↑
Zn+H2SO4=ZnSO4+H2↑
你还记得我吗?
气体的 制备装置
反应类型
制备的气体
O2
H2 CO2
O2
你还记得我吗?
气体发生装置
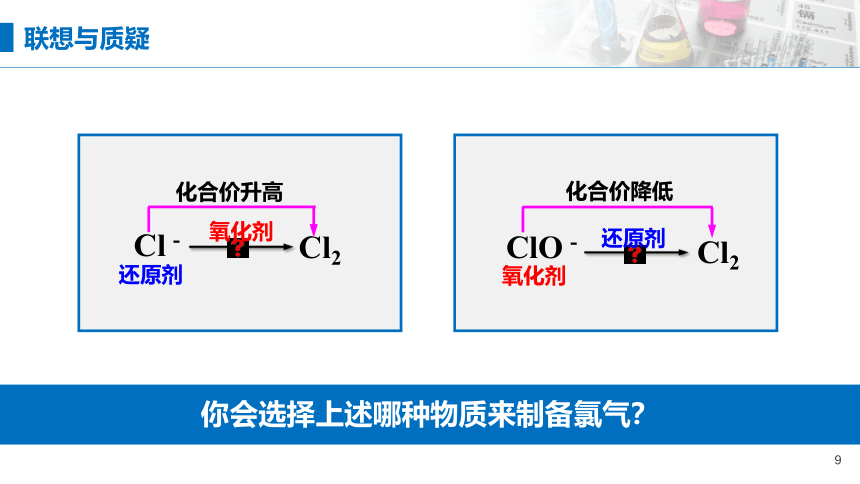
如用上述制备氯气,是利用什么原理?
问题探究
说说你所知道的含氯的物质?
Cl-
Cl2
ClO-
化合价升高
还原剂
氧化剂
Cl2
化合价降低
氧化剂
还原剂
你会选择上述哪种物质来制备氯气?
联想与质疑
氯气的实验制备
01
化学史话
舍勒经过3年功夫,确定它是一种新金属的氧化物 (MnO2)。
18世纪的后期由于冶金工业的发展,开展了对各种矿石的研究。其中有一种叫软锰矿。
他将软锰矿与浓盐酸混合并加热,立即冒出一种令人窒息的黄绿色气体
这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。
世间最大的快乐,莫过于发现世人从未见过的新物质。
——舍勒
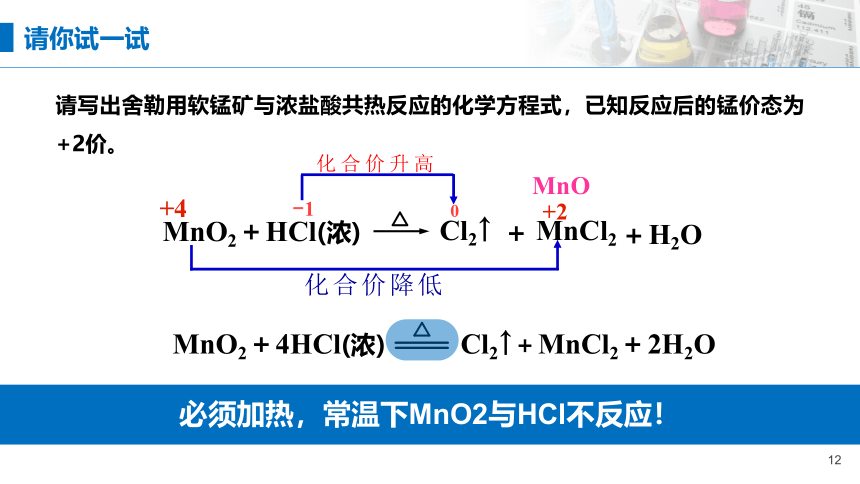
必须加热,常温下MnO2与HCl不反应!
请写出舍勒用软锰矿与浓盐酸共热反应的化学方程式,已知反应后的锰价态为+2价。
MnO2+HCl(浓)
MnCl2
Cl2↑
+
+
H2O
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
请你试一试
二氧化锰
1. 实验室制法
1.1 原料
浓盐酸
微热
稀盐酸与MnO2不反应!
浓盐酸易挥发!为防止其挥发
1. 实验室制法
1.2 原理
从化合价变化的角度,分析反应(被氧化、被还原、氧化剂、还原剂)。
化合价升高,被氧化
氧化剂
还原剂
写出离子方程式
你能提出什么问题?
盐酸的作用、被氧化的量
化合价降低,被还原
问题解决
实验室用下列两种方法制取氯气:①用含4×36.5g HCl的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。
若不考虑HCl的挥发,则反应后所得氯气的物质的量是何关系?
A.方法①比方法②多
B.方法②比方法①多
C.两种方法一样多
D.无法比较
Mn的相对原子质量为55
你学会了吗?
根据实验室Cl2的制备原理,请设计制备氯气的发生装置。
从反应物的状态及反应条件,属于哪种类型?
合作探究
交流与研讨
以下装置中的哪套适合作为氯气的发生装置?
使用分液漏斗:
一防浓盐酸挥发
二控制反应速率
请选择—制氯气装置
以下装置在实验过程中可能会出现什么问题?
如何使液体顺利滴下?
恒压漏斗
问题探究
1. 实验室制法
1.3 发生装置
(2012福建理综)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
ACB
你学会了吗?
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
收集方法 向上排气法 向下排气法 排水取气法
简易装置图
收集的气体
O2、H2
CO2
H2
Cl2
你还记得我吗?
气体的收集方法
1. 实验室制法
1.4 收集装置
该装置能否制得纯净的氯气?
如何改进?
思考
干燥剂 液体干燥剂 固体干燥剂 净化装置 常见干燥剂
不能干燥气体
气体的净化
浓硫酸
碱石灰
无水氯化钙
酸性气体
Cl2
(HCl、水蒸气)
除去Cl2中混有的××
1. 实验室制法
1.5 净化装置
绿色化学?
Cl2+2NaOH=NaCl+NaClO+H2O
能否用石灰水?
不能!Ca(OH)2溶解度小,不能充分吸收多余的Cl2。
问题探究
尾气吸收装置
1. 实验室制法
1.6 尾气处理装置
实验室制氯气时有如下操作,操作顺序________________________
看谁做得既准又快!
①连接好装置,检查气密性
②缓缓加热
③在烧瓶中加入少量的MnO2,向分液漏斗中加入浓盐酸
④通过分液漏斗慢慢向烧瓶中注入浓盐酸
⑤将多余氯气用浓NaOH溶液吸收
⑥当有连续气泡出现时,开始用向上排空气法收集氯气
找错
×
看我七十二变
A.① B.②
C.③ D.④
观察与思考
实验室制备氯气的装置如下图。图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是
以下两种物质都可与哪种物质都能发生反应?
如何检验NH4Cl、KCl中的阴离子Cl-?
回顾练习
氯离子的检验
02
实验探究
实验探究
AgCl不溶于稀硝酸
2.1 原理
2. 氯离子的检验
少许溶液于试管,加AgNO3溶液,再加过量稀硝酸
有白色沉淀生成
溶液中有Cl-
操作
现象
结论
2.1 答题模板
2. 氯离子的检验
为什么我们在检验含有Cl-离子的物质时,加入AgNO3溶液形成白色沉淀后,还要再加入稀HNO3,只有沉淀不溶解,才能证明该物质含有Cl-离子?
动动脑
实验探究
检验溶液中的Cl-时为什么要加入稀HNO3
深化理解
排除碳酸根离子的干扰,以免判断错误。
某河道两旁有甲、乙两厂,它们排放的工业废水中,共含K+,Ag+,Fe3+,Cl-,OH-,NO3-六种离子。甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是_____、_____、_____。乙厂的废水中含有另外三种离子是______、_______、_______,如果加一定量______(填“活性炭”、“硫酸亚铁”、“铁粉”)可以回收其中的金属____。另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的_________________________(填写离子符号)转化为沉淀,经过滤后的废水主要含_______,可用来浇灌农田。
OH-
K+
Cl-
Ag+
Fe3+
NO3-
铁粉
Ag
Ag+、Cl-;Fe3+、OH-
KNO3
看谁做得既准又快
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
氧化阴离子法
Cl-
Cl2
氧化剂
课堂小结
氯气的实验室制备原理
-1
0
-1
4 HCl
2 HCl
1 Cl2
2 HCl
1 MnCl2
1/2的HCl被氧化
课堂小结
HCl被氧化的量
1868年狄肯和洪特发明了用氯化铜作催化剂,在加热时,用空气中的氧气来氧化氯化氢气体制取氯气的方法
请你试一试
狄肯法(又译为地康法)
请写出化学方程式
课堂小结
浓盐酸
二氧化锰
检验氯气是否收满?
检验整套装置的气密性?
氯气的实验室制备
饱和食盐水
浓硫酸
NaOH溶液
发生装置
净化装置
干燥装置
收集装置
处理装置
反应物状态
及反应条件
制备气体及
杂质的性质
制备的气体
选择干燥剂
气体的水溶性
及气体的密度
气体的毒性
选择吸收剂
常见气体制备流程
课堂小结
尾气处理装置
课堂小结
A.H2 B.O2
C.Cl2 D.CO2
实验室制备下列气体的反应既是分解反应,又是氧化还原反应的是
看谁做得既准又快!
④ B. ②
C. ②③ D. ②③④
考考你自己
已知KMnO4与浓盐酸在常温下反应能产生Cl2 。若用图示的实验装置来制备纯净、干燥的氯气,并检验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是(不考虑①单元装置)
A.7.1 g
71 g
0.4×36.5 g
14.2 g
挑战自我
用二氧化锰和浓盐酸制取氯气,当有0.4×36.5 g被氧化时,生成的氯气在标准状况下的质量是
B.14.2 L
C.21.3 g
D.28.4 g
被氧化
感谢观看
世间最大的快乐,莫过于发现世人从未见过的新物质。
——舍勒
化学与生活
谁知道氯气还有哪些应用?
Preparation of chlorine gas
第三课时
第二章 第二节
氯气的制备
目标一
氯气制备原理
目标二
目标三
依据氧化还原反应,结合原料理解氯气的制备原理
氯气的实验室制备
原料、反应式、四装置(发生装置、收集装置、净化装置、处理装置)
氯离子的检验
原理、试剂、表达
学习目标
写出实验室制备O2、H2、CO2的化学方程式。
CaCO3+2HCl=CaCl2+H2O+CO2↑
Zn+H2SO4=ZnSO4+H2↑
你还记得我吗?
气体的 制备装置
反应类型
制备的气体
O2
H2 CO2
O2
你还记得我吗?
气体发生装置
如用上述制备氯气,是利用什么原理?
问题探究
说说你所知道的含氯的物质?
Cl-
Cl2
ClO-
化合价升高
还原剂
氧化剂
Cl2
化合价降低
氧化剂
还原剂
你会选择上述哪种物质来制备氯气?
联想与质疑
氯气的实验制备
01
化学史话
舍勒经过3年功夫,确定它是一种新金属的氧化物 (MnO2)。
18世纪的后期由于冶金工业的发展,开展了对各种矿石的研究。其中有一种叫软锰矿。
他将软锰矿与浓盐酸混合并加热,立即冒出一种令人窒息的黄绿色气体
这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。
世间最大的快乐,莫过于发现世人从未见过的新物质。
——舍勒
必须加热,常温下MnO2与HCl不反应!
请写出舍勒用软锰矿与浓盐酸共热反应的化学方程式,已知反应后的锰价态为+2价。
MnO2+HCl(浓)
MnCl2
Cl2↑
+
+
H2O
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
请你试一试
二氧化锰
1. 实验室制法
1.1 原料
浓盐酸
微热
稀盐酸与MnO2不反应!
浓盐酸易挥发!为防止其挥发
1. 实验室制法
1.2 原理
从化合价变化的角度,分析反应(被氧化、被还原、氧化剂、还原剂)。
化合价升高,被氧化
氧化剂
还原剂
写出离子方程式
你能提出什么问题?
盐酸的作用、被氧化的量
化合价降低,被还原
问题解决
实验室用下列两种方法制取氯气:①用含4×36.5g HCl的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。
若不考虑HCl的挥发,则反应后所得氯气的物质的量是何关系?
A.方法①比方法②多
B.方法②比方法①多
C.两种方法一样多
D.无法比较
Mn的相对原子质量为55
你学会了吗?
根据实验室Cl2的制备原理,请设计制备氯气的发生装置。
从反应物的状态及反应条件,属于哪种类型?
合作探究
交流与研讨
以下装置中的哪套适合作为氯气的发生装置?
使用分液漏斗:
一防浓盐酸挥发
二控制反应速率
请选择—制氯气装置
以下装置在实验过程中可能会出现什么问题?
如何使液体顺利滴下?
恒压漏斗
问题探究
1. 实验室制法
1.3 发生装置
(2012福建理综)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
ACB
你学会了吗?
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
收集方法 向上排气法 向下排气法 排水取气法
简易装置图
收集的气体
O2、H2
CO2
H2
Cl2
你还记得我吗?
气体的收集方法
1. 实验室制法
1.4 收集装置
该装置能否制得纯净的氯气?
如何改进?
思考
干燥剂 液体干燥剂 固体干燥剂 净化装置 常见干燥剂
不能干燥气体
气体的净化
浓硫酸
碱石灰
无水氯化钙
酸性气体
Cl2
(HCl、水蒸气)
除去Cl2中混有的××
1. 实验室制法
1.5 净化装置
绿色化学?
Cl2+2NaOH=NaCl+NaClO+H2O
能否用石灰水?
不能!Ca(OH)2溶解度小,不能充分吸收多余的Cl2。
问题探究
尾气吸收装置
1. 实验室制法
1.6 尾气处理装置
实验室制氯气时有如下操作,操作顺序________________________
看谁做得既准又快!
①连接好装置,检查气密性
②缓缓加热
③在烧瓶中加入少量的MnO2,向分液漏斗中加入浓盐酸
④通过分液漏斗慢慢向烧瓶中注入浓盐酸
⑤将多余氯气用浓NaOH溶液吸收
⑥当有连续气泡出现时,开始用向上排空气法收集氯气
找错
×
看我七十二变
A.① B.②
C.③ D.④
观察与思考
实验室制备氯气的装置如下图。图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是
以下两种物质都可与哪种物质都能发生反应?
如何检验NH4Cl、KCl中的阴离子Cl-?
回顾练习
氯离子的检验
02
实验探究
实验探究
AgCl不溶于稀硝酸
2.1 原理
2. 氯离子的检验
少许溶液于试管,加AgNO3溶液,再加过量稀硝酸
有白色沉淀生成
溶液中有Cl-
操作
现象
结论
2.1 答题模板
2. 氯离子的检验
为什么我们在检验含有Cl-离子的物质时,加入AgNO3溶液形成白色沉淀后,还要再加入稀HNO3,只有沉淀不溶解,才能证明该物质含有Cl-离子?
动动脑
实验探究
检验溶液中的Cl-时为什么要加入稀HNO3
深化理解
排除碳酸根离子的干扰,以免判断错误。
某河道两旁有甲、乙两厂,它们排放的工业废水中,共含K+,Ag+,Fe3+,Cl-,OH-,NO3-六种离子。甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是_____、_____、_____。乙厂的废水中含有另外三种离子是______、_______、_______,如果加一定量______(填“活性炭”、“硫酸亚铁”、“铁粉”)可以回收其中的金属____。另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的_________________________(填写离子符号)转化为沉淀,经过滤后的废水主要含_______,可用来浇灌农田。
OH-
K+
Cl-
Ag+
Fe3+
NO3-
铁粉
Ag
Ag+、Cl-;Fe3+、OH-
KNO3
看谁做得既准又快
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
氧化阴离子法
Cl-
Cl2
氧化剂
课堂小结
氯气的实验室制备原理
-1
0
-1
4 HCl
2 HCl
1 Cl2
2 HCl
1 MnCl2
1/2的HCl被氧化
课堂小结
HCl被氧化的量
1868年狄肯和洪特发明了用氯化铜作催化剂,在加热时,用空气中的氧气来氧化氯化氢气体制取氯气的方法
请你试一试
狄肯法(又译为地康法)
请写出化学方程式
课堂小结
浓盐酸
二氧化锰
检验氯气是否收满?
检验整套装置的气密性?
氯气的实验室制备
饱和食盐水
浓硫酸
NaOH溶液
发生装置
净化装置
干燥装置
收集装置
处理装置
反应物状态
及反应条件
制备气体及
杂质的性质
制备的气体
选择干燥剂
气体的水溶性
及气体的密度
气体的毒性
选择吸收剂
常见气体制备流程
课堂小结
尾气处理装置
课堂小结
A.H2 B.O2
C.Cl2 D.CO2
实验室制备下列气体的反应既是分解反应,又是氧化还原反应的是
看谁做得既准又快!
④ B. ②
C. ②③ D. ②③④
考考你自己
已知KMnO4与浓盐酸在常温下反应能产生Cl2 。若用图示的实验装置来制备纯净、干燥的氯气,并检验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是(不考虑①单元装置)
A.7.1 g
71 g
0.4×36.5 g
14.2 g
挑战自我
用二氧化锰和浓盐酸制取氯气,当有0.4×36.5 g被氧化时,生成的氯气在标准状况下的质量是
B.14.2 L
C.21.3 g
D.28.4 g
被氧化
感谢观看
