2.2《氯及其化合物——氯气与水及碱溶液的反应》(第一课时)课件(共82张PPT)
文档属性
| 名称 | 2.2《氯及其化合物——氯气与水及碱溶液的反应》(第一课时)课件(共82张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 17.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 17:54:22 | ||
图片预览










文档简介
(共82张PPT)
氯气与水及碱溶液的反应
Reaction of chlorine gas with water and alkali solution
第一课时
第二章 第二节
所有的科学家都应该固执,都要觉得自己是对的,否则不会成功。
(1933年生),华裔物理学家,生于中国上海,祖籍江苏金山。高锟是光纤通讯专家,普世誉之为“光纤通讯之父”曾任香港中文大学校长。
氯气
消毒剂的消毒
及制备原理是什么?
氯气为何可用于
自来水消毒?
辩证认识氯气的功与过
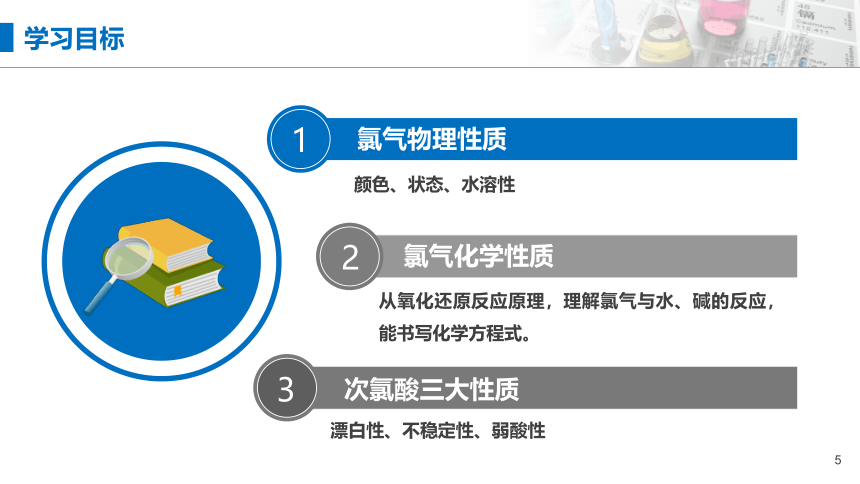
氯气的性质
次氯酸三大性质
氯气物理性质
颜色、状态、水溶性
氯气化学性质
从氧化还原反应原理,理解氯气与水、碱的反应,能书写化学方程式。
漂白性、不稳定性、弱酸性
1
2
3
学习目标
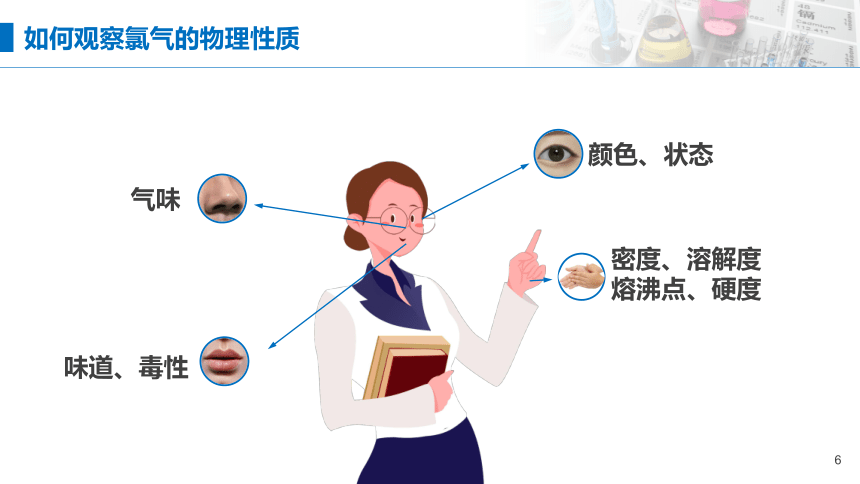
颜色、状态
气味
味道、毒性
密度、溶解度
熔沸点、硬度
如何观察氯气的物理性质
招气入鼻
用手轻轻地在瓶口扇动,使极少量的氯气飘进鼻孔。
气体的闻法
1774年,瑞典化学家舍勒发现氯气
1810年,英国化学家戴维将这种元素命名为chlorine,此名称来自希腊文,有“绿色”的意思,我国早年将其译成“绿气”,后改为氯气。
36年
氯气的发现和确定
化学史话
氯气长什么样子?
01
颜色 状态 水溶性
舍勒将软锰矿能溶于热的浓盐酸,并立即冒出一种令人窒息的黄绿色气体。
这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。
舍勒用氯气作了种种实验……;发现它可溶于水;在氯气体中的昆虫会立即死去。
世间最大的快乐,莫过于发现世人从未见过的新物质。
——舍勒
以上实验,说明氯气有何性质?
氯气趣史
1
2
3
4
颜 色
5
6
状 态
气 味
溶解性
密 度
沸 点
黄绿色
气体
刺激性
可溶于水【1:2】
不溶于饱和食盐水
大于空气
1. 物理性质
氯气趣史
1805年诺斯莫尔
将这种氯气压缩到一个2.25英寸的接受容器中, 它立刻转变成了一种黄色的液体,它在普通的大气压力下具有极大的挥发性,当把耐压的接受容器的阀门打开时,这种液体物质便立即完全挥发了。
1888年克尼许
用加压冷却的方法将液态的氯装在一种耐压的容器中, 以便於运输和使用。
1. 物理性质
1
2
3
4
颜 色
5
6
状 态
气 味
溶解性
密 度
沸 点
黄绿色
气体
刺激性
可溶于水 1 :2
不溶于饱和食盐水
大于空气
易液化
防毒面具为何象猪嘴?
Cl2有毒,在一战中,曾被德军制成毒气弹用于战争。在战场上使得英法联军伤亡惨重!
一战时,德军施放毒气
满载Cl2钢瓶的车辆将Cl2运往前线
德国毒气部分人员开启Cl2钢瓶
实施毒气战
高速公路附近一名女子被泄漏液氯熏死
2005年京沪高速公路淮安段液氯泄漏事故
28人中毒死亡 万人疏散
向上风向地区转移,并用湿毛巾护住口鼻。
如液氯发生泄漏,你应怎么做?
学以致用
应用范围
适用于制药工业、食品工业、宾馆、酒店、餐厅、学校、候车室的一般物体表面消毒。
宾馆
学校
餐厅
候车室
工厂
酒店
由84消毒液,认识次氯酸
02
漂白性 弱酸性
条件、产物
物质的分类、氧化还原反应
理解记忆,防止死记硬背!
学法指导
关注实验
理论指导
化学方程式非常多!
生活中的化学
消毒剂的消毒原理是什么?
资料在线
将有机色素的发色基团氧化,使有机物褪色的变化
酸碱指示剂
有机染料
说明
漂白
变蓝色,褪色不明显
难道次氯酸钠无漂白性?
实验探究
褪色
为何加稀硫酸明显褪色?
是稀硫酸有漂白性?
稀硫酸与NaClO反应的产物有漂白性!
实验探究
请写方程式
HClO与H2O相似,在溶液中主要以分子形式存在。
HClO分子有漂白性、杀菌性
HClO的漂白,是把有机显色物质的结构破坏而使其褪色
该复分解反应,没有沉淀、气体和水生成,为何能发生?
交流与研讨
将有机色质氧化使其褪色
强氧化性
2. 次氯酸化学性质
2.1 漂白性
淮安车祸 液氯泄漏后……
绿色田地 一夜变黄
2. 次氯酸化学性质
“84消毒液”起作用为何需一段时间?
问题探究
NaClO+CO2+H2O=HClO+NaHCO3
酸性:
实验探究
想一想
很快褪色
H2CO3 >
HClO
2. 次氯酸化学性质
2.2 弱酸性
酸性:
H2CO3
HClO
<
2. 次氯酸化学性质
2.3 不稳定性
由84消毒液制备,认识氯气化学性质
03
与碱的反应
消毒剂的有效成分是NaClO。
次氯酸钠是用Cl2与NaOH溶液反应制得。
考考你的智慧
请写出方程式
3.1 与碱反应
3.1.1 NaOH
3. 氯气化学性质
1785年法国人贝托雷
最早利用氯气做漂白剂, 它把舍勒发现的那种氯气溶解在水中, 这种溶液便具有了漂白作用。
漂白粉趣史
1789年贝托雷
改进了制备漂白溶液的方法,即把氯气通入巴黎一家化工厂生产的碱性草木灰 (即氢氧化钾) 的溶液中,效率又提高了很多。
后来, 蒸汽机的发明人瓦特从贝托雷那里了解到制造这种漂白剂的方法,并把这种制造方法转让给苏格兰的英国化学公司的创始人泰纳以便生产这种漂白剂。
1798年泰纳
把生产漂白剂的方法改为将氯气通到石灰水中, 这样改进以后生产成本便大大地降低了。
1799年泰纳
经过多次加工又把这种液体的漂白剂改进成为固体的产品, 当时叫做氯化石灰,也就是我们现在所用的漂白粉,这种固体产品的优越性就要大多了。
目前工业上,用石灰乳(主要成分是氢氧化钙)制备漂白粉(其有效成分为次氯酸钙)。
请写出反应的方程式
考考你的智慧
漂白粉主要成分
有效成分
3.1 与碱反应
3.1.2 Ca(OH) 2
3. 氯气化学性质
漂白粉主要用于棉织物、麻织物、纸浆等的漂白。它的消毒杀菌作用广泛用于自来水厂、游泳池、鱼塘等场合。
而我们知道真正具有杀菌漂白作用的是HClO
生活中的化学
ClO-如何转变为HClO?
Ca(ClO)2
HClO
弱酸
?
较强酸
H2CO3
Ca(ClO)2
CO2
H2O
HClO
CaCO3
Ca(ClO)2+CO2+H2O =2HClO+CaCO3
感受·理解
漂白粉主要成分
有效成分
漂白原理
Ca(ClO)2+CO2+H2O=CaCO3+2HClO
有漂白作用
3.1 与碱反应
3.1.2 Ca(OH) 2
3. 氯气化学性质
漂白粉如果长期露置在空气中是否会失效?
漂白粉应如何保存?
学以致用
漂白原理
Ca(ClO)2+CO2+H2O=CaCO3+2HClO
漂白粉失效原理
3.1 与碱反应
3.1.2 Ca(OH) 2
3. 氯气化学性质
保存方法
密封
由氯气是否有漂白性,认识氯气与水的反应
04
进一步理解氯气与碱反应的本质
舍勒把氯气溶解在水里进行进一步研究,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用,所以他认为这种氯气具有漂白性。
法国化学家贝托莱听说舍勒发现了新气体,就根据自己的想法继续进行新气体的研究,最终他提出真正具有漂白作用的物质不是这种纯净的气体,而是它的水溶液。
谁的观点正确?
化学趣史
舍勒用氯气作了种种实验,发现它可溶于水,使水略有酸味;具有漂白作用,能使蓝色的纸条几乎变白,又能漂白有色花朵和绿叶。
氯水中存在氯气分子
比较水溶液与原氯气的颜色,可得出什么结论?
氯水呈黄绿色
观察与比较
氯气具有漂白作用还是氯水具有漂白作用?
实验内容 实验现象 实验结论
干燥的氯气与红纸
氯水与红纸
红纸无变化
红纸褪色
干燥的氯气无漂白性
氯水有漂白性
疑惑一
设计实验证明
① 氯水中是否只含Cl2和H2O?
② 氯气溶于水后有没有与水反应?
水没有漂白性,氯气分子没有漂白性,一定是两者发生了化学反应!
氯气和水反应的产物是什么?
根据氧化还原反应原理,推测Cl2和H2O反应的可能产物。
疑惑二
Cl元素的价态既升高,又降低
怎样检验氯水中是否含有Cl-和H+?
问题解决
(必为—1价)
检验微粒 所用试剂 预期现象
Cl-
H+
思考·讨论
H+的检验
极少量气泡
大量气泡
实验探究
H+和Cl-都没有漂白作用
Cl-的检验
(用pH试纸检验酸的酸性时没有出现漂白现象,Cl-有漂白性我们就喝不到碧绿的菜汤)。
实验探究
白色沉淀
氯气和水反应的产物除HCl外,还生成一种具有漂白性的物质,它是什么?
Cl2+H2O→HCl
这种具有漂白性的物质一定含有氧元素
HClO
疑惑三
Cl2+H2O
HCl
HClO
+
次氯酸
+1
氯气跟水反应生成盐酸和次氯酸
怎么水中还会有氯气分子存在呢?
疑惑三
Cl2+H2O
HCl
HClO
+
氯气和水的反应
石蕊试液中加入过量氯水有何现象?
少量氯水
过量氯水
褪色
该实验说明什么问题?
氯水中HClO量很少!
实验探究
1/3的Cl2与水反应
3.2 与水反应
3. 氯气化学性质
碱与氯气与水反应生成的酸发生中和反应
思考·运用
氯气与碱反应的实质
思考·运用
氯气与氢氧化钠的反应
你学会了吗?
氯气与氢氧化钙的反应
慢慢褪色
Cl2之所以会减少是因为
Cl2与水反应生成的次氯酸见光分解
其含量减少,为了弥补损失
Cl2会不断与水发生反应,从而使氯分子消耗
观察与思考
05
次氯酸的不稳定性
当时贝托莱也有相同的疑惑
为了研究这个问题,他将氯水露置在阳光下,发现了氯水中奇妙的变化。
氯水在光照条件下有气体产生,贝托莱研究后认为是氧气。
化学趣史
氯水中起漂白作用的是什么微粒?
化合价升高
化合价降低
HClO → O2↑+ HCl
疑惑四
氧气是哪里来的?
请写出方程式
2.3 不稳定性
2. 次氯酸化学性质
若用强光照射氯水,利用数字化传感技术对氯水的pH变化、O2浓度变化进行测定。
观察与思考
实验数据记录见图
氯水在光照下氧气浓度变化示意图
氯水在光照下溶液pH变化示意图
A.利用紫外线杀死水中的细菌
B.提高水温,有利于金鱼生长
C.增加水中氧气的含量
D.促使水中的次氯酸分解
学以致用
用自来水养金鱼时,通常先将自来水经日晒一段时间后,再注入鱼缸,其目的是
新制氯水与久置氯水,其成分及性质有何不同?
新制氯水成分
Cl2、H2O、HCl、HClO
久置氯水成分
H2O、HCl
思考
主要成分 酸性 漂白性
新制氯水
久置氯水
Cl2、H+ Cl-、HClO
H+、Cl-
较弱
较强
强
无
新制氯水保存
贮存于棕色瓶细口瓶
放阴冷处
归纳与整理
新制氯水与久置氯水
看谁做得既准又快!
新制氯水与久置的氯水相比较,下列结论不正确的是
A.颜色相同
B.前者能使有色布条褪色
C.都含有H+
D.加AgNO3溶液都能生成白色沉淀
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
强氧化性
酸性:
H2CO3
HClO
<
课堂小结
次氯酸的三大特征
1
漂白性
2
弱酸性
3
不稳定性
Cl2
H2O
OH-
盐
自来水消毒
制氯尾气吸收
工业制漂白粉
课堂小结
氯气的化学性质
如何记忆以下方程式?
交流讨论
氯 水
液 氯
有
纯净物
H2O、Cl2、HClO
H+、Cl-、ClO-
Cl2
类别
漂白性
类别
漂白性
粒子
酸性
保存
混合物
无
粒子
酸性
保存
有
无
氯水
阴凉
课堂小结
氯水和液氯比较
Cl2 HClO H2O
H+ Cl- ClO-
H2O
弱
强
强(Cl2)
弱(H+)
有
无
H+ Cl-
课堂小结
新制与久置氯水的比较
新制氯水
久置氯水
存在微粒
酸性
氧化性
漂白性
泄漏现场空中不断喷出碱性水幕,以防止氯气扩散
学以致用
氯气泄漏如何处理?
出事槽罐被吊至临时建成的水塘里
学以致用
①氯水可导电,故Cl2是电解质。
②工业上用氯气与石灰水制备漂白粉
×
×
③盛放Cl2的瓶中放入湿润的红布,过一会儿褪色,说明氯气有漂白性。
×
考考你自己
考考你的智慧
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是
A.将NaHCO3固体加入新制的氯水中,有无色气泡产生(H+)
B.氯水呈浅黄绿色(Cl2)
C.将AgNO3溶液滴加到新制氯水中,有白色沉淀产生AgNO3
D.新制氯水使红色布条褪色(HCl)
感谢观看
氯气与水及碱溶液的反应
Reaction of chlorine gas with water and alkali solution
第一课时
第二章 第二节
所有的科学家都应该固执,都要觉得自己是对的,否则不会成功。
(1933年生),华裔物理学家,生于中国上海,祖籍江苏金山。高锟是光纤通讯专家,普世誉之为“光纤通讯之父”曾任香港中文大学校长。
氯气
消毒剂的消毒
及制备原理是什么?
氯气为何可用于
自来水消毒?
辩证认识氯气的功与过
氯气的性质
次氯酸三大性质
氯气物理性质
颜色、状态、水溶性
氯气化学性质
从氧化还原反应原理,理解氯气与水、碱的反应,能书写化学方程式。
漂白性、不稳定性、弱酸性
1
2
3
学习目标
颜色、状态
气味
味道、毒性
密度、溶解度
熔沸点、硬度
如何观察氯气的物理性质
招气入鼻
用手轻轻地在瓶口扇动,使极少量的氯气飘进鼻孔。
气体的闻法
1774年,瑞典化学家舍勒发现氯气
1810年,英国化学家戴维将这种元素命名为chlorine,此名称来自希腊文,有“绿色”的意思,我国早年将其译成“绿气”,后改为氯气。
36年
氯气的发现和确定
化学史话
氯气长什么样子?
01
颜色 状态 水溶性
舍勒将软锰矿能溶于热的浓盐酸,并立即冒出一种令人窒息的黄绿色气体。
这种气体的强烈的刺激性气味使舍勒感到极为难受,但是当他确信自己制得了一种新气体后,他又感到一种由衷的快乐。
舍勒用氯气作了种种实验……;发现它可溶于水;在氯气体中的昆虫会立即死去。
世间最大的快乐,莫过于发现世人从未见过的新物质。
——舍勒
以上实验,说明氯气有何性质?
氯气趣史
1
2
3
4
颜 色
5
6
状 态
气 味
溶解性
密 度
沸 点
黄绿色
气体
刺激性
可溶于水【1:2】
不溶于饱和食盐水
大于空气
1. 物理性质
氯气趣史
1805年诺斯莫尔
将这种氯气压缩到一个2.25英寸的接受容器中, 它立刻转变成了一种黄色的液体,它在普通的大气压力下具有极大的挥发性,当把耐压的接受容器的阀门打开时,这种液体物质便立即完全挥发了。
1888年克尼许
用加压冷却的方法将液态的氯装在一种耐压的容器中, 以便於运输和使用。
1. 物理性质
1
2
3
4
颜 色
5
6
状 态
气 味
溶解性
密 度
沸 点
黄绿色
气体
刺激性
可溶于水 1 :2
不溶于饱和食盐水
大于空气
易液化
防毒面具为何象猪嘴?
Cl2有毒,在一战中,曾被德军制成毒气弹用于战争。在战场上使得英法联军伤亡惨重!
一战时,德军施放毒气
满载Cl2钢瓶的车辆将Cl2运往前线
德国毒气部分人员开启Cl2钢瓶
实施毒气战
高速公路附近一名女子被泄漏液氯熏死
2005年京沪高速公路淮安段液氯泄漏事故
28人中毒死亡 万人疏散
向上风向地区转移,并用湿毛巾护住口鼻。
如液氯发生泄漏,你应怎么做?
学以致用
应用范围
适用于制药工业、食品工业、宾馆、酒店、餐厅、学校、候车室的一般物体表面消毒。
宾馆
学校
餐厅
候车室
工厂
酒店
由84消毒液,认识次氯酸
02
漂白性 弱酸性
条件、产物
物质的分类、氧化还原反应
理解记忆,防止死记硬背!
学法指导
关注实验
理论指导
化学方程式非常多!
生活中的化学
消毒剂的消毒原理是什么?
资料在线
将有机色素的发色基团氧化,使有机物褪色的变化
酸碱指示剂
有机染料
说明
漂白
变蓝色,褪色不明显
难道次氯酸钠无漂白性?
实验探究
褪色
为何加稀硫酸明显褪色?
是稀硫酸有漂白性?
稀硫酸与NaClO反应的产物有漂白性!
实验探究
请写方程式
HClO与H2O相似,在溶液中主要以分子形式存在。
HClO分子有漂白性、杀菌性
HClO的漂白,是把有机显色物质的结构破坏而使其褪色
该复分解反应,没有沉淀、气体和水生成,为何能发生?
交流与研讨
将有机色质氧化使其褪色
强氧化性
2. 次氯酸化学性质
2.1 漂白性
淮安车祸 液氯泄漏后……
绿色田地 一夜变黄
2. 次氯酸化学性质
“84消毒液”起作用为何需一段时间?
问题探究
NaClO+CO2+H2O=HClO+NaHCO3
酸性:
实验探究
想一想
很快褪色
H2CO3 >
HClO
2. 次氯酸化学性质
2.2 弱酸性
酸性:
H2CO3
HClO
<
2. 次氯酸化学性质
2.3 不稳定性
由84消毒液制备,认识氯气化学性质
03
与碱的反应
消毒剂的有效成分是NaClO。
次氯酸钠是用Cl2与NaOH溶液反应制得。
考考你的智慧
请写出方程式
3.1 与碱反应
3.1.1 NaOH
3. 氯气化学性质
1785年法国人贝托雷
最早利用氯气做漂白剂, 它把舍勒发现的那种氯气溶解在水中, 这种溶液便具有了漂白作用。
漂白粉趣史
1789年贝托雷
改进了制备漂白溶液的方法,即把氯气通入巴黎一家化工厂生产的碱性草木灰 (即氢氧化钾) 的溶液中,效率又提高了很多。
后来, 蒸汽机的发明人瓦特从贝托雷那里了解到制造这种漂白剂的方法,并把这种制造方法转让给苏格兰的英国化学公司的创始人泰纳以便生产这种漂白剂。
1798年泰纳
把生产漂白剂的方法改为将氯气通到石灰水中, 这样改进以后生产成本便大大地降低了。
1799年泰纳
经过多次加工又把这种液体的漂白剂改进成为固体的产品, 当时叫做氯化石灰,也就是我们现在所用的漂白粉,这种固体产品的优越性就要大多了。
目前工业上,用石灰乳(主要成分是氢氧化钙)制备漂白粉(其有效成分为次氯酸钙)。
请写出反应的方程式
考考你的智慧
漂白粉主要成分
有效成分
3.1 与碱反应
3.1.2 Ca(OH) 2
3. 氯气化学性质
漂白粉主要用于棉织物、麻织物、纸浆等的漂白。它的消毒杀菌作用广泛用于自来水厂、游泳池、鱼塘等场合。
而我们知道真正具有杀菌漂白作用的是HClO
生活中的化学
ClO-如何转变为HClO?
Ca(ClO)2
HClO
弱酸
?
较强酸
H2CO3
Ca(ClO)2
CO2
H2O
HClO
CaCO3
Ca(ClO)2+CO2+H2O =2HClO+CaCO3
感受·理解
漂白粉主要成分
有效成分
漂白原理
Ca(ClO)2+CO2+H2O=CaCO3+2HClO
有漂白作用
3.1 与碱反应
3.1.2 Ca(OH) 2
3. 氯气化学性质
漂白粉如果长期露置在空气中是否会失效?
漂白粉应如何保存?
学以致用
漂白原理
Ca(ClO)2+CO2+H2O=CaCO3+2HClO
漂白粉失效原理
3.1 与碱反应
3.1.2 Ca(OH) 2
3. 氯气化学性质
保存方法
密封
由氯气是否有漂白性,认识氯气与水的反应
04
进一步理解氯气与碱反应的本质
舍勒把氯气溶解在水里进行进一步研究,发现这种水溶液对纸张、蔬菜和花都具有永久性的漂白作用,所以他认为这种氯气具有漂白性。
法国化学家贝托莱听说舍勒发现了新气体,就根据自己的想法继续进行新气体的研究,最终他提出真正具有漂白作用的物质不是这种纯净的气体,而是它的水溶液。
谁的观点正确?
化学趣史
舍勒用氯气作了种种实验,发现它可溶于水,使水略有酸味;具有漂白作用,能使蓝色的纸条几乎变白,又能漂白有色花朵和绿叶。
氯水中存在氯气分子
比较水溶液与原氯气的颜色,可得出什么结论?
氯水呈黄绿色
观察与比较
氯气具有漂白作用还是氯水具有漂白作用?
实验内容 实验现象 实验结论
干燥的氯气与红纸
氯水与红纸
红纸无变化
红纸褪色
干燥的氯气无漂白性
氯水有漂白性
疑惑一
设计实验证明
① 氯水中是否只含Cl2和H2O?
② 氯气溶于水后有没有与水反应?
水没有漂白性,氯气分子没有漂白性,一定是两者发生了化学反应!
氯气和水反应的产物是什么?
根据氧化还原反应原理,推测Cl2和H2O反应的可能产物。
疑惑二
Cl元素的价态既升高,又降低
怎样检验氯水中是否含有Cl-和H+?
问题解决
(必为—1价)
检验微粒 所用试剂 预期现象
Cl-
H+
思考·讨论
H+的检验
极少量气泡
大量气泡
实验探究
H+和Cl-都没有漂白作用
Cl-的检验
(用pH试纸检验酸的酸性时没有出现漂白现象,Cl-有漂白性我们就喝不到碧绿的菜汤)。
实验探究
白色沉淀
氯气和水反应的产物除HCl外,还生成一种具有漂白性的物质,它是什么?
Cl2+H2O→HCl
这种具有漂白性的物质一定含有氧元素
HClO
疑惑三
Cl2+H2O
HCl
HClO
+
次氯酸
+1
氯气跟水反应生成盐酸和次氯酸
怎么水中还会有氯气分子存在呢?
疑惑三
Cl2+H2O
HCl
HClO
+
氯气和水的反应
石蕊试液中加入过量氯水有何现象?
少量氯水
过量氯水
褪色
该实验说明什么问题?
氯水中HClO量很少!
实验探究
1/3的Cl2与水反应
3.2 与水反应
3. 氯气化学性质
碱与氯气与水反应生成的酸发生中和反应
思考·运用
氯气与碱反应的实质
思考·运用
氯气与氢氧化钠的反应
你学会了吗?
氯气与氢氧化钙的反应
慢慢褪色
Cl2之所以会减少是因为
Cl2与水反应生成的次氯酸见光分解
其含量减少,为了弥补损失
Cl2会不断与水发生反应,从而使氯分子消耗
观察与思考
05
次氯酸的不稳定性
当时贝托莱也有相同的疑惑
为了研究这个问题,他将氯水露置在阳光下,发现了氯水中奇妙的变化。
氯水在光照条件下有气体产生,贝托莱研究后认为是氧气。
化学趣史
氯水中起漂白作用的是什么微粒?
化合价升高
化合价降低
HClO → O2↑+ HCl
疑惑四
氧气是哪里来的?
请写出方程式
2.3 不稳定性
2. 次氯酸化学性质
若用强光照射氯水,利用数字化传感技术对氯水的pH变化、O2浓度变化进行测定。
观察与思考
实验数据记录见图
氯水在光照下氧气浓度变化示意图
氯水在光照下溶液pH变化示意图
A.利用紫外线杀死水中的细菌
B.提高水温,有利于金鱼生长
C.增加水中氧气的含量
D.促使水中的次氯酸分解
学以致用
用自来水养金鱼时,通常先将自来水经日晒一段时间后,再注入鱼缸,其目的是
新制氯水与久置氯水,其成分及性质有何不同?
新制氯水成分
Cl2、H2O、HCl、HClO
久置氯水成分
H2O、HCl
思考
主要成分 酸性 漂白性
新制氯水
久置氯水
Cl2、H+ Cl-、HClO
H+、Cl-
较弱
较强
强
无
新制氯水保存
贮存于棕色瓶细口瓶
放阴冷处
归纳与整理
新制氯水与久置氯水
看谁做得既准又快!
新制氯水与久置的氯水相比较,下列结论不正确的是
A.颜色相同
B.前者能使有色布条褪色
C.都含有H+
D.加AgNO3溶液都能生成白色沉淀
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
强氧化性
酸性:
H2CO3
HClO
<
课堂小结
次氯酸的三大特征
1
漂白性
2
弱酸性
3
不稳定性
Cl2
H2O
OH-
盐
自来水消毒
制氯尾气吸收
工业制漂白粉
课堂小结
氯气的化学性质
如何记忆以下方程式?
交流讨论
氯 水
液 氯
有
纯净物
H2O、Cl2、HClO
H+、Cl-、ClO-
Cl2
类别
漂白性
类别
漂白性
粒子
酸性
保存
混合物
无
粒子
酸性
保存
有
无
氯水
阴凉
课堂小结
氯水和液氯比较
Cl2 HClO H2O
H+ Cl- ClO-
H2O
弱
强
强(Cl2)
弱(H+)
有
无
H+ Cl-
课堂小结
新制与久置氯水的比较
新制氯水
久置氯水
存在微粒
酸性
氧化性
漂白性
泄漏现场空中不断喷出碱性水幕,以防止氯气扩散
学以致用
氯气泄漏如何处理?
出事槽罐被吊至临时建成的水塘里
学以致用
①氯水可导电,故Cl2是电解质。
②工业上用氯气与石灰水制备漂白粉
×
×
③盛放Cl2的瓶中放入湿润的红布,过一会儿褪色,说明氯气有漂白性。
×
考考你自己
考考你的智慧
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是
A.将NaHCO3固体加入新制的氯水中,有无色气泡产生(H+)
B.氯水呈浅黄绿色(Cl2)
C.将AgNO3溶液滴加到新制氯水中,有白色沉淀产生AgNO3
D.新制氯水使红色布条褪色(HCl)
感谢观看
