2.3《物质的量——气体摩尔体积计算》(第四课时)课件(共36张PPT)
文档属性
| 名称 | 2.3《物质的量——气体摩尔体积计算》(第四课时)课件(共36张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 11.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 17:56:39 | ||
图片预览









文档简介
(共36张PPT)
1936年11月29日出生于台湾省新竹市,著名化学家、诺贝尔化学奖得主,是第一位获得诺贝尔化学奖的中国人
在科学研究上,先天的聪明不算什么,后天的努力却非常重要。
李远哲
看谁做得既准又快
判断以下说法是否正确?
①在标准状况下22.4 L H2中含有氢分子的个数为2NA
②标准状况下,22.4 L N2和H2混合气中含NA个原子
③标准状况下,11.2 L铁中含有原子的数目为0.5NA
④标准状况下,11.2 L氯气中含有的氯原子数为NA
×
×
×
√
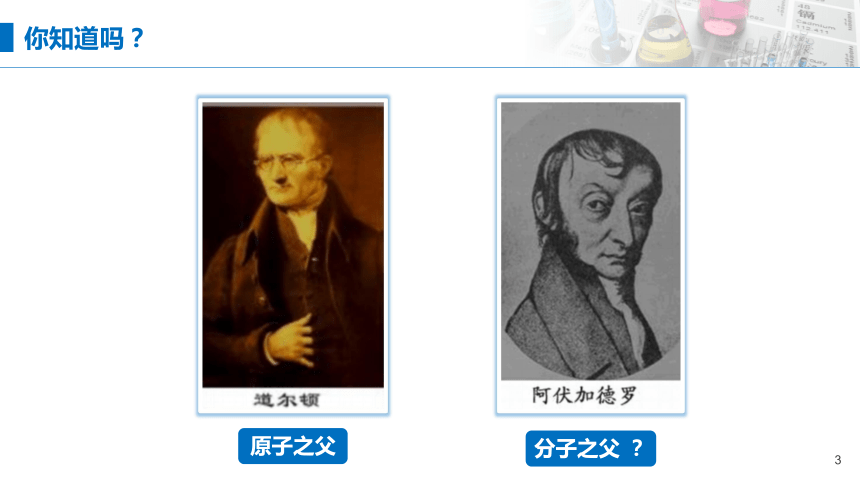
原子之父
分子之父 ?
你知道吗?
化学趣史
贝采里乌斯首先提出了一个假设:
在同温同压时,同体积的任何气体都含有相同数目的原子。
1氢气+1氯气=2氯化氢
H + Cl =
2
H0.5Cl0.5
思考
该假设能否解释如下事实——同温同压下,1体积的氢气和1体积的氯气反应生成2体积的氯化氢?
为解决此矛盾,1811年阿伏加德罗引入了分子的概念
单质分子可由几种原子构成。
提出阿伏加德罗假说:
在同温同压下,同体积的任何气体都含有
相同数目的分子
化学趣史
Gas molar volume calculation
第四课时
第二章 第三节
气体摩尔体积计算
根据方程式计算
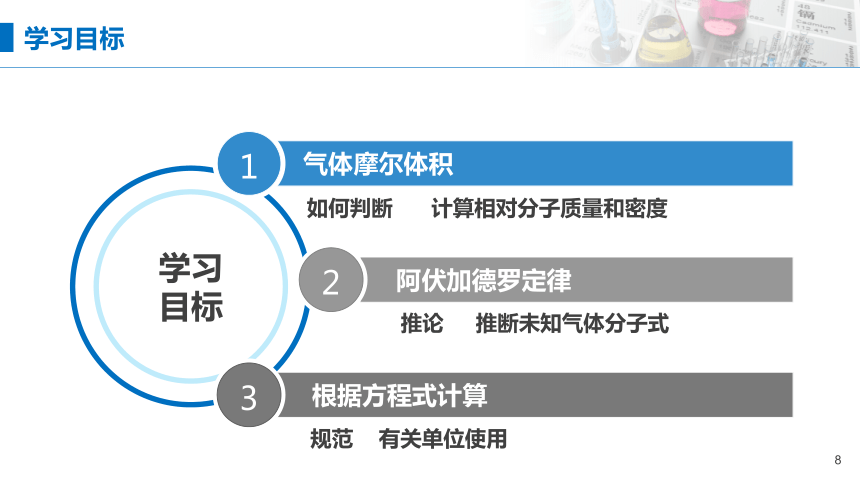
学习
目标
气体摩尔体积
如何判断 计算相对分子质量和密度
阿伏加德罗定律
推论 推断未知气体分子式
规范 有关单位使用
1
2
3
学习目标
气体摩尔体积
01
A.标准状况下,1 mol H2SO4 体积是22.4 L
B.通常状况下, 11.2 L CO2的物质的量为0.5 mol
C.通常状况下,8 g CH4 的物质的量为0.5 mol
D.标准状况下,11.2 LH2中含有的氢原子数为3.01×1023
请你试一试
下列叙述正确的是
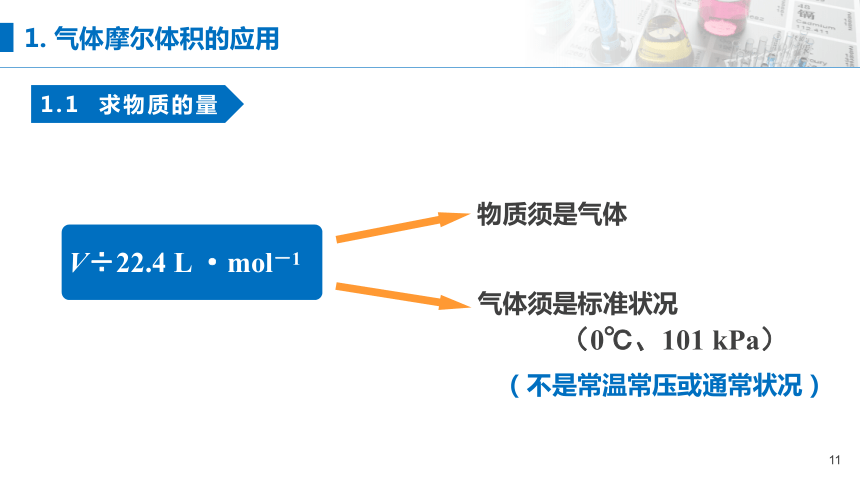
V÷22.4 L ·mol-1
物质须是气体
气体须是标准状况
(0℃、101 kPa)
(不是常温常压或通常状况)
1. 气体摩尔体积的应用
1.1 求物质的量
依据
解析
1
2
1 mol物质的质量以g为单位,在数值等于其相对分子质量。
取1 mol气体,其在标准状况下的体积为22.4 L。
1 mol气体的质量为:
1.96 g·L-1× 22.4 L=43.9 g
请你试一试
某气体在标准状况下的密度为1.96 g·L-1 ,请计算其相对分子质量。
Mr=22.4×ρ(STP)
1. 气体摩尔体积的应用
1.2 求相对分子质量
阿伏加德罗定律
02
阿伏加德罗定律揭示了温度(T) 、压强(p) 、分子数(N)或物质的量(n) 、气体体积(V)之间的联系。
(1)同T、p时,气体分子数与其体积间有何关系?
问题探究
观察与思考
观察与思考
(1)同T、p 时,气体分子数与其体积间有何关系?
(2)同T、V 时,气体分子数与其压强间有何关系?
问题探究
阿伏加德罗定律揭示了温度(T) 、压强(p) 、分子数(N)或物质的量(n) 、气体体积(V)之间的联系。
气体压强产生的原因
A.H2 B.O2
C.SO2 D.Cl2
看谁做得既准又快!
在相同的温度下,相同质量的下列气体分别通入相同容积的容器中,容器内的压强最小的是
当一幛建筑物完成时,应该把脚手架拆除干净。
——高斯
德国著名数学家、物理学家、天文学家、大地测量学家,近代数学奠基者之一。高斯被认为是历史上最重要的数学家之一,并享有“数学王子”之称。
2+1=2
180多年前,德国的数学家高斯和意大利科学家阿伏加德罗进行了一场激烈的辩论,核心是化学究竟是不是一门真正的科学
高斯说:“科学规律只存在于数学之中,化学不在精密科学之列。”
阿伏加德罗反驳道:“数学虽然是自然科学之王,但没有其他科学,就失去它的真正价值.”
此话惹恼了高斯,这位数学权威竟说:“对数学来说,化学充其量只能起一个女仆的作用.”
阿伏加德罗并没有被压服,他用实验事实进一步来证实自己的观点
在将2 L氢气放在1 L氧气中燃烧得到2 L水蒸气的结果给高斯时,他十分自豪地说:“请看吧!只要化学愿意,它能使2加1等于2,数学能做到这一点吗?遗憾的是我们对化学知道得太少了!”
科学的发展证明了阿伏加德罗的观点是正确的,生活在现代社会的人们,谁也不再怀疑化学的重要性了。
化学趣史
A.XY3 B.XY
C.X3Y D.X2Y3
考考你的智慧
在一定的温度和压强下,1体积X2气体跟3体积Y2气体化合生成2体积的化合物Z ,则该化合物的化学式是
2. 阿伏加德罗定律推论及应用
2.2 应用
推测未知气体的 分子式
在一定的温度和压强下,4体积某气态化合物完全分解后产生1体积气体A4和6体积气体B2,由此可推断该气态化合物化学式为________,该分解反应的化学方程式为_____________________________________。
AB3
4AB3 A4+6B2
一定温度压强
你学会了吗?
化学方程式计算
03
1 mol
33.6 L
2NaN3=2Na+3N2
2 mol
3 mol
1 mol
1.5 mol
考考你自己
汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应: NaN3→Na+N2(未配平),所产生的气体快速充满气囊,可以达到保证车内人员安全的目的。
(1)若气囊中放置65 g NaN3,则其物质的量为________。
(2)若65 g NaN3完全分解,在标准状况下,气囊膨胀的体积为_________。
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
使用22.4 L·mol-1时
先看物质是否是气体
再看是否是标准状况
课堂小结
标准状况下气体摩尔体积使用
判断以下说法是否正确?
⑤常温常压下,22.4 L氧气中含有的氧原子数为2NA
⑥标准状况下,33.6 L氦气含有的原子数为3NA
⑦4.48 L N2与CO的混合物所含分子数为0.2NA
⑧常温常压下, 92gNO2和N2O4的混合气体中含有的原子总数为6NA
×
×
×
√
看谁做得既准又快!
A.标准状况下,5.6 L氯气和16.8 L氧气的混合气体中含有分子数为NA
B.标准状况下,22.4 L H2O所含有原子数为3NA
C.NA个N2分子所占的体积与0.5NA个H2分子所占的体积比一定是2∶1
D.在标准状况下,2.24 L NH3气体中含有氢原子数为3NA
考考你的智慧
1. NA为阿伏加德罗常数,下列说法正确的是
回答下列问题:
(1)上述气体中,体积最大的是____(填序号)
(2)①②③④四种气体的体积比为______________。
考考你的智慧
2.在标准状况下:① 6.72 L CH4气体;② 3.01×1023个HCl气体分子;③ 13.6 g H2S气体;④ 0.2 mol NH3。
0.3 mol
0.5 mol
0.4 mol
0.2 mol
②
3∶5∶4∶2
(1)上述气体中,体积最大的是______(填序号)
(2)①②③④四种气体的体积比为__________________。
考考你的智慧
2.在标准状况下:
① 6.72 L CH4气体;
② 3.01×1023个HCl气体分子;
③ 13.6 g H2S气体;
④ 0.2 mol NH3。
感谢观看
1936年11月29日出生于台湾省新竹市,著名化学家、诺贝尔化学奖得主,是第一位获得诺贝尔化学奖的中国人
在科学研究上,先天的聪明不算什么,后天的努力却非常重要。
李远哲
看谁做得既准又快
判断以下说法是否正确?
①在标准状况下22.4 L H2中含有氢分子的个数为2NA
②标准状况下,22.4 L N2和H2混合气中含NA个原子
③标准状况下,11.2 L铁中含有原子的数目为0.5NA
④标准状况下,11.2 L氯气中含有的氯原子数为NA
×
×
×
√
原子之父
分子之父 ?
你知道吗?
化学趣史
贝采里乌斯首先提出了一个假设:
在同温同压时,同体积的任何气体都含有相同数目的原子。
1氢气+1氯气=2氯化氢
H + Cl =
2
H0.5Cl0.5
思考
该假设能否解释如下事实——同温同压下,1体积的氢气和1体积的氯气反应生成2体积的氯化氢?
为解决此矛盾,1811年阿伏加德罗引入了分子的概念
单质分子可由几种原子构成。
提出阿伏加德罗假说:
在同温同压下,同体积的任何气体都含有
相同数目的分子
化学趣史
Gas molar volume calculation
第四课时
第二章 第三节
气体摩尔体积计算
根据方程式计算
学习
目标
气体摩尔体积
如何判断 计算相对分子质量和密度
阿伏加德罗定律
推论 推断未知气体分子式
规范 有关单位使用
1
2
3
学习目标
气体摩尔体积
01
A.标准状况下,1 mol H2SO4 体积是22.4 L
B.通常状况下, 11.2 L CO2的物质的量为0.5 mol
C.通常状况下,8 g CH4 的物质的量为0.5 mol
D.标准状况下,11.2 LH2中含有的氢原子数为3.01×1023
请你试一试
下列叙述正确的是
V÷22.4 L ·mol-1
物质须是气体
气体须是标准状况
(0℃、101 kPa)
(不是常温常压或通常状况)
1. 气体摩尔体积的应用
1.1 求物质的量
依据
解析
1
2
1 mol物质的质量以g为单位,在数值等于其相对分子质量。
取1 mol气体,其在标准状况下的体积为22.4 L。
1 mol气体的质量为:
1.96 g·L-1× 22.4 L=43.9 g
请你试一试
某气体在标准状况下的密度为1.96 g·L-1 ,请计算其相对分子质量。
Mr=22.4×ρ(STP)
1. 气体摩尔体积的应用
1.2 求相对分子质量
阿伏加德罗定律
02
阿伏加德罗定律揭示了温度(T) 、压强(p) 、分子数(N)或物质的量(n) 、气体体积(V)之间的联系。
(1)同T、p时,气体分子数与其体积间有何关系?
问题探究
观察与思考
观察与思考
(1)同T、p 时,气体分子数与其体积间有何关系?
(2)同T、V 时,气体分子数与其压强间有何关系?
问题探究
阿伏加德罗定律揭示了温度(T) 、压强(p) 、分子数(N)或物质的量(n) 、气体体积(V)之间的联系。
气体压强产生的原因
A.H2 B.O2
C.SO2 D.Cl2
看谁做得既准又快!
在相同的温度下,相同质量的下列气体分别通入相同容积的容器中,容器内的压强最小的是
当一幛建筑物完成时,应该把脚手架拆除干净。
——高斯
德国著名数学家、物理学家、天文学家、大地测量学家,近代数学奠基者之一。高斯被认为是历史上最重要的数学家之一,并享有“数学王子”之称。
2+1=2
180多年前,德国的数学家高斯和意大利科学家阿伏加德罗进行了一场激烈的辩论,核心是化学究竟是不是一门真正的科学
高斯说:“科学规律只存在于数学之中,化学不在精密科学之列。”
阿伏加德罗反驳道:“数学虽然是自然科学之王,但没有其他科学,就失去它的真正价值.”
此话惹恼了高斯,这位数学权威竟说:“对数学来说,化学充其量只能起一个女仆的作用.”
阿伏加德罗并没有被压服,他用实验事实进一步来证实自己的观点
在将2 L氢气放在1 L氧气中燃烧得到2 L水蒸气的结果给高斯时,他十分自豪地说:“请看吧!只要化学愿意,它能使2加1等于2,数学能做到这一点吗?遗憾的是我们对化学知道得太少了!”
科学的发展证明了阿伏加德罗的观点是正确的,生活在现代社会的人们,谁也不再怀疑化学的重要性了。
化学趣史
A.XY3 B.XY
C.X3Y D.X2Y3
考考你的智慧
在一定的温度和压强下,1体积X2气体跟3体积Y2气体化合生成2体积的化合物Z ,则该化合物的化学式是
2. 阿伏加德罗定律推论及应用
2.2 应用
推测未知气体的 分子式
在一定的温度和压强下,4体积某气态化合物完全分解后产生1体积气体A4和6体积气体B2,由此可推断该气态化合物化学式为________,该分解反应的化学方程式为_____________________________________。
AB3
4AB3 A4+6B2
一定温度压强
你学会了吗?
化学方程式计算
03
1 mol
33.6 L
2NaN3=2Na+3N2
2 mol
3 mol
1 mol
1.5 mol
考考你自己
汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应: NaN3→Na+N2(未配平),所产生的气体快速充满气囊,可以达到保证车内人员安全的目的。
(1)若气囊中放置65 g NaN3,则其物质的量为________。
(2)若65 g NaN3完全分解,在标准状况下,气囊膨胀的体积为_________。
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
使用22.4 L·mol-1时
先看物质是否是气体
再看是否是标准状况
课堂小结
标准状况下气体摩尔体积使用
判断以下说法是否正确?
⑤常温常压下,22.4 L氧气中含有的氧原子数为2NA
⑥标准状况下,33.6 L氦气含有的原子数为3NA
⑦4.48 L N2与CO的混合物所含分子数为0.2NA
⑧常温常压下, 92gNO2和N2O4的混合气体中含有的原子总数为6NA
×
×
×
√
看谁做得既准又快!
A.标准状况下,5.6 L氯气和16.8 L氧气的混合气体中含有分子数为NA
B.标准状况下,22.4 L H2O所含有原子数为3NA
C.NA个N2分子所占的体积与0.5NA个H2分子所占的体积比一定是2∶1
D.在标准状况下,2.24 L NH3气体中含有氢原子数为3NA
考考你的智慧
1. NA为阿伏加德罗常数,下列说法正确的是
回答下列问题:
(1)上述气体中,体积最大的是____(填序号)
(2)①②③④四种气体的体积比为______________。
考考你的智慧
2.在标准状况下:① 6.72 L CH4气体;② 3.01×1023个HCl气体分子;③ 13.6 g H2S气体;④ 0.2 mol NH3。
0.3 mol
0.5 mol
0.4 mol
0.2 mol
②
3∶5∶4∶2
(1)上述气体中,体积最大的是______(填序号)
(2)①②③④四种气体的体积比为__________________。
考考你的智慧
2.在标准状况下:
① 6.72 L CH4气体;
② 3.01×1023个HCl气体分子;
③ 13.6 g H2S气体;
④ 0.2 mol NH3。
感谢观看
