3.1《铁及其化合物——铁单质氧化物和氢氧化物》(第一课时)课件(共73张PPT)
文档属性
| 名称 | 3.1《铁及其化合物——铁单质氧化物和氢氧化物》(第一课时)课件(共73张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 26.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 18:01:02 | ||
图片预览











文档简介
(共73张PPT)
倘若你有一个苹果,我也有一个苹果,而我们彼此交换苹果,那么我们仍然各有一个苹果。但是,倘若你有一种思想,我也有一种思想,而我们彼此交流这些思想,那么我们每人将各有两种思想。——萧伯纳
To prepare a solution of a certain concentration of substance
第一课时
第三章 第一节
铁单质 氧化物和氢氧化物
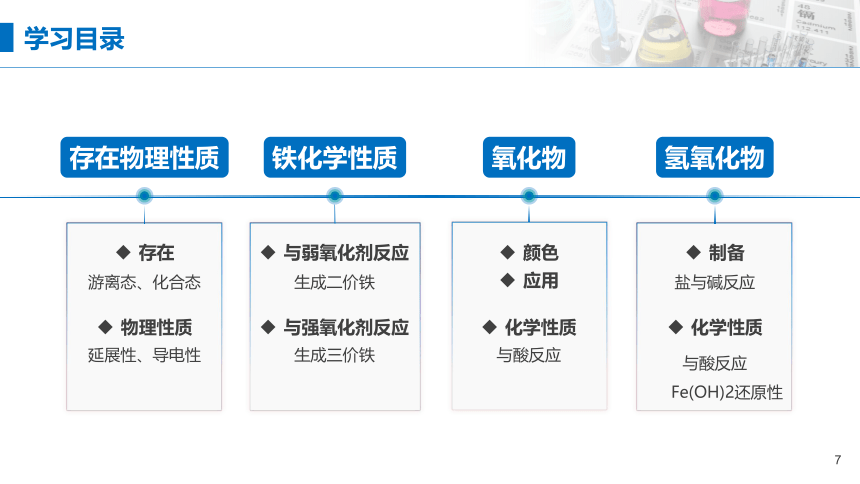
学习目录
存在
游离态、化合态
铁化学性质
氢氧化物
氧化物
存在物理性质
物理性质
延展性、导电性
与弱氧化剂反应
生成二价铁
与强氧化剂反应
生成三价铁
颜色
化学性质
与酸反应
应用
制备
盐与碱反应
化学性质
与酸反应
Fe(OH)2还原性
纯铁长什么样子?
铁能和那些物质发生反应?
01
纯铁
常见的钢铁
你见过纯铁吗?
银白色
耐腐蚀
1. 铁物理性质
铁磁性
陈列于新疆地质矿产博物馆重达30吨
世界排行第三的大陨铁
游离态
单质
化合态
化合物
2. 铁存在
磁铁矿
Fe
3
O
4
赤铁矿
Fe
2
O
3
你吃过纯铁吗?
你吃过纯铁吗?
用吸铁石从麦片中吸出了铁粉
食品中的铁起什么作用?
你吃过纯铁吗?
铁能与哪些物质反应?
02
写出铁参加反应的离子方程式或化学方程式。
并标出电子转移的方向和数目。
Fe
Fe
+2
Fe
Fe
+3
氧化剂
氧化剂
弱
强
回顾练习
通性
特性
与非金属单质反应
与酸反应
钝化
与盐反应
铁的化学性质
脱氧剂有的是铁
强氧化剂
弱氧化剂
O2
Cl2
I2
S
3.1 与非金属单质反应
3. 铁化学性质
如何除去铜中的铁?
写出反应的离子方程式。
问题解决
3.2. 1 CuSO4溶液
Fe+Cu2+=Fe2+ +Cu
用单线桥表示电子转移方向和数目
3.2 与盐反应
3. 铁化学性质
FeSO4溶液在空气中易被氧化为硫酸铁,通常加入铁粉或铁钉,可将硫酸铁还原为FeSO4。
考考你的智慧
请写硫酸铁与铁反应的离子方程式。
3.2.2 Fe3+盐溶液
Fe+2Fe3+=3Fe2+
Fe+Fe3+=2Fe2+
×
3.2. 1 CuSO4溶液
Fe+Cu2+=Fe2+ +Cu
3.2 与盐反应
3. 铁化学性质
食品中的铁
起什么作用?
你吃过纯铁吗?
3. 铁化学性质
3.3 与酸反应
3.3.1 非氧化性酸
Fe+2H+=Fe2+ +H2↑
有气泡
实验探究
3.3.2.1 稀硝酸
3. 铁化学性质
3.3 与酸反应
3.3.2 氧化性酸
化学趣史
将一小块纯铁放入盛70%浓硝酸的小烧杯中(室温),铁在浓硝酸不溶解。
再用滴管缓慢地向烧杯中加蒸馏水,直加到溶液体积是原酸液的2倍,浓度约为35%,铁在这稀释后的硝酸还是不溶解。
已知铁直接与35%硝酸反应是很快的,那么为什么浓度从70%慢慢降为35%就不反应了呢?
在金属表面形成一层致密的氧化膜,
而发生钝化。
神秘钝化的拓荒者
思考
观察与思考
常温
加热
观察与思考
条件
注意
常温
先反应后即停止
有何应用?
钝化
3. 铁化学性质
3.3 与酸反应
3.3.2.2 浓硫酸、浓硝酸
3.3.2 氧化性酸
铁的钝化应用
运浓硝酸的铁槽罐车
运浓硫酸的铁槽罐车
炽热的铁水注入模具之前,模具必须进行充分的干燥处理,不得有水,这是为什么呢?
钢铁铸造倾倒铁水进入模具
实验探究
3. 铁化学性质
3.3 与酸反应
3.3.3 水蒸气
1982年8月16日10时56分,冶金部某钢铁公司炼铁厂铁水发生爆炸,死亡14人,直接经济损失90余万元。
是日上午,该厂运输部213机车调车组前往二炼钢送铁水。返回时,从二炼钢厂带回三个铁水罐,其中2个空罐,一个重罐。因7号扳道房主任扳道号没有完整地把要求将此重罐送到罐铁机处理的作业计划传达到该调车组,致使该调车组误将这个重罐当成空罐送到了修罐库。修罐库负责扣罐的徐某检查不认真,未查出该重罐,就盲目指挥75吨吊车翻罐。由于重罐罐体重达50吨,罐内有铁水76吨,超过负荷50多吨。吊车起吊后,重罐迅速下坠,罐底坠到罐坑边缘,罐体猛然倾斜,铁水冲出流入坑内,与坑内积水相遇立即引起爆炸。吊车司机当场死亡,在修罐库北侧墙外卸砖的青山区装卸二站的2O多名工人和炼铁厂的2名工人被铁水烧伤,经抢救无效又死亡13人。还有部分厂房设备也被炸坏。
武汉钢铁公司炼铁厂铁水爆炸
氧化剂
氧化剂
弱
强
雪后的故宫红墙
氧化铁作外墙涂料
铁有几种氧化物?
02
Fe2O3
FeO
Fe3O4
黑色
1
2
红棕色
FeO
Fe3O4
Fe2O3
4. 氧化物
4.1 颜色
颜料
1
2
磁性材料
Fe2O3
Fe3O4
4. 氧化物
4.2 应用
回顾练习
分别写出氧化亚铁、氧化铁及四氧化三铁与盐酸反应的离子方程式。
硝酸与FeO的反应与盐酸、稀硫酸不同!
FeO+H++NO3- → Fe3++NO↑+H2O
4.3 化学性质
4.3.1 与酸反应
4. 氧化物
思考﹒ 讨论
从铁的价态考虑,铁的氧化物还能发生什么反应?
C、H2、CO、Al
4. 氧化物
4.3 化学性质
4.3.2 与某些还原剂反应
生活中的化学
玉石中的氧化亚铁经氧化而成三价铁,颜色变成红棕色
特别是裂缝部位或有空隙的部位,还有暴露在外的截面部分也容易氧化而成红棕色
6FeO+O2 2Fe3O4
4. 氧化物
4.3 化学性质
4.3.3 与氧气反应
铁的氢氧化物
03
Fe(OH)2
Fe(OH)3
5. 氢氧化物
5.1 颜色
白色
红褐色
问题解决
写出生成Fe(OH)2、Fe(OH)3的离子方程式。
Fe3++3OH-= Fe(OH)3↓
Fe2++2OH-= Fe(OH)2↓
碱与盐
5. 氢氧化物
5.2 制备
实验探究
白色
灰绿色
红褐色
红褐色
请你试一试
Fe(OH)2
Fe(OH)3
+2
O2
+3
Fe(OH)2+O2→Fe(OH)3
请配平
Fe(OH)2+O2→Fe(OH)3
+2
+3
失去
e-
0
-2
得到
4e-
4
×
×
1
4Fe(OH)2+1O2→Fe(OH)3
4Fe(OH)2+1O2→4Fe(OH)3
4Fe(OH)2+1O2 →4Fe(OH)3
2H2O
+
请你试一试
实验探究
你认为如何制备氢氧化亚铁?
生成的白色絮状沉淀
迅速变成灰绿色
过一段时间后变为红褐色
5. 氢氧化物
5.3 化学性质
5.3.1 还原性
回顾练习
写出Fe(OH)2 、 Fe(OH)3
分别与盐酸反应的离子方程式。
Fe(OH)3+3H+=Fe2++3H2O
Fe(OH)2+H+→Fe3++ NO↑+ H2O
与硝酸发生氧化还原反应
5. 氢氧化物
5.3 化学性质
5.3.2 碱性
Fe(OH)2+2H+=Fe2++2H2O
问题探究
溶液中的 可通过加BaCl2溶液,测定沉淀质量可求解。
然而溶液中的Fe3+则不能通过加NaOH溶液,测定沉淀质量来求解。
这是为什么?应进一步如何操作?
5. 氢氧化物
5.3 化学性质
5.3.3 热稳定性
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
铁的性质及碱的性质与制备
弱 氧化剂
Fe2+
Fe3+
强 氧化剂
碱
碱
钝化
酸
酸
浓硫酸
浓硝酸
看谁做得既准又快
下列可用于吸收食品包装袋内的氧气和水分的物质是
A.氯化钙
B.炭粉
C.铁粉
D.生石灰
看谁做得既准又快
下列物质中,在一定条件下能将铁元素从0价转变为+3价的是
A.氯气
B.稀盐酸
C.CuCl2溶液
D.ZnCl2溶液
成功体验
将铁片投入到下列溶液中,不放出气体并且铁片质量增重的是
A.CuCl2溶液
B.HCl溶液
C.ZnSO4溶液
D.FeCl2溶液
探究 · 拓展
物质 开始沉淀 沉淀完全
Fe(OH)3 2.7 3.7
Fe(OH)2 7.6 9.6
Cu(OH)2 4.4 6.4
某Cu2+溶液中含有Fe2+,如何除去Fe2+?
不同金属离子在溶液中开始沉淀与完全沉淀pH如下:
① 能直接加碱沉淀?
② 根据沉淀pH不同,应如何处理?
探究 · 拓展
感谢观看
倘若你有一个苹果,我也有一个苹果,而我们彼此交换苹果,那么我们仍然各有一个苹果。但是,倘若你有一种思想,我也有一种思想,而我们彼此交流这些思想,那么我们每人将各有两种思想。——萧伯纳
To prepare a solution of a certain concentration of substance
第一课时
第三章 第一节
铁单质 氧化物和氢氧化物
学习目录
存在
游离态、化合态
铁化学性质
氢氧化物
氧化物
存在物理性质
物理性质
延展性、导电性
与弱氧化剂反应
生成二价铁
与强氧化剂反应
生成三价铁
颜色
化学性质
与酸反应
应用
制备
盐与碱反应
化学性质
与酸反应
Fe(OH)2还原性
纯铁长什么样子?
铁能和那些物质发生反应?
01
纯铁
常见的钢铁
你见过纯铁吗?
银白色
耐腐蚀
1. 铁物理性质
铁磁性
陈列于新疆地质矿产博物馆重达30吨
世界排行第三的大陨铁
游离态
单质
化合态
化合物
2. 铁存在
磁铁矿
Fe
3
O
4
赤铁矿
Fe
2
O
3
你吃过纯铁吗?
你吃过纯铁吗?
用吸铁石从麦片中吸出了铁粉
食品中的铁起什么作用?
你吃过纯铁吗?
铁能与哪些物质反应?
02
写出铁参加反应的离子方程式或化学方程式。
并标出电子转移的方向和数目。
Fe
Fe
+2
Fe
Fe
+3
氧化剂
氧化剂
弱
强
回顾练习
通性
特性
与非金属单质反应
与酸反应
钝化
与盐反应
铁的化学性质
脱氧剂有的是铁
强氧化剂
弱氧化剂
O2
Cl2
I2
S
3.1 与非金属单质反应
3. 铁化学性质
如何除去铜中的铁?
写出反应的离子方程式。
问题解决
3.2. 1 CuSO4溶液
Fe+Cu2+=Fe2+ +Cu
用单线桥表示电子转移方向和数目
3.2 与盐反应
3. 铁化学性质
FeSO4溶液在空气中易被氧化为硫酸铁,通常加入铁粉或铁钉,可将硫酸铁还原为FeSO4。
考考你的智慧
请写硫酸铁与铁反应的离子方程式。
3.2.2 Fe3+盐溶液
Fe+2Fe3+=3Fe2+
Fe+Fe3+=2Fe2+
×
3.2. 1 CuSO4溶液
Fe+Cu2+=Fe2+ +Cu
3.2 与盐反应
3. 铁化学性质
食品中的铁
起什么作用?
你吃过纯铁吗?
3. 铁化学性质
3.3 与酸反应
3.3.1 非氧化性酸
Fe+2H+=Fe2+ +H2↑
有气泡
实验探究
3.3.2.1 稀硝酸
3. 铁化学性质
3.3 与酸反应
3.3.2 氧化性酸
化学趣史
将一小块纯铁放入盛70%浓硝酸的小烧杯中(室温),铁在浓硝酸不溶解。
再用滴管缓慢地向烧杯中加蒸馏水,直加到溶液体积是原酸液的2倍,浓度约为35%,铁在这稀释后的硝酸还是不溶解。
已知铁直接与35%硝酸反应是很快的,那么为什么浓度从70%慢慢降为35%就不反应了呢?
在金属表面形成一层致密的氧化膜,
而发生钝化。
神秘钝化的拓荒者
思考
观察与思考
常温
加热
观察与思考
条件
注意
常温
先反应后即停止
有何应用?
钝化
3. 铁化学性质
3.3 与酸反应
3.3.2.2 浓硫酸、浓硝酸
3.3.2 氧化性酸
铁的钝化应用
运浓硝酸的铁槽罐车
运浓硫酸的铁槽罐车
炽热的铁水注入模具之前,模具必须进行充分的干燥处理,不得有水,这是为什么呢?
钢铁铸造倾倒铁水进入模具
实验探究
3. 铁化学性质
3.3 与酸反应
3.3.3 水蒸气
1982年8月16日10时56分,冶金部某钢铁公司炼铁厂铁水发生爆炸,死亡14人,直接经济损失90余万元。
是日上午,该厂运输部213机车调车组前往二炼钢送铁水。返回时,从二炼钢厂带回三个铁水罐,其中2个空罐,一个重罐。因7号扳道房主任扳道号没有完整地把要求将此重罐送到罐铁机处理的作业计划传达到该调车组,致使该调车组误将这个重罐当成空罐送到了修罐库。修罐库负责扣罐的徐某检查不认真,未查出该重罐,就盲目指挥75吨吊车翻罐。由于重罐罐体重达50吨,罐内有铁水76吨,超过负荷50多吨。吊车起吊后,重罐迅速下坠,罐底坠到罐坑边缘,罐体猛然倾斜,铁水冲出流入坑内,与坑内积水相遇立即引起爆炸。吊车司机当场死亡,在修罐库北侧墙外卸砖的青山区装卸二站的2O多名工人和炼铁厂的2名工人被铁水烧伤,经抢救无效又死亡13人。还有部分厂房设备也被炸坏。
武汉钢铁公司炼铁厂铁水爆炸
氧化剂
氧化剂
弱
强
雪后的故宫红墙
氧化铁作外墙涂料
铁有几种氧化物?
02
Fe2O3
FeO
Fe3O4
黑色
1
2
红棕色
FeO
Fe3O4
Fe2O3
4. 氧化物
4.1 颜色
颜料
1
2
磁性材料
Fe2O3
Fe3O4
4. 氧化物
4.2 应用
回顾练习
分别写出氧化亚铁、氧化铁及四氧化三铁与盐酸反应的离子方程式。
硝酸与FeO的反应与盐酸、稀硫酸不同!
FeO+H++NO3- → Fe3++NO↑+H2O
4.3 化学性质
4.3.1 与酸反应
4. 氧化物
思考﹒ 讨论
从铁的价态考虑,铁的氧化物还能发生什么反应?
C、H2、CO、Al
4. 氧化物
4.3 化学性质
4.3.2 与某些还原剂反应
生活中的化学
玉石中的氧化亚铁经氧化而成三价铁,颜色变成红棕色
特别是裂缝部位或有空隙的部位,还有暴露在外的截面部分也容易氧化而成红棕色
6FeO+O2 2Fe3O4
4. 氧化物
4.3 化学性质
4.3.3 与氧气反应
铁的氢氧化物
03
Fe(OH)2
Fe(OH)3
5. 氢氧化物
5.1 颜色
白色
红褐色
问题解决
写出生成Fe(OH)2、Fe(OH)3的离子方程式。
Fe3++3OH-= Fe(OH)3↓
Fe2++2OH-= Fe(OH)2↓
碱与盐
5. 氢氧化物
5.2 制备
实验探究
白色
灰绿色
红褐色
红褐色
请你试一试
Fe(OH)2
Fe(OH)3
+2
O2
+3
Fe(OH)2+O2→Fe(OH)3
请配平
Fe(OH)2+O2→Fe(OH)3
+2
+3
失去
e-
0
-2
得到
4e-
4
×
×
1
4Fe(OH)2+1O2→Fe(OH)3
4Fe(OH)2+1O2→4Fe(OH)3
4Fe(OH)2+1O2 →4Fe(OH)3
2H2O
+
请你试一试
实验探究
你认为如何制备氢氧化亚铁?
生成的白色絮状沉淀
迅速变成灰绿色
过一段时间后变为红褐色
5. 氢氧化物
5.3 化学性质
5.3.1 还原性
回顾练习
写出Fe(OH)2 、 Fe(OH)3
分别与盐酸反应的离子方程式。
Fe(OH)3+3H+=Fe2++3H2O
Fe(OH)2+H+→Fe3++ NO↑+ H2O
与硝酸发生氧化还原反应
5. 氢氧化物
5.3 化学性质
5.3.2 碱性
Fe(OH)2+2H+=Fe2++2H2O
问题探究
溶液中的 可通过加BaCl2溶液,测定沉淀质量可求解。
然而溶液中的Fe3+则不能通过加NaOH溶液,测定沉淀质量来求解。
这是为什么?应进一步如何操作?
5. 氢氧化物
5.3 化学性质
5.3.3 热稳定性
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
铁的性质及碱的性质与制备
弱 氧化剂
Fe2+
Fe3+
强 氧化剂
碱
碱
钝化
酸
酸
浓硫酸
浓硝酸
看谁做得既准又快
下列可用于吸收食品包装袋内的氧气和水分的物质是
A.氯化钙
B.炭粉
C.铁粉
D.生石灰
看谁做得既准又快
下列物质中,在一定条件下能将铁元素从0价转变为+3价的是
A.氯气
B.稀盐酸
C.CuCl2溶液
D.ZnCl2溶液
成功体验
将铁片投入到下列溶液中,不放出气体并且铁片质量增重的是
A.CuCl2溶液
B.HCl溶液
C.ZnSO4溶液
D.FeCl2溶液
探究 · 拓展
物质 开始沉淀 沉淀完全
Fe(OH)3 2.7 3.7
Fe(OH)2 7.6 9.6
Cu(OH)2 4.4 6.4
某Cu2+溶液中含有Fe2+,如何除去Fe2+?
不同金属离子在溶液中开始沉淀与完全沉淀pH如下:
① 能直接加碱沉淀?
② 根据沉淀pH不同,应如何处理?
探究 · 拓展
感谢观看
