3.2《金属材料——物质的量在方程式计算中应用》(第二课时)课件(共45张PPT)
文档属性
| 名称 | 3.2《金属材料——物质的量在方程式计算中应用》(第二课时)课件(共45张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 18:01:29 | ||
图片预览











文档简介
(共45张PPT)
我们愈是学习,愈觉得自己的贫乏。 ——雪莱
问题解决
为什么产生的H2和O2的体积比为2 : 1?
若电解18 g的水能产生多少升的H2(标准状况下)?
Application of the quantity of substance in the calculation of chemical equations
第二课时
第三章 第二节
物质的量在化学方程式计算中的应用
学习目标
解题计算步骤与注意事项
2
多步反应计算的解法
3
化学计量数与有关量的关系
1
氧化还原反应计算的解法
4
问题解决
为什么产生的H2和O2的体积比为2 : 1?
化学计量数与有关量的关系
01
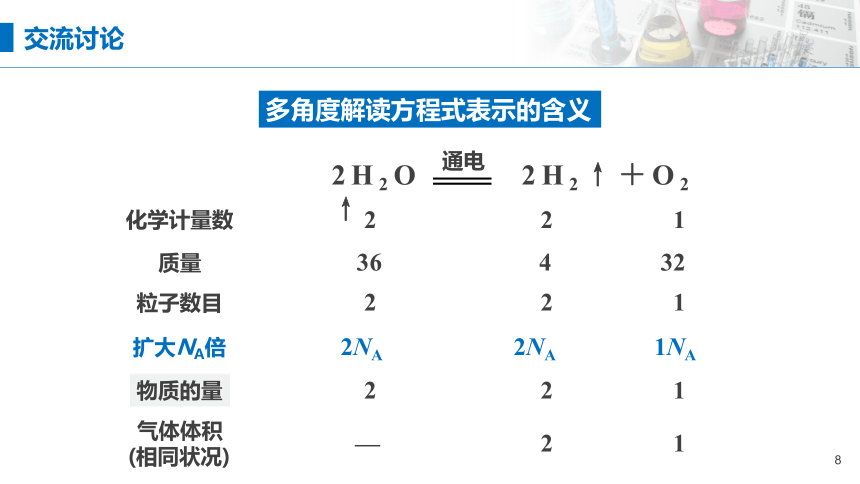
2H2O 2H2↑+O2 ↑
多角度解读方程式表示的含义
化学计量数
质量
粒子数目
物质的量
2
2
1
36
4
32
2
2
1
扩大NA倍
2NA
2NA
1NA
2
2
1
通电
气体体积
(相同状况)
—
2
1
交流讨论
化学方程式中各物质的化学计量数之比等于
各粒子个数之比
各物质的物质的量之比
各气体的体积之比(相同状况)
1. 化学计量数与有关量的关系
若电解18 g的水能产生多少升的H2(标准状况下)?
问题解决
解题步骤及注意事项
02
若电解18 g的水能产生多少升的H2(标准状况下)?
2H2O 2H2↑+O2↑
通电
2×18 g
2×2 g
18 g
m(H2)
2×18 g
18 g
=
解:
2×2 g
m(H2)
m(H2)
=
2 g
n(H2) =
2 g
2 g·mol-1
=
1 mol
V(H2) =
1 mol
×
22.4 L·mol-1
=
22.4 L
答:
生成的氢气体积为22.4 L。
问题解决
解:
2H2O 2H2↑+O2↑
通电
2×18 g
2 mol
18 g
n(H2)
=
2×18 g
18 g
2 mol
n(H2)
n(H2)
=
1 mol
V(H2) =
1 mol
×
22.4 L·mol-1
=
22.4 L
若电解18 g的水能产生多少升的H2(标准状况下)?
问题解决
答:
生成的氢气体积为22.4 L。
解:
18 g的物质的量为:
n(H2O)
=
18 g
18 g·mol-1
=
1 mol
2H2O 2H2↑+O2↑
通电
2 mol
2 mol
1 mol
n(H2)
=
2 mol
1 mol
2 mol
n(H2)
n(H2)
=
1 mol
V(H2) =
1 mol
×
22.4 L·mol-1
=
22.4 L
感受 · 理解
答:
生成的氢气体积为22.4 L。
若电解18 g的水能产生多少升的H2(标准状况下)?
将已知物理量转化为物质的量
转
写出相关的方程式
写
在有关物质的化学式下面标出已知量和未知量
标
列出比例式
列
根据比例式求解
解
简明写出答案
答
2.1 解题步骤
2. 解题步骤和注意事项
解:
18 g的物质的量为:
n(H2O)
=
18 g
18 g·mol-1
=
1 mol
2H2O 2H2↑+O2↑
通电
2 mol
2×22.4 L·mol-1
1 mol
V(H2)
=
2 mol
1 mol
2×22.4 L·mol-1
V(H2)
V(H2) =
22.4 L
若电解18 g的水能产生多少升的H2(标准状况下)?
答:
生成的氢气体积为22.4 L。
感受 · 理解
2H2O 2H2↑+O2↑
通电
36 g
44.8 L
1 mol
V(H2)
=
36 g
1 mol
44.8 L
V(H2)
V(H2) =
1.2 L
上下单位不相同
若电解18 g的水能产生多少升的H2(标准状况下)?
感受 · 理解
解:
18 g的物质的量为:
n(H2O)
=
18 g
18 g·mol-1
=
1 mol
答:
生成的氢气体积为1.2 L。
01
上下单位相同
g
g
mol
mol
L
L
02
左右单位相当
g
g
mol
mol
L
L
g
moL
g
L
mol
L
03
不纯物要化为纯物质的有关量代入计算
2.2 注意事项
2. 解题步骤和注意事项
若实验室用二氧化锰与浓盐酸加热制备11.2 L的Cl2(标准状况下),求:
(1)参加反应的二氧化锰的质量。
(2)被氧化的HCl的物质的量。
你学会了吗?
多步反应的计算
03
把CO还原Fe2O3所生成的CO2通入澄清石灰水中生成沉淀,若将沉淀过滤、烘干后称得质量为10 g。求:至少需要通入多少克CO?
解:
n(CaCO3)
=
10 g
100 g·mol-1
=
0.1 mol
CO2+Ca(OH)2 = CaCO3↓ +H2O
1 mol
1 mol
0.1 mol
0.1 mol
3CO+Fe2O3 2Fe+3CO2
64 g
3 mol
0.1 mol
2.8 g
答:
至少需通入2.8 g的CO。
问题解决
解:
n(CaCO3)
=
10 g
100 g·mol-1
=
0.1 mol
CO2+Ca(OH)2 = CaCO3↓ +H2O
3CO+Fe2O3 2Fe+3CO2
3CO
CO ~ CaCO3
3CaCO3
3CO2
~
~
28 g
1 mol
0.1 mol
2.8 g
把CO还原Fe2O3所生成的CO2通入澄清石灰水中生成沉淀,若将沉淀过滤、烘干后称得质量为10 g。求:至少需要通入多少克CO?
问题解决
答:
至少需通入2.8 g的CO。
温馨
提醒
关系式法
1
2
也可根据某元素守恒来列关系式
有时也将可各方程式叠加
3. 多步反应计算
据每步方程式,找出有关物质之间量的关系
确定已知物质和所求物质之间量的关系
据已知物质、所求物质间的量关系和已知条件进行计算
写出各步反应的方程式
二氧化氯(ClO2)泡腾片由NaClO2、固体酸及辅助剂混合制得,是一种用来消毒的家庭用品。使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出ClO2反应a:5ClO2-+4H+=4ClO2+Cl-+2H2O。
注:ClO2是一种易溶于水的气体。
请你试一试
请你试一试
测定二氧化氯泡腾片有效成分的含量。
i.取1片二氧化氯泡腾片,加稀硫酸充分溶解。
ii.通N2将ClO2吹出,并用过量的硫酸和淀粉碘化钾溶液吸收。
iii.用x mol·L-1Na2S2O3溶液滴定生成的I2,消耗Na2S2O3溶液的体积为y mL。
有关反应方程式为:
2ClO2+10I-+8H+=5I2+2Cl-+4H2O I2+2S2O32-=2I-+S4O62—。
二氧化氯泡腾片有效成分的含量为_________mg/片(以ClO2计)。
x mol·L-1×y mL×10-3 L·mL-1
n(S2O32-)
=
=
10-3 xy mol
2ClO2
~
5I2
~
10S2O32-
2 mol
10 mol
n(ClO2)
10-3 xy mol
2 mol
n(ClO2)
=
10 mol
10-3 xy mol
n(ClO2)
=
2×10-4xy mol
m(ClO2)=67.5 g·mol-1×2×10-4 xy mol=0.0135 xy g=13.5 xy mg
请你试一试
9 g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A.8 g B.9 g C.12 g D.13.5 g
2Na2O2+2CO2=2Na2CO3+O2
2CO+2Na2O2=2Na2CO3
2Na2O2+2H2O=4NaOH+O2↑
2H2+2Na2O2=4NaOH
质量增重为CO的质量
质量增重为H2的质量
考考你的智慧
看谁做得既准又快
实验室用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl 2↑+8H2O制备氯气,若参加反应的氧化剂为0.2 mol,则被氧化的还原剂的物质的量为
A.1.6 mol
B.3.2 mol
C.0.2 mol
D.1 mol
用双线桥表示电子转移方向和数目:
10 ×
2 ×
2 mol
被氧化
10 mol
0.2 mol
1 mol
感受 · 理解
电子得失原理应用
04
KMnO4与HCl(浓) 反应生成KCl 、MnCl2 、Cl 2 和H2O制备氯气,若参加反应的氧化剂为0.2 mol,求被氧化的还原剂的物质的量。
KMnO4得电子
HCl失电子
的数目
的数目
有何关系
相等
看我七十二变
0.2 mol
×
5
n(HCl)
×
1
=
n(HCl)=1 mol
思考 · 运用
解析
1
2
依据
氧化剂得电子总数与还原剂失电子总数相等
步骤
找物质
氧化剂
还原产物
还原剂
氧化产物
定得失
确定1个粒子得失电子数
化合价变化值×变价原子个数
列关系
n(氧化剂)×1个粒子得电子数
n(还原剂)×1个粒子得失子数
4. 电子守恒法
ClO2是广谱型的消毒剂,用于自来水的消毒。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化的反应制得,在以上反应中NaClO3和Na2SO3的物质的量比为_________。
Na2SO3
-2e-
Na2SO4
NaClO3
+1e-
ClO2
n(NaClO3)×1
+5
+4
+4
+6
n(Na2SO3)×2
n(NaClO3)
n(Na2SO3)
∶
=
2∶1
牛刀小试
实验室将NaClO3和Na2SO3按物质的量比2 ∶ 1倒入烧瓶 中,用水浴加热,同时滴入硫酸溶液,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应(Na2SO3生成Na2SO4),则X为
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
Na2SO3
-2e-
Na2SO4
NaClO3
+(5-x)e-
Cl
+5
x
+4
+6
n(NaClO3)×1
n(Na2SO3)×2
2 mol×(5-x)
1 mol×2
x
4
看我七十二变
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
1
规范
解:
答:
2
注意
上下单位相同
左右单位相当
物质的量应用于化学方程式计算中的应用
找关系式
3
多步反应
据电子得失相等
4
氧化还原反应
有两份质量相同的NaHCO3固体,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸充分反应,则它们所消耗的盐酸的体积比为
A.2∶1 B.1∶1 C.1∶2 D.4∶1
看谁做得既准又快
第一份
NaHCO3+HCl=NaCl+H2O+CO2↑
84 36.5
2×84 106
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 36.5×2
耗用的盐酸量相等
84 g
36.5 g
第二份
84 g
53 g
53 g
36.5 g
看谁做得既准又快
不论NaHCO3是直接与酸反应,还是受热分解后的固体再与酸反应,其中的Na+均转化为NaCl,因Na+的量一定,则需Cl-的量一定,即需盐酸的量一定,所以由守恒法可直接判断出消耗的盐酸的量相等。
本题可从Na+守恒角度考虑。无论NaHCO3是直接与盐酸反应,还是先加热分解再与盐酸反应,Na+的量不变,生成的NaCl的量相等,则消耗盐酸的量相等。
NaHCO3
NaCl
HCl
有两份质量相同的NaHCO3固体,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸充分反应,则它们所消耗的盐酸的体积比为
CO2 H2O
Na2CO3
HCl
NaCl
加热
看谁做得既准又快
在KI和KIO3混合溶液中加入稀硫酸,发生反应,生成碘、硫酸钾和水。此反应中被氧化的碘元素与被还原的碘元素的物质的量比是
KI
失去1e-
I2
KIO3
得到5e-
I2
n(KI)
×
1
n(KIO3)
×
5
=
KI中碘被氧化,KIO3中碘被还原
n(KI)
∶
n(KIO3)
=
5∶1
考考你自己
A.5∶1 B.2∶1 C.1∶3 D.1∶5
解析
+
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定 NaClO、NaClO3的浓度之比为1 ∶ 3,则Cl2与NaOH溶液反应时被还原的氯与被氧化的氯的物质的量之比为_________。
Cl2
+1e-
Cl-
0
-1
Cl2
-1e-
NaClO
0
+1
Cl2
-5e-
NaClO3
0
+5
n(Cl -)×1
n(NaClO)×1
n(NaClO3)×5
=
n(Cl -)×1
=
1×1
+
3×5
n(Cl -)
=
16
16
∶
(1+3)
=
4∶1
考考你的智慧
“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为________。(计算结果保留两位小数)
已知:NaClO2的还原产物是NaCl
挑战自我
NaClO2
+4e-
NaCl
Cl2
+2e-
NaCl
细菌失电子,两含氯消毒剂得电子数相等。
设所需Cl2质量为x
×
4
×
2
=
x=1.57
解析:
挑战自我
感谢观看
我们愈是学习,愈觉得自己的贫乏。 ——雪莱
问题解决
为什么产生的H2和O2的体积比为2 : 1?
若电解18 g的水能产生多少升的H2(标准状况下)?
Application of the quantity of substance in the calculation of chemical equations
第二课时
第三章 第二节
物质的量在化学方程式计算中的应用
学习目标
解题计算步骤与注意事项
2
多步反应计算的解法
3
化学计量数与有关量的关系
1
氧化还原反应计算的解法
4
问题解决
为什么产生的H2和O2的体积比为2 : 1?
化学计量数与有关量的关系
01
2H2O 2H2↑+O2 ↑
多角度解读方程式表示的含义
化学计量数
质量
粒子数目
物质的量
2
2
1
36
4
32
2
2
1
扩大NA倍
2NA
2NA
1NA
2
2
1
通电
气体体积
(相同状况)
—
2
1
交流讨论
化学方程式中各物质的化学计量数之比等于
各粒子个数之比
各物质的物质的量之比
各气体的体积之比(相同状况)
1. 化学计量数与有关量的关系
若电解18 g的水能产生多少升的H2(标准状况下)?
问题解决
解题步骤及注意事项
02
若电解18 g的水能产生多少升的H2(标准状况下)?
2H2O 2H2↑+O2↑
通电
2×18 g
2×2 g
18 g
m(H2)
2×18 g
18 g
=
解:
2×2 g
m(H2)
m(H2)
=
2 g
n(H2) =
2 g
2 g·mol-1
=
1 mol
V(H2) =
1 mol
×
22.4 L·mol-1
=
22.4 L
答:
生成的氢气体积为22.4 L。
问题解决
解:
2H2O 2H2↑+O2↑
通电
2×18 g
2 mol
18 g
n(H2)
=
2×18 g
18 g
2 mol
n(H2)
n(H2)
=
1 mol
V(H2) =
1 mol
×
22.4 L·mol-1
=
22.4 L
若电解18 g的水能产生多少升的H2(标准状况下)?
问题解决
答:
生成的氢气体积为22.4 L。
解:
18 g的物质的量为:
n(H2O)
=
18 g
18 g·mol-1
=
1 mol
2H2O 2H2↑+O2↑
通电
2 mol
2 mol
1 mol
n(H2)
=
2 mol
1 mol
2 mol
n(H2)
n(H2)
=
1 mol
V(H2) =
1 mol
×
22.4 L·mol-1
=
22.4 L
感受 · 理解
答:
生成的氢气体积为22.4 L。
若电解18 g的水能产生多少升的H2(标准状况下)?
将已知物理量转化为物质的量
转
写出相关的方程式
写
在有关物质的化学式下面标出已知量和未知量
标
列出比例式
列
根据比例式求解
解
简明写出答案
答
2.1 解题步骤
2. 解题步骤和注意事项
解:
18 g的物质的量为:
n(H2O)
=
18 g
18 g·mol-1
=
1 mol
2H2O 2H2↑+O2↑
通电
2 mol
2×22.4 L·mol-1
1 mol
V(H2)
=
2 mol
1 mol
2×22.4 L·mol-1
V(H2)
V(H2) =
22.4 L
若电解18 g的水能产生多少升的H2(标准状况下)?
答:
生成的氢气体积为22.4 L。
感受 · 理解
2H2O 2H2↑+O2↑
通电
36 g
44.8 L
1 mol
V(H2)
=
36 g
1 mol
44.8 L
V(H2)
V(H2) =
1.2 L
上下单位不相同
若电解18 g的水能产生多少升的H2(标准状况下)?
感受 · 理解
解:
18 g的物质的量为:
n(H2O)
=
18 g
18 g·mol-1
=
1 mol
答:
生成的氢气体积为1.2 L。
01
上下单位相同
g
g
mol
mol
L
L
02
左右单位相当
g
g
mol
mol
L
L
g
moL
g
L
mol
L
03
不纯物要化为纯物质的有关量代入计算
2.2 注意事项
2. 解题步骤和注意事项
若实验室用二氧化锰与浓盐酸加热制备11.2 L的Cl2(标准状况下),求:
(1)参加反应的二氧化锰的质量。
(2)被氧化的HCl的物质的量。
你学会了吗?
多步反应的计算
03
把CO还原Fe2O3所生成的CO2通入澄清石灰水中生成沉淀,若将沉淀过滤、烘干后称得质量为10 g。求:至少需要通入多少克CO?
解:
n(CaCO3)
=
10 g
100 g·mol-1
=
0.1 mol
CO2+Ca(OH)2 = CaCO3↓ +H2O
1 mol
1 mol
0.1 mol
0.1 mol
3CO+Fe2O3 2Fe+3CO2
64 g
3 mol
0.1 mol
2.8 g
答:
至少需通入2.8 g的CO。
问题解决
解:
n(CaCO3)
=
10 g
100 g·mol-1
=
0.1 mol
CO2+Ca(OH)2 = CaCO3↓ +H2O
3CO+Fe2O3 2Fe+3CO2
3CO
CO ~ CaCO3
3CaCO3
3CO2
~
~
28 g
1 mol
0.1 mol
2.8 g
把CO还原Fe2O3所生成的CO2通入澄清石灰水中生成沉淀,若将沉淀过滤、烘干后称得质量为10 g。求:至少需要通入多少克CO?
问题解决
答:
至少需通入2.8 g的CO。
温馨
提醒
关系式法
1
2
也可根据某元素守恒来列关系式
有时也将可各方程式叠加
3. 多步反应计算
据每步方程式,找出有关物质之间量的关系
确定已知物质和所求物质之间量的关系
据已知物质、所求物质间的量关系和已知条件进行计算
写出各步反应的方程式
二氧化氯(ClO2)泡腾片由NaClO2、固体酸及辅助剂混合制得,是一种用来消毒的家庭用品。使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出ClO2反应a:5ClO2-+4H+=4ClO2+Cl-+2H2O。
注:ClO2是一种易溶于水的气体。
请你试一试
请你试一试
测定二氧化氯泡腾片有效成分的含量。
i.取1片二氧化氯泡腾片,加稀硫酸充分溶解。
ii.通N2将ClO2吹出,并用过量的硫酸和淀粉碘化钾溶液吸收。
iii.用x mol·L-1Na2S2O3溶液滴定生成的I2,消耗Na2S2O3溶液的体积为y mL。
有关反应方程式为:
2ClO2+10I-+8H+=5I2+2Cl-+4H2O I2+2S2O32-=2I-+S4O62—。
二氧化氯泡腾片有效成分的含量为_________mg/片(以ClO2计)。
x mol·L-1×y mL×10-3 L·mL-1
n(S2O32-)
=
=
10-3 xy mol
2ClO2
~
5I2
~
10S2O32-
2 mol
10 mol
n(ClO2)
10-3 xy mol
2 mol
n(ClO2)
=
10 mol
10-3 xy mol
n(ClO2)
=
2×10-4xy mol
m(ClO2)=67.5 g·mol-1×2×10-4 xy mol=0.0135 xy g=13.5 xy mg
请你试一试
9 g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A.8 g B.9 g C.12 g D.13.5 g
2Na2O2+2CO2=2Na2CO3+O2
2CO+2Na2O2=2Na2CO3
2Na2O2+2H2O=4NaOH+O2↑
2H2+2Na2O2=4NaOH
质量增重为CO的质量
质量增重为H2的质量
考考你的智慧
看谁做得既准又快
实验室用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl 2↑+8H2O制备氯气,若参加反应的氧化剂为0.2 mol,则被氧化的还原剂的物质的量为
A.1.6 mol
B.3.2 mol
C.0.2 mol
D.1 mol
用双线桥表示电子转移方向和数目:
10 ×
2 ×
2 mol
被氧化
10 mol
0.2 mol
1 mol
感受 · 理解
电子得失原理应用
04
KMnO4与HCl(浓) 反应生成KCl 、MnCl2 、Cl 2 和H2O制备氯气,若参加反应的氧化剂为0.2 mol,求被氧化的还原剂的物质的量。
KMnO4得电子
HCl失电子
的数目
的数目
有何关系
相等
看我七十二变
0.2 mol
×
5
n(HCl)
×
1
=
n(HCl)=1 mol
思考 · 运用
解析
1
2
依据
氧化剂得电子总数与还原剂失电子总数相等
步骤
找物质
氧化剂
还原产物
还原剂
氧化产物
定得失
确定1个粒子得失电子数
化合价变化值×变价原子个数
列关系
n(氧化剂)×1个粒子得电子数
n(还原剂)×1个粒子得失子数
4. 电子守恒法
ClO2是广谱型的消毒剂,用于自来水的消毒。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化的反应制得,在以上反应中NaClO3和Na2SO3的物质的量比为_________。
Na2SO3
-2e-
Na2SO4
NaClO3
+1e-
ClO2
n(NaClO3)×1
+5
+4
+4
+6
n(Na2SO3)×2
n(NaClO3)
n(Na2SO3)
∶
=
2∶1
牛刀小试
实验室将NaClO3和Na2SO3按物质的量比2 ∶ 1倒入烧瓶 中,用水浴加热,同时滴入硫酸溶液,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应(Na2SO3生成Na2SO4),则X为
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
Na2SO3
-2e-
Na2SO4
NaClO3
+(5-x)e-
Cl
+5
x
+4
+6
n(NaClO3)×1
n(Na2SO3)×2
2 mol×(5-x)
1 mol×2
x
4
看我七十二变
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
1
规范
解:
答:
2
注意
上下单位相同
左右单位相当
物质的量应用于化学方程式计算中的应用
找关系式
3
多步反应
据电子得失相等
4
氧化还原反应
有两份质量相同的NaHCO3固体,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸充分反应,则它们所消耗的盐酸的体积比为
A.2∶1 B.1∶1 C.1∶2 D.4∶1
看谁做得既准又快
第一份
NaHCO3+HCl=NaCl+H2O+CO2↑
84 36.5
2×84 106
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 36.5×2
耗用的盐酸量相等
84 g
36.5 g
第二份
84 g
53 g
53 g
36.5 g
看谁做得既准又快
不论NaHCO3是直接与酸反应,还是受热分解后的固体再与酸反应,其中的Na+均转化为NaCl,因Na+的量一定,则需Cl-的量一定,即需盐酸的量一定,所以由守恒法可直接判断出消耗的盐酸的量相等。
本题可从Na+守恒角度考虑。无论NaHCO3是直接与盐酸反应,还是先加热分解再与盐酸反应,Na+的量不变,生成的NaCl的量相等,则消耗盐酸的量相等。
NaHCO3
NaCl
HCl
有两份质量相同的NaHCO3固体,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸充分反应,则它们所消耗的盐酸的体积比为
CO2 H2O
Na2CO3
HCl
NaCl
加热
看谁做得既准又快
在KI和KIO3混合溶液中加入稀硫酸,发生反应,生成碘、硫酸钾和水。此反应中被氧化的碘元素与被还原的碘元素的物质的量比是
KI
失去1e-
I2
KIO3
得到5e-
I2
n(KI)
×
1
n(KIO3)
×
5
=
KI中碘被氧化,KIO3中碘被还原
n(KI)
∶
n(KIO3)
=
5∶1
考考你自己
A.5∶1 B.2∶1 C.1∶3 D.1∶5
解析
+
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定 NaClO、NaClO3的浓度之比为1 ∶ 3,则Cl2与NaOH溶液反应时被还原的氯与被氧化的氯的物质的量之比为_________。
Cl2
+1e-
Cl-
0
-1
Cl2
-1e-
NaClO
0
+1
Cl2
-5e-
NaClO3
0
+5
n(Cl -)×1
n(NaClO)×1
n(NaClO3)×5
=
n(Cl -)×1
=
1×1
+
3×5
n(Cl -)
=
16
16
∶
(1+3)
=
4∶1
考考你的智慧
“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为________。(计算结果保留两位小数)
已知:NaClO2的还原产物是NaCl
挑战自我
NaClO2
+4e-
NaCl
Cl2
+2e-
NaCl
细菌失电子,两含氯消毒剂得电子数相等。
设所需Cl2质量为x
×
4
×
2
=
x=1.57
解析:
挑战自我
感谢观看
