4.2《元素周期律——元素周期律》(第一课时)课件(共85张PPT)
文档属性
| 名称 | 4.2《元素周期律——元素周期律》(第一课时)课件(共85张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 19.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 18:06:43 | ||
图片预览








文档简介
(共85张PPT)
门捷列夫
天才就是这样
终身努力便成天才
元素周期律
第一课时
第四章 第二节
法国的古名为
“家里亚”
放在手中会熔化的金属镓
布瓦博德朗
门捷列夫
1875年发现一种新元素,将其命名为镓(纪念法国)
并公布了所测镓的主要性质
比重为4.70
您所说的镓就是我四年前所预言的“类铝”
它的比重应该为5.9左右
请您再测一下吧
镓的比重是 5.94
同学们,你们知道是什么神奇的规律让门捷列夫大胆的猜测镓的性质吗?
镓的故事
化学王国的宪法
元素周期律
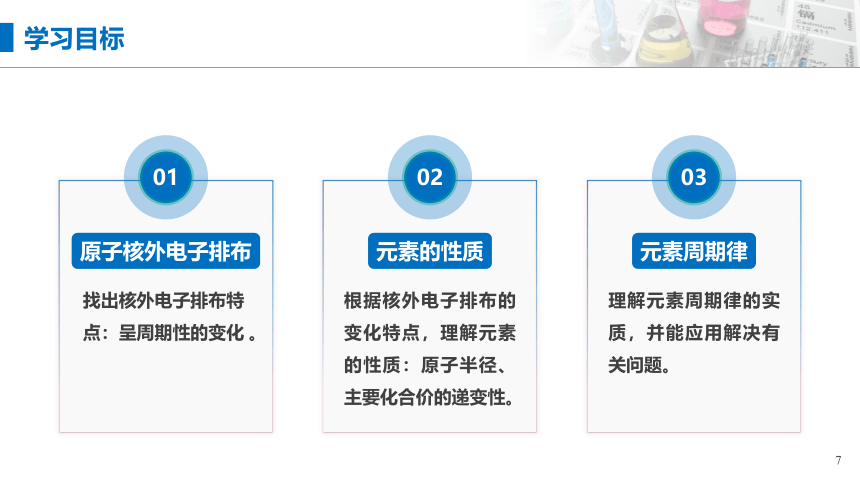
学习目标
01
原子核外电子排布
找出核外电子排布特点:呈周期性的变化 。
02
元素的性质
根据核外电子排布的变化特点,理解元素的性质:原子半径、主要化合价的递变性。
03
元素周期律
理解元素周期律的实质,并能应用解决有关问题。
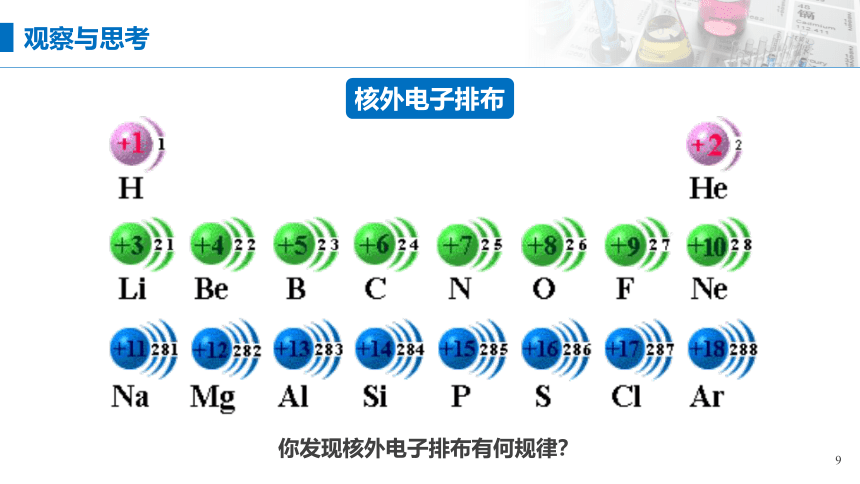
核外电子排布
01
最外层电子数变化
你发现核外电子排布有何规律?
核外电子排布
观察与思考
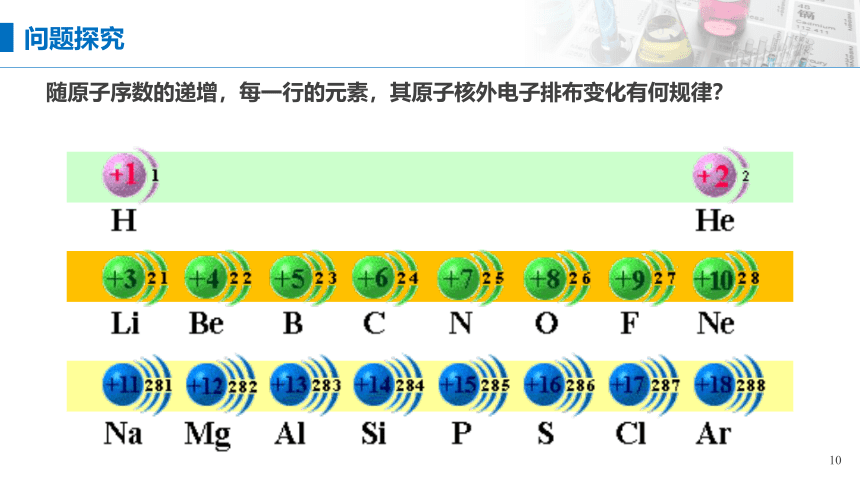
随原子序数的递增,每一行的元素,其原子核外电子排布变化有何规律?
问题探究
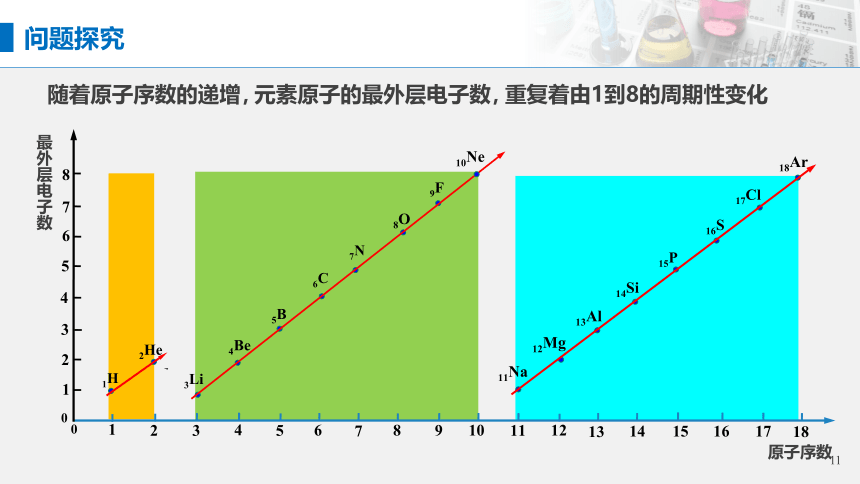
最外层电子数
随着原子序数的递增,
元素原子的最外层电子数,
重复着由1到8的周期性变化
原子序数
问题探究
随原子序数的递增,元素的核外最外层电子数呈周期性变化
1. 原子核外电子排布的周期性变化
结构
性质
原子半径
决定
主要化合价
金属性和非金属性
1. 原子核外电子排布的周期性变化
元素性质
02
原子半径
考考你的智慧
你认为每一行元素的原子半径,从左到右怎样变化?
原子序数 3 4 5 6 7 8 9
元素符号 Li Be B C N O F
原子半径 10-1 nm 1.52 0.89 0.82 0.77 0.75 0.74 0.71
原子序数 11 12 13 14 15 16 17
元素符号 Na Mg Al Si P S Cl
原子半径 10-1 nm 1.86 1.60 1.43 1.17 1.10 1.02 0.99
研究表中数据,原子半径随原子序数的递增,呈现什么规律性的变化?
资料在线
资料在线
元素(除稀有气体外)的原子半径,
重复着由大到小的周期性变化
原子半径变化规律探讨
原子核对核外电子吸引力
(电子层数相同)
质子数
原子半径
弱
强
问题探究
小
大
大
小
原子半径
规律性变化图
随原子序数的递增
原子半径呈周期性变化
2.1 原子半径
2. 元素性质
元素性质
03
主要化合价
元素 Na Mg Al Si P S Cl Ar
示 意 图
最高价 —
最低价 — — — —
元素的化合价(最高与与最低)最外层电子数有何关系?
+1
+2
+3
+4
-4
+5
-3
+6
-2
+7
-1
18
7
4
14
2
12
1
11
3
13
5
15
6
16
问题解决
判断下列元素的主要化合价
最高价
最低价
最高价=最外层电子数
(O、F例外)
负价=最外层电子数-8
2.2.1 一般规律
2.2 主要化合价
2. 元素性质
氟无正价,氧无最高价
温馨提示
思考 · 运用
找一找各元素的主要化合价
(最高正价、最低负价)
主要元素的化合价
主族元素的最高正化合价,重复着由+1到+7
随着原子序数的递增(除氢、稀有气体),
最低负化合价重复着由-4到-1的周期性变化
主族元素的最高正化合价,重复着由+1到+7
随着原子序数的递增(除氢、稀有气体),
随原子序数的递增,元素的主要化合价呈周期性变化
2.2.2 递变规律
2.2 主要化合价
2. 元素性质
你学会了吗?
原子序数从11依次增加到17,下列递变关系错误的是
A.电子层数不变
B.原子半径逐渐增大
C.最高正价数值逐渐增大
D.从硅到氯,负价从-4到-1
元素代号 X Y Z W
原子半径/pm 160 143 70 66
主要化合价 +2 +3 +5、+3、-3 -2
则四种元素分别为X_______ Y_______ Z_______ W_______
考考你的智慧
1至18号元素的原子半径及主要化合价如下表:
核外电子排布的周期变化
原子半径的周期性变化
元素主要化合价的周期性变化
原子半径、化合价较为抽象
比较平时接触较多的元素性质——金属性与非金属性
归纳与整理
元素性质的周期性变化
金属性与非金属性
04
概念判断
反应条件苛刻程度
反应速率快慢情况
反应现象是否明显
金属性判断
金属单质与水反应的难易
金属单质与水反应的难易
反应速率快慢
金属元素最高价氧化物
对应的水化物碱性
碱性强弱
金属性和非金属性判断依据
1
2
3
Na、Mg、Al、Si、P、S、Cl、Ar
如何设计实验证明三者金属性的强弱?
比较金属与水反应难易
比较金属与酸反应难易
比较最高价氧化物的水化物的碱性强弱
第三周期元素性质的递变探究
实验探究
Mg
蒸馏水
酚酞溶液
写出镁与热水反应的化学方程式。
比较镁、钠分别与水反应的情况。
Na Mg Al
与水 反应 与冷水反应
与热水反应 ——
与盐酸的反应 ——
最高价氧化物 对应水化物碱性
结论 问题探究
剧烈反应
不反应
反应较快
不反应
反应较慢
Mg
稀盐酸
Al
稀盐酸
实验探究
Na Mg Al
与水 反应 与冷水反应
与热水反应 ——
与盐酸的反应 ——
最高价氧化物 对应水化物碱性
结论 剧烈反应
不反应
反应较快
不反应
反应较慢
问题探究
剧烈反应
较为迅速
Na Mg Al
与水 反应 与冷水反应
与热水反应 ——
与盐酸的反应 ——
最高价氧化物 对应水化物碱性
结论 NaOH
强碱
Mg(OH)2
中强碱
剧烈反应
不反应
反应较快
不反应
反应较慢
问题探究
剧烈反应
较为迅速
氨水
AlCl3溶液
Al3++3NH3·H2O =Al(OH)3↓+ 3NH4+
实验探究
盐酸
NaOH溶液
Al(OH)3+3H+= Al3++3H2O
Al(OH)3+OH-= AlO2-+2H2O
碱性
酸性
两性氢氧化物
实验探究
Na Mg Al
与水 反应 与冷水反应
与热水反应 ——
与盐酸的反应 ——
最高价氧化物 对应水化物碱性
结论 NaOH
强碱
Mg(OH)2
中强碱
剧烈反应
不反应
反应较快
不反应
反应较慢
问题探究
剧烈反应
较为迅速
AI(OH)3
两性氢氧化物
金属性
Na>Mg>Al
随原子序数的递增,元素的金属性呈周期性变化
2.3.1 金属性
2.3 元素的金属性和非金属性
2. 元素性质
×
反应条件苛刻程度
反应速率快慢情况
反应现象是否明显
金属性判断
非金属单质与H2反应的难易
非金属氢化物的热稳定性
加热是否易分解
最高价氧化物
对应的水化物酸性
酸性强弱
金属性和非金属性判断依据
1
2
3
Na、Mg、Al、Si、P、S、Cl、Ar
如何设计实验证明三者非金属性的强弱?
比较非金属与氢气反应难易
比较非金属氢化物的稳定性
比较最高价氧化物的水化物的酸性强弱
第三周期元素性质的递变探究
元素 C N O F
最高价氧化物 —— ——
对应水化物 —— ——
元素 Si P S Cl
最高价氧化物
对应水化物
温馨提醒
CO2
N2O5
H2CO3
HNO3
SiO2
P2O5
SO3
Cl2O7
H2SiO2
H4SiO4
H3PO4
H2SO4
HCIO4
逐渐增强
14Si 15P 16S 17Cl
最高价氧化物
最高价氧化物水化物
酸性强弱
单质与H2反应条件
气态氢化物及稳定性
结论
P2O5
SO3
Cl2O7
H2SiO3
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
最强酸
逐渐增强
高温
加热
加热
点燃或光照
SiH4
PH3
H2S
HCl
逐渐降低
逐渐增强
增强
非金属性逐渐
很不稳定
不稳定
300℃
1000℃
随原子序数的递增,元素的金属性呈周期性变化
2.3.1 金属性
2.3 元素的金属性和非金属性
2. 元素性质
随原子序数的递增,元素的非金属性呈周期性变化
2.3.2 非金属性
归纳与整理
11~18号元素性质的变化中得出如下的结论:
Na Mg Al Si P S Cl
Ar
稀有气体元素
金属性逐渐减弱
非金属性逐渐增强
A.NH3比H2S沸点高
B.NH3比H2S热稳定性强
C.HNO3比H2SO3酸性强
D.HNO3比H2SO4挥发性强
归纳与整理
下列能说明氮元素比硫元素非金属性强的是
元素周期律
05
将元素各种性质的递变性,概括成一句话
决定
归纳
核外电子排布呈周期性变化
原子半径呈周期性变化
主要化合价呈周期性变化
元素金属性与非金属性呈周期性变化
原子结构的周期性变化
元素性质的周期性变化
元素周期律
随着原子序数的递增
而呈周期性变化
元素的性质随着元素原子序数的递增而呈周期性的变化
元素原子的核外电子排布的周期性变化
5. 元素周期律
概念
1
实质
2
在大学一年级时,他是全班28名学生中的第25名。
但他奋起直追,大学毕业时便跃居第一名,荣获金质奖章,二十三岁时成为副教授,三十一岁时成为教授。
什么是天才,
终身努力便成天才!
发现元素周期律时,有人说他是天才,他说
门捷列夫雕像
利用下图表示元素周期表中元素金属性、非金属性的递变规律,完成下列答题。
思考 · 讨论
非金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
金属性逐渐增强
1. 在图中4个箭号旁边的方框中,分别用简要的文字说明元素金属性和非金属性的递变规律。
思考 · 讨论
2. 在图中适当位置写出金属性最强的元素和非金属性最强的元素的符号(放射性元素除外)。
思考 · 讨论
Cs
F
非金属
金属
3. 指出图中虚线右上方、左下方区域的元素是金属元素还是非金属元素。
思考 · 讨论
4. 图中临近虚线两侧的元素既表现出一定的金属性,又表现出一定的非金属性。这给了我们什么启示?
思考 · 讨论
观察与思考
Si、Ge
6.1 寻找半导体材料
6. 元素周期律和元素周期表的应用
最活泼的金属元素是什么?
1
最活泼的非金属元素是什么?
2
交流讨论
周期
族
1
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅦA
ⅥA
0
Cs
B
Ge
Al
Si
At
As
Sb
Po
Te
金属性增强
金属性增强
非金属性增强
非金属性增强
F
观察与思考
Fe、Ni、Pt、Rh
过渡元素
(副族和Ⅷ族元素)
铱合金火花塞
6.2 寻找催化剂、耐高温耐腐蚀的合金材料
6. 元素周期律和元素周期表的应用
6.3 制造新农药
6. 元素周期律和元素周期表的应用
如铯有何化学性质?
6.4 发现新元素,预测原子结构和性质
6. 元素周期律和元素周期表的应用
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
非金属单质与H2化合的难易
非金属元素氢化物的热稳定性
最高价氧化物对应的水化物的酸性强弱
×
×
非金属性
判据
如何判断非金属性的强弱
1
2
3
金属单质与水反应的难易
金属氧化物对应的水化物碱性强弱
如何判断金属性的强弱
非金属性
判据
1
2
3
十分剧烈
较剧烈
强碱
中强碱
两性
金属单质与酸反应的快慢
金属性
与最高价氧化物对应水化物的碱性一致
非金属性
与氢化物的热稳定性及最高价氧化物水化物的酸性一致
温馨提醒
金属性
非金属性
逐渐减小
逐渐增加
随原子序数的递增,同周期元素的金属性、非金属性变化规律
归纳与整理
核电荷数
原子半径
失电子减小,得电子增强
逐渐增加
逐渐减小
金属性减弱,非金属性增加
同周期元素的金属性逐渐减小,金属性逐渐增强,请解释?
金属性逐渐减弱
金属性逐渐增强
非金属性逐渐增强
非金属性逐渐减弱
金属性和非金属性的递变性
随原子序数的递增
呈周期性变化
原子最外层电子数
原子半径
元素的主要化合价
元素的金属性
递变规律
元素的非金属性
课堂小结
元素周期律
课堂小结
元素
周期律
原子核外电子排
布的周期性变化
原子半径
主要化合价
金属性和非金属性
牛刀小试
某元素最高价氧化物对应水化物的化学式是H2XO3,则该元素的气态氢化物的化学式为
该元素的最高价氧化物的化学为_________
A.HX B.H2X C.XH3 D.XH4
A.酸性:H2SO4>H3PO4>H4SiO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S>HCl
D.非金属性:F>O>S
成功体验
下列各组中化合物的性质比较,不正确的是
A.钠的硬度比镁小
B.NaOH的碱性比Mg(OH)2强
C.钠的熔点比镁低
D.Na2O的熔点比MgO低
E.
F.
与水反应
与盐酸反应
请你试一试
能说明钠的金属性比镁强的事实是
A.气态氢化物的稳定性:HX>H2Y>ZH3
B.非金属活动性:Y<X<Z
C.原子半径:X>Y>Z
D.原子最外电子层上电子数的关系:Y=X+Z
考考你的智慧
已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。则下列说法正确的是
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成化合物具有弱酸性
D.Y和Z两者最高价氧化物对应的水化物能相互反应
看我七十二变
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
感谢观看
门捷列夫
天才就是这样
终身努力便成天才
元素周期律
第一课时
第四章 第二节
法国的古名为
“家里亚”
放在手中会熔化的金属镓
布瓦博德朗
门捷列夫
1875年发现一种新元素,将其命名为镓(纪念法国)
并公布了所测镓的主要性质
比重为4.70
您所说的镓就是我四年前所预言的“类铝”
它的比重应该为5.9左右
请您再测一下吧
镓的比重是 5.94
同学们,你们知道是什么神奇的规律让门捷列夫大胆的猜测镓的性质吗?
镓的故事
化学王国的宪法
元素周期律
学习目标
01
原子核外电子排布
找出核外电子排布特点:呈周期性的变化 。
02
元素的性质
根据核外电子排布的变化特点,理解元素的性质:原子半径、主要化合价的递变性。
03
元素周期律
理解元素周期律的实质,并能应用解决有关问题。
核外电子排布
01
最外层电子数变化
你发现核外电子排布有何规律?
核外电子排布
观察与思考
随原子序数的递增,每一行的元素,其原子核外电子排布变化有何规律?
问题探究
最外层电子数
随着原子序数的递增,
元素原子的最外层电子数,
重复着由1到8的周期性变化
原子序数
问题探究
随原子序数的递增,元素的核外最外层电子数呈周期性变化
1. 原子核外电子排布的周期性变化
结构
性质
原子半径
决定
主要化合价
金属性和非金属性
1. 原子核外电子排布的周期性变化
元素性质
02
原子半径
考考你的智慧
你认为每一行元素的原子半径,从左到右怎样变化?
原子序数 3 4 5 6 7 8 9
元素符号 Li Be B C N O F
原子半径 10-1 nm 1.52 0.89 0.82 0.77 0.75 0.74 0.71
原子序数 11 12 13 14 15 16 17
元素符号 Na Mg Al Si P S Cl
原子半径 10-1 nm 1.86 1.60 1.43 1.17 1.10 1.02 0.99
研究表中数据,原子半径随原子序数的递增,呈现什么规律性的变化?
资料在线
资料在线
元素(除稀有气体外)的原子半径,
重复着由大到小的周期性变化
原子半径变化规律探讨
原子核对核外电子吸引力
(电子层数相同)
质子数
原子半径
弱
强
问题探究
小
大
大
小
原子半径
规律性变化图
随原子序数的递增
原子半径呈周期性变化
2.1 原子半径
2. 元素性质
元素性质
03
主要化合价
元素 Na Mg Al Si P S Cl Ar
示 意 图
最高价 —
最低价 — — — —
元素的化合价(最高与与最低)最外层电子数有何关系?
+1
+2
+3
+4
-4
+5
-3
+6
-2
+7
-1
18
7
4
14
2
12
1
11
3
13
5
15
6
16
问题解决
判断下列元素的主要化合价
最高价
最低价
最高价=最外层电子数
(O、F例外)
负价=最外层电子数-8
2.2.1 一般规律
2.2 主要化合价
2. 元素性质
氟无正价,氧无最高价
温馨提示
思考 · 运用
找一找各元素的主要化合价
(最高正价、最低负价)
主要元素的化合价
主族元素的最高正化合价,重复着由+1到+7
随着原子序数的递增(除氢、稀有气体),
最低负化合价重复着由-4到-1的周期性变化
主族元素的最高正化合价,重复着由+1到+7
随着原子序数的递增(除氢、稀有气体),
随原子序数的递增,元素的主要化合价呈周期性变化
2.2.2 递变规律
2.2 主要化合价
2. 元素性质
你学会了吗?
原子序数从11依次增加到17,下列递变关系错误的是
A.电子层数不变
B.原子半径逐渐增大
C.最高正价数值逐渐增大
D.从硅到氯,负价从-4到-1
元素代号 X Y Z W
原子半径/pm 160 143 70 66
主要化合价 +2 +3 +5、+3、-3 -2
则四种元素分别为X_______ Y_______ Z_______ W_______
考考你的智慧
1至18号元素的原子半径及主要化合价如下表:
核外电子排布的周期变化
原子半径的周期性变化
元素主要化合价的周期性变化
原子半径、化合价较为抽象
比较平时接触较多的元素性质——金属性与非金属性
归纳与整理
元素性质的周期性变化
金属性与非金属性
04
概念判断
反应条件苛刻程度
反应速率快慢情况
反应现象是否明显
金属性判断
金属单质与水反应的难易
金属单质与水反应的难易
反应速率快慢
金属元素最高价氧化物
对应的水化物碱性
碱性强弱
金属性和非金属性判断依据
1
2
3
Na、Mg、Al、Si、P、S、Cl、Ar
如何设计实验证明三者金属性的强弱?
比较金属与水反应难易
比较金属与酸反应难易
比较最高价氧化物的水化物的碱性强弱
第三周期元素性质的递变探究
实验探究
Mg
蒸馏水
酚酞溶液
写出镁与热水反应的化学方程式。
比较镁、钠分别与水反应的情况。
Na Mg Al
与水 反应 与冷水反应
与热水反应 ——
与盐酸的反应 ——
最高价氧化物 对应水化物碱性
结论 问题探究
剧烈反应
不反应
反应较快
不反应
反应较慢
Mg
稀盐酸
Al
稀盐酸
实验探究
Na Mg Al
与水 反应 与冷水反应
与热水反应 ——
与盐酸的反应 ——
最高价氧化物 对应水化物碱性
结论 剧烈反应
不反应
反应较快
不反应
反应较慢
问题探究
剧烈反应
较为迅速
Na Mg Al
与水 反应 与冷水反应
与热水反应 ——
与盐酸的反应 ——
最高价氧化物 对应水化物碱性
结论 NaOH
强碱
Mg(OH)2
中强碱
剧烈反应
不反应
反应较快
不反应
反应较慢
问题探究
剧烈反应
较为迅速
氨水
AlCl3溶液
Al3++3NH3·H2O =Al(OH)3↓+ 3NH4+
实验探究
盐酸
NaOH溶液
Al(OH)3+3H+= Al3++3H2O
Al(OH)3+OH-= AlO2-+2H2O
碱性
酸性
两性氢氧化物
实验探究
Na Mg Al
与水 反应 与冷水反应
与热水反应 ——
与盐酸的反应 ——
最高价氧化物 对应水化物碱性
结论 NaOH
强碱
Mg(OH)2
中强碱
剧烈反应
不反应
反应较快
不反应
反应较慢
问题探究
剧烈反应
较为迅速
AI(OH)3
两性氢氧化物
金属性
Na>Mg>Al
随原子序数的递增,元素的金属性呈周期性变化
2.3.1 金属性
2.3 元素的金属性和非金属性
2. 元素性质
×
反应条件苛刻程度
反应速率快慢情况
反应现象是否明显
金属性判断
非金属单质与H2反应的难易
非金属氢化物的热稳定性
加热是否易分解
最高价氧化物
对应的水化物酸性
酸性强弱
金属性和非金属性判断依据
1
2
3
Na、Mg、Al、Si、P、S、Cl、Ar
如何设计实验证明三者非金属性的强弱?
比较非金属与氢气反应难易
比较非金属氢化物的稳定性
比较最高价氧化物的水化物的酸性强弱
第三周期元素性质的递变探究
元素 C N O F
最高价氧化物 —— ——
对应水化物 —— ——
元素 Si P S Cl
最高价氧化物
对应水化物
温馨提醒
CO2
N2O5
H2CO3
HNO3
SiO2
P2O5
SO3
Cl2O7
H2SiO2
H4SiO4
H3PO4
H2SO4
HCIO4
逐渐增强
14Si 15P 16S 17Cl
最高价氧化物
最高价氧化物水化物
酸性强弱
单质与H2反应条件
气态氢化物及稳定性
结论
P2O5
SO3
Cl2O7
H2SiO3
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
最强酸
逐渐增强
高温
加热
加热
点燃或光照
SiH4
PH3
H2S
HCl
逐渐降低
逐渐增强
增强
非金属性逐渐
很不稳定
不稳定
300℃
1000℃
随原子序数的递增,元素的金属性呈周期性变化
2.3.1 金属性
2.3 元素的金属性和非金属性
2. 元素性质
随原子序数的递增,元素的非金属性呈周期性变化
2.3.2 非金属性
归纳与整理
11~18号元素性质的变化中得出如下的结论:
Na Mg Al Si P S Cl
Ar
稀有气体元素
金属性逐渐减弱
非金属性逐渐增强
A.NH3比H2S沸点高
B.NH3比H2S热稳定性强
C.HNO3比H2SO3酸性强
D.HNO3比H2SO4挥发性强
归纳与整理
下列能说明氮元素比硫元素非金属性强的是
元素周期律
05
将元素各种性质的递变性,概括成一句话
决定
归纳
核外电子排布呈周期性变化
原子半径呈周期性变化
主要化合价呈周期性变化
元素金属性与非金属性呈周期性变化
原子结构的周期性变化
元素性质的周期性变化
元素周期律
随着原子序数的递增
而呈周期性变化
元素的性质随着元素原子序数的递增而呈周期性的变化
元素原子的核外电子排布的周期性变化
5. 元素周期律
概念
1
实质
2
在大学一年级时,他是全班28名学生中的第25名。
但他奋起直追,大学毕业时便跃居第一名,荣获金质奖章,二十三岁时成为副教授,三十一岁时成为教授。
什么是天才,
终身努力便成天才!
发现元素周期律时,有人说他是天才,他说
门捷列夫雕像
利用下图表示元素周期表中元素金属性、非金属性的递变规律,完成下列答题。
思考 · 讨论
非金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
金属性逐渐增强
1. 在图中4个箭号旁边的方框中,分别用简要的文字说明元素金属性和非金属性的递变规律。
思考 · 讨论
2. 在图中适当位置写出金属性最强的元素和非金属性最强的元素的符号(放射性元素除外)。
思考 · 讨论
Cs
F
非金属
金属
3. 指出图中虚线右上方、左下方区域的元素是金属元素还是非金属元素。
思考 · 讨论
4. 图中临近虚线两侧的元素既表现出一定的金属性,又表现出一定的非金属性。这给了我们什么启示?
思考 · 讨论
观察与思考
Si、Ge
6.1 寻找半导体材料
6. 元素周期律和元素周期表的应用
最活泼的金属元素是什么?
1
最活泼的非金属元素是什么?
2
交流讨论
周期
族
1
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅦA
ⅥA
0
Cs
B
Ge
Al
Si
At
As
Sb
Po
Te
金属性增强
金属性增强
非金属性增强
非金属性增强
F
观察与思考
Fe、Ni、Pt、Rh
过渡元素
(副族和Ⅷ族元素)
铱合金火花塞
6.2 寻找催化剂、耐高温耐腐蚀的合金材料
6. 元素周期律和元素周期表的应用
6.3 制造新农药
6. 元素周期律和元素周期表的应用
如铯有何化学性质?
6.4 发现新元素,预测原子结构和性质
6. 元素周期律和元素周期表的应用
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
非金属单质与H2化合的难易
非金属元素氢化物的热稳定性
最高价氧化物对应的水化物的酸性强弱
×
×
非金属性
判据
如何判断非金属性的强弱
1
2
3
金属单质与水反应的难易
金属氧化物对应的水化物碱性强弱
如何判断金属性的强弱
非金属性
判据
1
2
3
十分剧烈
较剧烈
强碱
中强碱
两性
金属单质与酸反应的快慢
金属性
与最高价氧化物对应水化物的碱性一致
非金属性
与氢化物的热稳定性及最高价氧化物水化物的酸性一致
温馨提醒
金属性
非金属性
逐渐减小
逐渐增加
随原子序数的递增,同周期元素的金属性、非金属性变化规律
归纳与整理
核电荷数
原子半径
失电子减小,得电子增强
逐渐增加
逐渐减小
金属性减弱,非金属性增加
同周期元素的金属性逐渐减小,金属性逐渐增强,请解释?
金属性逐渐减弱
金属性逐渐增强
非金属性逐渐增强
非金属性逐渐减弱
金属性和非金属性的递变性
随原子序数的递增
呈周期性变化
原子最外层电子数
原子半径
元素的主要化合价
元素的金属性
递变规律
元素的非金属性
课堂小结
元素周期律
课堂小结
元素
周期律
原子核外电子排
布的周期性变化
原子半径
主要化合价
金属性和非金属性
牛刀小试
某元素最高价氧化物对应水化物的化学式是H2XO3,则该元素的气态氢化物的化学式为
该元素的最高价氧化物的化学为_________
A.HX B.H2X C.XH3 D.XH4
A.酸性:H2SO4>H3PO4>H4SiO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S>HCl
D.非金属性:F>O>S
成功体验
下列各组中化合物的性质比较,不正确的是
A.钠的硬度比镁小
B.NaOH的碱性比Mg(OH)2强
C.钠的熔点比镁低
D.Na2O的熔点比MgO低
E.
F.
与水反应
与盐酸反应
请你试一试
能说明钠的金属性比镁强的事实是
A.气态氢化物的稳定性:HX>H2Y>ZH3
B.非金属活动性:Y<X<Z
C.原子半径:X>Y>Z
D.原子最外电子层上电子数的关系:Y=X+Z
考考你的智慧
已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。则下列说法正确的是
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成化合物具有弱酸性
D.Y和Z两者最高价氧化物对应的水化物能相互反应
看我七十二变
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
感谢观看
