第二章《整理提升-化学计算类型与技巧——过量、混合物、差量法及电子守恒计算》课件(共58张PPT)
文档属性
| 名称 | 第二章《整理提升-化学计算类型与技巧——过量、混合物、差量法及电子守恒计算》课件(共58张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 18:08:37 | ||
图片预览










文档简介
(共58张PPT)
——苏轼
古之立大志者,不惟有超世之才,亦必有坚韧不拔之志。
Types and techniques of chemical computation
整理与提升
化学计算类型与技巧
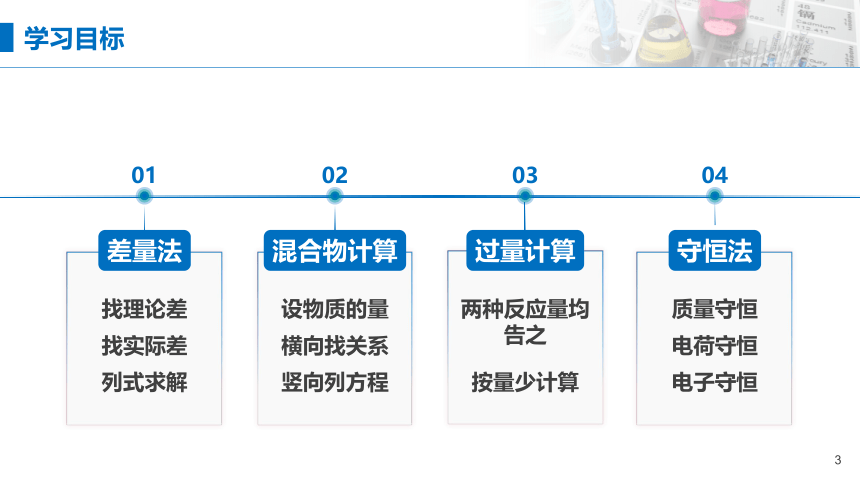
学习目标
02
04
找理论差
设物质的量
找实际差
列式求解
横向找关系
竖向列方程
两种反应量均告之
按量少计算
质量守恒
电荷守恒
电子守恒
03
01
混合物计算
守恒法
过量计算
差量法
差量法
01
请你试一试
78 gNa2O2中通入一定量的CO2气体后,固体质量为 92g ,求生成Na2CO3的物质的量。
2Na2O2+2CO2=2Na2CO3+O2
78 g-78 g/mol×x+106 g/mol×x=92 g
2Na2O2+2CO2=2Na2CO3+O2
156 g
212 g
56 g
2Na2O2+2CO2=2Na2CO3+O2
2 mol
56 g
92 g-78 g
n(Na2CO3)
n(Na2CO3)=0.5 mol
请你试一试
78 gNa2O2中通入一定量的CO2气体后,固体质量为 92g ,求生成Na2CO3的物质的量。
1.1.1 差量
指反应过程中反应物的某种物理量之和(始态量)与同一状态下生成物的相同物理量之和(终态量)的差。
1.1.2 物理量
可以是质量、物质的量、气体体积、气体压强、反应过程中的热效应等。
1. 差量法
1.1 原理
化学反应中反应物或生成物的量与差量成正比
1. 差量法
1.2 计算依据
一是明确产生差量的原因,并能根据化学方程式求出理论上的差值(理论差量)。
1. 差量法
1.3 解题关键
二是结合题中的条件求出实际的差值(实际差量)。
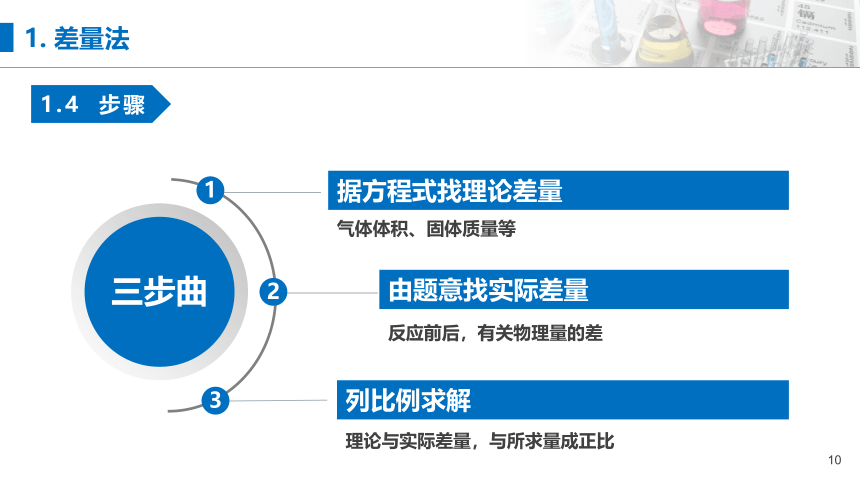
据方程式找理论差量
气体体积、固体质量等
1
2
3
由题意找实际差量
反应前后,有关物理量的差
列比例求解
理论与实际差量,与所求量成正比
三步曲
1. 差量法
1.4 步骤
考考你自己
常温下,在27.9 g水中溶解12.1 g Cu(NO3)2·3H2O ,恰好达到饱和。设该溶液密度为1.20 g /cm3 。
将一根质量为100 g的铁棒插入到该溶液中,一段时间后取出,洗净、干燥后称量,铁棒的质量变为100.2 g ,求此时溶液中Fe2+的物质的量浓度。(忽略溶液体积的变化)
1.20 g /cm3
Fe+Cu(NO3)2=Fe(NO3)2 +Cu
56 g
64 g
8 g
100.2 g-100 g
1 mol
n(Fe2+)
n(Fe2+)
1 mol
×
0.2 g
8 g
=
0.025 mol
=
V(Fe2+)
=
27.9 g+12.1 g
=
33.3 mL
0.0333 L
c(Fe2+)
=
0.025 mol
=
0.75 mol/L
考考你自己
混合物计算
02
请你试一试
CuO+FeO+H2 Cu+Fe+2H2O
氧化铜和氧化亚铁的混合物58 g ,通足量的氢气,完全反应后得到46 g固体。
求混合物中氧化铜的质量。
请你试一试
解
设CuO、FeO的物质的量分别为x、y
1 mol
1 mol
1 mol
1 mol
横向找关系
80 g/mol×x+72g/mol×y=58 g
64 g/mol×x+56g/mol×y=46 g
竖向列方程
解得
=
0.5 mol
=
0.25 mol
m(CuO)
=
0.5 mol×80 g/mol
=
40g
答
混合物中氧化铜的质量为40 g。
设××、××的物质的量分别为x、y
不论求什么量,均设为物质的量
2. 混合物计算
2.1 如何设
横向找关系
竖向列方程
2. 混合物计算
2.2 方法
审题
H2SO4
HCl
NaHCO3
CO2
0.05 mol
BaCl2
BaSO4
0.02 mol
你学会了吗?
将100 mL稀硫酸和稀盐酸的混合溶液为两等份,向其中一份加入足量NaHCO3 ,产生气体1.12 L(标准状况下);向另一份中加入足量BaCl2溶液,产生沉淀4.66 g 。
请计算原溶液中盐酸的物质的量浓度。
设H2SO4、HCl物质的量分别为x、y
解
H2SO4+2NaHCO3=Na2SO4+CO2↑+H2O
HCl+NaHCO3=NaCl+CO2↑+H2O
x+y=0.05 mol
解得:x=0.02 mol y=0.03 mol
H2SO4+BaCl2=BaSO4 ↓ +2HCl
1 mol 1 mol
c(HCl)=
=0.8 mol/L
0.03 mol
×
答
HCl物质的量浓度为0.8 mol/L。
你学会了吗?
过量计算
03
考考你的智慧
50 g CaCO3与足量的36.5%盐酸完全反应,求生成二氧化碳的质量。
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
50 g的36.5%盐酸与足量CaCO3完全反应,求生成二氧化碳的质量。
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
50 g CaCO3与50 g的36.5%盐酸完全反应,求生成二氧化碳的质量。
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
1 mol
2 mol
0.5 mol
0.5 mol
先假设一物质完全反应,再求出所另一物质的量
3. 过量计算
3.1 判过量
50 g CaCO3与50 g的36.5%盐酸完全反应,求生成二氧化碳的质量。
设CaCO3完全反应,需HCl物质的量为x
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
1 mol
2 mol
0.5 mol
x
x
=
0.5 mol
×
2 mol
1 mol
=
1 mol
>
0.5 mol
故盐酸少量
3. 过量计算
依量少的计算
3. 过量计算
3.2 计算
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
2 mol
1 mol
0.5 mol
x
x
=
0.5 mol
×
1 mol
2 mol
=
0.25mol
二氧化碳质量为:0.25 mol×44g/mol=11 g
3. 过量计算
50 g CaCO3与50 g的36.5%盐酸完全反应,求生成二氧化碳的质量。
设CaCO3完全反应,需HCl物质的量为x
在100 mL 0.1 mol/L NaOH溶液中,通入标准状况下二氧化碳0.224 L,求生成的盐的物质的量。
CO2+2NaOH=Na2CO3+H2O
1 mol
2 mol
0.01 mol
0.01 mol
CO2+2NaOH=Na2CO3+H2O
2 mol
1 mol
0.01 mol
0.005 mol
Na2CO3+CO2+H2O=2NaHCO3
0.005 mol
0.005 mol
0.01 mol
考考你的智慧
守恒法
04
将8.3 g由铝和锌的混合物加入到200 g稀硫酸中,恰好完全反应,将反应后的溶液小心蒸干,得到无水固体27.5 g ,求原稀硫酸中硫酸的物质的量。
请你试一试
8.3 g铝和锌反应后生成的盐为27.5 g,则SO42-2的质量为7.5 g-8.3 g =19.2 g
n(H2SO4)
=
n(SO42-)
=
19.2 g
96 g/mol
=
0.2 mol
4.1.1 根据某粒子在反应前后个数不变
4. 守恒法
4.1 质量守恒
4.1.2 根据反应前后质量差,求出某原子团或某物质的质量
某碳酸钠样品中含有氯化钠,现称量该样品中11g放入烧杯中,现加入50g稀盐酸,恰好完全反应,称得烧杯中的溶液质量为56.6g。求盐酸中HCl的物质的量。
你学会了吗?
11 g Na2CO3、NaCl与50 g盐酸反应后,生成的溶液为56.6 g,则生成CO2质量为:50 g+11 g-56.6 g =4.4 g,物质的量为0.1 mol。
Na2CO3+2HCl=2NaCl+CO2↑+H2O
2 mol
1 mol
0.1 mol
0.2 mol
确定产物成分
CO2+2KOH=K2CO3+H2O · · · · ①
CO2+KOH=KHCO3 · · · · ②
若按反应②进行: m(KHCO3)=0.1 mol×100 g/mol=10.0 g
若按反应①进行:m(K2CO3)=0.1 mol×138 g/mol=13.8 g
10.0 g<11.9 g<13.8 g
反应产物为K2CO3和KHCO3的混合物
问题解决
向300 mLKOH溶液中缓慢通往2.24 L(标准状态下) CO2 ,充分反应后在减压低温条件下蒸发所得溶液,得到了11.9 g白色固体。计算确实白色固体成分及KOH溶液的物质的量浓度?
CO2+2KOH=K2CO3+H2O · · · · ①
CO2+KOH=KHCO3 · · · · ②
y
x
x
y
x+y=0.01 mol
x×138 g/mol+y×100 g/mol=11.9 g
x=y=0.05 mol
n(KOH)=2x+y=0.15 mol
c(KOH)=0.15 mol/0.3 L=0.5 mol/L
KOH
CO2
K2CO3
KHCO3
0.01 mol
0.3 Lg
问题解决
设K2CO3和KHCO3的物质的量分别为x、y
据质量守恒:
x×138 g/mol+y×100 g/mol=11.9 g
据原子守恒:
x+y=0.01 mol
KOH
CO2
K2CO3
KHCO3
0.01 mol
0.3 Lg
问题解决
c(H+)×1+c(Cu2+)×2 +c(Fe3+)×3 =6 mol/L
c(H+)=1 mol/L
2HCl+Zn=ZnCl2+H2↑
请你试一试
某盐酸、 CuCl2、FeCl3的混合液100 ml ,若溶液中各阳离子物质的量浓度相等, Cl-总浓度为6 mol·L-1 ,则该溶液与足量锌反应,生成标准状况下H2的体积为多少升?
4.2.1 找出所有的阳离子和阴离子
4. 守恒法
4.2 电荷守恒
4.2.2 物质的量乘以化合价,二价、三价必须乘以2、3!
c(M+)×1+c(M2+)×2 +c(M3+)×3
c(R-)×1+c(R2-)×2 +c(R3-)×3
4.2.3 列式计算
考考你自己
某工厂用氯化铁溶液腐蚀铜板的废腐蚀液中:c(Fe3+)=1 mol/L, c(H+)=3 mol/L, c(Cl-)=15 mol/L,计算废腐蚀液中的Fe2+离子浓度。
Fe3+ Fe2+ H+ Cl-
1
3
15
x
2FeCl3+Cu =2FeCl2+CuCl2
x
x/2
Fe3+ Fe2+ H+ Cu2+ Cl-
1
3
15
x
x/2
工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为______。
2∶1
KClO3
+1e-
ClO2
Na2SO3
-2e-
Na2SO4
n(KClO3)
×
1
n(Na2SO3)
×
2
=
审清要求,防止答案搞反了!
解后反思
请你试一试
二氧化氯(ClO2 ,黄绿色易溶于水的气体)是高效、低毒的消毒剂。
找物质
1
2
3
定得失
列关系
氧化剂→还原产物 还原剂→氧化产物
确定1个粒子得失电子数
化合价变化值×变价原子个数
三步曲
n(氧化剂)×1个粒子得电子数
n(还原剂)×1个粒子得失子数
4. 守恒法
4.3 电子守恒
K2Cr2O7
+(6-x)× e-
Na2SO3
-2 e-
Na2SO4
20 mL×0.02mol/L
×
(6-x)×2
24mL×0.05 mol/L
×
2
=
x= 3
2
例题
24 mL 0.05 mol/L的Na2SO3溶液恰好与20 mL 0.02 mol/L的K2Cr2O7溶液完全反应后生成Na2SO4 ,求反应后Cr在还原产物中的化合价为____。
二氧化氯具有很强的氧化性,常用作消毒剂。则其消毒的能力是氯气______倍。(以等物质的量的物质得到的电子数表示)
二氧化氯具有很强的氧化性,常用作消毒剂。则其消毒的次序是氯气______倍。(以等质量的物质得到的电子数表示)
你学会了吗?
二氧化氯具有很强的氧化性,常用作消毒剂。则其消毒的次序是氯气______倍。(以等物质的量的物质得到的电子数表示)
ClO2
+5e-
Cl-
Cl2
+2e-
Cl-
你学会了吗?
你学会了吗?
二氧化氯具有很强的氧化性,常用作消毒剂。则其消毒的次序是氯气______倍。(以等质量的物质得到的电子数表示)
ClO2
+5e-
Cl-
Cl2
+2e-
Cl-
1 g
67.5 g·L-1
×
5
1 g
71 g·L-1
×
2
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
差量法计算
课堂小结
1.设
设××、××的物质的量分别为x、y
不论求什么量,均设为物质的量
2.技巧
横向找关系
竖向列方程
混合物计算
课堂小结
过量计算
课堂小结
1.判过量
先假设一物质完全反应,再求出所另一物质的量
2.依量少的计算
守恒法
质量守恒
电荷守恒
电子守恒
据质量差求出某微粒的质量
找全离子,一价可略去
有的是求产物,关注化学式中原子个数
守恒法计算
课堂小结
挑战自我
“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。 NaClO2的有效氯含量为________。(计算结果保留两位小数)
已知: NaClO2的还原产物是NaCl
NaClO2
+4e-
NaCl
Cl2
+2e-
NaCl
细菌失电子,两含氯消毒剂得电子数相等。
设所需Cl2质量为x
×
4
×
2
=
x=1.57
解析
挑战自我
2.5 g NaCl和KCl混合物溶于水,再加100 g7.14%的AgNO3溶液,充分反应后滤出沉淀,向滤液中加入10 g铜片,完全反应后,取出 洗涤、干燥,称得质量为10.152 g 。求混合物中NaCl的物质的量。
NaCl KCl
2.5 g
AgNO3
0.042 mol
NaNO3 KNO3
AgNO3
Cu
10 g
Ag
Cu
10.152 g
挑战自我
Cu + 2AgNO3 = Cu(NO3) 2 + 2Ag↓
64 g
2 mol
216 g
152 g
0.152 g
=
2 mol×0.152 g
152 g
=
0.002 mol
与NaCl、KCl反应的AgNO3的物质的量为:
0.042 mol-0.002 mol=0.04 mol
NaCl KCl
2.5 g
AgNO3
0.042 mol
NaNO3 KNO3
AgNO3
Cu
10 g
Ag
Cu
10.152 g
挑战自我
设与NaCl、KCl物质的量为别为x、y
NaCl + AgNO3 = NaNO3 + AgCl↓
KCl + AgNO3 = KNO3 + AgCl↓
58.5 g/mol×x+74.5g/mol×y=58 g
x+y = 0.04 mol
=
0.03 mol
=
0.01 mol
挑战自我
NaCl KCl
2.5 g
AgNO3
0.042 mol
NaNO3 KNO3
AgNO3
Cu
10 g
Ag
Cu
10.152 g
解
2NaHCO3 Na2CO3+CO2↑+H2O
Ca(OH)2 +CO2=CaCO3↓+H2O
2NaHCO3~CO2~CaCO3
2 mol 1 mol
n(NaHCO3) 0.002 mol
n(NaHCO3)=0.004 mol
m(Na2CO3)=0.442 g-0.004 mol×84 g/mol =0.106 g
w(Na2CO3)=
挑战自我
由氯、钠守恒,
n(HCl)=n(NaCl)
=n(NaHCO3)+2n(Na2CO3)
=0.004 mol +2× 0.001 mol
=0.006 mol
挑战自我
某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、 Pb(MnO4)2(强电解质)、 H2O、X(水溶液呈无色)、 H2SO4 , 已知 X 是一种盐,且 0.1 mol X 在该反应中失去 3.01×1023 个电子
MnSO4
0.5 mol
挑战自我
(1) 写出 X 的化学式:________________。
(2)若有 9.8 g H2SO4 参加反应,则转移电子的物质的量为______________ mol 。
某强酸性反应体系中,反应物和生成物共六种物质: PbO2、PbSO4、Pb(MnO4)2、H2O、X(水溶液呈无色)、 H2SO4 , 已知 X 是一种盐,且 0.1 mol X 在该反应中失去 3.01×1023 个电子。
X →
+PbO2
PbSO4 +Pb(MnO4)2
X+PbO2 →PbSO4+Pb(MnO4)2
+H2SO4
+H2O
Mn
x
(7-x)×0.1 mol =0.5 mol
x=2
MnSO4
解析
挑战自我
MnSO4+PbO2+H2SO4→PbSO4+Pb(MnO4)2 +H2O
5PbO2+2MnSO4+2H2SO4=Pb(MnO4)2+4PbSO4+2H2O
0.2 mol
10 mol
0.1 mol
0.5 mol
(2)若有 9.8 g H2SO4 参加反应,则转移电子的物质的量为____________ mol 。
0.5 mol
挑战自我
感谢观看
——苏轼
古之立大志者,不惟有超世之才,亦必有坚韧不拔之志。
Types and techniques of chemical computation
整理与提升
化学计算类型与技巧
学习目标
02
04
找理论差
设物质的量
找实际差
列式求解
横向找关系
竖向列方程
两种反应量均告之
按量少计算
质量守恒
电荷守恒
电子守恒
03
01
混合物计算
守恒法
过量计算
差量法
差量法
01
请你试一试
78 gNa2O2中通入一定量的CO2气体后,固体质量为 92g ,求生成Na2CO3的物质的量。
2Na2O2+2CO2=2Na2CO3+O2
78 g-78 g/mol×x+106 g/mol×x=92 g
2Na2O2+2CO2=2Na2CO3+O2
156 g
212 g
56 g
2Na2O2+2CO2=2Na2CO3+O2
2 mol
56 g
92 g-78 g
n(Na2CO3)
n(Na2CO3)=0.5 mol
请你试一试
78 gNa2O2中通入一定量的CO2气体后,固体质量为 92g ,求生成Na2CO3的物质的量。
1.1.1 差量
指反应过程中反应物的某种物理量之和(始态量)与同一状态下生成物的相同物理量之和(终态量)的差。
1.1.2 物理量
可以是质量、物质的量、气体体积、气体压强、反应过程中的热效应等。
1. 差量法
1.1 原理
化学反应中反应物或生成物的量与差量成正比
1. 差量法
1.2 计算依据
一是明确产生差量的原因,并能根据化学方程式求出理论上的差值(理论差量)。
1. 差量法
1.3 解题关键
二是结合题中的条件求出实际的差值(实际差量)。
据方程式找理论差量
气体体积、固体质量等
1
2
3
由题意找实际差量
反应前后,有关物理量的差
列比例求解
理论与实际差量,与所求量成正比
三步曲
1. 差量法
1.4 步骤
考考你自己
常温下,在27.9 g水中溶解12.1 g Cu(NO3)2·3H2O ,恰好达到饱和。设该溶液密度为1.20 g /cm3 。
将一根质量为100 g的铁棒插入到该溶液中,一段时间后取出,洗净、干燥后称量,铁棒的质量变为100.2 g ,求此时溶液中Fe2+的物质的量浓度。(忽略溶液体积的变化)
1.20 g /cm3
Fe+Cu(NO3)2=Fe(NO3)2 +Cu
56 g
64 g
8 g
100.2 g-100 g
1 mol
n(Fe2+)
n(Fe2+)
1 mol
×
0.2 g
8 g
=
0.025 mol
=
V(Fe2+)
=
27.9 g+12.1 g
=
33.3 mL
0.0333 L
c(Fe2+)
=
0.025 mol
=
0.75 mol/L
考考你自己
混合物计算
02
请你试一试
CuO+FeO+H2 Cu+Fe+2H2O
氧化铜和氧化亚铁的混合物58 g ,通足量的氢气,完全反应后得到46 g固体。
求混合物中氧化铜的质量。
请你试一试
解
设CuO、FeO的物质的量分别为x、y
1 mol
1 mol
1 mol
1 mol
横向找关系
80 g/mol×x+72g/mol×y=58 g
64 g/mol×x+56g/mol×y=46 g
竖向列方程
解得
=
0.5 mol
=
0.25 mol
m(CuO)
=
0.5 mol×80 g/mol
=
40g
答
混合物中氧化铜的质量为40 g。
设××、××的物质的量分别为x、y
不论求什么量,均设为物质的量
2. 混合物计算
2.1 如何设
横向找关系
竖向列方程
2. 混合物计算
2.2 方法
审题
H2SO4
HCl
NaHCO3
CO2
0.05 mol
BaCl2
BaSO4
0.02 mol
你学会了吗?
将100 mL稀硫酸和稀盐酸的混合溶液为两等份,向其中一份加入足量NaHCO3 ,产生气体1.12 L(标准状况下);向另一份中加入足量BaCl2溶液,产生沉淀4.66 g 。
请计算原溶液中盐酸的物质的量浓度。
设H2SO4、HCl物质的量分别为x、y
解
H2SO4+2NaHCO3=Na2SO4+CO2↑+H2O
HCl+NaHCO3=NaCl+CO2↑+H2O
x+y=0.05 mol
解得:x=0.02 mol y=0.03 mol
H2SO4+BaCl2=BaSO4 ↓ +2HCl
1 mol 1 mol
c(HCl)=
=0.8 mol/L
0.03 mol
×
答
HCl物质的量浓度为0.8 mol/L。
你学会了吗?
过量计算
03
考考你的智慧
50 g CaCO3与足量的36.5%盐酸完全反应,求生成二氧化碳的质量。
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
50 g的36.5%盐酸与足量CaCO3完全反应,求生成二氧化碳的质量。
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
50 g CaCO3与50 g的36.5%盐酸完全反应,求生成二氧化碳的质量。
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
1 mol
2 mol
0.5 mol
0.5 mol
先假设一物质完全反应,再求出所另一物质的量
3. 过量计算
3.1 判过量
50 g CaCO3与50 g的36.5%盐酸完全反应,求生成二氧化碳的质量。
设CaCO3完全反应,需HCl物质的量为x
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
1 mol
2 mol
0.5 mol
x
x
=
0.5 mol
×
2 mol
1 mol
=
1 mol
>
0.5 mol
故盐酸少量
3. 过量计算
依量少的计算
3. 过量计算
3.2 计算
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
2 mol
1 mol
0.5 mol
x
x
=
0.5 mol
×
1 mol
2 mol
=
0.25mol
二氧化碳质量为:0.25 mol×44g/mol=11 g
3. 过量计算
50 g CaCO3与50 g的36.5%盐酸完全反应,求生成二氧化碳的质量。
设CaCO3完全反应,需HCl物质的量为x
在100 mL 0.1 mol/L NaOH溶液中,通入标准状况下二氧化碳0.224 L,求生成的盐的物质的量。
CO2+2NaOH=Na2CO3+H2O
1 mol
2 mol
0.01 mol
0.01 mol
CO2+2NaOH=Na2CO3+H2O
2 mol
1 mol
0.01 mol
0.005 mol
Na2CO3+CO2+H2O=2NaHCO3
0.005 mol
0.005 mol
0.01 mol
考考你的智慧
守恒法
04
将8.3 g由铝和锌的混合物加入到200 g稀硫酸中,恰好完全反应,将反应后的溶液小心蒸干,得到无水固体27.5 g ,求原稀硫酸中硫酸的物质的量。
请你试一试
8.3 g铝和锌反应后生成的盐为27.5 g,则SO42-2的质量为7.5 g-8.3 g =19.2 g
n(H2SO4)
=
n(SO42-)
=
19.2 g
96 g/mol
=
0.2 mol
4.1.1 根据某粒子在反应前后个数不变
4. 守恒法
4.1 质量守恒
4.1.2 根据反应前后质量差,求出某原子团或某物质的质量
某碳酸钠样品中含有氯化钠,现称量该样品中11g放入烧杯中,现加入50g稀盐酸,恰好完全反应,称得烧杯中的溶液质量为56.6g。求盐酸中HCl的物质的量。
你学会了吗?
11 g Na2CO3、NaCl与50 g盐酸反应后,生成的溶液为56.6 g,则生成CO2质量为:50 g+11 g-56.6 g =4.4 g,物质的量为0.1 mol。
Na2CO3+2HCl=2NaCl+CO2↑+H2O
2 mol
1 mol
0.1 mol
0.2 mol
确定产物成分
CO2+2KOH=K2CO3+H2O · · · · ①
CO2+KOH=KHCO3 · · · · ②
若按反应②进行: m(KHCO3)=0.1 mol×100 g/mol=10.0 g
若按反应①进行:m(K2CO3)=0.1 mol×138 g/mol=13.8 g
10.0 g<11.9 g<13.8 g
反应产物为K2CO3和KHCO3的混合物
问题解决
向300 mLKOH溶液中缓慢通往2.24 L(标准状态下) CO2 ,充分反应后在减压低温条件下蒸发所得溶液,得到了11.9 g白色固体。计算确实白色固体成分及KOH溶液的物质的量浓度?
CO2+2KOH=K2CO3+H2O · · · · ①
CO2+KOH=KHCO3 · · · · ②
y
x
x
y
x+y=0.01 mol
x×138 g/mol+y×100 g/mol=11.9 g
x=y=0.05 mol
n(KOH)=2x+y=0.15 mol
c(KOH)=0.15 mol/0.3 L=0.5 mol/L
KOH
CO2
K2CO3
KHCO3
0.01 mol
0.3 Lg
问题解决
设K2CO3和KHCO3的物质的量分别为x、y
据质量守恒:
x×138 g/mol+y×100 g/mol=11.9 g
据原子守恒:
x+y=0.01 mol
KOH
CO2
K2CO3
KHCO3
0.01 mol
0.3 Lg
问题解决
c(H+)×1+c(Cu2+)×2 +c(Fe3+)×3 =6 mol/L
c(H+)=1 mol/L
2HCl+Zn=ZnCl2+H2↑
请你试一试
某盐酸、 CuCl2、FeCl3的混合液100 ml ,若溶液中各阳离子物质的量浓度相等, Cl-总浓度为6 mol·L-1 ,则该溶液与足量锌反应,生成标准状况下H2的体积为多少升?
4.2.1 找出所有的阳离子和阴离子
4. 守恒法
4.2 电荷守恒
4.2.2 物质的量乘以化合价,二价、三价必须乘以2、3!
c(M+)×1+c(M2+)×2 +c(M3+)×3
c(R-)×1+c(R2-)×2 +c(R3-)×3
4.2.3 列式计算
考考你自己
某工厂用氯化铁溶液腐蚀铜板的废腐蚀液中:c(Fe3+)=1 mol/L, c(H+)=3 mol/L, c(Cl-)=15 mol/L,计算废腐蚀液中的Fe2+离子浓度。
Fe3+ Fe2+ H+ Cl-
1
3
15
x
2FeCl3+Cu =2FeCl2+CuCl2
x
x/2
Fe3+ Fe2+ H+ Cu2+ Cl-
1
3
15
x
x/2
工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为______。
2∶1
KClO3
+1e-
ClO2
Na2SO3
-2e-
Na2SO4
n(KClO3)
×
1
n(Na2SO3)
×
2
=
审清要求,防止答案搞反了!
解后反思
请你试一试
二氧化氯(ClO2 ,黄绿色易溶于水的气体)是高效、低毒的消毒剂。
找物质
1
2
3
定得失
列关系
氧化剂→还原产物 还原剂→氧化产物
确定1个粒子得失电子数
化合价变化值×变价原子个数
三步曲
n(氧化剂)×1个粒子得电子数
n(还原剂)×1个粒子得失子数
4. 守恒法
4.3 电子守恒
K2Cr2O7
+(6-x)× e-
Na2SO3
-2 e-
Na2SO4
20 mL×0.02mol/L
×
(6-x)×2
24mL×0.05 mol/L
×
2
=
x= 3
2
例题
24 mL 0.05 mol/L的Na2SO3溶液恰好与20 mL 0.02 mol/L的K2Cr2O7溶液完全反应后生成Na2SO4 ,求反应后Cr在还原产物中的化合价为____。
二氧化氯具有很强的氧化性,常用作消毒剂。则其消毒的能力是氯气______倍。(以等物质的量的物质得到的电子数表示)
二氧化氯具有很强的氧化性,常用作消毒剂。则其消毒的次序是氯气______倍。(以等质量的物质得到的电子数表示)
你学会了吗?
二氧化氯具有很强的氧化性,常用作消毒剂。则其消毒的次序是氯气______倍。(以等物质的量的物质得到的电子数表示)
ClO2
+5e-
Cl-
Cl2
+2e-
Cl-
你学会了吗?
你学会了吗?
二氧化氯具有很强的氧化性,常用作消毒剂。则其消毒的次序是氯气______倍。(以等质量的物质得到的电子数表示)
ClO2
+5e-
Cl-
Cl2
+2e-
Cl-
1 g
67.5 g·L-1
×
5
1 g
71 g·L-1
×
2
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
差量法计算
课堂小结
1.设
设××、××的物质的量分别为x、y
不论求什么量,均设为物质的量
2.技巧
横向找关系
竖向列方程
混合物计算
课堂小结
过量计算
课堂小结
1.判过量
先假设一物质完全反应,再求出所另一物质的量
2.依量少的计算
守恒法
质量守恒
电荷守恒
电子守恒
据质量差求出某微粒的质量
找全离子,一价可略去
有的是求产物,关注化学式中原子个数
守恒法计算
课堂小结
挑战自我
“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。 NaClO2的有效氯含量为________。(计算结果保留两位小数)
已知: NaClO2的还原产物是NaCl
NaClO2
+4e-
NaCl
Cl2
+2e-
NaCl
细菌失电子,两含氯消毒剂得电子数相等。
设所需Cl2质量为x
×
4
×
2
=
x=1.57
解析
挑战自我
2.5 g NaCl和KCl混合物溶于水,再加100 g7.14%的AgNO3溶液,充分反应后滤出沉淀,向滤液中加入10 g铜片,完全反应后,取出 洗涤、干燥,称得质量为10.152 g 。求混合物中NaCl的物质的量。
NaCl KCl
2.5 g
AgNO3
0.042 mol
NaNO3 KNO3
AgNO3
Cu
10 g
Ag
Cu
10.152 g
挑战自我
Cu + 2AgNO3 = Cu(NO3) 2 + 2Ag↓
64 g
2 mol
216 g
152 g
0.152 g
=
2 mol×0.152 g
152 g
=
0.002 mol
与NaCl、KCl反应的AgNO3的物质的量为:
0.042 mol-0.002 mol=0.04 mol
NaCl KCl
2.5 g
AgNO3
0.042 mol
NaNO3 KNO3
AgNO3
Cu
10 g
Ag
Cu
10.152 g
挑战自我
设与NaCl、KCl物质的量为别为x、y
NaCl + AgNO3 = NaNO3 + AgCl↓
KCl + AgNO3 = KNO3 + AgCl↓
58.5 g/mol×x+74.5g/mol×y=58 g
x+y = 0.04 mol
=
0.03 mol
=
0.01 mol
挑战自我
NaCl KCl
2.5 g
AgNO3
0.042 mol
NaNO3 KNO3
AgNO3
Cu
10 g
Ag
Cu
10.152 g
解
2NaHCO3 Na2CO3+CO2↑+H2O
Ca(OH)2 +CO2=CaCO3↓+H2O
2NaHCO3~CO2~CaCO3
2 mol 1 mol
n(NaHCO3) 0.002 mol
n(NaHCO3)=0.004 mol
m(Na2CO3)=0.442 g-0.004 mol×84 g/mol =0.106 g
w(Na2CO3)=
挑战自我
由氯、钠守恒,
n(HCl)=n(NaCl)
=n(NaHCO3)+2n(Na2CO3)
=0.004 mol +2× 0.001 mol
=0.006 mol
挑战自我
某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4(难溶盐)、 Pb(MnO4)2(强电解质)、 H2O、X(水溶液呈无色)、 H2SO4 , 已知 X 是一种盐,且 0.1 mol X 在该反应中失去 3.01×1023 个电子
MnSO4
0.5 mol
挑战自我
(1) 写出 X 的化学式:________________。
(2)若有 9.8 g H2SO4 参加反应,则转移电子的物质的量为______________ mol 。
某强酸性反应体系中,反应物和生成物共六种物质: PbO2、PbSO4、Pb(MnO4)2、H2O、X(水溶液呈无色)、 H2SO4 , 已知 X 是一种盐,且 0.1 mol X 在该反应中失去 3.01×1023 个电子。
X →
+PbO2
PbSO4 +Pb(MnO4)2
X+PbO2 →PbSO4+Pb(MnO4)2
+H2SO4
+H2O
Mn
x
(7-x)×0.1 mol =0.5 mol
x=2
MnSO4
解析
挑战自我
MnSO4+PbO2+H2SO4→PbSO4+Pb(MnO4)2 +H2O
5PbO2+2MnSO4+2H2SO4=Pb(MnO4)2+4PbSO4+2H2O
0.2 mol
10 mol
0.1 mol
0.5 mol
(2)若有 9.8 g H2SO4 参加反应,则转移电子的物质的量为____________ mol 。
0.5 mol
挑战自我
感谢观看
