第三章《铁 金属材料》单元复习课件(共51张PPT)
文档属性
| 名称 | 第三章《铁 金属材料》单元复习课件(共51张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 00:00:00 | ||
图片预览







文档简介
(共51张PPT)
——杜威
科学的每一项巨大成就。都是以大胆的幻想为出发点的。
美国著名哲学家、教育家,实用主义哲学的创始人之一,功能心理学的先驱,美国进步主义教育运动的代表。
Iron and its compounds-- Identification of mutually transforming ions
整理与提升
铁及其化合物
——相互转化 离子鉴别
第三章
铁的化合物五颜六色,请举例说明之。并进行分类。
FeCl2
四氧化三铁
三氧化二铁
绿矾
硫氰化铁
赤红黄绿青蓝紫
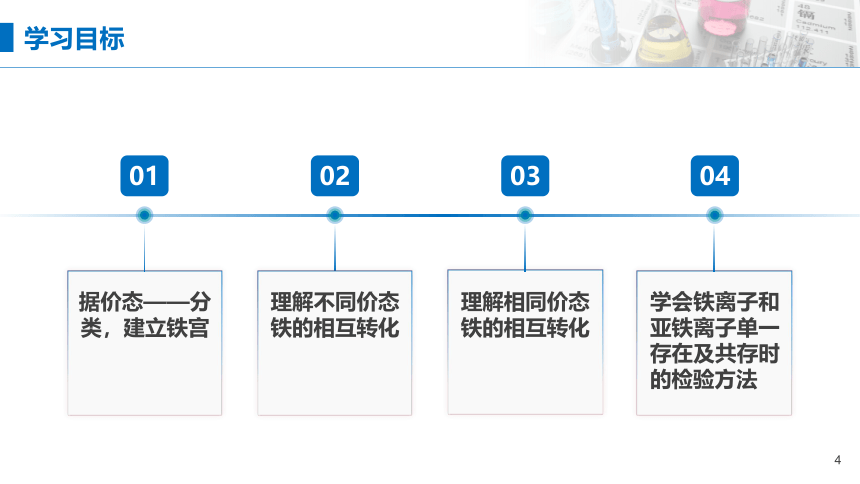
学习目标
02
04
理解不同价态铁的相互转化
03
01
据价态——分类,建立铁宫
理解相同价态铁的相互转化
学会铁离子和亚铁离子单一存在及共存时的检验方法
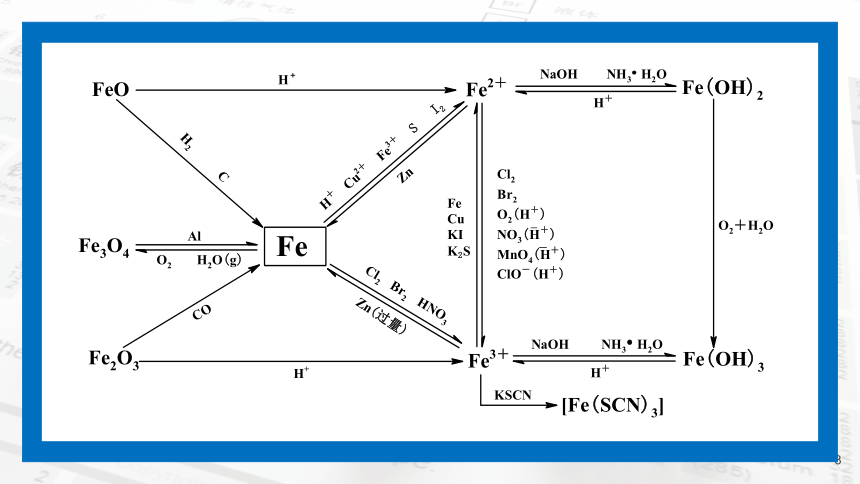
不同价态铁之间的转化
01
铁单质与二价铁
二价铁与三价铁
铁单质与三价铁
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
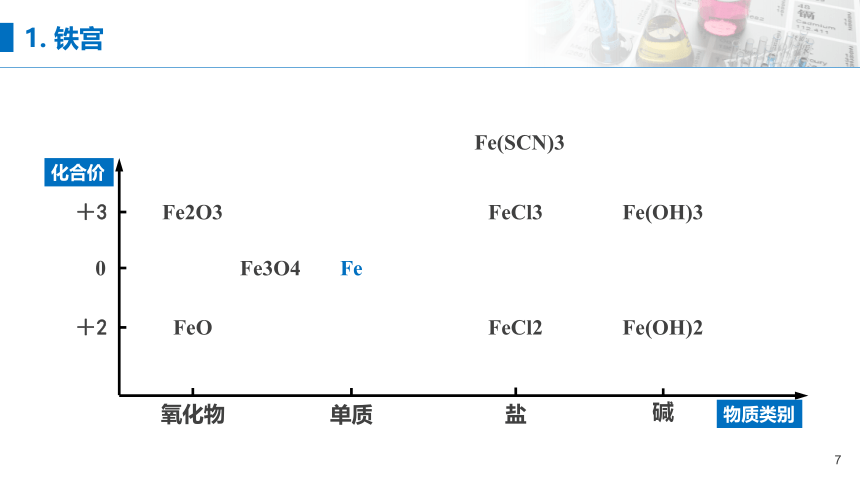
以物质的类别为横坐标、化合价为纵坐标,请有关物质放入“坐标系”中。
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
问题解决
1. 铁宫
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
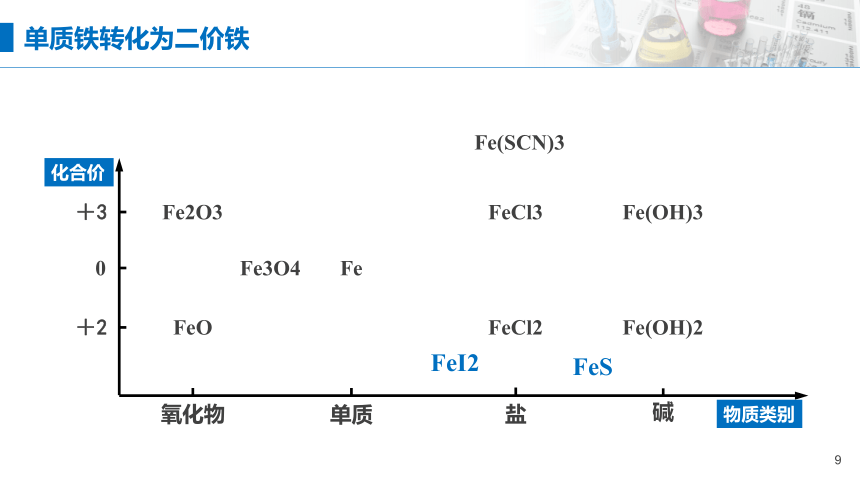
FeI2
FeS
单质铁转化为二价铁
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
Fe+2H+=Fe2++H2↑
Fe+CuSO4=Cu+FeSO4
3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
2. 不同价态铁的转化
1.1 Fe→Fe2+
1.2.1 化合反应
1.2.2 置换反应
1.2.3 其它反应
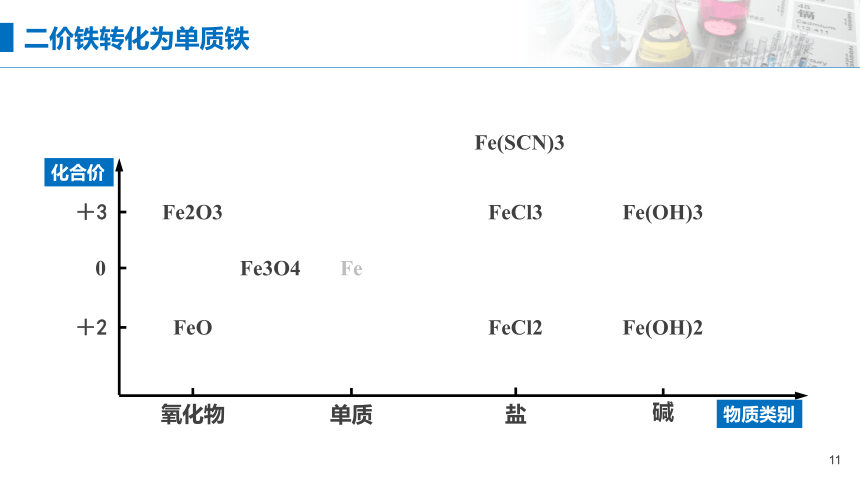
二价铁转化为单质铁
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
FeO+H2 Fe +H2O
3FeO+3C 3Fe+3CO↑
Zn+Fe2+=Zn2++Fe
FeO+CO Fe+CO2
2. 不同价态铁的转化
1.2 Fe2+→Fe
1.1.1 置换反应
1.1.2 其它反应
1. 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑。
2. 铁与强氧化剂硝酸反应,一定生成硝酸铁。
3. 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,现象是有气体生成,溶液呈血红色,说明稀硝酸将Fe氧化为Fe3+。
牛刀小试
判断以下表述是否正确:
单质铁转化为三价铁
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
2. 不同价态铁的转化
1.3 Fe→Fe2+
1.3.1 化合反应
1.3.2 其它反应
三价铁转化为单质铁
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
Fe2O3+3H2 2Fe +3H2O
2Fe2O3+3C 4Fe+3CO2↑
Fe2O3+3CO 2Fe+3CO2
2. 不同价态铁的转化
1.4 Fe3+→Fe
1.4.1 置换反应
1.4.2 其它反应
二价铁转化为三价铁
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
2. 不同价态铁的转化
1.5 Fe2+→Fe3+
1.5.1 化合反应
1.5.2 其它反应
1. 煅烧FeCO3可得到红棕色固体,写出化学方程式
2. 若FeCO3浊液久置后会有部分固体表面变为红褐色,该变化的化学方程式是
思考 · 运用
三价铁转化二价铁
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
2Fe3++Fe=3Fe2+
2Fe3++Cu=2Fe2++Cu2+
2Fe3++2I-=2Fe2++I2
2. 不同价态铁的转化
1.6 Fe3+→Fe2+
1.6.1 化合反应
1.6.2 其它反应
1. 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液,加入H2O2后溶液变成血红色,说明Fe2+既有氧化性又有还原性。
成功体验
判断以下表述是否正确:
2. 将铜粉加入1.0 mol·L-1 Fe2(SO4)3溶液中,现象是溶液变蓝、有黑色固体出现。
3. FeCl3与氢碘酸反应生成棕色物质的离子方程式为:2Fe3++2I-=2Fe2++I2。
高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,可在NaOH溶液中用氯气氧化硝酸铁制备。
请写出化学方程式。
铁元素的最高价是+6价,而不是+3价
2Fe(NO3)3+16NaOH+3Cl2
=2Na2FeO4+6NaNO3+6NaCl+8H2O
特别提醒
铁粉、氯水
先加入足量铁粉,过滤,再向滤液中加入足量氯水
Fe +2Fe3+ = 3Fe2+
Fe + Cu2+ = Fe2+ + Cu
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
看谁做得既准又快
除去FeCl3溶液中少量CuCl2。
①所用试剂:
②实验操作:
③写出有关的离子方式:
硫酸铁溶液中,通入二氧化硫气体,溶液由黄色变为浅绿色。
请写出反应的化学方程式及离子方程式。
Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4
2Fe3++SO2+2H2O=2Fe2++4H++SO42-
考考你的智慧
1. (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2离子方程式:
Fe2++2OH-=Fe(OH)2↓。
2. 使用下图所示装置观察Fe(OH)2的生成。
问题解决
判断以下表述是否正确:
相同价态铁之间的转化
02
二价铁与二价铁之间
三价铁与三价铁之间
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
二价铁与二价铁的相互转化
Fe2++2OH-=Fe(OH)2↓
FeO+2H+=Fe2++H2O
Fe(OH)2 +2H+=Fe2++2H2O
3. 相同价态铁的转化
1.1 Fe2+→Fe2+
1.6.1 化合反应
三价铁与三价铁的相互转化
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
Fe3++3OH-=Fe(OH)3↓
Fe2O3+6H+=2Fe2++3H2O
Fe(OH)3 +3H+=Fe3++3H2O
Fe3++3SCN-=Fe(SCN)3
3. 相同价态铁的转化
1.1 Fe2+→Fe2+
1.2 Fe3+→Fe3+
加入KSCN溶液
Fe3++3SCN-=Fe(SCN)3
FeCl3+3KSCN=Fe(SCN)3+3KCl
×
血红色溶液
易错警示
显色法
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在____________(填离子符号),检验溶液中还存在Fe2+的方法是__________________________________ (注明试剂、现象)。
Fe3+
取少量溶液,滴加KMnO4溶液,KMnO4褪色
考考你自己
Fe2+
方法 试剂 现象 离子方程式
NaOH溶液
白色→灰绿色→红褐色
KSCN溶液
氯水
无色→血红色
显色法
沉淀法
3. Fe3+、Fe2+检验
3.1 单个离子
方法 试剂 现象 离子方程式
NaOH溶液
红褐色沉淀
沉淀法
KSCN溶液
血红色溶液
显色法
3. Fe3+、Fe2+检验
3.1 单个离子
Fe2+
Fe3+
Fe2+
3. Fe3+、Fe2+检验
3.2 两个离子
混合溶液
混合溶液
滴加KSCN溶液
滴在KI淀粉试纸上
溶液变血红色,
说明含有Fe3+
试纸上变蓝色,
说明含有Fe3+
混合溶液
滴加酸性KMnO4溶液
紫红色褪去,
说明含有Fe2+
2. 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象。
3. 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含有Fe2+。
1. 因为Fe3+具有氧化性,所以KSCN溶液可以鉴别Fe3+。
考考你自己
判断下列说法的正误
4. 向某溶液中滴加氯水后再加入 KSCN 溶液,溶液呈红色。则溶液中一定含有Fe2+。
5. 在溶液中加KSCN溶液,溶液显红色,证明原溶液中有Fe3+,无Fe2+ 。
考考你自己
判断下列说法的正误
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
价态未变化,表现酸碱性
复分解反应
Fe2+以还原性为主
Fe3+强氧化性
价态变化,表现氧化性或还原性
课堂小结
成功体验
操作和现象 结论
A 切开金属钠,钠表面的银白色会逐渐褪去 Na在空气中会生成Na2O2
B 铁钉插入浓硝酸中,无明显 铁与浓硝酸不反应
C FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色 FeCl2具有漂白性
D 向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,溶液变成红色 溶液中有Fe3+生成
下列实验“操作和现象”与“结论”都正确的是
己知在碱性溶液中可发生如下反应:2Fe(OH)3+3C1O-+4OH-=2FeO4n-+3Cl-+5H2O关于该反应的说法正确的是
考考你自己
A.FeO4n-中Fe的化合价是+6
B.ClO-是还原剂
C.由上述离子方程式可知,该反应是由氨水提供的碱性环境
D.反应过程中生成1 mol FeO4n-,转移6 mol e-
在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:__________________________ 、____________________________________。
样品中没有Fe3+
Fe2+易被氧气氧化为Fe3+
看谁做得既准又快
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。
1.检验上述流程中“过滤”后杂质是否除尽的实验方法是_____________。
2.写出“氧化”步骤的离子方程____________________。
3.上述流程中,“分离”所包含的操作依次为:______、______、过滤、洗涤、干燥。
硫酸铝铵晶体制备的实验流程如下:
硫酸铝铵晶体制备的实验流程如下:
1.检验上述流程中“过滤”后杂质是否除尽的实验方法是_____________。
取少量滤液于试管中,加几滴KSCN溶液,若溶液不变红,则杂质已除尽
2.写出“氧化”步骤的离子方程式
_____________________________________________________。
2Fe2++H2O2+2H+=2Fe3++2H2O
硫酸铝铵晶体制备的实验流程如下:
3.上述流程中,“分离”所包含的操作依次为:____________、_____________、过滤、洗涤、干燥。
硫酸铝铵晶体制备的实验流程如下:
蒸发浓缩
冷却结晶
物质 开始沉淀 沉淀完全
Fe(OH)3 2.7 3.7
Fe(OH)2 7.6 9.6
Cu(OH)2 4.4 6.4
不同金属离子在溶液中开始沉淀与完全沉淀pH如下:
某Cu2+溶液中含有Fe2+,如何除去Fe2+?
探究 · 拓展
① 能直接加碱沉淀?
② 根据沉淀pH不同,应如何处理?
探究 · 拓展
感谢观看
——杜威
科学的每一项巨大成就。都是以大胆的幻想为出发点的。
美国著名哲学家、教育家,实用主义哲学的创始人之一,功能心理学的先驱,美国进步主义教育运动的代表。
Iron and its compounds-- Identification of mutually transforming ions
整理与提升
铁及其化合物
——相互转化 离子鉴别
第三章
铁的化合物五颜六色,请举例说明之。并进行分类。
FeCl2
四氧化三铁
三氧化二铁
绿矾
硫氰化铁
赤红黄绿青蓝紫
学习目标
02
04
理解不同价态铁的相互转化
03
01
据价态——分类,建立铁宫
理解相同价态铁的相互转化
学会铁离子和亚铁离子单一存在及共存时的检验方法
不同价态铁之间的转化
01
铁单质与二价铁
二价铁与三价铁
铁单质与三价铁
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
以物质的类别为横坐标、化合价为纵坐标,请有关物质放入“坐标系”中。
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
问题解决
1. 铁宫
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
FeI2
FeS
单质铁转化为二价铁
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
Fe+2H+=Fe2++H2↑
Fe+CuSO4=Cu+FeSO4
3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
2. 不同价态铁的转化
1.1 Fe→Fe2+
1.2.1 化合反应
1.2.2 置换反应
1.2.3 其它反应
二价铁转化为单质铁
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
FeO+H2 Fe +H2O
3FeO+3C 3Fe+3CO↑
Zn+Fe2+=Zn2++Fe
FeO+CO Fe+CO2
2. 不同价态铁的转化
1.2 Fe2+→Fe
1.1.1 置换反应
1.1.2 其它反应
1. 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑。
2. 铁与强氧化剂硝酸反应,一定生成硝酸铁。
3. 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,现象是有气体生成,溶液呈血红色,说明稀硝酸将Fe氧化为Fe3+。
牛刀小试
判断以下表述是否正确:
单质铁转化为三价铁
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
2. 不同价态铁的转化
1.3 Fe→Fe2+
1.3.1 化合反应
1.3.2 其它反应
三价铁转化为单质铁
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
Fe2O3+3H2 2Fe +3H2O
2Fe2O3+3C 4Fe+3CO2↑
Fe2O3+3CO 2Fe+3CO2
2. 不同价态铁的转化
1.4 Fe3+→Fe
1.4.1 置换反应
1.4.2 其它反应
二价铁转化为三价铁
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
2. 不同价态铁的转化
1.5 Fe2+→Fe3+
1.5.1 化合反应
1.5.2 其它反应
1. 煅烧FeCO3可得到红棕色固体,写出化学方程式
2. 若FeCO3浊液久置后会有部分固体表面变为红褐色,该变化的化学方程式是
思考 · 运用
三价铁转化二价铁
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
2Fe3++Fe=3Fe2+
2Fe3++Cu=2Fe2++Cu2+
2Fe3++2I-=2Fe2++I2
2. 不同价态铁的转化
1.6 Fe3+→Fe2+
1.6.1 化合反应
1.6.2 其它反应
1. 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液,加入H2O2后溶液变成血红色,说明Fe2+既有氧化性又有还原性。
成功体验
判断以下表述是否正确:
2. 将铜粉加入1.0 mol·L-1 Fe2(SO4)3溶液中,现象是溶液变蓝、有黑色固体出现。
3. FeCl3与氢碘酸反应生成棕色物质的离子方程式为:2Fe3++2I-=2Fe2++I2。
高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,可在NaOH溶液中用氯气氧化硝酸铁制备。
请写出化学方程式。
铁元素的最高价是+6价,而不是+3价
2Fe(NO3)3+16NaOH+3Cl2
=2Na2FeO4+6NaNO3+6NaCl+8H2O
特别提醒
铁粉、氯水
先加入足量铁粉,过滤,再向滤液中加入足量氯水
Fe +2Fe3+ = 3Fe2+
Fe + Cu2+ = Fe2+ + Cu
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
看谁做得既准又快
除去FeCl3溶液中少量CuCl2。
①所用试剂:
②实验操作:
③写出有关的离子方式:
硫酸铁溶液中,通入二氧化硫气体,溶液由黄色变为浅绿色。
请写出反应的化学方程式及离子方程式。
Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4
2Fe3++SO2+2H2O=2Fe2++4H++SO42-
考考你的智慧
1. (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2离子方程式:
Fe2++2OH-=Fe(OH)2↓。
2. 使用下图所示装置观察Fe(OH)2的生成。
问题解决
判断以下表述是否正确:
相同价态铁之间的转化
02
二价铁与二价铁之间
三价铁与三价铁之间
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
二价铁与二价铁的相互转化
Fe2++2OH-=Fe(OH)2↓
FeO+2H+=Fe2++H2O
Fe(OH)2 +2H+=Fe2++2H2O
3. 相同价态铁的转化
1.1 Fe2+→Fe2+
1.6.1 化合反应
三价铁与三价铁的相互转化
Fe
FeCl3
物质类别
化合价
氧化物
单质
盐
碱
+2
0
+3
Fe(OH)3
Fe2O3
FeO
Fe3O4
FeCl2
Fe(OH)2
Fe(SCN)3
Fe3++3OH-=Fe(OH)3↓
Fe2O3+6H+=2Fe2++3H2O
Fe(OH)3 +3H+=Fe3++3H2O
Fe3++3SCN-=Fe(SCN)3
3. 相同价态铁的转化
1.1 Fe2+→Fe2+
1.2 Fe3+→Fe3+
加入KSCN溶液
Fe3++3SCN-=Fe(SCN)3
FeCl3+3KSCN=Fe(SCN)3+3KCl
×
血红色溶液
易错警示
显色法
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在____________(填离子符号),检验溶液中还存在Fe2+的方法是__________________________________ (注明试剂、现象)。
Fe3+
取少量溶液,滴加KMnO4溶液,KMnO4褪色
考考你自己
Fe2+
方法 试剂 现象 离子方程式
NaOH溶液
白色→灰绿色→红褐色
KSCN溶液
氯水
无色→血红色
显色法
沉淀法
3. Fe3+、Fe2+检验
3.1 单个离子
方法 试剂 现象 离子方程式
NaOH溶液
红褐色沉淀
沉淀法
KSCN溶液
血红色溶液
显色法
3. Fe3+、Fe2+检验
3.1 单个离子
Fe2+
Fe3+
Fe2+
3. Fe3+、Fe2+检验
3.2 两个离子
混合溶液
混合溶液
滴加KSCN溶液
滴在KI淀粉试纸上
溶液变血红色,
说明含有Fe3+
试纸上变蓝色,
说明含有Fe3+
混合溶液
滴加酸性KMnO4溶液
紫红色褪去,
说明含有Fe2+
2. 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象。
3. 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含有Fe2+。
1. 因为Fe3+具有氧化性,所以KSCN溶液可以鉴别Fe3+。
考考你自己
判断下列说法的正误
4. 向某溶液中滴加氯水后再加入 KSCN 溶液,溶液呈红色。则溶液中一定含有Fe2+。
5. 在溶液中加KSCN溶液,溶液显红色,证明原溶液中有Fe3+,无Fe2+ 。
考考你自己
判断下列说法的正误
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
价态未变化,表现酸碱性
复分解反应
Fe2+以还原性为主
Fe3+强氧化性
价态变化,表现氧化性或还原性
课堂小结
成功体验
操作和现象 结论
A 切开金属钠,钠表面的银白色会逐渐褪去 Na在空气中会生成Na2O2
B 铁钉插入浓硝酸中,无明显 铁与浓硝酸不反应
C FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色 FeCl2具有漂白性
D 向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,溶液变成红色 溶液中有Fe3+生成
下列实验“操作和现象”与“结论”都正确的是
己知在碱性溶液中可发生如下反应:2Fe(OH)3+3C1O-+4OH-=2FeO4n-+3Cl-+5H2O关于该反应的说法正确的是
考考你自己
A.FeO4n-中Fe的化合价是+6
B.ClO-是还原剂
C.由上述离子方程式可知,该反应是由氨水提供的碱性环境
D.反应过程中生成1 mol FeO4n-,转移6 mol e-
在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:__________________________ 、____________________________________。
样品中没有Fe3+
Fe2+易被氧气氧化为Fe3+
看谁做得既准又快
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。
1.检验上述流程中“过滤”后杂质是否除尽的实验方法是_____________。
2.写出“氧化”步骤的离子方程____________________。
3.上述流程中,“分离”所包含的操作依次为:______、______、过滤、洗涤、干燥。
硫酸铝铵晶体制备的实验流程如下:
硫酸铝铵晶体制备的实验流程如下:
1.检验上述流程中“过滤”后杂质是否除尽的实验方法是_____________。
取少量滤液于试管中,加几滴KSCN溶液,若溶液不变红,则杂质已除尽
2.写出“氧化”步骤的离子方程式
_____________________________________________________。
2Fe2++H2O2+2H+=2Fe3++2H2O
硫酸铝铵晶体制备的实验流程如下:
3.上述流程中,“分离”所包含的操作依次为:____________、_____________、过滤、洗涤、干燥。
硫酸铝铵晶体制备的实验流程如下:
蒸发浓缩
冷却结晶
物质 开始沉淀 沉淀完全
Fe(OH)3 2.7 3.7
Fe(OH)2 7.6 9.6
Cu(OH)2 4.4 6.4
不同金属离子在溶液中开始沉淀与完全沉淀pH如下:
某Cu2+溶液中含有Fe2+,如何除去Fe2+?
探究 · 拓展
① 能直接加碱沉淀?
② 根据沉淀pH不同,应如何处理?
探究 · 拓展
感谢观看
