第一章《物质及其变化》单元复习课件(共48张PPT)
文档属性
| 名称 | 第一章《物质及其变化》单元复习课件(共48张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 18:10:38 | ||
图片预览









文档简介
(共48张PPT)
素养提升
Literacy improvement
第一章复习
你有信仰就年轻,疑惑就年老;
有自信就年轻,畏惧就年老;
有希望就年轻,绝望就年老;
岁月使你皮肤起皱,但是失去了热忱,就损伤了灵魂。
——卡耐基
学习目标
目标一
目标二
目标三
反应的分类
物质的转化
物质的分类
同素异形体
酸性与碱性氧化物
胶体
电解质及强弱
导电性
电离方程式
三大反应
四种基本反应
氧化还原反应
离子反应
氧化还原反应
概念、电子转移、配平
离子反应
方程式书写与判断、离子共存
物质的分类
01
2. 盐酸、硝酸、氢氧化铁胶体、干冰均为纯净物
3. H2O和H2O2互为同素异形体
1. 根据纯净物的元素组成,将纯净物分为单质和化合物
请判断以下叙述是否正确:
问题解决
1.1.1 概述
纯净物
混合物
单质
化合物
非金属单质
同素异形体
电解质、非电解质
氧化剂、还原剂
溶液、浊液、胶体
金属单质
1. 物质的分类
1.1 据组成和性质
物质
问题解决
2. 非金属元素的氧化物一定是酸性氧化物
3. SO2、SiO2、CO均为酸性氧化物
1. 活泼金属元素的氧化物一定是碱性氧化物
请判断以下叙述是否正确:
金属氧化物
问题解决
两种氧化物分类间的关系?
酸性氧化物
碱性氧化物
两性氧化物
过氧化物
不成盐氧化物
非金属氧化物
1.1.2 氧化物
金属氧化物
非金属氧化物
酸性
氧化物
1. 物质的分类
1.1 据组成和性质
碱性氧化物
过氧化物
两性氧化物
不成盐氧化物
1. 盐类一定含有金属元素
2. 溶于水能能电离出H+的电解质都是酸
成功体验
请判断以下叙述是否正确:
考考你自己
2. 硫酸铜溶液和水都是不能产生丁达尔效应的分散系
3. 丁达尔效应是胶体与溶液的本质区别
1. 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
请判断以下叙述是否正确:
1.2.1 三种分散系
分散质粒子直径
10-9 m
溶液
10-9 m
浊液
胶体
1.物质的分类
1.2 分散系
分散质粒子大小
三分散系本质区别是
性质 应用
丁达尔效应
鉴别胶体溶液与溶液
吸附性
净水
1.2.2 胶体的性质与应用
1.物质的分类
1.2 分散系
① 铜导电,为什么不是电解质?
② 稀硫酸、氨水溶液导电,为何不是电解质?
③ CO2的溶液能导电,为什么CO2不是电解质?
④ 熔融的NaOH是电解质,而为什么NaOH溶液不是电解质?
请解释以下说法:
1.物质的分类
感受﹒ 理解
1.3.1 内涵和外延
化合物的一种分类方法!
酸:
碱:
盐:
金属氧化物:
H2O
H2SO4 HNO3 HCl CH3COOH
NaOH KOH Ca(OH)2
NaCl KNO3 BaSO4
CaO Al2O3 Na2O
1.物质的分类
1.3 电解质
在水溶液或熔融状态下,均能导电
本质
在水溶液或熔融状态下,自身电离
化合物
现象
电
解
质
① 某物质不是电解质,但其水溶液导电
② 某物质液态时不导电,水溶液导电,但属于电解质
CO2 SO3 NH3
HCl、H2SO4
AgCl BaSO4
③ 某物质水溶液不导电,但熔融时导电
看我七十二变
请根据以下要求,各举一例:
电解质
导电
导电物质
电解质
不一定
NaCl固体
不一定是
金属单质
KCl溶液
温馨提醒
01
02
现有以下物质:
①NaCl晶体; ②液态CO2;③醋酸;④汞;⑤Na2SO4固体;⑥蔗糖;⑦酒精;⑧熔化的KNO3
④
⑧
有自由移动的电子或离子
酸、碱、盐、氧化物、水
①
③
⑤
⑧
(1)以上物质能导电的是________
(2)以上物质属于电解质的是__________
感受﹒ 理解
请回答下列问题(用序号):
物质导电
1.物质的分类
1.3 电解质
1.3.2 导电性
自由电子
金属
石墨
自由移动
离子
电解质熔融
电解质溶于水
下列有关电解质说法正确的是
看谁做得既准又快
A. NaOH固体溶于水后可以导电,所以NaOH是电解质
B. CO2的水溶液可以导电,所以CO2是电解质
C.液态的汞导电性良好,所以汞是电解质
D.FeCl3溶液能够导电,所以FeCl3溶液是电解质
考考你自己
下列电离方程式正确的是
A.H2SO4=H++SO42-
B.Fe2(SO4)3=2Fe2++3SO42 -
C.Ba(OH)2=Ba2++2OH-
D.K2CO3=2K++CO3-2
1
2
3
规范:不乱写离子符号
质量守恒:粒子个数不变
电荷守恒:阴阳离子电荷总数相等
1.物质的分类
1.3 电解质
1.3.3 电离方程式
反应的分类
02
A. Fe+CuSO4=FeSO4+Cu
B. CaCO3 CaO+CO2↑
C. 2H2O2=2H2O+O2↑
D. CO+CuO CO2+Cu
以下反应中,属于分解反应同时也属于氧化还原反应的是
请你试一试
1
2
3
三反应
反应前后物质种类及类别
化合反应、分解反应、置换反应、复分解反应
反应中有离子参加
离子反应
反应中有电子转移
氧化还原反应
2. 反应的分类
A. KOH+HCl=KCl+H2O
B. CO2+C 2CO
C. Fe+2HCl=FeCl2+H2↑
D. 2NaOH+Cl2=NaCl+NaClO+H2O
以下反应中,属于氧化还原反应反应且可以书写离子方程式的是
谁做得既准又快
物质的转化
03
A. KCl→KOH
B. CuCO3→CuSO4
C. AgCl→AgNO3
D. Cu→Cu(OH)2
通常情况下以下物质间的转化,一步能实现的是
问题解决
生成沉淀、气体、水,具备其中之一即可
3. 物质的转化
3.1 不同类别物质的转化
3.1.1 复分解反应的条件
以水、食盐、硫酸铜为原料,制备氧化铜,写出有关反应的化学方程式。
已知反应:
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
通电
思考﹒ 运用
原理正确、经济可行
3. 物质的转化
3.1 不同类别物质的转化
3.1.2 制备新物质
3.1.1 复分解反应的条件
1. 稀硫酸与氢氧化钠溶液
2. 盐酸与氨水
3. 稀硝酸与氢氧化铜
4. 醋酸与氢氧化钾溶液
问题解决
请写出以下反应的离子方程式。
书写二法
直写法:找出参加反应的粒子及用量,直接书写
改写法:写→拆→删→查
易错警示
只有溶于水的强电解质可拆!
3. 物质的转化
3.2 离子反应
3.2.1 离子方程式书写与判断
有关物质及反应的离子方程式 错因分析
1 铁与盐酸反应 2Fe+6H+=Fe3++H2↑
2 氧化铁与稀硫酸 O2-+2H+=H2O
3 氯化亚铁溶液与氯气反应生成氯化铁 Fe2++Cl2=Fe3++2Cl-
4 稀硫酸与氢氧化钡溶液 H++SO42-+Ba2++OH-=BaSO4↓+H2O
5 硫酸铁溶液与氢氧化钡溶液 Ba2++SO42-=BaSO4↓
易错问题防范
失真:产物写错
错拆:不能拆的拆了
不守恒:不满足质量及电荷守恒
错约分:局部计量数不能约去
漏写:有时四种离子均反应
3. 物质的转化
3.2 离子反应
3.2.1 离子方程式书写与判断
判断陷阱
颜色
无色或有色
限制离子
酸碱性——直接、间接(指示剂或与某物质反应现象)
存在某离子或物质
存在情况
共存或不共存
3. 物质的转化
3.2 离子反应
3.2.1 审题
3. 物质的转化
3.2 离子反应
3.2.2 不共存情况
生成沉淀
难溶盐、难溶碱
生成气体
H+与CO32- HCO3- SO32-
生成弱电解质
H+与OH- ClO- CH3COO-
OH-与NH4+
反应HgS+O2=Hg+SO2中,氧化剂和还原产物分别是___________、______________。
请用双线桥表示电子转移方向和数目。
1 ×
1 ×
2×
考考你的智慧
升
失
氧
3. 物质的转化
3.3 氧化还原反应
3.3.1 概念
氧化剂
还原剂
还原产物
氧化产物
化合价降低
得电子被还原
化合价升高
失电子被氧化
3NO2+H2O=2HNO3+NO
请分别用双线桥和单线桥表示电子转移方向和数目。
2H2S+SO2=3S↓+2H2O
考考你自己
双线桥
m ×
x ×
3. 物质的转化
3.3 氧化还原反应
3.3.2 电子转移表示
氧化剂
还原剂
还原产物
氧化产物
3. 物质的转化
3.3 氧化还原反应
3.3.2 电子转移表示
单线桥
氧化剂
还原剂
还原产物
氧化产物
3NO2+H2O=2HNO3+NO,请命题:
①氧化剂是_______,氧化产物是______。
②氧化剂和还原剂的质量比是______。
③_______在反应被还原。
④_______在反应中得电子。
⑤若转移6.02×1023个电子,生成___________ 个NO 。
⑥若有6.02×1023个HNO3生成,则转移的电子的个数为__________。
NO2
HNO3
1∶2
NO2
NO2
3.01×1023
6.02×1023
考考你自己
请配平:
___C+ ___HNO3 (浓) → ___CO2↑+ ___NO2↑+ ___H2O
问题及绝
电子守恒
1
2
3
质量守恒
电荷守恒
得失电子数相等
粒子数相等
离子方程式而言
3. 物质的转化
3.3 氧化还原反应
3.3.3 配平
三守恒
标
等
定
平
查
标价态变化元素化合价
得失电子数相等
确定四大物质计量数
配平其他物质计量数
三大守恒
五步骤
3. 物质的转化
3.3 氧化还原反应
3.3.3 配平
PbO2+MnSO4+H2SO4→Pb(MnO4)2+PbSO4+H2O
5PbO2+2MnSO4+2H2SO4=1Pb(MnO4)2+4PbSO4+2H2O
成功体验
请配平:
课后强化复习!
素养提升
Literacy improvement
第一章复习
你有信仰就年轻,疑惑就年老;
有自信就年轻,畏惧就年老;
有希望就年轻,绝望就年老;
岁月使你皮肤起皱,但是失去了热忱,就损伤了灵魂。
——卡耐基
学习目标
目标一
目标二
目标三
反应的分类
物质的转化
物质的分类
同素异形体
酸性与碱性氧化物
胶体
电解质及强弱
导电性
电离方程式
三大反应
四种基本反应
氧化还原反应
离子反应
氧化还原反应
概念、电子转移、配平
离子反应
方程式书写与判断、离子共存
物质的分类
01
2. 盐酸、硝酸、氢氧化铁胶体、干冰均为纯净物
3. H2O和H2O2互为同素异形体
1. 根据纯净物的元素组成,将纯净物分为单质和化合物
请判断以下叙述是否正确:
问题解决
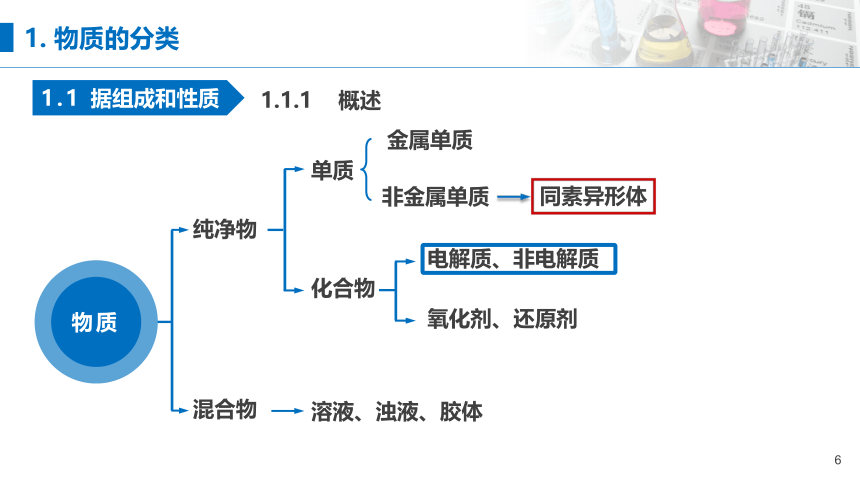
1.1.1 概述
纯净物
混合物
单质
化合物
非金属单质
同素异形体
电解质、非电解质
氧化剂、还原剂
溶液、浊液、胶体
金属单质
1. 物质的分类
1.1 据组成和性质
物质
问题解决
2. 非金属元素的氧化物一定是酸性氧化物
3. SO2、SiO2、CO均为酸性氧化物
1. 活泼金属元素的氧化物一定是碱性氧化物
请判断以下叙述是否正确:
金属氧化物
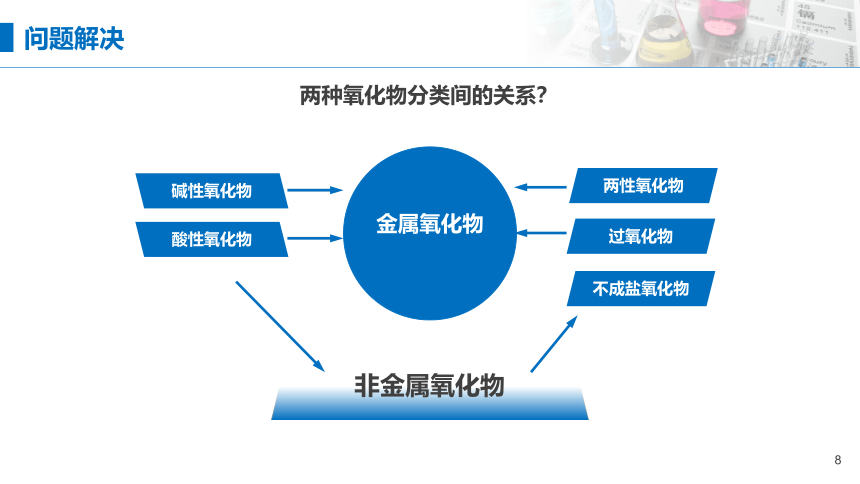
问题解决
两种氧化物分类间的关系?
酸性氧化物
碱性氧化物
两性氧化物
过氧化物
不成盐氧化物
非金属氧化物
1.1.2 氧化物
金属氧化物
非金属氧化物
酸性
氧化物
1. 物质的分类
1.1 据组成和性质
碱性氧化物
过氧化物
两性氧化物
不成盐氧化物
1. 盐类一定含有金属元素
2. 溶于水能能电离出H+的电解质都是酸
成功体验
请判断以下叙述是否正确:
考考你自己
2. 硫酸铜溶液和水都是不能产生丁达尔效应的分散系
3. 丁达尔效应是胶体与溶液的本质区别
1. 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
请判断以下叙述是否正确:
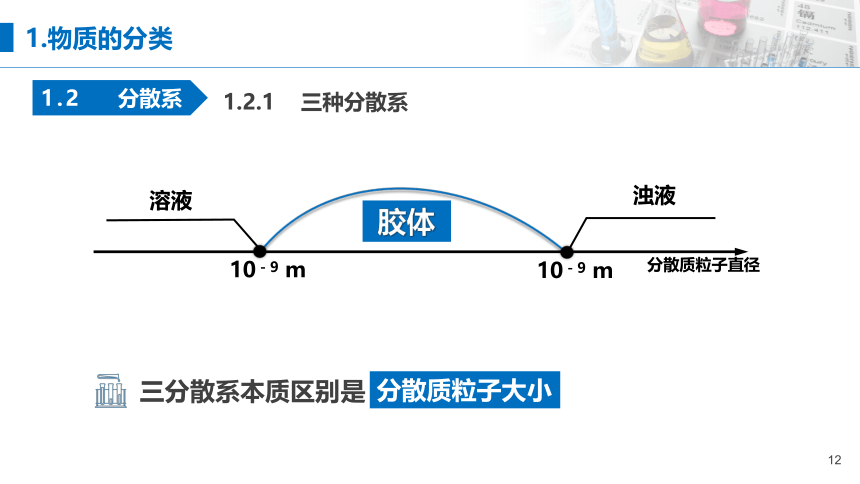
1.2.1 三种分散系
分散质粒子直径
10-9 m
溶液
10-9 m
浊液
胶体
1.物质的分类
1.2 分散系
分散质粒子大小
三分散系本质区别是
性质 应用
丁达尔效应
鉴别胶体溶液与溶液
吸附性
净水
1.2.2 胶体的性质与应用
1.物质的分类
1.2 分散系
① 铜导电,为什么不是电解质?
② 稀硫酸、氨水溶液导电,为何不是电解质?
③ CO2的溶液能导电,为什么CO2不是电解质?
④ 熔融的NaOH是电解质,而为什么NaOH溶液不是电解质?
请解释以下说法:
1.物质的分类
感受﹒ 理解
1.3.1 内涵和外延
化合物的一种分类方法!
酸:
碱:
盐:
金属氧化物:
H2O
H2SO4 HNO3 HCl CH3COOH
NaOH KOH Ca(OH)2
NaCl KNO3 BaSO4
CaO Al2O3 Na2O
1.物质的分类
1.3 电解质
在水溶液或熔融状态下,均能导电
本质
在水溶液或熔融状态下,自身电离
化合物
现象
电
解
质
① 某物质不是电解质,但其水溶液导电
② 某物质液态时不导电,水溶液导电,但属于电解质
CO2 SO3 NH3
HCl、H2SO4
AgCl BaSO4
③ 某物质水溶液不导电,但熔融时导电
看我七十二变
请根据以下要求,各举一例:
电解质
导电
导电物质
电解质
不一定
NaCl固体
不一定是
金属单质
KCl溶液
温馨提醒
01
02
现有以下物质:
①NaCl晶体; ②液态CO2;③醋酸;④汞;⑤Na2SO4固体;⑥蔗糖;⑦酒精;⑧熔化的KNO3
④
⑧
有自由移动的电子或离子
酸、碱、盐、氧化物、水
①
③
⑤
⑧
(1)以上物质能导电的是________
(2)以上物质属于电解质的是__________
感受﹒ 理解
请回答下列问题(用序号):
物质导电
1.物质的分类
1.3 电解质
1.3.2 导电性
自由电子
金属
石墨
自由移动
离子
电解质熔融
电解质溶于水
下列有关电解质说法正确的是
看谁做得既准又快
A. NaOH固体溶于水后可以导电,所以NaOH是电解质
B. CO2的水溶液可以导电,所以CO2是电解质
C.液态的汞导电性良好,所以汞是电解质
D.FeCl3溶液能够导电,所以FeCl3溶液是电解质
考考你自己
下列电离方程式正确的是
A.H2SO4=H++SO42-
B.Fe2(SO4)3=2Fe2++3SO42 -
C.Ba(OH)2=Ba2++2OH-
D.K2CO3=2K++CO3-2
1
2
3
规范:不乱写离子符号
质量守恒:粒子个数不变
电荷守恒:阴阳离子电荷总数相等
1.物质的分类
1.3 电解质
1.3.3 电离方程式
反应的分类
02
A. Fe+CuSO4=FeSO4+Cu
B. CaCO3 CaO+CO2↑
C. 2H2O2=2H2O+O2↑
D. CO+CuO CO2+Cu
以下反应中,属于分解反应同时也属于氧化还原反应的是
请你试一试
1
2
3
三反应
反应前后物质种类及类别
化合反应、分解反应、置换反应、复分解反应
反应中有离子参加
离子反应
反应中有电子转移
氧化还原反应
2. 反应的分类
A. KOH+HCl=KCl+H2O
B. CO2+C 2CO
C. Fe+2HCl=FeCl2+H2↑
D. 2NaOH+Cl2=NaCl+NaClO+H2O
以下反应中,属于氧化还原反应反应且可以书写离子方程式的是
谁做得既准又快
物质的转化
03
A. KCl→KOH
B. CuCO3→CuSO4
C. AgCl→AgNO3
D. Cu→Cu(OH)2
通常情况下以下物质间的转化,一步能实现的是
问题解决
生成沉淀、气体、水,具备其中之一即可
3. 物质的转化
3.1 不同类别物质的转化
3.1.1 复分解反应的条件
以水、食盐、硫酸铜为原料,制备氧化铜,写出有关反应的化学方程式。
已知反应:
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
通电
思考﹒ 运用
原理正确、经济可行
3. 物质的转化
3.1 不同类别物质的转化
3.1.2 制备新物质
3.1.1 复分解反应的条件
1. 稀硫酸与氢氧化钠溶液
2. 盐酸与氨水
3. 稀硝酸与氢氧化铜
4. 醋酸与氢氧化钾溶液
问题解决
请写出以下反应的离子方程式。
书写二法
直写法:找出参加反应的粒子及用量,直接书写
改写法:写→拆→删→查
易错警示
只有溶于水的强电解质可拆!
3. 物质的转化
3.2 离子反应
3.2.1 离子方程式书写与判断
有关物质及反应的离子方程式 错因分析
1 铁与盐酸反应 2Fe+6H+=Fe3++H2↑
2 氧化铁与稀硫酸 O2-+2H+=H2O
3 氯化亚铁溶液与氯气反应生成氯化铁 Fe2++Cl2=Fe3++2Cl-
4 稀硫酸与氢氧化钡溶液 H++SO42-+Ba2++OH-=BaSO4↓+H2O
5 硫酸铁溶液与氢氧化钡溶液 Ba2++SO42-=BaSO4↓
易错问题防范
失真:产物写错
错拆:不能拆的拆了
不守恒:不满足质量及电荷守恒
错约分:局部计量数不能约去
漏写:有时四种离子均反应
3. 物质的转化
3.2 离子反应
3.2.1 离子方程式书写与判断
判断陷阱
颜色
无色或有色
限制离子
酸碱性——直接、间接(指示剂或与某物质反应现象)
存在某离子或物质
存在情况
共存或不共存
3. 物质的转化
3.2 离子反应
3.2.1 审题
3. 物质的转化
3.2 离子反应
3.2.2 不共存情况
生成沉淀
难溶盐、难溶碱
生成气体
H+与CO32- HCO3- SO32-
生成弱电解质
H+与OH- ClO- CH3COO-
OH-与NH4+
反应HgS+O2=Hg+SO2中,氧化剂和还原产物分别是___________、______________。
请用双线桥表示电子转移方向和数目。
1 ×
1 ×
2×
考考你的智慧
升
失
氧
3. 物质的转化
3.3 氧化还原反应
3.3.1 概念
氧化剂
还原剂
还原产物
氧化产物
化合价降低
得电子被还原
化合价升高
失电子被氧化
3NO2+H2O=2HNO3+NO
请分别用双线桥和单线桥表示电子转移方向和数目。
2H2S+SO2=3S↓+2H2O
考考你自己
双线桥
m ×
x ×
3. 物质的转化
3.3 氧化还原反应
3.3.2 电子转移表示
氧化剂
还原剂
还原产物
氧化产物
3. 物质的转化
3.3 氧化还原反应
3.3.2 电子转移表示
单线桥
氧化剂
还原剂
还原产物
氧化产物
3NO2+H2O=2HNO3+NO,请命题:
①氧化剂是_______,氧化产物是______。
②氧化剂和还原剂的质量比是______。
③_______在反应被还原。
④_______在反应中得电子。
⑤若转移6.02×1023个电子,生成___________ 个NO 。
⑥若有6.02×1023个HNO3生成,则转移的电子的个数为__________。
NO2
HNO3
1∶2
NO2
NO2
3.01×1023
6.02×1023
考考你自己
请配平:
___C+ ___HNO3 (浓) → ___CO2↑+ ___NO2↑+ ___H2O
问题及绝
电子守恒
1
2
3
质量守恒
电荷守恒
得失电子数相等
粒子数相等
离子方程式而言
3. 物质的转化
3.3 氧化还原反应
3.3.3 配平
三守恒
标
等
定
平
查
标价态变化元素化合价
得失电子数相等
确定四大物质计量数
配平其他物质计量数
三大守恒
五步骤
3. 物质的转化
3.3 氧化还原反应
3.3.3 配平
PbO2+MnSO4+H2SO4→Pb(MnO4)2+PbSO4+H2O
5PbO2+2MnSO4+2H2SO4=1Pb(MnO4)2+4PbSO4+2H2O
成功体验
请配平:
课后强化复习!
