4.3《化学键——离子键》(第一课时)课件(共68张PPT)
文档属性
| 名称 | 4.3《化学键——离子键》(第一课时)课件(共68张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 19.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 18:13:32 | ||
图片预览







文档简介
(共68张PPT)
牛顿
真理的大海,让未发现的一切事物躺卧在我的眼前,任我去探寻。
安装在车轴头上管住车轮或使轴与齿轮等连接固定的零件,一般是用钢制的长方条(亦称“辖”)
牛顿最有名的定律是什么?
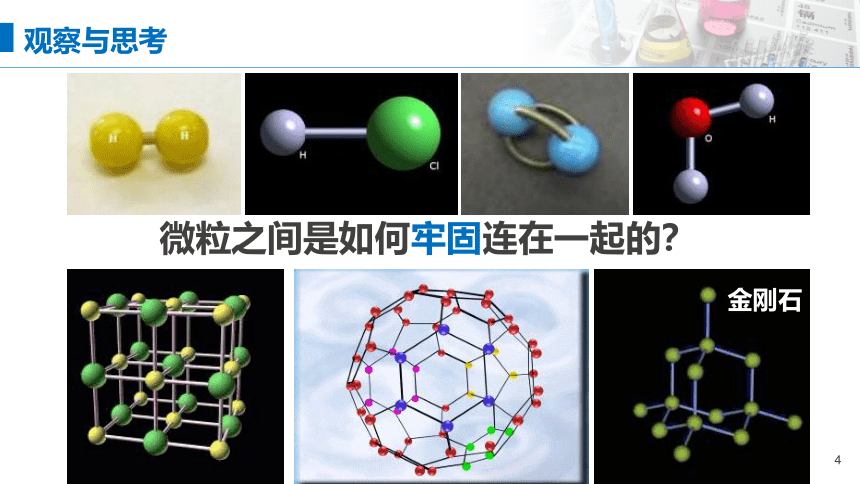
金刚石
微粒之间是如何牢固连在一起的?
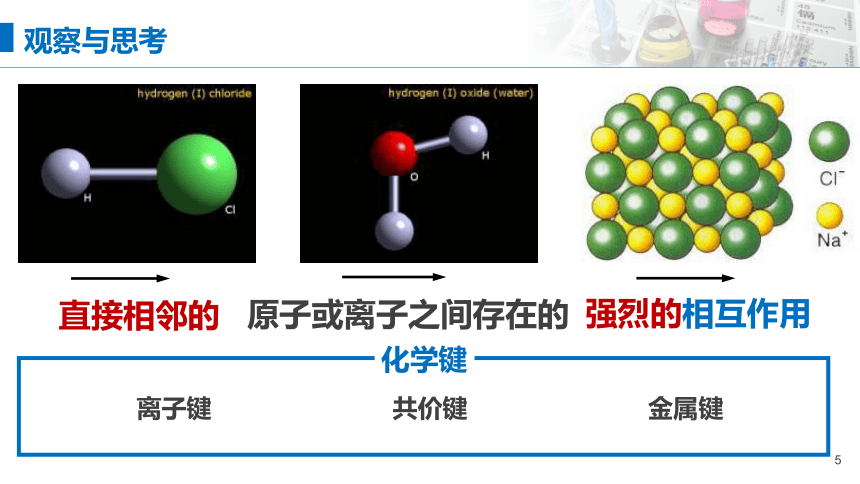
观察与思考
直接相邻的
原子或离子之间存在的
强烈的相互作用
离子键
共价键
金属键
观察与思考
化学键
离子键
Ionic bond
第一课时
第四章 第三节
化学键
学习目标
本质判断
01
概念判断
02
书写判断
03
离子键
离子化合物
电子式
什么元素之间可形成离子键?
01
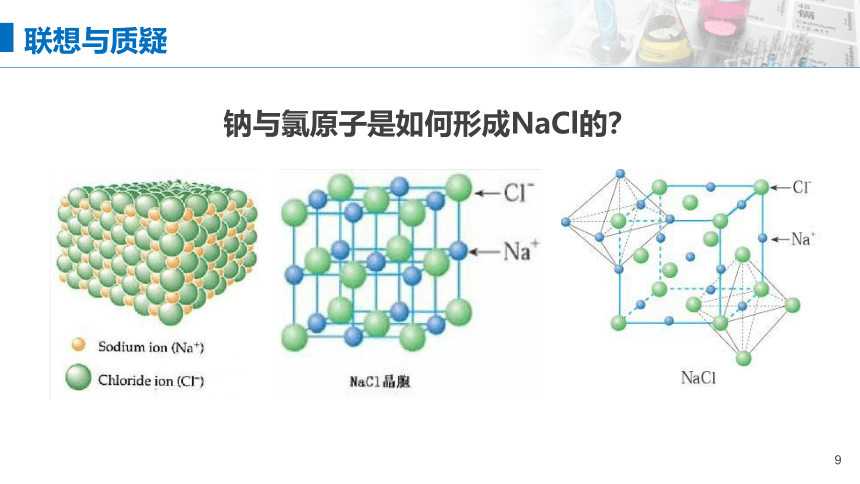
钠与氯原子是如何形成NaCl的?
联想与质疑
欧文·朗缪尔(Irving Langmuir,1881年1月31日-1957年8月16日),美国化学家、物理学家
1932年诺贝尔化学奖。他是第一个成为诺贝尔奖得主的工业化学家
1946年,欧文·朗缪尔第一次人工降雨试验获得成功,朗缪尔开创了人工降雨的新时代
延长灯泡里钨丝的寿命
“同心壳层”和“稳定结构”理论
灯泡里充有惰性气体(稀有气体)
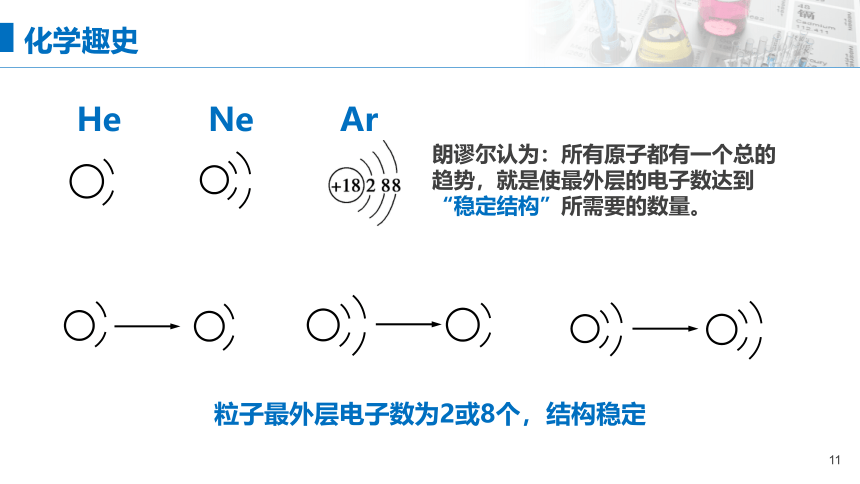
化学趣史
He Ne Ar
朗谬尔认为:所有原子都有一个总的趋势,就是使最外层的电子数达到“稳定结构”所需要的数量。
粒子最外层电子数为2或8个,结构稳定
化学趣史
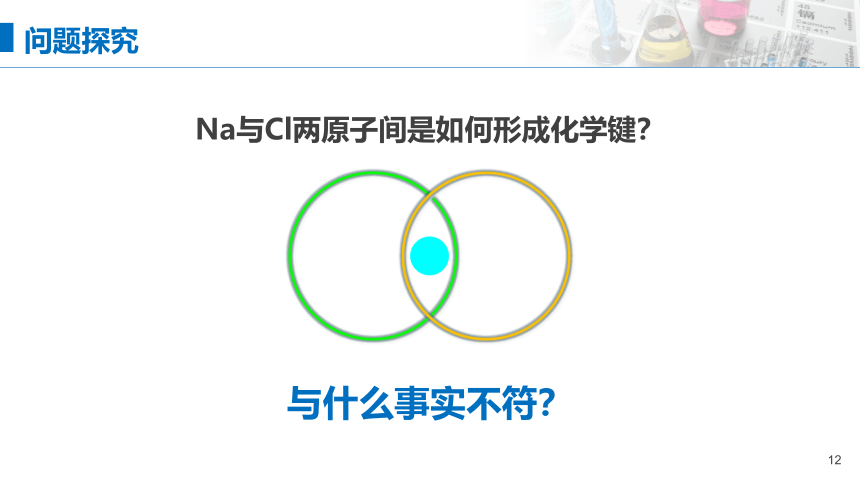
Na与Cl两原子间是如何形成化学键?
与什么事实不符?
问题探究
事实
历史故事
1916年,德国化学家柯塞尔(W. Kossel)根据稀有气体原子的电子层结构具有高度稳定性的事实,提出了离子键( ionic bond)的概念。
问题探究
我多了一个电子
我想要一个电子
问题探究
问题探究
好的
你能给我一个电子吗?
你能给我一个电子吗?
问题探究
我把多余的一个电子给你
好的,谢谢
问题探究
我现在带了正电荷
我现在带了负电荷
问题探究
Na+离子和Cl-离子间的作用力探讨
Na+离子和Cl-离子间的静电________作用
阴阳离子中,电子与电子、原子核与原子核间的_________作用
问题探究
相互吸引作用
相互排斥作用
相互作用
问题探究
1
定义
带相反电荷离子之间的相互作用
2
成键粒子
阴阳离子
1.离子键
相互吸引作用
相互排斥作用
相互作用
静电作用
不是静电吸引!
1.离子键
3
成键本质
静电作用
(静电引力和斥力)
1
定义
带相反电荷离子之间的相互作用
2
成键粒子
阴阳离子
1.离子键
什么元素间可形成离子键?
易失电子的原子
易得电子的原子
形成阴阳离子
1.离子键
易失电子的原子
易得电子的原子
活泼金属原子失电子
活泼非金属原子得电子
1.离子键
什么元素间可形成离子键?
形成阴阳离子
4
成键元素
一般是活泼金属元素与活泼非金属元素
(AlCl3、FeCl3例外)
1.离子键
3
成键本质
静电作用
(静电引力和斥力)
1
定义
带相反电荷离子之间的相互作用
2
成键粒子
阴阳离子
AlCl3
由Al和Cl原子构成,熔融不导电!
资料在线
下列元素原子,最难形成离子键的是
如何判断物质中是否有离子键?
问题解决
A.K
B.Ca
C.S
D.C
5
判断
三点
4
成键元素
一般是活泼金属元素与活泼非金属元素
(AlCl3、FeCl3例外)
3
成键本质
静电作用
(静电引力和斥力)
1
定义
带相反电荷离子之间的相互作用
2
成键粒子
阴阳离子
1.离子键
据组成元素
一般两活
据物质类别
Na
OH
Ba
(OH)2
OH
(OH)2
Na2
K2
SO4
CO3
Na
K
HS
HCO3
铵盐
1.离子键
判断
下列化合物中不含离子键的是
HNO3在熔融状态是否导电?
不导电,可得出什么结论?
HNO3=H++NO3-
请你试一试
C.KOH
D.HNO3
A .(NH4)2S
B.Al2(SO4)3
化合物的另一分类——离子化合物
02
如何判断物质是否是离子化合物?
2. 离子化合物
1
定义
由离子键构成的化合物
2
类别
强碱、盐、活泼金属氧化物
1
定义
由离子键构成的化合物
2
类别
强碱、盐、活泼金属氧化物
2. 离子化合物
3
判断
化学键类型:
含有离子键的化合物
化合物性质:
_______状态下能导电的化合物
熔融
下图形象地表示了氯化钠的形成过程。
下列相关叙述中不正确的是
A.钠原子易失去一个电子,氯原子易得到一个电子
B.钠离子与钠原子有相似的化学性质
C.钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D.氯化钠是离子化合物
你学会了吗?
小亮的纠错笔记中有两道题未分析,请帮他分析。
(1)下列说法正确的是______
A.阴、阳离子通过静电引力形成离子键
B.阴、阳离子间通过离子键一定能形成离子化合物
C.离子化合物一定能导电
D.只有在活泼金属元素和活泼非金属元素化合时,才能形成离子键
(2)下列属于离子化合物的是_____
A.CaCl2 B.HCl C.Na D.H2O
看我七十二变
成功体验
下列不属于离子化合物的是
C.KOH
D.NaNO3
A.H2O
B.CaCl2
氯化钠的形成
离子化合物中离子键的表示
电子式
03
看一看
在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子
如何书写电子式?
X
把最外层的电子优先分布在不同的方向上
每个方向上最多2个电子
3. 电子式
3.1 定义
×
×
×
感受﹒ 理解
3.2.1 原子的电子式
先分散
后集中
3. 电子式
3.2 书写
离子 Na+ Mg2+ Al3+
电子式
×
×
最外层没有电子
深化理解
3.2.2 离子的电子式
阳离子的电子式
单核就是离子符号
复杂离子,如
3. 电子式
3.2 书写
NH4+的电子式
复杂离子的电子式
形成过程
记忆
离子 O2- Cl- N3- H-
电子式
请写出以下离子的电子式
请你试一试
3.2.2 离子的电子式
不但要画出最外层电子数,而且还应用中括号“[ ]”括起来,并在右上角标出“n-”电荷字样。
3. 电子式
3.2 书写
阳离子的电子式
阴离子的电子式
AB型:将阳离子和阴离子的电子式合在一起
NaCl电子式
若阴阳离子的数目不相等
相同的离子不能放在一起
化合物电子式书写
3.2.3 离子化合物的电子式
正确书写离子的电子式
将阴阳离子电子式正确组合
3. 电子式
3.2 书写
相同离子:
不能合并,不能相邻
提醒
AB型 NaCl
A2B型 Na2S
AB2型 MgCl2
3. 电子式
3.2 书写
3.2.3 离子化合物的电子式
1. CaO
2. MgF2
3. NaH
4. (NH4)2S
试一试
写各原子电子式,中间用“+”,用弯前头表示电子转移
画“→”
写离子化合物的电子式
3. 电子式
3.3 离子化合物的形成书写
用电子式表示出下列物质的形成过程:
MgO
MgCl2
Na2O
你学会了吗?
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
电子
得失
得电子
阴离子
阳离子
相互
作用
离子键
离子化合物
失电子
水或
电离
阴离子
阳离子
课堂小结
A.表示一个氯化钠分子
B.Na+与Cl-之间存在离子键
C.Na+与Cl-的结构示意图相同
D.在氯化钠中存在钠原子和氯原子
小试身手
对于NaCl的下列叙述正确的是
A.非金属元素的原子间不能形成离子化合物
B.所有金属与所有非金属之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
挑战自我
下列说法正确的是
1. 漏写或多写[ ]
2. 误将电荷数标成化合价
3. 离子的排列顺序写错
4. 未将每个离子单独写,而用角码将相同离子合并在一起
归纳与整理
判断下列化合物电子式书写是否正确
A.可溶于水
B.具有较高的熔点
C.水溶液能导电
D.熔融状态能导电
问题探究
下列性质可证明某化合物中一定存在离子键的是
看谁做得既准又快
下列不是离子化合物的是
成功体验
1.下列物质中,含硫离子的是
A.硫化氢 B.二硫化碳
C.硫化钙 D.二氧化硫
2.下列各类物质中,不含有离子键的是
A.酸 B.碱
C.盐 D.金属氧化物
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
W X
Y Z
A.X 、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性大于Y
D.Z元素单质在化学反应中只表现氧化性
N
O
S
Cl
挑战自我
感谢观看
牛顿
真理的大海,让未发现的一切事物躺卧在我的眼前,任我去探寻。
安装在车轴头上管住车轮或使轴与齿轮等连接固定的零件,一般是用钢制的长方条(亦称“辖”)
牛顿最有名的定律是什么?
金刚石
微粒之间是如何牢固连在一起的?
观察与思考
直接相邻的
原子或离子之间存在的
强烈的相互作用
离子键
共价键
金属键
观察与思考
化学键
离子键
Ionic bond
第一课时
第四章 第三节
化学键
学习目标
本质判断
01
概念判断
02
书写判断
03
离子键
离子化合物
电子式
什么元素之间可形成离子键?
01
钠与氯原子是如何形成NaCl的?
联想与质疑
欧文·朗缪尔(Irving Langmuir,1881年1月31日-1957年8月16日),美国化学家、物理学家
1932年诺贝尔化学奖。他是第一个成为诺贝尔奖得主的工业化学家
1946年,欧文·朗缪尔第一次人工降雨试验获得成功,朗缪尔开创了人工降雨的新时代
延长灯泡里钨丝的寿命
“同心壳层”和“稳定结构”理论
灯泡里充有惰性气体(稀有气体)
化学趣史
He Ne Ar
朗谬尔认为:所有原子都有一个总的趋势,就是使最外层的电子数达到“稳定结构”所需要的数量。
粒子最外层电子数为2或8个,结构稳定
化学趣史
Na与Cl两原子间是如何形成化学键?
与什么事实不符?
问题探究
事实
历史故事
1916年,德国化学家柯塞尔(W. Kossel)根据稀有气体原子的电子层结构具有高度稳定性的事实,提出了离子键( ionic bond)的概念。
问题探究
我多了一个电子
我想要一个电子
问题探究
问题探究
好的
你能给我一个电子吗?
你能给我一个电子吗?
问题探究
我把多余的一个电子给你
好的,谢谢
问题探究
我现在带了正电荷
我现在带了负电荷
问题探究
Na+离子和Cl-离子间的作用力探讨
Na+离子和Cl-离子间的静电________作用
阴阳离子中,电子与电子、原子核与原子核间的_________作用
问题探究
相互吸引作用
相互排斥作用
相互作用
问题探究
1
定义
带相反电荷离子之间的相互作用
2
成键粒子
阴阳离子
1.离子键
相互吸引作用
相互排斥作用
相互作用
静电作用
不是静电吸引!
1.离子键
3
成键本质
静电作用
(静电引力和斥力)
1
定义
带相反电荷离子之间的相互作用
2
成键粒子
阴阳离子
1.离子键
什么元素间可形成离子键?
易失电子的原子
易得电子的原子
形成阴阳离子
1.离子键
易失电子的原子
易得电子的原子
活泼金属原子失电子
活泼非金属原子得电子
1.离子键
什么元素间可形成离子键?
形成阴阳离子
4
成键元素
一般是活泼金属元素与活泼非金属元素
(AlCl3、FeCl3例外)
1.离子键
3
成键本质
静电作用
(静电引力和斥力)
1
定义
带相反电荷离子之间的相互作用
2
成键粒子
阴阳离子
AlCl3
由Al和Cl原子构成,熔融不导电!
资料在线
下列元素原子,最难形成离子键的是
如何判断物质中是否有离子键?
问题解决
A.K
B.Ca
C.S
D.C
5
判断
三点
4
成键元素
一般是活泼金属元素与活泼非金属元素
(AlCl3、FeCl3例外)
3
成键本质
静电作用
(静电引力和斥力)
1
定义
带相反电荷离子之间的相互作用
2
成键粒子
阴阳离子
1.离子键
据组成元素
一般两活
据物质类别
Na
OH
Ba
(OH)2
OH
(OH)2
Na2
K2
SO4
CO3
Na
K
HS
HCO3
铵盐
1.离子键
判断
下列化合物中不含离子键的是
HNO3在熔融状态是否导电?
不导电,可得出什么结论?
HNO3=H++NO3-
请你试一试
C.KOH
D.HNO3
A .(NH4)2S
B.Al2(SO4)3
化合物的另一分类——离子化合物
02
如何判断物质是否是离子化合物?
2. 离子化合物
1
定义
由离子键构成的化合物
2
类别
强碱、盐、活泼金属氧化物
1
定义
由离子键构成的化合物
2
类别
强碱、盐、活泼金属氧化物
2. 离子化合物
3
判断
化学键类型:
含有离子键的化合物
化合物性质:
_______状态下能导电的化合物
熔融
下图形象地表示了氯化钠的形成过程。
下列相关叙述中不正确的是
A.钠原子易失去一个电子,氯原子易得到一个电子
B.钠离子与钠原子有相似的化学性质
C.钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D.氯化钠是离子化合物
你学会了吗?
小亮的纠错笔记中有两道题未分析,请帮他分析。
(1)下列说法正确的是______
A.阴、阳离子通过静电引力形成离子键
B.阴、阳离子间通过离子键一定能形成离子化合物
C.离子化合物一定能导电
D.只有在活泼金属元素和活泼非金属元素化合时,才能形成离子键
(2)下列属于离子化合物的是_____
A.CaCl2 B.HCl C.Na D.H2O
看我七十二变
成功体验
下列不属于离子化合物的是
C.KOH
D.NaNO3
A.H2O
B.CaCl2
氯化钠的形成
离子化合物中离子键的表示
电子式
03
看一看
在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子
如何书写电子式?
X
把最外层的电子优先分布在不同的方向上
每个方向上最多2个电子
3. 电子式
3.1 定义
×
×
×
感受﹒ 理解
3.2.1 原子的电子式
先分散
后集中
3. 电子式
3.2 书写
离子 Na+ Mg2+ Al3+
电子式
×
×
最外层没有电子
深化理解
3.2.2 离子的电子式
阳离子的电子式
单核就是离子符号
复杂离子,如
3. 电子式
3.2 书写
NH4+的电子式
复杂离子的电子式
形成过程
记忆
离子 O2- Cl- N3- H-
电子式
请写出以下离子的电子式
请你试一试
3.2.2 离子的电子式
不但要画出最外层电子数,而且还应用中括号“[ ]”括起来,并在右上角标出“n-”电荷字样。
3. 电子式
3.2 书写
阳离子的电子式
阴离子的电子式
AB型:将阳离子和阴离子的电子式合在一起
NaCl电子式
若阴阳离子的数目不相等
相同的离子不能放在一起
化合物电子式书写
3.2.3 离子化合物的电子式
正确书写离子的电子式
将阴阳离子电子式正确组合
3. 电子式
3.2 书写
相同离子:
不能合并,不能相邻
提醒
AB型 NaCl
A2B型 Na2S
AB2型 MgCl2
3. 电子式
3.2 书写
3.2.3 离子化合物的电子式
1. CaO
2. MgF2
3. NaH
4. (NH4)2S
试一试
写各原子电子式,中间用“+”,用弯前头表示电子转移
画“→”
写离子化合物的电子式
3. 电子式
3.3 离子化合物的形成书写
用电子式表示出下列物质的形成过程:
MgO
MgCl2
Na2O
你学会了吗?
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
电子
得失
得电子
阴离子
阳离子
相互
作用
离子键
离子化合物
失电子
水或
电离
阴离子
阳离子
课堂小结
A.表示一个氯化钠分子
B.Na+与Cl-之间存在离子键
C.Na+与Cl-的结构示意图相同
D.在氯化钠中存在钠原子和氯原子
小试身手
对于NaCl的下列叙述正确的是
A.非金属元素的原子间不能形成离子化合物
B.所有金属与所有非金属之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
挑战自我
下列说法正确的是
1. 漏写或多写[ ]
2. 误将电荷数标成化合价
3. 离子的排列顺序写错
4. 未将每个离子单独写,而用角码将相同离子合并在一起
归纳与整理
判断下列化合物电子式书写是否正确
A.可溶于水
B.具有较高的熔点
C.水溶液能导电
D.熔融状态能导电
问题探究
下列性质可证明某化合物中一定存在离子键的是
看谁做得既准又快
下列不是离子化合物的是
成功体验
1.下列物质中,含硫离子的是
A.硫化氢 B.二硫化碳
C.硫化钙 D.二氧化硫
2.下列各类物质中,不含有离子键的是
A.酸 B.碱
C.盐 D.金属氧化物
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
W X
Y Z
A.X 、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性大于Y
D.Z元素单质在化学反应中只表现氧化性
N
O
S
Cl
挑战自我
感谢观看
