1.1《反应热——热化学反应方程式、燃烧热》(第2课时)课件(共35张PPT)
文档属性
| 名称 | 1.1《反应热——热化学反应方程式、燃烧热》(第2课时)课件(共35张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 18:15:37 | ||
图片预览










文档简介
(共35张PPT)
网
1.1.2 热化学方程式 燃烧热
化学反应的热效应
第一章 第一节 反应热
The thermal effect of A chemical reaction
了解热化学方程式的含义并能正确书写热化学方程式。
1
了解燃烧热的定义、热化学方程式的书写。
2
学习目标
导 入
你能列举日常生活中的常用燃料吗 燃料燃烧都是放热反应吗
答案: 煤炭、甲烷、液化石油气、氢气等;燃料燃烧都是放热反应。
【思考】我们已经知道了该如何表示化学反应中的物质变化,又知道了如何
表示反应热。该怎样将这两者同时表示出来呢?
表明了1mol气态 H2和1mol气态 Cl2反应生成了2mol气态 HCl时,放出热量184.6KJ。
下面这个书写形式能表明什么信息
H2(g)+Cl2(g)======2HCl(g) △H=-184.6 kJ/mol
点燃
101kPa
物质变化
能量变化
表示的意义是
上述方程式就叫热化学方程式
学习任务一 热化学反应方程式的书写
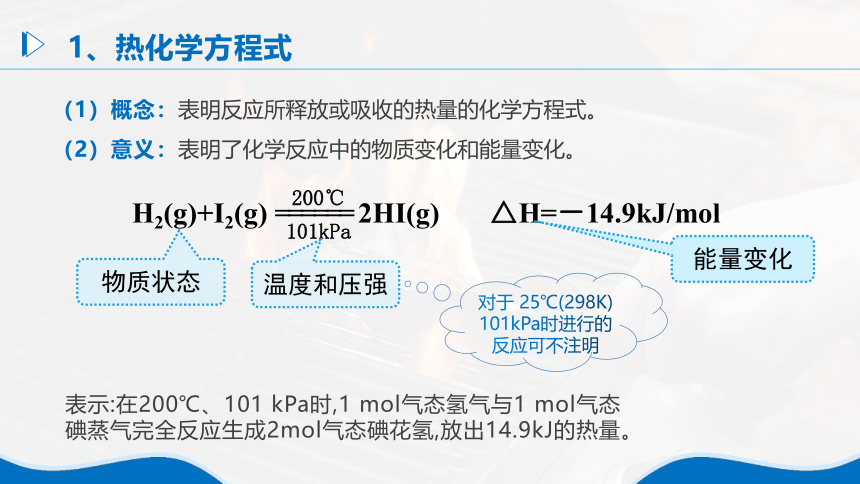
(1)概念:表明反应所释放或吸收的热量的化学方程式。
(2)意义:表明了化学反应中的物质变化和能量变化。
H2(g)+I2(g) ====== 2HI(g) △H=-14.9kJ/mol
200℃
101kPa
物质状态
温度和压强
能量变化
对于 25℃(298K) 101kPa时进行的反应可不注明
表示:在200℃、101 kPa时,1 mol气态氢气与1 mol气态
碘蒸气完全反应生成2mol气态碘花氢,放出14.9kJ的热量。
1、热化学方程式
标明物质聚集状态
△H= 183 kJ/mol
写出反应焓变
ΔH= 57.3 kJ/mol
思考:如何正确书写热化学方程式?
2、书写热化学方程式的方法
思考:如何正确书写热化学方程式?
书写的注意事项
注意:热化学方程式中不用“↑”和“↓”
① 注明反应体系中反应物和生成物的聚集状态,不用写“点燃”、“加热”等引发条件。例如:气态(g)、固态(s)、液态(l)、溶液(aq)
ΔH= 57.3 kJ/mol
H2(g)+ O2(g)==H2O(l) △H=-285.8kJ/mol
1
2
H2(g)+ O2(g)==H2O(g) △H=-241.8kJ/mol
1
2
② 注明反应时的温度和压强,因为同一反应在不同温度下进行时,其焓变是不同的。
2、书写热化学方程式的方法
H2(g) + I2 (g) ===== 2HI(g) ΔH= -14.9 kJ/mol
200℃
101kPa
H2(g) + Cl2(g) == 2HCl(g) ΔH= -184.6 kJ/mol
对于25℃,101 kPa 下进行的化学反应,可以不注明。
③ △H 为“+”,表示吸热反应; △H 为“ ”,表示放热反应
④ △H 与化学计量数有关,热化学方程式中各物质的化学计量数仅表示其物质的量,可以是整数,也可以是分数(但一般仍用最简整数比);化学计量数加倍,△H 也要加倍。
2、书写热化学方程式的方法
示例:在25℃,101 kPa下,写出下列反应的热化学方程式:
(2)3 mol NO2(g) 与 1 mol H2O(l) 反应,生成 HNO3(aq)
和 NO(g),放热138 kJ
(1)1 mol HgO(s) 分解为液态汞和氧气,吸热90.7 kJ
△H= +90.7 kJ/mol
ΔH= 138 kJ/mol
ΔH= 285.8 kJ/mol
ΔH= 571.6 kJ/mol
注:热化学方程式中ΔH 的单位“mol-1”是指 “每摩尔反应”。
注意可逆反应的ΔH和实际吸收或放出热量的区别∶不论化学反应是否可逆,热化学方程式中的反应热ΔH都表示反应进行到底时的能量变化。
特别提醒:
⑤ 若正反应为放热反应(△H<0),则逆反应为吸热反应(△H>0)
△H= 41 kJ/mol
△H= +41 kJ/mol
可逆反应的△H是指物质完全反应时的热效应,当反应逆向进行时,其反应热与正反应的数值相等,符号相反。
2、书写热化学方程式的方法
【拓展提升】热化学方程式中的标注问题
2、书写热化学方程式的方法
归纳与整理:
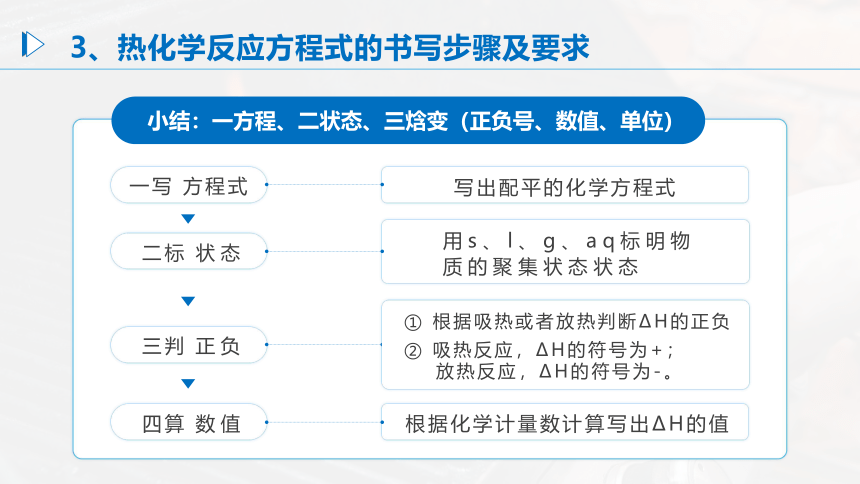
小结:一方程、二状态、三焓变(正负号、数值、单位)
一写 方程式
二标 状态
三判 正负
四算 数值
根据化学计量数计算写出ΔH的值
用s、l、g、aq标明物质的聚集状态状态
写出配平的化学方程式
3、热化学反应方程式的书写步骤及要求
① 根据吸热或者放热判断ΔH的正负
② 吸热反应,ΔH的符号为+;
放热反应,ΔH的符号为-。
沼气的主要成分是甲烷。0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是( )
A. 2CH4( g ) + 4O2( g ) = 2CO2( g ) + 4H2O ( l ) ΔH = + 890 kJ/mol
B. CH4 + 2O2 = CO2 + H2O ΔH = – 890 kJ/mol
1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l ) ΔH = – 890 kJ/mol
C
C. CH4 ( g ) + 2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l ) ΔH = – 890 kJ/mol
无状态
ΔH = – 445 kJ/mol
4、判断热化学方程式正误
一看——各物质的聚集状态是否正确;
二看——ΔH的符号“+”“-”是否与吸热 放热相一致;
三看——反应热的单位是否是kJ·mol-1;
四看——反应热数值与化学计量数是否相对应。
四看”法判断热化学方程式的正误:
【例1】依据事实,写出下列反应的热化学方程式。
0.5mol Cu(s)与适量O2(g)反应生成CuO(s),放出78.65kJ的热量。
【解析】先写出常规化学方程式,然后标注状态及焓变,
根据 0.5 mol Cu 反应的焓变信息计算出 1 mol Cu 对应焓变。
Cu(s)+1/2O2(g)=CuO(s) △H=-157.3kJ/mol
4、判断热化学方程式正误
【例2】 H2(g)+Cl2(g)=2HCl(g) H =-184.6kJ/mol
单位中的mol-1含义?
H单位中的mol-1既不是每摩尔H2或Cl2,也不是每摩尔HCl,而是“每摩尔反应”“:1 mol H2(g)和 1 mol Cl2(g) 反应生成2 mol HCl(g),“每摩尔反应” 放出184.6kJ的热量。
1/2H2(g)+1/2Cl2(g)=HCl(g) H=-92.3kJ/mol
0.5 mol H2 (g)和 0.5 mol Cl2 (g)反应生成1 mol HCl(g)表示“每摩尔反应”,“每摩尔反应”放出92.3kJ的热量
H的单位为KJ/mol,它并不是指每摩尔具体物质反应时伴随的能量变化是多少千焦,而是指给定形式的具体反应以各物质的化学计量数来计量其物质的量时伴随的能量变化是多少千焦。
注意
4、判断热化学方程式正误
典题精练
1.下列热化学方程式中书写正确的是 ( )
2CO2+3H2O ΔH=-1 366.8 kJ/mol
A.C2H5OH+3O2
ΔH=-269.8 kJ/mol
C.S(s)+O2(g) SO2(g)
D.2NO(g)+O2(g) 2NO2(g)
ΔH=-116.2 kJ
B.NaOH(aq)+HCl(aq)
ΔH=+57.3 kJ/mol
NaCl(aq)+H2O(l)
解析: A项,未标明各物质的聚集状态;B项,NaOH与HCl的反应为放热反
应,ΔH<0;D项,ΔH的单位是“kJ/mol”而不是“kJ”。
答案: C
典题精练
2. 肼(N2H4)是一种高效清洁的火箭燃料。8 g N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+H2O(l) ΔH=-267 kJ·mol-1
D.N2H4(g)+O2(g)===N2(g)+H2O(g) ΔH=+267 kJ·mol-1
典题精练
【解析】选A。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时放出133.5 kJ热量,则1 mol N2H4(g)完全燃烧生成氮气和气态水时放出133.5 kJ×4=534 kJ热量,热化学方程式为N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1,A项正确。
总结:用结构图梳理书写热化学方程式的注意事项
热化学
方程式
符号
吸热 +
放热
数值
与化学计量
数相对应
单位
kJ/mol
固体(s)
液体(l)
气体(g)
溶液(aq)
化学计量数
与焓变数值对应
表示物质的量
(整数、分数均可)
条件
压强
温度
状态
由于反应的情况不同,反应热可分为燃烧热、中和热、溶解热等,
其中以燃烧热的实际应用最广泛。
思考 ?
我们知道物质燃烧都会放出热量,那么是不是物质燃烧放出的热量就叫燃烧热呢?
一、燃烧热
如何定量描述?
101 kPa 时,1 mol 纯物质完全燃烧生成指定产物时,所放出的热量,叫做该物质的燃烧热,单位 kJ/mol 或 kJ·mol-1。
例如:25℃,101 kPa,1 mol CH4 完全燃烧,放出 890.31 kJ 的热量,这就是 CH4 的燃烧热。用热化学方程式表示如下:
ΔH= 890.3 kJ/mol
学习任务二 燃烧热 中和热
1. 定义:
可燃物的化学计量数为“1”
例如:25℃,101 kPa,1 mol CH3CH2OH 完全燃烧,放出 1366.8 kJ 的热量,这就是 CH3CH2OH 的燃烧热。用热化学方程式表示如下:
可燃物的化学计量数为“1”
例如:25℃,101 kPa,1 mol 乙炔(C2H2)完全燃烧,放出 1366.8 kJ 的热量,这就是乙炔(C2H2)的燃烧热。用热化学方程式表示如下:
可燃物的化学计量数为“1”
学习任务二 燃烧热 中和热
ΔH= 890.3 kJ/mol
ΔH= 1366.8 kJ/mol
如何定量描述?
学习任务二 燃烧热 中和热
“完全燃烧生成指定产物”是指单质或化合物燃烧后变为最稳定的物质。
完全燃烧时,下列元素要生成对应的物质∶
C→CO2(g),H→H2O(l),S→SO2(g),N→N2(g)等。
C→CO不是完全燃烧;而 S→SO3,SO3不是燃烧产物; 生成的水为液态不能是气态。
2. 注意事项:
ΔH= 890.3 kJ/mol
出890.3 kJ的热量。
它表示25 ℃、101 kPa时, 1 molCH4完全燃烧生成气态CO2和液态H2O时放
3.燃烧热的意义:
甲烷的燃烧热为ΔH=-890.3 kJ·mol。
1. C(s)+ O2(g)=CO(g); △H=-110.5kJ/mol
C(s)+ O2(g)=CO2(g);△H=-393.5kJ/mol
则C的燃烧热为 。
393.5kJ/mol
2. 2H2( g ) + O2 ( g) = 2H2O ( l ) ΔH=-571.6 kJ/mol
H2( g ) +1/2 O2 ( g) = H2O ( g ) ΔH=-241.8 kJ/mol
求氢气的燃烧热。
ΔH= -285.8 kJ/mol
4.对燃烧热的深入理解:
(1)反应条件∶25 ℃和101 kPa(书中给出的燃烧热数值均为此条件下测得)。
(2)物质的燃烧热要求的是纯物质。
(3)文字叙述燃烧热时用正值或ΔH表示,
例如,CH4的燃烧热为890.3 kJ·mol-1或 ΔH=-890.3 kJ·mol-1。
学习任务二 燃烧热 中和热
学习任务二 燃烧热 中和热
燃烧热是以1 mol纯物质完全燃烧所放出的热量来定义的,因此在书写表示燃烧热的热化学方程式时,应以燃烧1 mol物质为标准来配平其余物质的化学计量数,故在表示燃烧热的热化学方程式中常出现分数。
5.表示燃烧热的热化学方程式的书写
学习任务二 燃烧热 中和热
例:C8H18燃烧的热化学方程式为:
2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-11 036 kJ·mol-1,C8H18的燃烧热为5 518 kJ·mol-1,而不是11 036 kJ·mol-1。
C8H18燃烧热的热化学方程式为:
C8H18(l)+O2(g)===8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1。
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H= -2599.2kJ/mol
例:0.3mol的气态高能燃料乙炔(C2H2)在氧气中完全燃烧,生成气态CO2和
液态水,放出389.88kJ热量,其热化学方程式为
【思考】
燃烧放出的热量与燃烧热有什么不同?
表示燃烧热的热化学方程式为
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H= -1299.6kJ/mol
1299.6kJ/mol
其燃烧热为
① 燃烧放出的热量与物质的多少有关,燃烧的物质越多,放出的热量就越多,而燃烧热
规定是1 mol的纯物质;
② 研究燃烧放出的热量并未限定燃烧产物的形态,而研究燃烧热必须是生成稳定的氧化物。
学习任务二 燃烧热 中和热
6.书写或判断表示燃烧热的热化学方程式要做到“四看”
一看 可燃物的化学计量数是否为1。
二看 碳元素完全燃烧生成的氧化物是否为CO2(g)。
三看 氢元素完全燃烧生成的氧化物是否为H2O(l)。
四看 ΔH是否为“—”及单位是否正确。
学习任务二 燃烧热 中和热
典题精练
解析: 表示燃烧热的热化学方程式要求1 mol 纯物质完全燃烧,生成稳定的燃烧产物。符合要求的只有A项。
答案: A
1.下列热化学方程式中能表示可燃物燃烧热的热化学方程式的是 ( )
CO2(g) ΔH=-283.0 kJ/mol
A. CO(g)
2H2O(l) ΔH=-571.6 kJ/mol
C. 2H2(g)+O2(g)
B. CH4(g)+2O2(g)
CO2(g)+2H2O(g) ΔH=-802.3 kJ/mol
D. 2H2(g)+O2(g)
2H2O(g) ΔH=-483.6 kJ/mol
典题精练
2.沼气是一种能源,它的主要成分是CH4,0.5 mol CH4完全燃烧生成CO2(g)和H2O(l)时,放出445 kJ 热量,则下列热化学方程式中正确的是 ( )
解析: 0.5 mol CH4完全燃烧生成CO2(g)和H2O(l)时,放出445 kJ热量,则1 mol CH4完全燃烧生成CO2(g)和H2O(l)时,放出890 kJ热量,根据书写热化学方程式的有关规定,要注明参加反应的物质的聚集状态,标出热效应,故符合题意的是C项。
答案: C
2CO2(g)+4H2O(l) ΔH=+890 kJ/mol
A.2CH4(g)+4O2(g)
B.CH4(g)+2O2(g)
CO2(g)+2H2O( l) ΔH=+890 kJ/mol
C.CH4(g)+2O2(g)
CO2(g)+2H2O(l) ΔH=-890 kJ/mol
D. CH4(g)+O2(g)
CO2(g)+H2O(l) ΔH=-890 kJ/mol
典题精练
解析: 丙烷的分子式是C3H8,1 mol丙烷燃烧会产生4 mol水,则丙烷完全燃烧产生1.8 g H2O(l),消耗丙烷的物质的量n(C3H8)=×n(H2O)=×=×=0.025 mol,所以反应放出的热量Q=2 219.9 kJ/mol×0.025 mol=55.4975 kJ≈55 kJ。
答案: A
3. 已知丙烷的燃烧热ΔH=-2 219.9 kJ/mol,若一定量的丙烷完全燃烧后生成1.8 g H2O(l),则放出的热量约为( )
A.55 kJ B.220 kJ C.550 kJ D.1 108 kJ
要点
酸碱中和反应的热化学方程式≠中和热的热化学方程式。
酸碱中和反应的热化学方程式
——水的系数可以是任意的!
中和热的热化学方程式
——水的系数必须是“1”
在稀溶液中,酸和碱发生中和反应而生成1mol H2O所放出的热量
1、定义:
H+(aq)+OH-(aq)=H2O (1) △H=-57.3kJ/mol
研究条件:稀溶液
反应物:强酸与强碱
生成物及其物质的量:水 1mol
注意:强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1mol H2O放出的热小于57.3KJ;
中和热的表示:
容易混淆问题:
二、中和热
放出的热量:57.3kJ
例:1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应的中和热为 ___________ ;
表示该中和热的热化学方程式为: _____________________________________________________________。
1/2H2SO4(aq) +NaOH(aq)=1/2Na2SO4(aq)+H2O(l) △H= -57.3 kJ/mol
57.3kJ /mol
二、中和热
反应热 中和热 燃烧热
含义 化学反应过程中放出或吸收的热量 在稀溶液中,强酸和强碱发生中和反应而生成1 mol H2O(l)时所放出的热量 在101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时所放出的热量
反应特点 任何反应 中和反应 燃烧反应
物质状态 物质的状态要确定 稀溶液 生成物在常温下为稳定态
方程式配平标准 任意物质的量 以生成1 mol H2O(l)为标准 以燃烧1 mol 可燃物为标准
ΔH符号 放热取负值、吸热取正值 负值 负值
能量数值的描述 必须指出是放热还是吸热或使用正负值或用ΔH表示 直接描述热量的变化时不必再指明是放出的热量,可用ΔH表示
反应热、中和热、燃烧热的异同点
热化学方程式 燃烧热
热化学
方程式
概念
表示
书写
燃烧热
一种特定的反应热
概念
注意问题
课堂小结
网
1.1.2 热化学方程式 燃烧热
化学反应的热效应
第一章 第一节 反应热
The thermal effect of A chemical reaction
了解热化学方程式的含义并能正确书写热化学方程式。
1
了解燃烧热的定义、热化学方程式的书写。
2
学习目标
导 入
你能列举日常生活中的常用燃料吗 燃料燃烧都是放热反应吗
答案: 煤炭、甲烷、液化石油气、氢气等;燃料燃烧都是放热反应。
【思考】我们已经知道了该如何表示化学反应中的物质变化,又知道了如何
表示反应热。该怎样将这两者同时表示出来呢?
表明了1mol气态 H2和1mol气态 Cl2反应生成了2mol气态 HCl时,放出热量184.6KJ。
下面这个书写形式能表明什么信息
H2(g)+Cl2(g)======2HCl(g) △H=-184.6 kJ/mol
点燃
101kPa
物质变化
能量变化
表示的意义是
上述方程式就叫热化学方程式
学习任务一 热化学反应方程式的书写
(1)概念:表明反应所释放或吸收的热量的化学方程式。
(2)意义:表明了化学反应中的物质变化和能量变化。
H2(g)+I2(g) ====== 2HI(g) △H=-14.9kJ/mol
200℃
101kPa
物质状态
温度和压强
能量变化
对于 25℃(298K) 101kPa时进行的反应可不注明
表示:在200℃、101 kPa时,1 mol气态氢气与1 mol气态
碘蒸气完全反应生成2mol气态碘花氢,放出14.9kJ的热量。
1、热化学方程式
标明物质聚集状态
△H= 183 kJ/mol
写出反应焓变
ΔH= 57.3 kJ/mol
思考:如何正确书写热化学方程式?
2、书写热化学方程式的方法
思考:如何正确书写热化学方程式?
书写的注意事项
注意:热化学方程式中不用“↑”和“↓”
① 注明反应体系中反应物和生成物的聚集状态,不用写“点燃”、“加热”等引发条件。例如:气态(g)、固态(s)、液态(l)、溶液(aq)
ΔH= 57.3 kJ/mol
H2(g)+ O2(g)==H2O(l) △H=-285.8kJ/mol
1
2
H2(g)+ O2(g)==H2O(g) △H=-241.8kJ/mol
1
2
② 注明反应时的温度和压强,因为同一反应在不同温度下进行时,其焓变是不同的。
2、书写热化学方程式的方法
H2(g) + I2 (g) ===== 2HI(g) ΔH= -14.9 kJ/mol
200℃
101kPa
H2(g) + Cl2(g) == 2HCl(g) ΔH= -184.6 kJ/mol
对于25℃,101 kPa 下进行的化学反应,可以不注明。
③ △H 为“+”,表示吸热反应; △H 为“ ”,表示放热反应
④ △H 与化学计量数有关,热化学方程式中各物质的化学计量数仅表示其物质的量,可以是整数,也可以是分数(但一般仍用最简整数比);化学计量数加倍,△H 也要加倍。
2、书写热化学方程式的方法
示例:在25℃,101 kPa下,写出下列反应的热化学方程式:
(2)3 mol NO2(g) 与 1 mol H2O(l) 反应,生成 HNO3(aq)
和 NO(g),放热138 kJ
(1)1 mol HgO(s) 分解为液态汞和氧气,吸热90.7 kJ
△H= +90.7 kJ/mol
ΔH= 138 kJ/mol
ΔH= 285.8 kJ/mol
ΔH= 571.6 kJ/mol
注:热化学方程式中ΔH 的单位“mol-1”是指 “每摩尔反应”。
注意可逆反应的ΔH和实际吸收或放出热量的区别∶不论化学反应是否可逆,热化学方程式中的反应热ΔH都表示反应进行到底时的能量变化。
特别提醒:
⑤ 若正反应为放热反应(△H<0),则逆反应为吸热反应(△H>0)
△H= 41 kJ/mol
△H= +41 kJ/mol
可逆反应的△H是指物质完全反应时的热效应,当反应逆向进行时,其反应热与正反应的数值相等,符号相反。
2、书写热化学方程式的方法
【拓展提升】热化学方程式中的标注问题
2、书写热化学方程式的方法
归纳与整理:
小结:一方程、二状态、三焓变(正负号、数值、单位)
一写 方程式
二标 状态
三判 正负
四算 数值
根据化学计量数计算写出ΔH的值
用s、l、g、aq标明物质的聚集状态状态
写出配平的化学方程式
3、热化学反应方程式的书写步骤及要求
① 根据吸热或者放热判断ΔH的正负
② 吸热反应,ΔH的符号为+;
放热反应,ΔH的符号为-。
沼气的主要成分是甲烷。0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是( )
A. 2CH4( g ) + 4O2( g ) = 2CO2( g ) + 4H2O ( l ) ΔH = + 890 kJ/mol
B. CH4 + 2O2 = CO2 + H2O ΔH = – 890 kJ/mol
1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l ) ΔH = – 890 kJ/mol
C
C. CH4 ( g ) + 2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l ) ΔH = – 890 kJ/mol
无状态
ΔH = – 445 kJ/mol
4、判断热化学方程式正误
一看——各物质的聚集状态是否正确;
二看——ΔH的符号“+”“-”是否与吸热 放热相一致;
三看——反应热的单位是否是kJ·mol-1;
四看——反应热数值与化学计量数是否相对应。
四看”法判断热化学方程式的正误:
【例1】依据事实,写出下列反应的热化学方程式。
0.5mol Cu(s)与适量O2(g)反应生成CuO(s),放出78.65kJ的热量。
【解析】先写出常规化学方程式,然后标注状态及焓变,
根据 0.5 mol Cu 反应的焓变信息计算出 1 mol Cu 对应焓变。
Cu(s)+1/2O2(g)=CuO(s) △H=-157.3kJ/mol
4、判断热化学方程式正误
【例2】 H2(g)+Cl2(g)=2HCl(g) H =-184.6kJ/mol
单位中的mol-1含义?
H单位中的mol-1既不是每摩尔H2或Cl2,也不是每摩尔HCl,而是“每摩尔反应”“:1 mol H2(g)和 1 mol Cl2(g) 反应生成2 mol HCl(g),“每摩尔反应” 放出184.6kJ的热量。
1/2H2(g)+1/2Cl2(g)=HCl(g) H=-92.3kJ/mol
0.5 mol H2 (g)和 0.5 mol Cl2 (g)反应生成1 mol HCl(g)表示“每摩尔反应”,“每摩尔反应”放出92.3kJ的热量
H的单位为KJ/mol,它并不是指每摩尔具体物质反应时伴随的能量变化是多少千焦,而是指给定形式的具体反应以各物质的化学计量数来计量其物质的量时伴随的能量变化是多少千焦。
注意
4、判断热化学方程式正误
典题精练
1.下列热化学方程式中书写正确的是 ( )
2CO2+3H2O ΔH=-1 366.8 kJ/mol
A.C2H5OH+3O2
ΔH=-269.8 kJ/mol
C.S(s)+O2(g) SO2(g)
D.2NO(g)+O2(g) 2NO2(g)
ΔH=-116.2 kJ
B.NaOH(aq)+HCl(aq)
ΔH=+57.3 kJ/mol
NaCl(aq)+H2O(l)
解析: A项,未标明各物质的聚集状态;B项,NaOH与HCl的反应为放热反
应,ΔH<0;D项,ΔH的单位是“kJ/mol”而不是“kJ”。
答案: C
典题精练
2. 肼(N2H4)是一种高效清洁的火箭燃料。8 g N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+H2O(l) ΔH=-267 kJ·mol-1
D.N2H4(g)+O2(g)===N2(g)+H2O(g) ΔH=+267 kJ·mol-1
典题精练
【解析】选A。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时放出133.5 kJ热量,则1 mol N2H4(g)完全燃烧生成氮气和气态水时放出133.5 kJ×4=534 kJ热量,热化学方程式为N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1,A项正确。
总结:用结构图梳理书写热化学方程式的注意事项
热化学
方程式
符号
吸热 +
放热
数值
与化学计量
数相对应
单位
kJ/mol
固体(s)
液体(l)
气体(g)
溶液(aq)
化学计量数
与焓变数值对应
表示物质的量
(整数、分数均可)
条件
压强
温度
状态
由于反应的情况不同,反应热可分为燃烧热、中和热、溶解热等,
其中以燃烧热的实际应用最广泛。
思考 ?
我们知道物质燃烧都会放出热量,那么是不是物质燃烧放出的热量就叫燃烧热呢?
一、燃烧热
如何定量描述?
101 kPa 时,1 mol 纯物质完全燃烧生成指定产物时,所放出的热量,叫做该物质的燃烧热,单位 kJ/mol 或 kJ·mol-1。
例如:25℃,101 kPa,1 mol CH4 完全燃烧,放出 890.31 kJ 的热量,这就是 CH4 的燃烧热。用热化学方程式表示如下:
ΔH= 890.3 kJ/mol
学习任务二 燃烧热 中和热
1. 定义:
可燃物的化学计量数为“1”
例如:25℃,101 kPa,1 mol CH3CH2OH 完全燃烧,放出 1366.8 kJ 的热量,这就是 CH3CH2OH 的燃烧热。用热化学方程式表示如下:
可燃物的化学计量数为“1”
例如:25℃,101 kPa,1 mol 乙炔(C2H2)完全燃烧,放出 1366.8 kJ 的热量,这就是乙炔(C2H2)的燃烧热。用热化学方程式表示如下:
可燃物的化学计量数为“1”
学习任务二 燃烧热 中和热
ΔH= 890.3 kJ/mol
ΔH= 1366.8 kJ/mol
如何定量描述?
学习任务二 燃烧热 中和热
“完全燃烧生成指定产物”是指单质或化合物燃烧后变为最稳定的物质。
完全燃烧时,下列元素要生成对应的物质∶
C→CO2(g),H→H2O(l),S→SO2(g),N→N2(g)等。
C→CO不是完全燃烧;而 S→SO3,SO3不是燃烧产物; 生成的水为液态不能是气态。
2. 注意事项:
ΔH= 890.3 kJ/mol
出890.3 kJ的热量。
它表示25 ℃、101 kPa时, 1 molCH4完全燃烧生成气态CO2和液态H2O时放
3.燃烧热的意义:
甲烷的燃烧热为ΔH=-890.3 kJ·mol。
1. C(s)+ O2(g)=CO(g); △H=-110.5kJ/mol
C(s)+ O2(g)=CO2(g);△H=-393.5kJ/mol
则C的燃烧热为 。
393.5kJ/mol
2. 2H2( g ) + O2 ( g) = 2H2O ( l ) ΔH=-571.6 kJ/mol
H2( g ) +1/2 O2 ( g) = H2O ( g ) ΔH=-241.8 kJ/mol
求氢气的燃烧热。
ΔH= -285.8 kJ/mol
4.对燃烧热的深入理解:
(1)反应条件∶25 ℃和101 kPa(书中给出的燃烧热数值均为此条件下测得)。
(2)物质的燃烧热要求的是纯物质。
(3)文字叙述燃烧热时用正值或ΔH表示,
例如,CH4的燃烧热为890.3 kJ·mol-1或 ΔH=-890.3 kJ·mol-1。
学习任务二 燃烧热 中和热
学习任务二 燃烧热 中和热
燃烧热是以1 mol纯物质完全燃烧所放出的热量来定义的,因此在书写表示燃烧热的热化学方程式时,应以燃烧1 mol物质为标准来配平其余物质的化学计量数,故在表示燃烧热的热化学方程式中常出现分数。
5.表示燃烧热的热化学方程式的书写
学习任务二 燃烧热 中和热
例:C8H18燃烧的热化学方程式为:
2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-11 036 kJ·mol-1,C8H18的燃烧热为5 518 kJ·mol-1,而不是11 036 kJ·mol-1。
C8H18燃烧热的热化学方程式为:
C8H18(l)+O2(g)===8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1。
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H= -2599.2kJ/mol
例:0.3mol的气态高能燃料乙炔(C2H2)在氧气中完全燃烧,生成气态CO2和
液态水,放出389.88kJ热量,其热化学方程式为
【思考】
燃烧放出的热量与燃烧热有什么不同?
表示燃烧热的热化学方程式为
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H= -1299.6kJ/mol
1299.6kJ/mol
其燃烧热为
① 燃烧放出的热量与物质的多少有关,燃烧的物质越多,放出的热量就越多,而燃烧热
规定是1 mol的纯物质;
② 研究燃烧放出的热量并未限定燃烧产物的形态,而研究燃烧热必须是生成稳定的氧化物。
学习任务二 燃烧热 中和热
6.书写或判断表示燃烧热的热化学方程式要做到“四看”
一看 可燃物的化学计量数是否为1。
二看 碳元素完全燃烧生成的氧化物是否为CO2(g)。
三看 氢元素完全燃烧生成的氧化物是否为H2O(l)。
四看 ΔH是否为“—”及单位是否正确。
学习任务二 燃烧热 中和热
典题精练
解析: 表示燃烧热的热化学方程式要求1 mol 纯物质完全燃烧,生成稳定的燃烧产物。符合要求的只有A项。
答案: A
1.下列热化学方程式中能表示可燃物燃烧热的热化学方程式的是 ( )
CO2(g) ΔH=-283.0 kJ/mol
A. CO(g)
2H2O(l) ΔH=-571.6 kJ/mol
C. 2H2(g)+O2(g)
B. CH4(g)+2O2(g)
CO2(g)+2H2O(g) ΔH=-802.3 kJ/mol
D. 2H2(g)+O2(g)
2H2O(g) ΔH=-483.6 kJ/mol
典题精练
2.沼气是一种能源,它的主要成分是CH4,0.5 mol CH4完全燃烧生成CO2(g)和H2O(l)时,放出445 kJ 热量,则下列热化学方程式中正确的是 ( )
解析: 0.5 mol CH4完全燃烧生成CO2(g)和H2O(l)时,放出445 kJ热量,则1 mol CH4完全燃烧生成CO2(g)和H2O(l)时,放出890 kJ热量,根据书写热化学方程式的有关规定,要注明参加反应的物质的聚集状态,标出热效应,故符合题意的是C项。
答案: C
2CO2(g)+4H2O(l) ΔH=+890 kJ/mol
A.2CH4(g)+4O2(g)
B.CH4(g)+2O2(g)
CO2(g)+2H2O( l) ΔH=+890 kJ/mol
C.CH4(g)+2O2(g)
CO2(g)+2H2O(l) ΔH=-890 kJ/mol
D. CH4(g)+O2(g)
CO2(g)+H2O(l) ΔH=-890 kJ/mol
典题精练
解析: 丙烷的分子式是C3H8,1 mol丙烷燃烧会产生4 mol水,则丙烷完全燃烧产生1.8 g H2O(l),消耗丙烷的物质的量n(C3H8)=×n(H2O)=×=×=0.025 mol,所以反应放出的热量Q=2 219.9 kJ/mol×0.025 mol=55.4975 kJ≈55 kJ。
答案: A
3. 已知丙烷的燃烧热ΔH=-2 219.9 kJ/mol,若一定量的丙烷完全燃烧后生成1.8 g H2O(l),则放出的热量约为( )
A.55 kJ B.220 kJ C.550 kJ D.1 108 kJ
要点
酸碱中和反应的热化学方程式≠中和热的热化学方程式。
酸碱中和反应的热化学方程式
——水的系数可以是任意的!
中和热的热化学方程式
——水的系数必须是“1”
在稀溶液中,酸和碱发生中和反应而生成1mol H2O所放出的热量
1、定义:
H+(aq)+OH-(aq)=H2O (1) △H=-57.3kJ/mol
研究条件:稀溶液
反应物:强酸与强碱
生成物及其物质的量:水 1mol
注意:强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1mol H2O放出的热小于57.3KJ;
中和热的表示:
容易混淆问题:
二、中和热
放出的热量:57.3kJ
例:1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应的中和热为 ___________ ;
表示该中和热的热化学方程式为: _____________________________________________________________。
1/2H2SO4(aq) +NaOH(aq)=1/2Na2SO4(aq)+H2O(l) △H= -57.3 kJ/mol
57.3kJ /mol
二、中和热
反应热 中和热 燃烧热
含义 化学反应过程中放出或吸收的热量 在稀溶液中,强酸和强碱发生中和反应而生成1 mol H2O(l)时所放出的热量 在101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时所放出的热量
反应特点 任何反应 中和反应 燃烧反应
物质状态 物质的状态要确定 稀溶液 生成物在常温下为稳定态
方程式配平标准 任意物质的量 以生成1 mol H2O(l)为标准 以燃烧1 mol 可燃物为标准
ΔH符号 放热取负值、吸热取正值 负值 负值
能量数值的描述 必须指出是放热还是吸热或使用正负值或用ΔH表示 直接描述热量的变化时不必再指明是放出的热量,可用ΔH表示
反应热、中和热、燃烧热的异同点
热化学方程式 燃烧热
热化学
方程式
概念
表示
书写
燃烧热
一种特定的反应热
概念
注意问题
课堂小结
