河北省石家庄市2022-2023学年高二上学期期末教学质量检测化学试题(含答案)
文档属性
| 名称 | 河北省石家庄市2022-2023学年高二上学期期末教学质量检测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 16:56:25 | ||
图片预览



文档简介
石家庄市2022-2023学年高二上学期期末教学质量检测
化学
(时间75分钟,满分100分)
注意事项:
1.试卷分Ⅰ卷(选择题)和Ⅱ卷(非选择题)两部分。
2.答题前,考生务必将自己的姓名、准考证号填写在答题卡相应的位置。
3.全部答案在答题卡上完成,答在本试卷上无效。
可能用到的相对原子质量:H 1 O 16 Ca 40
Ⅰ卷(选择题,共45分)
一、单项选择题:本题共15小题,每小题2分,共30分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学在生产和日常生活中有着重要应用。下列说法错误的是( )
A.施肥时,草木灰不能与铵态氮肥混合使用
B.使用含氟牙膏预防龋齿利用了沉淀转化的原理
C.可用明矾对生活用水进行杀菌消毒
D.处理锅炉水垢中的,可先用饱和溶液浸泡,后加盐酸除去
2.下列化学用语正确并能解释相关事实的是( )
A.溴化氢水溶液显酸性:
B.配制溶液时加入盐酸:
C.溶液显碱性:
D.溶液显碱性:
3.下列说法错误的是( )
A.原电池的两极材料可以相同
B.生铁比纯铁容易生锈
C.电解质溶液导电的过程必然伴随化学变化
D.燃料电池将化学能转化为电能的转化率可达100%
4.下列说法正确的是( )
A.激光的产生、LED灯发光都与电子跃迁有关
B.2d能级最多容纳10个电子
C.电子从激发态跃迁到基态时可形成吸收光谱
D.3d原子轨道的能量一定大于4s原子轨道的能量
5.某反应过程的能量变化如图所示,下列说法错误的是( )
A.该反应为放热反应, B.过程b有催化剂参与
C.过程a的活化能大于 D.过程b中第二步反应是决速步骤
6.下列说法错误的是( )
A.f能级有7个原子轨道
B.np能级都有3个相互垂直的原子轨道,且能量相等
C.基态原子的核外电子填充在5个轨道中的元素有2种
D.从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道
7.下列说法正确的是( )
A.升高温度,会使单位体积内分子数增多,从而加快化学反应速率
B.(蓝色)(黄色) ,稀溶液受热颜色变绿
C.达平衡后,加入少量KCl固体,溶液红色变浅
D.(橙色)(黄色),向溶液中滴加几滴浓硫酸,溶液变为黄色
8.下列装置不能达到相应实验目的的是( )
A.用①装置测定中和反应的反应热 B.用②装置测定氢气的生成速率(mL/s)
C.用③装置探究温度对平衡的影响 D.用④装置模拟铅酸蓄电池的充放电过程
9.下列说法正确的是( )
A.已知C(石墨,s)(金刚石,s) ,则金刚石比石墨稳定
B.已知 , ,则
C.氢气的燃烧热为285.8 kJ/mol,则表示氢气燃烧热的热化学方程式为
D.在一定条件下,将和置于密闭容器中充分反应,放出热量79.2 kJ,则该反应的热化学方程式为
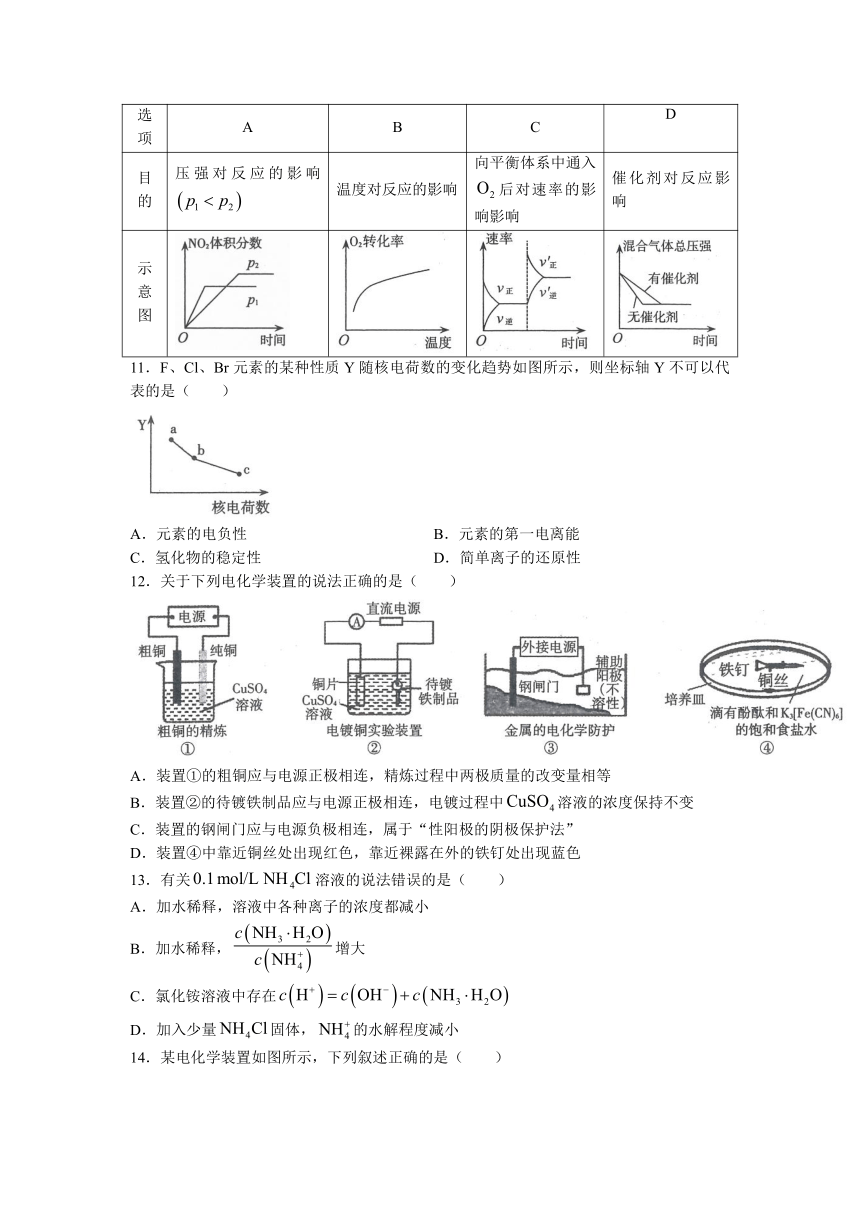
10.在一恒容密闭容器中,发生如下反应 ,下列研究目的和示意图相符的是( )
选项 A B C D
目的 压强对反应的影响 温度对反应的影响 向平衡体系中通入后对速率的影响影响 催化剂对反应影响
示意图
11.F、Cl、Br元素的某种性质Y随核电荷数的变化趋势如图所示,则坐标轴Y不可以代表的是( )
A.元素的电负性 B.元素的第一电离能
C.氢化物的稳定性 D.简单离子的还原性
12.关于下列电化学装置的说法正确的是( )
A.装置①的粗铜应与电源正极相连,精炼过程中两极质量的改变量相等
B.装置②的待镀铁制品应与电源正极相连,电镀过程中溶液的浓度保持不变
C.装置的钢闸门应与电源负极相连,属于“性阳极的阴极保护法”
D.装置④中靠近铜丝处出现红色,靠近裸露在外的铁钉处出现蓝色
13.有关溶液的说法错误的是( )
A.加水稀释,溶液中各种离子的浓度都减小
B.加水稀释,增大
C.氯化铵溶液中存在
D.加入少量固体,的水解程度减小
14.某电化学装置如图所示,下列叙述正确的是( )
A.由锌电极附近通过隔膜向铜电极附近移动
B.电子移动方向
C.Y与滤纸接触处变红
D.X极的电极反应式为
15.T℃时,在一个2 L的密闭容器中,加入和进行如下反应:
,反应一段时间后达到平衡,测得生成。下列说法正确的是( )
A.该反应的化学平衡常数表达式为
B.N的平衡转化率为40%
C.升高温度,减小,增大
D.增加N的量,平衡向右移动,N的平衡转化率增大
二、不定项选择题:本题共5小题,每小题3分,共15分。在每小题给出的四个选项中,有一项或两项符合题目要求。若正确答案只包括一个选项,多选时,该小题得0分:若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得3分,但只要选错一个,该小题得0分。
16.在两个密闭的维形瓶中,0.05 g形状相同的镁条(过量)分别与2 mL 2 mol/L的盐酸和醋酸溶液反应,测得容器内压强随时间的变化曲线如图所示。下列说法正确的是( )
A.①代表的是盐酸与镁条反应时容器内压强随时间的变化曲线
B.两种溶液最终产生的氢气总量基本相等
C.在100~150s时间段内,醋酸与Mg反应的速率更快
D.用1 mol/L NaOH溶液完全中和上述两种酸溶液,盐酸消耗NaOH溶液的体积更多
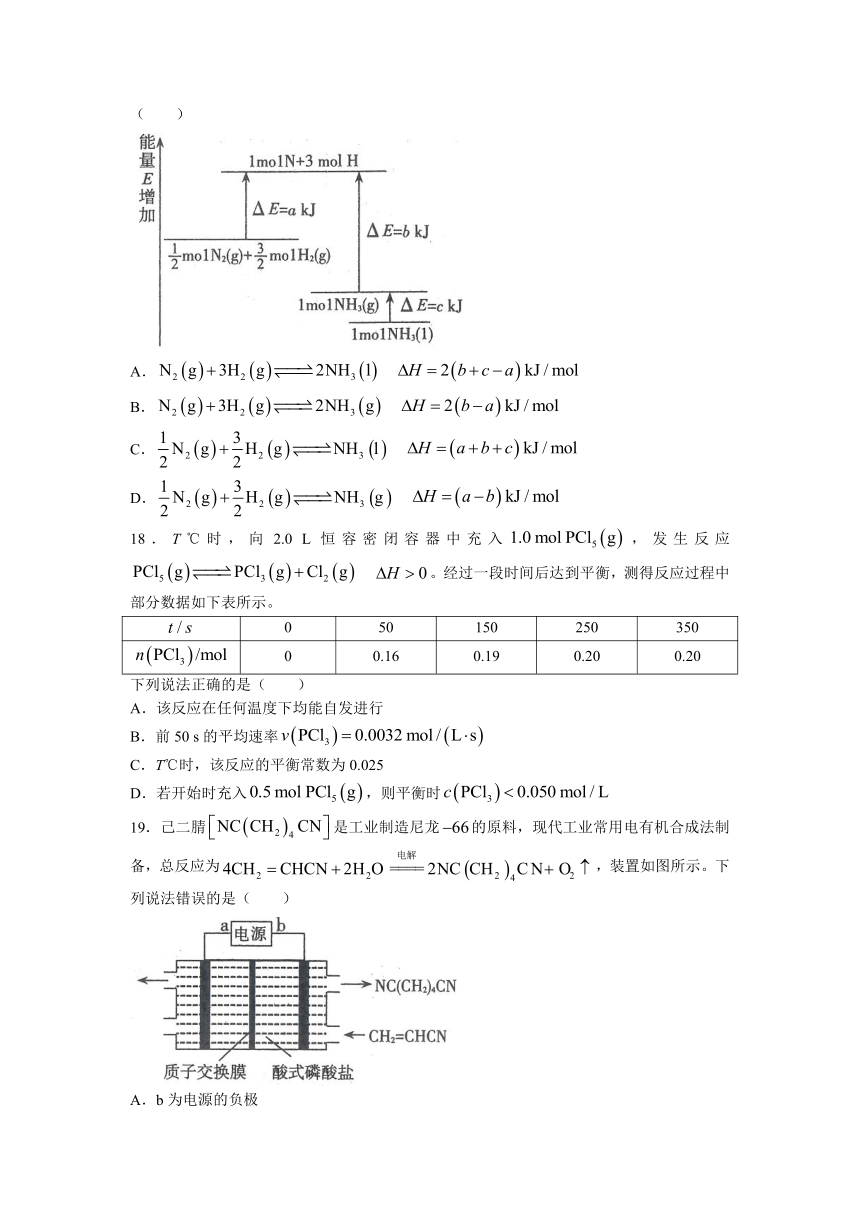
17.化学反应的能量变化如图所示,下列热化学方程式正确的为( )
A.
B.
C.
D.
18.T℃时,向2.0 L恒容密闭容器中充入,发生反应 。经过一段时间后达到平衡,测得反应过程中部分数据如下表所示。
0 50 150 250 350
0 0.16 0.19 0.20 0.20
下列说法正确的是( )
A.该反应在任何温度下均能自发进行
B.前50 s的平均速率
C.T℃时,该反应的平衡常数为0.025
D.若开始时充入,则平衡时
19.己二腈是工业制造尼龙的原料,现代工业常用电有机合成法制备,总反应为,装置如图所示。下列说法错误的是( )
A.b为电源的负极
B.阳极的电极反应为
C.当电路中转移时,阳极室溶液质量减少16 g
D.阴极的电极反应为:
20.常温下,向,溶液中滴加溶液,滴加过程中与溶液体积的关系如图所示。下列说法正确的是( )
A.的数量级为
B.溶液中:
C.溶液中:
D.a、b、c三点中,由水电离出的最小的为b点
Ⅱ卷(非选择题,共55分)
三、填空题:本题包括4小题,共55分。
21.(15分)W、X、Y、Z、M、Q是原子序数依次增大的前四周期元素,其元素性质或原子结构如下表所示。
元素 元素性质或原子结构
W 电子只有一种自旋取向
X 最外层电子排布式为
Y 非金属元素,且s能级上的电子总数与p能级上的电子总数相等
Z 电离能……578181727451157514830……
M 前四周期元素中原子核外未成对电子数最多
Q 与X同主族
(1)W、Z、Q的元素符号分别为__________、__________、__________。
(2)X的基态原子有__________种空间运动状态不同的电子,其中能量最高的电子所占据的原子轨道呈__________形。
(③)与Y处于同一周期的所有元素中,第一电离能比Y大的元素有__________种。
(4)M位于元素周期表的__________区,简化的电子排布式为____________________。
(4)Q位于元素周期表的第__________周期__________族,其价层电子排布图为____________________。
(6)W、X、Y、Z的电负性由大到小的顺序为____________________(填元素符号)。
22.(12分)氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
已知:①乙醇水蒸气重整制氢的部分反应过程如图1所示。
②反应Ⅰ和反应Ⅱ的平衡常数(K)随温度(T)的变化曲线如图2所示。
(1)反应Ⅰ中,参与反应后的热量变化是256 kJ,则该反应的热化学方程式为________________________________________。
(2)一定温度下,在一恒容密闭容器中发生反应Ⅰ,下列叙述能说明此反应达到化学平衡状态的是__________(填选项字母)。
a. b.
c.不再发生变化 d.混合气体密度不再发生变化
(3)在一恒容密闭容器中按不同进料比通入与发生反应Ⅱ,在不同温度时测得CO的平衡转化率如图3所示。
①B、C两点对应的反应温度分别为和,则__________(填“<”“=”或“>”)。
②A点对应温度下,反应Ⅱ的化学平衡常数__________。
③若向A点对应的平衡体系中再充入、、和,此时平衡向__________(填“正反应”或“逆反应”)方向移动。
④实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大的体积分数,其原因为____________________。
23.(14分)滴定法是化学分析的常用方法,某兴趣小组利用滴定法进行如下实验。
实验Ⅰ.测定NaOH溶液的浓度
操作步骤如下:
i.用0.1000 mol/L盐酸溶液润洗滴定管2~3次。
ii.向滴定管中注入盐酸溶液至“0”刻度以上2~3cm。
ii.固定好滴定管,排气泡,并调节液面至“0”或“0”刻度以下,准确记录读数。
iv.向锥形瓶里注入25.00 mL待测NaOH溶液,并加入2~3滴酚酞溶液。
v.用标准盐酸溶液滴定至终点,并记下滴定管液面的读数。
vi.……
实验数据记录如下。
滴定序号 待测液体积(mL) 所消耗盐酸标准液的体积(mL)
滴定前 滴定后
1 25.00 0.50 20.60
2 25.00 1.10 21.00
3 25.00 2.20 22.20
(1)步骤vi的操作为_____________________________________________________。
(2)步骤v中操作滴定管的图示如下,正确的是________(填选项字母)。
(3)根据实验数据计算,__________mol/L。
(4)下列情况会使所测NaOH溶液浓度偏低的是__________(填选项字母)。
a.锥形瓶事先用待测NaOH溶液润洗 b.滴定前有气泡,滴定过程中气泡消失
c.未用标准盐酸溶液润洗滴定管 d.滴定结束后,读取溶液体积时,俯视刻度线
实验Ⅱ.测定血液中钙的含量操作步骤如下:
i.将2.00 mL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体,反应生成沉淀,过滤后,将沉淀用足量稀硫酸处理得溶液。
ii.将i中得到的溶液装入锥形瓶内,再用酸性溶液滴定,所用酸性溶液的体积为20.00 mL(平均值)。
(5)滴定过程中盛装酸性溶液的仪器名称为______________。
(6)滴定过程中发生反应的离子方程式为____________________________。
(7)滴定终点时的现象为________________________________________________________。
(8)该血液中钙的含量为______________mg/mL。
24.(14分)规范、科学处置废旧锂离子电池具有重要的环保意义和经济价值。废旧锂离子电池的正极材料主要含有及少量Al、Fe等,处理该废料的一种工艺流程如图所示。
已知:①难溶于水。
②相关金属离子形成氢氧化物沉淀的pH如下表所示。
开始沉淀的pH 2.7 7.6 7.0
沉淀完全的pH 3.7 9.6 9.0
③的溶解度(S)随温度(T)的变化曲线如下图所示。
(1)“放电处理”有助于锂元素在正极的回收,电池放电时的总反应为,则此时正极的电极反应式为__________。
(2)“碱溶”所得滤液中大量存在的阴离子为和__________。
(3)为提高“酸溶”的速率,可采取的措施有__________(任写一条)。
(4)“酸溶”过程中所用的量远高于理论用量,原因为____________________;若用浓盐酸代替和的混合液,产生的问题是______________________________。
(5)“调pH”时,用氨水调节pH的范围为__________。
(6)“沉钴”过程中发生反应的化学方程式为______________________________。
(7)“沉锂”后,洗涤所得沉淀要使用__________(填“热水”或“冷水”),理由为____________________
________________________________________。
高二化学参考答案
1~5:CBDAD 6~10:CBABC 11~15:DDACB
16~20:BC D C C AD
21.(15分)除标注外,每空1分。
(1)H Al As
(2)5 哑铃
(3)3
(4)d (2分)
(5)四(或4) VA (2分)
(6)(2分)
22.(12分)
(1) (2分)
(2)c(2分)
(3)①<(2分)
②1(2分)
③正反应(2分)
④和CaO反应,促使反应Ⅱ向正反应方向移动,的体积分数增大(2分)
23.(14分)
(1)重复操作2~3次(2分)
(2)b(1分)
(3)0.0800或0.08(2分)
(4)d(2分)
(5)酸式滴定管(1分)
(6)(2分)
(7)溶液由无色变为粉红色,且半分钟内不变色(2分)
(8)0.10或0.1(2分)
24.(14分)
(1)(2分)
(2)(1分)
(3)搅拌、适当升温、适当增大硫酸或双氧水的浓度(任写一种)(1分)
(4)溶液中的能催化分解或受热分解(2分,写出1条即可得分)
被氧化为,污染空气(2分)
(5)(1分)
(6)(2分)
(7)热水(1分)、在较高温度下溶解度小,用热水洗涤可减少的损耗(2分)
化学
(时间75分钟,满分100分)
注意事项:
1.试卷分Ⅰ卷(选择题)和Ⅱ卷(非选择题)两部分。
2.答题前,考生务必将自己的姓名、准考证号填写在答题卡相应的位置。
3.全部答案在答题卡上完成,答在本试卷上无效。
可能用到的相对原子质量:H 1 O 16 Ca 40
Ⅰ卷(选择题,共45分)
一、单项选择题:本题共15小题,每小题2分,共30分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学在生产和日常生活中有着重要应用。下列说法错误的是( )
A.施肥时,草木灰不能与铵态氮肥混合使用
B.使用含氟牙膏预防龋齿利用了沉淀转化的原理
C.可用明矾对生活用水进行杀菌消毒
D.处理锅炉水垢中的,可先用饱和溶液浸泡,后加盐酸除去
2.下列化学用语正确并能解释相关事实的是( )
A.溴化氢水溶液显酸性:
B.配制溶液时加入盐酸:
C.溶液显碱性:
D.溶液显碱性:
3.下列说法错误的是( )
A.原电池的两极材料可以相同
B.生铁比纯铁容易生锈
C.电解质溶液导电的过程必然伴随化学变化
D.燃料电池将化学能转化为电能的转化率可达100%
4.下列说法正确的是( )
A.激光的产生、LED灯发光都与电子跃迁有关
B.2d能级最多容纳10个电子
C.电子从激发态跃迁到基态时可形成吸收光谱
D.3d原子轨道的能量一定大于4s原子轨道的能量
5.某反应过程的能量变化如图所示,下列说法错误的是( )
A.该反应为放热反应, B.过程b有催化剂参与
C.过程a的活化能大于 D.过程b中第二步反应是决速步骤
6.下列说法错误的是( )
A.f能级有7个原子轨道
B.np能级都有3个相互垂直的原子轨道,且能量相等
C.基态原子的核外电子填充在5个轨道中的元素有2种
D.从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道
7.下列说法正确的是( )
A.升高温度,会使单位体积内分子数增多,从而加快化学反应速率
B.(蓝色)(黄色) ,稀溶液受热颜色变绿
C.达平衡后,加入少量KCl固体,溶液红色变浅
D.(橙色)(黄色),向溶液中滴加几滴浓硫酸,溶液变为黄色
8.下列装置不能达到相应实验目的的是( )
A.用①装置测定中和反应的反应热 B.用②装置测定氢气的生成速率(mL/s)
C.用③装置探究温度对平衡的影响 D.用④装置模拟铅酸蓄电池的充放电过程
9.下列说法正确的是( )
A.已知C(石墨,s)(金刚石,s) ,则金刚石比石墨稳定
B.已知 , ,则
C.氢气的燃烧热为285.8 kJ/mol,则表示氢气燃烧热的热化学方程式为
D.在一定条件下,将和置于密闭容器中充分反应,放出热量79.2 kJ,则该反应的热化学方程式为
10.在一恒容密闭容器中,发生如下反应 ,下列研究目的和示意图相符的是( )
选项 A B C D
目的 压强对反应的影响 温度对反应的影响 向平衡体系中通入后对速率的影响影响 催化剂对反应影响
示意图
11.F、Cl、Br元素的某种性质Y随核电荷数的变化趋势如图所示,则坐标轴Y不可以代表的是( )
A.元素的电负性 B.元素的第一电离能
C.氢化物的稳定性 D.简单离子的还原性
12.关于下列电化学装置的说法正确的是( )
A.装置①的粗铜应与电源正极相连,精炼过程中两极质量的改变量相等
B.装置②的待镀铁制品应与电源正极相连,电镀过程中溶液的浓度保持不变
C.装置的钢闸门应与电源负极相连,属于“性阳极的阴极保护法”
D.装置④中靠近铜丝处出现红色,靠近裸露在外的铁钉处出现蓝色
13.有关溶液的说法错误的是( )
A.加水稀释,溶液中各种离子的浓度都减小
B.加水稀释,增大
C.氯化铵溶液中存在
D.加入少量固体,的水解程度减小
14.某电化学装置如图所示,下列叙述正确的是( )
A.由锌电极附近通过隔膜向铜电极附近移动
B.电子移动方向
C.Y与滤纸接触处变红
D.X极的电极反应式为
15.T℃时,在一个2 L的密闭容器中,加入和进行如下反应:
,反应一段时间后达到平衡,测得生成。下列说法正确的是( )
A.该反应的化学平衡常数表达式为
B.N的平衡转化率为40%
C.升高温度,减小,增大
D.增加N的量,平衡向右移动,N的平衡转化率增大
二、不定项选择题:本题共5小题,每小题3分,共15分。在每小题给出的四个选项中,有一项或两项符合题目要求。若正确答案只包括一个选项,多选时,该小题得0分:若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得3分,但只要选错一个,该小题得0分。
16.在两个密闭的维形瓶中,0.05 g形状相同的镁条(过量)分别与2 mL 2 mol/L的盐酸和醋酸溶液反应,测得容器内压强随时间的变化曲线如图所示。下列说法正确的是( )
A.①代表的是盐酸与镁条反应时容器内压强随时间的变化曲线
B.两种溶液最终产生的氢气总量基本相等
C.在100~150s时间段内,醋酸与Mg反应的速率更快
D.用1 mol/L NaOH溶液完全中和上述两种酸溶液,盐酸消耗NaOH溶液的体积更多
17.化学反应的能量变化如图所示,下列热化学方程式正确的为( )
A.
B.
C.
D.
18.T℃时,向2.0 L恒容密闭容器中充入,发生反应 。经过一段时间后达到平衡,测得反应过程中部分数据如下表所示。
0 50 150 250 350
0 0.16 0.19 0.20 0.20
下列说法正确的是( )
A.该反应在任何温度下均能自发进行
B.前50 s的平均速率
C.T℃时,该反应的平衡常数为0.025
D.若开始时充入,则平衡时
19.己二腈是工业制造尼龙的原料,现代工业常用电有机合成法制备,总反应为,装置如图所示。下列说法错误的是( )
A.b为电源的负极
B.阳极的电极反应为
C.当电路中转移时,阳极室溶液质量减少16 g
D.阴极的电极反应为:
20.常温下,向,溶液中滴加溶液,滴加过程中与溶液体积的关系如图所示。下列说法正确的是( )
A.的数量级为
B.溶液中:
C.溶液中:
D.a、b、c三点中,由水电离出的最小的为b点
Ⅱ卷(非选择题,共55分)
三、填空题:本题包括4小题,共55分。
21.(15分)W、X、Y、Z、M、Q是原子序数依次增大的前四周期元素,其元素性质或原子结构如下表所示。
元素 元素性质或原子结构
W 电子只有一种自旋取向
X 最外层电子排布式为
Y 非金属元素,且s能级上的电子总数与p能级上的电子总数相等
Z 电离能……578181727451157514830……
M 前四周期元素中原子核外未成对电子数最多
Q 与X同主族
(1)W、Z、Q的元素符号分别为__________、__________、__________。
(2)X的基态原子有__________种空间运动状态不同的电子,其中能量最高的电子所占据的原子轨道呈__________形。
(③)与Y处于同一周期的所有元素中,第一电离能比Y大的元素有__________种。
(4)M位于元素周期表的__________区,简化的电子排布式为____________________。
(4)Q位于元素周期表的第__________周期__________族,其价层电子排布图为____________________。
(6)W、X、Y、Z的电负性由大到小的顺序为____________________(填元素符号)。
22.(12分)氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
已知:①乙醇水蒸气重整制氢的部分反应过程如图1所示。
②反应Ⅰ和反应Ⅱ的平衡常数(K)随温度(T)的变化曲线如图2所示。
(1)反应Ⅰ中,参与反应后的热量变化是256 kJ,则该反应的热化学方程式为________________________________________。
(2)一定温度下,在一恒容密闭容器中发生反应Ⅰ,下列叙述能说明此反应达到化学平衡状态的是__________(填选项字母)。
a. b.
c.不再发生变化 d.混合气体密度不再发生变化
(3)在一恒容密闭容器中按不同进料比通入与发生反应Ⅱ,在不同温度时测得CO的平衡转化率如图3所示。
①B、C两点对应的反应温度分别为和,则__________(填“<”“=”或“>”)。
②A点对应温度下,反应Ⅱ的化学平衡常数__________。
③若向A点对应的平衡体系中再充入、、和,此时平衡向__________(填“正反应”或“逆反应”)方向移动。
④实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大的体积分数,其原因为____________________。
23.(14分)滴定法是化学分析的常用方法,某兴趣小组利用滴定法进行如下实验。
实验Ⅰ.测定NaOH溶液的浓度
操作步骤如下:
i.用0.1000 mol/L盐酸溶液润洗滴定管2~3次。
ii.向滴定管中注入盐酸溶液至“0”刻度以上2~3cm。
ii.固定好滴定管,排气泡,并调节液面至“0”或“0”刻度以下,准确记录读数。
iv.向锥形瓶里注入25.00 mL待测NaOH溶液,并加入2~3滴酚酞溶液。
v.用标准盐酸溶液滴定至终点,并记下滴定管液面的读数。
vi.……
实验数据记录如下。
滴定序号 待测液体积(mL) 所消耗盐酸标准液的体积(mL)
滴定前 滴定后
1 25.00 0.50 20.60
2 25.00 1.10 21.00
3 25.00 2.20 22.20
(1)步骤vi的操作为_____________________________________________________。
(2)步骤v中操作滴定管的图示如下,正确的是________(填选项字母)。
(3)根据实验数据计算,__________mol/L。
(4)下列情况会使所测NaOH溶液浓度偏低的是__________(填选项字母)。
a.锥形瓶事先用待测NaOH溶液润洗 b.滴定前有气泡,滴定过程中气泡消失
c.未用标准盐酸溶液润洗滴定管 d.滴定结束后,读取溶液体积时,俯视刻度线
实验Ⅱ.测定血液中钙的含量操作步骤如下:
i.将2.00 mL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体,反应生成沉淀,过滤后,将沉淀用足量稀硫酸处理得溶液。
ii.将i中得到的溶液装入锥形瓶内,再用酸性溶液滴定,所用酸性溶液的体积为20.00 mL(平均值)。
(5)滴定过程中盛装酸性溶液的仪器名称为______________。
(6)滴定过程中发生反应的离子方程式为____________________________。
(7)滴定终点时的现象为________________________________________________________。
(8)该血液中钙的含量为______________mg/mL。
24.(14分)规范、科学处置废旧锂离子电池具有重要的环保意义和经济价值。废旧锂离子电池的正极材料主要含有及少量Al、Fe等,处理该废料的一种工艺流程如图所示。
已知:①难溶于水。
②相关金属离子形成氢氧化物沉淀的pH如下表所示。
开始沉淀的pH 2.7 7.6 7.0
沉淀完全的pH 3.7 9.6 9.0
③的溶解度(S)随温度(T)的变化曲线如下图所示。
(1)“放电处理”有助于锂元素在正极的回收,电池放电时的总反应为,则此时正极的电极反应式为__________。
(2)“碱溶”所得滤液中大量存在的阴离子为和__________。
(3)为提高“酸溶”的速率,可采取的措施有__________(任写一条)。
(4)“酸溶”过程中所用的量远高于理论用量,原因为____________________;若用浓盐酸代替和的混合液,产生的问题是______________________________。
(5)“调pH”时,用氨水调节pH的范围为__________。
(6)“沉钴”过程中发生反应的化学方程式为______________________________。
(7)“沉锂”后,洗涤所得沉淀要使用__________(填“热水”或“冷水”),理由为____________________
________________________________________。
高二化学参考答案
1~5:CBDAD 6~10:CBABC 11~15:DDACB
16~20:BC D C C AD
21.(15分)除标注外,每空1分。
(1)H Al As
(2)5 哑铃
(3)3
(4)d (2分)
(5)四(或4) VA (2分)
(6)(2分)
22.(12分)
(1) (2分)
(2)c(2分)
(3)①<(2分)
②1(2分)
③正反应(2分)
④和CaO反应,促使反应Ⅱ向正反应方向移动,的体积分数增大(2分)
23.(14分)
(1)重复操作2~3次(2分)
(2)b(1分)
(3)0.0800或0.08(2分)
(4)d(2分)
(5)酸式滴定管(1分)
(6)(2分)
(7)溶液由无色变为粉红色,且半分钟内不变色(2分)
(8)0.10或0.1(2分)
24.(14分)
(1)(2分)
(2)(1分)
(3)搅拌、适当升温、适当增大硫酸或双氧水的浓度(任写一种)(1分)
(4)溶液中的能催化分解或受热分解(2分,写出1条即可得分)
被氧化为,污染空气(2分)
(5)(1分)
(6)(2分)
(7)热水(1分)、在较高温度下溶解度小,用热水洗涤可减少的损耗(2分)
同课章节目录
