第五章第一节第1课时《硫和二氧化硫》课件(共30张PPT)(人教版必修第二册)
文档属性
| 名称 | 第五章第一节第1课时《硫和二氧化硫》课件(共30张PPT)(人教版必修第二册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 18.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-22 17:03:56 | ||
图片预览









文档简介
(共30张PPT)
人教版必修(第二册)
第五章 化学生产中的重要非金属元素
第一节 硫及其化合物
第1课时——硫和二氧化硫
自然界的硫单质
火山口附近的硫
印尼东爪哇外南梦,卡瓦伊真火山喷出的气体通过火山口内的喷气孔形成硫磺,当地很多青壮年男子冒险去火山口采硫磺矿谋生。这些硫矿被运到当地工厂加工,在硫化橡胶、漂白糖等工业步骤中使用。
一、硫的物理性质
物理性质:硫(俗称硫黄),黄色晶体,质脆,易研成粉末,难溶于水,微溶于酒精,易溶于二硫化碳。
问题1:试管内壁附着的硫怎样洗掉?
【提示】试管内壁附着的硫可用二硫化碳洗掉。
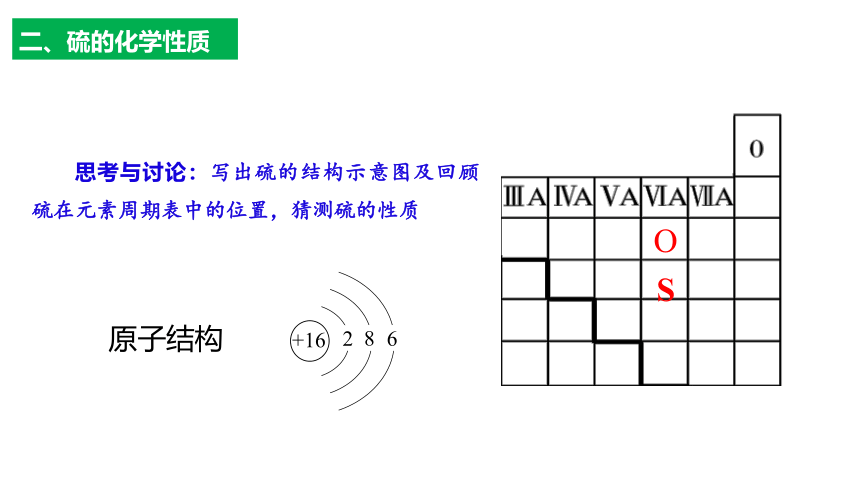
思考与讨论:写出硫的结构示意图及回顾硫在元素周期表中的位置,猜测硫的性质
原子结构
+16
2
8
6
O
S
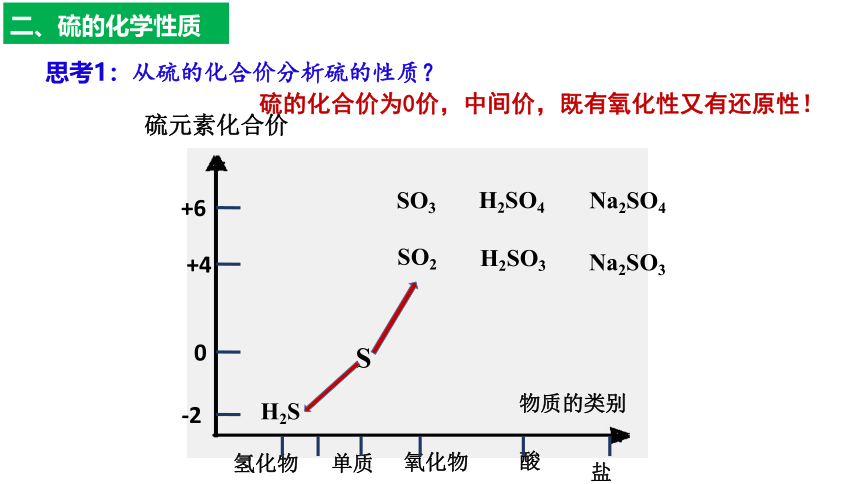
二、硫的化学性质
+6
+4
0
-2
硫元素化合价
物质的类别
氢化物
单质
氧化物
酸
盐
H2S
S
SO2
SO3
H2SO3
H2SO4
Na2SO4
Na2SO3
思考1:从硫的化合价分析硫的性质?
硫的化合价为0价,中间价,既有氧化性又有还原性!
二、硫的化学性质
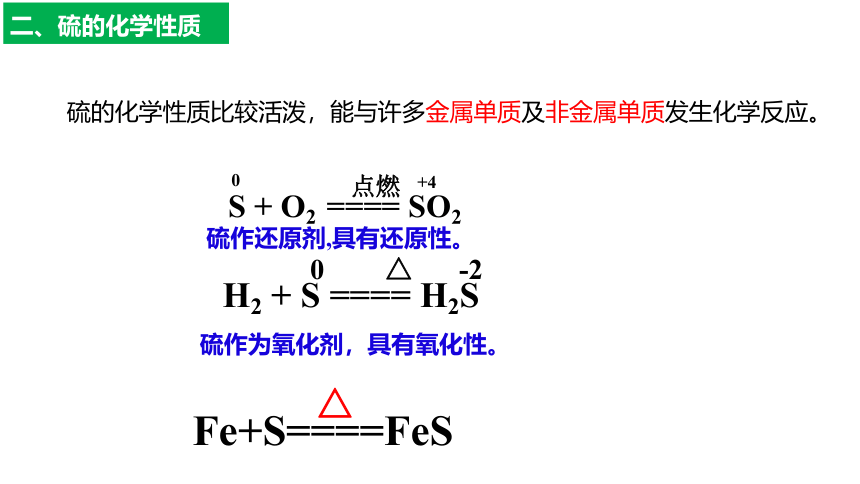
二、硫的化学性质
硫作还原剂,具有还原性。
H2 + S ==== H2S
△
0
-2
S + O2 ==== SO2
点燃
0
+4
硫作为氧化剂,具有氧化性。
硫的化学性质比较活泼,能与许多金属单质及非金属单质发生化学反应。
Fe+S====FeS
△
二、硫的化学性质
1. 为什么硫与铁、铜反应生成的化合物中硫化合价为-2价,而与氧气反应生成二氧化硫中硫的化合价为+2价?
硫原子最外层电子有6个,在化学反应中容易得到2个电子,形成-2价硫的化合物。而与同族氧元素比较,硫元素多了一个电子层,得电子能力相对较弱,而失电子能力相对较强。
2.能不能根据Fe、Cu与S、Cl2反应的产物判断S和Cl2的氧化性的强弱
可以。Fe、Cu与S反应生成低价的化合物,Fe、Cu与Cl2反应生成高价的化合物,故Cl2的氧化性大于S。
深度思考
(1)硫元素在自然界中只存在化合态,没有游离态( )
(2)高价态的含硫物质要实现向低价态含硫物质转化,一定发生还原反应( )
(3)要洗涤试管壁上附着的硫单质,不能用水洗,可以用酒精洗涤( )
(4)硫和铁、铜在加热条件下生成Fe2S3和CuS( )
(5)单质硫在纯氧中燃烧,其氧化产物为SO3( )
(6)硫是一种非金属单质,与其他单质反应,只能作氧化剂( )
判断正误
×
√
×
×
×
×
1.实验室洗涤试管壁上附着的硫单质,常用两种方法。
(1)物理方法:用CS2洗涤,利用单质硫的性质为____________。
(2)化学方法:用热的NaOH溶液洗涤,该反应原理为 3S+6NaOH
2Na2S+Na2SO3+3H2O,在该反应中,硫单质表现____性和_____性,氧化剂和还原剂的物质的量之比为______,写出上述反应的离子方程式:________________________________。
(3)向上述反应的溶液中再加入适量的稀H2SO4,会产生淡黄色沉淀,写出该反应的离子方程式:______________________________。
易溶于CS2
氧化
还原
2∶1
应用体验
2.(2020.衡水中学校月考)下列化合物能用相应的单质直接化合制得的是_______________ (填序号)。
①CuS ②FeS ③HCl ④SO2 ⑤SO3 ⑥FeCl2 ⑦CuCl2 ⑧Cu2S ⑨HgS ⑩Ag2S
②③④⑦⑧⑨⑩
无色
气态
刺激性
气味
密度大于空气
有毒
颜色
状态
气味
密度
毒性
溶解性
思考与讨论:SO2的物理性质体现在哪些方面?
三、二氧化硫的性质
探究结论1:SO2易溶于水
实验探究一:将集满SO2的试管倒扣在水中,振荡,观察现象并分析。
探究现象:试管内液面上升
三、二氧化硫的性质
实验内容
实验现象
结论或方程式
石蕊和SO2
石灰水和SO2
石蕊试纸变红
有酸生成
H2O +SO2 H2SO3
溶液变浑浊
Ca(OH)2+SO2 = CaSO3 ↓+ H2O
探究结论2:SO2具有酸性氧化物的通性
实验探究二:
1.在二氧化硫水溶液中滴入紫色石蕊试液,观察颜色变化
2.在澄清石灰水中滴加少量SO2水溶液,观察现象。
三、二氧化硫的性质
实验探究三:向盛有品红溶液的试管中通入SO2气体(二氧化硫溶液)。观察溶液的颜色变化,再加热观察颜色变化。
三、二氧化硫的性质
实验内容
实验现象
结论或方程式
品红溶液褪色
SO2具有漂白性
品红溶液和SO2
实验探究三:向盛有品红溶液的试管中通入SO2气体(二氧化硫溶液)。观察溶液的颜色变化,再加热观察颜色变化。
探究结论3:SO2具有漂白性
三、二氧化硫的性质
市场黄白两种银耳对比
学以致用
不可使用于食品漂白,但可用于日用品的漂白
竹筷子的漂白
草帽的漂白
三、二氧化硫的性质
不可使用于食品漂白,但可用于日用品的漂白
竹筷子的漂白
草帽的漂白
三、二氧化硫的性质
现象:KMnO4溶液的红色褪色
分析原因:SO2 + KMnO4 + H2O -- K2SO4 + MnSO4 + H2SO4
请配平方程式
实验探究四:取酸性KMnO4溶液5~8滴,滴入几滴SO2的水溶液,观察现象。
探究结论4:SO2具有还原性
三、二氧化硫的性质
SO2+Br2+ 2H2O=H2SO+ HBr
+4
+6
0
-1
2SO2+O2 2SO3
催化剂
△
小结:SO2具有较强的还原性,可以被O2、Cl2、Br2、酸性KMnO4、H2O2等氧化
思考与讨论:SO2能使酸性KMnO4褪色,实验表明SO2也能使溴水褪色体现SO2哪方面性质?
三、二氧化硫的性质
现象:溶液变浑浊
分析原因:SO2 + H2S -- S ↓ + H2O
实验探究五:在饱和Na2S溶液中加入适量SO2的水溶液(同时滴入几滴稀硫酸),观察现象。
请配平方程式
探究结论5:SO2具有氧化性
三、二氧化硫的性质
1.若将SO2、Cl2分别通入紫色石蕊溶液中,会观察到什么现象 原理是什么?
现象:SO2使紫色石蕊溶液变红色;Cl2使紫色石蕊溶液先变红色后褪色
分析原因:SO2属于酸性氧化物与水反应生成亚硫酸,亚硫酸会使紫色石蕊溶液变红色;Cl2会与水反应生成 HCl、HClO,HCl会使紫色石蕊溶液变红色,HClO具有强氧化性,又会使红色石蕊溶液褪色。
深度思考
2. SO2有漂白性,氯水有漂白性,如果将二者等物质的量混合,漂白性是不是更强?
不是。原理:SO2 + Cl2 + 2H2O== 2HCl + H2 SO4。而HCl 和H2 SO4是没有漂白性的,因此漂白性可能消失
3. SO2可以使高锰酸钾褪色和SO2使品红褪色原理一样吗?
前者是表现还原性,后者是表现漂白性。
深度思考
判断正误
(1)SO2的水溶液中存在SO2、H2SO3的原因是SO2与H2O的反应为可逆反应( )
(2)SO2可使溴水褪色,是因为SO2有漂白性( )
(3)SO2中硫的化合价为+4价,是硫元素的中间价,所以SO2既有氧化性又有还原性( )
(4)SO2气体通入BaCl2溶液产生白色沉淀BaSO3( )
(5)某气体通入品红溶液后,品红溶液褪色,则该气体一定是SO2( )
(6)SO2通入紫色石蕊溶液中先变红色后褪色( )
×
√
×
×
√
×
1.将SO2分别通入下列五种溶液中:
深度思考
回答下列问题:
(1)试管①中的实验现象:KMnO4溶液____,证明SO2具有____性。
(2)试管②中的实验现象:溶液____,证明SO2具有____性。
(3)试管③中的实验现象:溶液____,证明SO2能中和NaOH,写出该反应的离子方程式:____________________________________________。
褪色
还原
褪色
漂白
褪色
(4)试管④中能产生____沉淀,该沉淀是______。
(5)试管⑤中能产生白色沉淀,该沉淀是______。
白色
BaSO3
BaSO4
4.(2020·陕西黄陵中学期中)下列变化可以说明SO2具有漂白性的是
A.SO2通入溴水中,溴水褪色
B.SO2通入酸性高锰酸钾溶液中,溶液的紫红色褪去
C.SO2通入品红溶液中,溶液的红色褪去
D.SO2通入滴有酚酞的氢氧化钠溶液中,溶液的红色褪去
√
1
2
3
5
4
二氧化硫
分类观
(酸性氧化物
与CO2类似)
价态观
(还原性和
弱氧化性)
特性——漂白性:使品红溶液褪色
SO2+H2O H2SO3
SO2+NaOH === Na2SO3+H2O
SO2+Ca(OH)2 === CaSO3+H2O
2SO2+Ca(OH)2 === Ca(HSO3)2
2SO2+O2 2SO3
2H2SO3+O2 === 2H2SO4
SO2+Br2+2H2O === H2SO4+2HBr
H2O2+SO2 === H2SO4
2H2S+SO2 === 3S↓+2H2O
催化剂
△
知识小结
SO2
现象?原因?
已知C +H2SO4(浓) ---CO2 ↑ + SO2 ↑ +H2O ↑
如果用图中的装置检验三种产物,写出下面标号所表示的仪器中应加 入的试剂的名称及其作用
人教版必修(第二册)
第五章 化学生产中的重要非金属元素
第一节 硫及其化合物
第1课时——硫和二氧化硫
自然界的硫单质
火山口附近的硫
印尼东爪哇外南梦,卡瓦伊真火山喷出的气体通过火山口内的喷气孔形成硫磺,当地很多青壮年男子冒险去火山口采硫磺矿谋生。这些硫矿被运到当地工厂加工,在硫化橡胶、漂白糖等工业步骤中使用。
一、硫的物理性质
物理性质:硫(俗称硫黄),黄色晶体,质脆,易研成粉末,难溶于水,微溶于酒精,易溶于二硫化碳。
问题1:试管内壁附着的硫怎样洗掉?
【提示】试管内壁附着的硫可用二硫化碳洗掉。
思考与讨论:写出硫的结构示意图及回顾硫在元素周期表中的位置,猜测硫的性质
原子结构
+16
2
8
6
O
S
二、硫的化学性质
+6
+4
0
-2
硫元素化合价
物质的类别
氢化物
单质
氧化物
酸
盐
H2S
S
SO2
SO3
H2SO3
H2SO4
Na2SO4
Na2SO3
思考1:从硫的化合价分析硫的性质?
硫的化合价为0价,中间价,既有氧化性又有还原性!
二、硫的化学性质
二、硫的化学性质
硫作还原剂,具有还原性。
H2 + S ==== H2S
△
0
-2
S + O2 ==== SO2
点燃
0
+4
硫作为氧化剂,具有氧化性。
硫的化学性质比较活泼,能与许多金属单质及非金属单质发生化学反应。
Fe+S====FeS
△
二、硫的化学性质
1. 为什么硫与铁、铜反应生成的化合物中硫化合价为-2价,而与氧气反应生成二氧化硫中硫的化合价为+2价?
硫原子最外层电子有6个,在化学反应中容易得到2个电子,形成-2价硫的化合物。而与同族氧元素比较,硫元素多了一个电子层,得电子能力相对较弱,而失电子能力相对较强。
2.能不能根据Fe、Cu与S、Cl2反应的产物判断S和Cl2的氧化性的强弱
可以。Fe、Cu与S反应生成低价的化合物,Fe、Cu与Cl2反应生成高价的化合物,故Cl2的氧化性大于S。
深度思考
(1)硫元素在自然界中只存在化合态,没有游离态( )
(2)高价态的含硫物质要实现向低价态含硫物质转化,一定发生还原反应( )
(3)要洗涤试管壁上附着的硫单质,不能用水洗,可以用酒精洗涤( )
(4)硫和铁、铜在加热条件下生成Fe2S3和CuS( )
(5)单质硫在纯氧中燃烧,其氧化产物为SO3( )
(6)硫是一种非金属单质,与其他单质反应,只能作氧化剂( )
判断正误
×
√
×
×
×
×
1.实验室洗涤试管壁上附着的硫单质,常用两种方法。
(1)物理方法:用CS2洗涤,利用单质硫的性质为____________。
(2)化学方法:用热的NaOH溶液洗涤,该反应原理为 3S+6NaOH
2Na2S+Na2SO3+3H2O,在该反应中,硫单质表现____性和_____性,氧化剂和还原剂的物质的量之比为______,写出上述反应的离子方程式:________________________________。
(3)向上述反应的溶液中再加入适量的稀H2SO4,会产生淡黄色沉淀,写出该反应的离子方程式:______________________________。
易溶于CS2
氧化
还原
2∶1
应用体验
2.(2020.衡水中学校月考)下列化合物能用相应的单质直接化合制得的是_______________ (填序号)。
①CuS ②FeS ③HCl ④SO2 ⑤SO3 ⑥FeCl2 ⑦CuCl2 ⑧Cu2S ⑨HgS ⑩Ag2S
②③④⑦⑧⑨⑩
无色
气态
刺激性
气味
密度大于空气
有毒
颜色
状态
气味
密度
毒性
溶解性
思考与讨论:SO2的物理性质体现在哪些方面?
三、二氧化硫的性质
探究结论1:SO2易溶于水
实验探究一:将集满SO2的试管倒扣在水中,振荡,观察现象并分析。
探究现象:试管内液面上升
三、二氧化硫的性质
实验内容
实验现象
结论或方程式
石蕊和SO2
石灰水和SO2
石蕊试纸变红
有酸生成
H2O +SO2 H2SO3
溶液变浑浊
Ca(OH)2+SO2 = CaSO3 ↓+ H2O
探究结论2:SO2具有酸性氧化物的通性
实验探究二:
1.在二氧化硫水溶液中滴入紫色石蕊试液,观察颜色变化
2.在澄清石灰水中滴加少量SO2水溶液,观察现象。
三、二氧化硫的性质
实验探究三:向盛有品红溶液的试管中通入SO2气体(二氧化硫溶液)。观察溶液的颜色变化,再加热观察颜色变化。
三、二氧化硫的性质
实验内容
实验现象
结论或方程式
品红溶液褪色
SO2具有漂白性
品红溶液和SO2
实验探究三:向盛有品红溶液的试管中通入SO2气体(二氧化硫溶液)。观察溶液的颜色变化,再加热观察颜色变化。
探究结论3:SO2具有漂白性
三、二氧化硫的性质
市场黄白两种银耳对比
学以致用
不可使用于食品漂白,但可用于日用品的漂白
竹筷子的漂白
草帽的漂白
三、二氧化硫的性质
不可使用于食品漂白,但可用于日用品的漂白
竹筷子的漂白
草帽的漂白
三、二氧化硫的性质
现象:KMnO4溶液的红色褪色
分析原因:SO2 + KMnO4 + H2O -- K2SO4 + MnSO4 + H2SO4
请配平方程式
实验探究四:取酸性KMnO4溶液5~8滴,滴入几滴SO2的水溶液,观察现象。
探究结论4:SO2具有还原性
三、二氧化硫的性质
SO2+Br2+ 2H2O=H2SO+ HBr
+4
+6
0
-1
2SO2+O2 2SO3
催化剂
△
小结:SO2具有较强的还原性,可以被O2、Cl2、Br2、酸性KMnO4、H2O2等氧化
思考与讨论:SO2能使酸性KMnO4褪色,实验表明SO2也能使溴水褪色体现SO2哪方面性质?
三、二氧化硫的性质
现象:溶液变浑浊
分析原因:SO2 + H2S -- S ↓ + H2O
实验探究五:在饱和Na2S溶液中加入适量SO2的水溶液(同时滴入几滴稀硫酸),观察现象。
请配平方程式
探究结论5:SO2具有氧化性
三、二氧化硫的性质
1.若将SO2、Cl2分别通入紫色石蕊溶液中,会观察到什么现象 原理是什么?
现象:SO2使紫色石蕊溶液变红色;Cl2使紫色石蕊溶液先变红色后褪色
分析原因:SO2属于酸性氧化物与水反应生成亚硫酸,亚硫酸会使紫色石蕊溶液变红色;Cl2会与水反应生成 HCl、HClO,HCl会使紫色石蕊溶液变红色,HClO具有强氧化性,又会使红色石蕊溶液褪色。
深度思考
2. SO2有漂白性,氯水有漂白性,如果将二者等物质的量混合,漂白性是不是更强?
不是。原理:SO2 + Cl2 + 2H2O== 2HCl + H2 SO4。而HCl 和H2 SO4是没有漂白性的,因此漂白性可能消失
3. SO2可以使高锰酸钾褪色和SO2使品红褪色原理一样吗?
前者是表现还原性,后者是表现漂白性。
深度思考
判断正误
(1)SO2的水溶液中存在SO2、H2SO3的原因是SO2与H2O的反应为可逆反应( )
(2)SO2可使溴水褪色,是因为SO2有漂白性( )
(3)SO2中硫的化合价为+4价,是硫元素的中间价,所以SO2既有氧化性又有还原性( )
(4)SO2气体通入BaCl2溶液产生白色沉淀BaSO3( )
(5)某气体通入品红溶液后,品红溶液褪色,则该气体一定是SO2( )
(6)SO2通入紫色石蕊溶液中先变红色后褪色( )
×
√
×
×
√
×
1.将SO2分别通入下列五种溶液中:
深度思考
回答下列问题:
(1)试管①中的实验现象:KMnO4溶液____,证明SO2具有____性。
(2)试管②中的实验现象:溶液____,证明SO2具有____性。
(3)试管③中的实验现象:溶液____,证明SO2能中和NaOH,写出该反应的离子方程式:____________________________________________。
褪色
还原
褪色
漂白
褪色
(4)试管④中能产生____沉淀,该沉淀是______。
(5)试管⑤中能产生白色沉淀,该沉淀是______。
白色
BaSO3
BaSO4
4.(2020·陕西黄陵中学期中)下列变化可以说明SO2具有漂白性的是
A.SO2通入溴水中,溴水褪色
B.SO2通入酸性高锰酸钾溶液中,溶液的紫红色褪去
C.SO2通入品红溶液中,溶液的红色褪去
D.SO2通入滴有酚酞的氢氧化钠溶液中,溶液的红色褪去
√
1
2
3
5
4
二氧化硫
分类观
(酸性氧化物
与CO2类似)
价态观
(还原性和
弱氧化性)
特性——漂白性:使品红溶液褪色
SO2+H2O H2SO3
SO2+NaOH === Na2SO3+H2O
SO2+Ca(OH)2 === CaSO3+H2O
2SO2+Ca(OH)2 === Ca(HSO3)2
2SO2+O2 2SO3
2H2SO3+O2 === 2H2SO4
SO2+Br2+2H2O === H2SO4+2HBr
H2O2+SO2 === H2SO4
2H2S+SO2 === 3S↓+2H2O
催化剂
△
知识小结
SO2
现象?原因?
已知C +H2SO4(浓) ---CO2 ↑ + SO2 ↑ +H2O ↑
如果用图中的装置检验三种产物,写出下面标号所表示的仪器中应加 入的试剂的名称及其作用
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
