1.1《原子结构》(第1课时)课件(共22张PPT)
文档属性
| 名称 | 1.1《原子结构》(第1课时)课件(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
能层与能级 基态与激发态 原子光谱
第1课时
Application of precipitation dissolution equilibrium
第一节 难溶电解质的溶解平衡
第一章 原子结构与性质
选择性必修一
#0070C0
#00B0F0
原子结构模型的演变
1803年,道尔顿实心球模型
原子是构成物质的最小粒子
是不可再分的实心球
1904年汤姆逊葡萄干面包模型
原子平均分布着正电荷粒子,
镶嵌电子,形成电中性原子
1911年卢瑟福原子行星模型
原子中心有带正电的核(质量几乎等于原子质量,电子围绕它沿着不同的轨道运行,就像行星围绕太阳运转一样)
1913年,玻尓原子轨道模型
对卢瑟福模型改进,称电子在原子核外空间的一定轨道上绕核作高速运动。
1926-1935年电子云模型
现代物质结构学说,电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道
-
+
+
-
+
-
+
+
-
原子结构与性质
学习目标
通过认识原子结构和电子排布理解能层和能级的关系。
通过核外电子能量不同分析、理解基态与激发态的含义。
3. 能辨识光谱与电子跃迁之间的关系。
#0070C0
#00B0F0
一、能层与能级
1920年,丹麦科学家玻尔在氢原子模型基础上,提出 ,开启了用原子结构解释 的篇章。1925年以后,玻尔的“壳层”落实为“能层”与“能级”,厘清了核外电子的可能状态,复杂的原子光谱得以诠释。1936年,德国科学家马德隆发表了以 事实为依据的完整的 。
构造原理
元素周期律
原子光谱
构造原理
#0070C0
#00B0F0
一、影响化学反应速率的因素
1. 能层
(1) 含义:根据核外电子的 不同,将核外电子分为不同的能层(电子层)。
(2) 序号及符号 :
能层序号一、二、三、四、五、六、七……分别用 、 、 、 、 、
、 ……表示,其中每层所容纳的电子数最多为 个。
(3) 能量关系 : 能层越高,电子的能量越高,能量的高低顺序为
__________________________________________________。
能量
K
L
M
N
O
P
Q
2n2
E(K)<E(L)<E(M)<
E(N)<E(O)<E(P)<E(Q)
#0070C0
#00B0F0
一、影响化学反应速率的因素
1. 能级
含义:根据多电子原子的同一能层的电子的 也可能不同,将它们分
为不同能级。
(2) 表示方法:分别用相应能层的序数和字母 等表示,如n能
层的能级按能量由低到高的排列顺序为ns、 、 、nf等。
能量
s、p、d、f
np
nd
#0070C0
#00B0F0
一、影响化学反应速率的因素
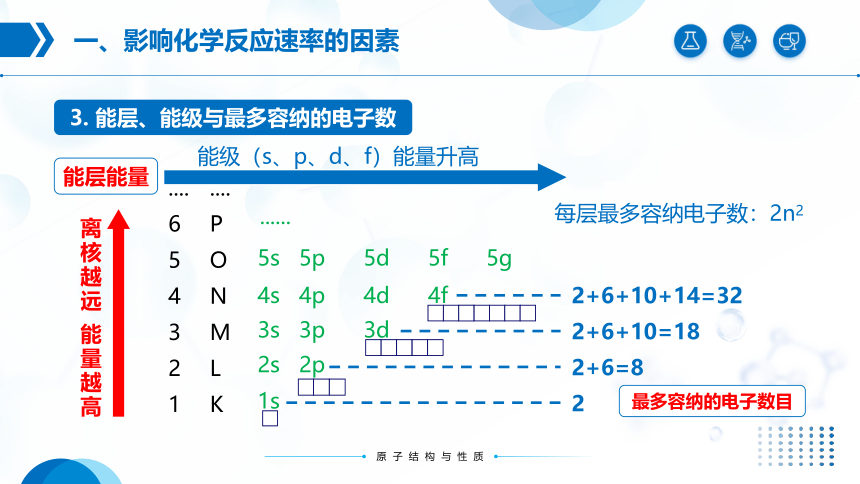
3. 能层、能级与最多容纳的电子数
....
6
5
4
3
2
1
....
PONML
K
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f 5g
......
能层能量
离核越远 能量越高
能级(s、p、d、f)能量升高
2
2+6=8
2+6+10=18
2+6+10+14=32
每层最多容纳电子数:2n2
最多容纳的电子数目
#0070C0
#00B0F0
一、影响化学反应速率的因素
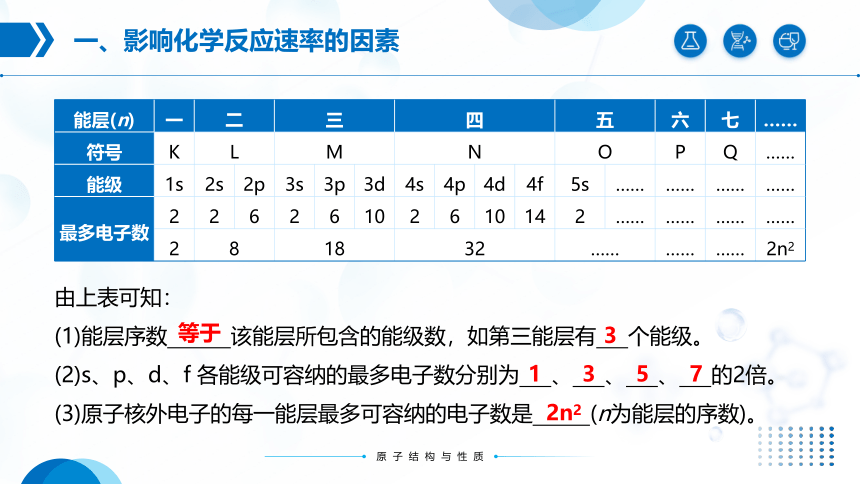
能层(n) 一 二 三 四 五 六 七 ……
符号 K L M N O P Q ……
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s …… …… …… ……
最多电子数 2 2 6 2 6 10 2 6 10 14 2 …… …… …… ……
2 8 18 32 …… …… …… 2n2
由上表可知:
(1)能层序数 该能层所包含的能级数,如第三能层有 个能级。
(2)s、p、d、f 各能级可容纳的最多电子数分别为 、 、 、 的2倍。
(3)原子核外电子的每一能层最多可容纳的电子数是 (n为能层的序数)。
等于
3
1
3
5
7
2n2
#0070C0
#00B0F0
随堂检测
1. 什么是能层,有什么规律?
2. 什么是能级?能级的符号和所能容纳的电子数?
核外电子按能量不同分成能层,能层越高,电子能量越高。
在多电子原子中,同一能层的电子,还被分成不同能级。
能层 K L M N O 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p ...
最多电子数 ...
2
2
6
2
6
10
2
6
10
2
14
6
#0070C0
#00B0F0
思考与讨论
一个能层的能级与能层序数(n)间存在什么关系?一个能层最多可容纳的电子数与能层序数(n)间存在什么关系
2. 以s、p、d、f、为符号的能级分别最多可容纳多少电子?3d、4d、5d能级所
能容纳的最多电子数是否相同?
3. 第五能层最多可容纳多少电子?它们分别容纳在几个能级中?各能级最多容纳
多少个电子?(注:高于f的能级不用符号表示。)
一个能层的能级序数与能层序数(n)相等。一个能层最多可容纳的电子数=2n2
s能级最多容纳2电子,p能级最多可容纳6个电子,d能级最多可容纳10个电子,f能级最多可容纳14个电子。3d、4d、5d能级所能容纳的最多电子数相同
第五能层最多可容纳50个电子,它们分别容纳在5个能级中,5s能级最多容纳2个电子,5p能级最多容纳6个电子,5d能级最多容纳10个电子,5f能级最多容纳14个电子,还有一个能级最多容纳18个电子。
#0070C0
#00B0F0
二、基态与激发态 原子光谱
1. 基态原子与激发态原子
(1) 基态原子:处于 状态的原子。
(2) 激发态原子:基态原子 能量,它的电子会跃迁到 能级,
变成激发态原子。
最低能量
吸收
较高
#0070C0
#00B0F0
二、基态与激发态 原子光谱
1. 基态原子与激发态原子
#0070C0
#00B0F0
二、基态与激发态 原子光谱
2. 光谱
(1) 光谱的成因及分类
吸收光谱
发射光谱
#0070C0
#00B0F0
二、基态与激发态 原子光谱
2. 光谱
(2) 原子光谱与光谱分析
① 原子光谱: 不同元素的原子, 电子发生跃迁时会吸收或释放不同的光, 可以用光
谱仪摄取各种元素原子的 吸收 光谱或 发射 光谱,总称原子光谱。
② 光谱分析: 现代化学中, 常利用原子光谱上的 特征谱线 来鉴定元素, 称为光谱
分析。
提示: 激发态原子中的电子跃迁到低能级时, 多余的能量以光的形式释放出来。
【思考】
金属的焰色试验中, 一些金属元素呈现不同焰色的原因是什么
#0070C0
#00B0F0
二、基态与激发态 原子光谱
3. 基态原子、激发态原子与原子光谱的关系
基态原子
激发态原子
吸收能量
形成吸收光谱
释放能量
形成发射光谱
电子跃迁
有什么发现?
同一原子发射光谱中的亮线和吸收光谱中的暗线的位置对应相同。
有什么用?
光谱分析:每一种元素都有自己的特征谱线,就像“指纹”一样可用于辨别形成光谱的元素。
#0070C0
#00B0F0
随堂检测
1. 什么是基态原子?什么是激发态原子?
处于最低能量状态的原子叫基态原子。
基态原子吸收能量,它的电子跃迁到较高能级,变为激发态原子。
不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱,总称原子光谱。
2. 日常生活中,与原子核核外电子跃迁释放能量有关的例子?
3. 原子光谱的形成?
led灯光
焰火
激光
#0070C0
#00B0F0
课堂训练
1. 下列叙述正确的是( )
A. 能级就是电子层
B. 每个能层最多可容纳的电子数是2n2
C. 同一能层中的不同能级的能量高低相同
D. 不同能层中的s能级的能量高低相同
B
#0070C0
#00B0F0
课堂练习
解析
能层是电子层,对于同一能层里能量不同的电子,又将其分为不同的能级,故A错误;
不同能层中的s能级的能量不同,能层越大,s能级的能量越高,例如:E(1s)每个能层最多可容纳的电子数是2n2,故B正确;
同一能层里不同能级,能量按照s、p、d、f的顺序升高,故C错误;
#0070C0
#00B0F0
课堂训练
2. 某元素原子的核外有三个能层,最外能层有4个电子,该原子核内
的质子数为( )
A.14 B.15 C.16 D.17
A
原子核外共有三个能层,最内层只有1s能级,可容纳2个电子,第二层有2s、2p两个能级,可容纳1×2+3×2=8个电子,最外层有4个电子,所以该原子核外有14个电子,又因在原子中核外电子数等于核内质子数,故选A。
解析
#0070C0
#00B0F0
课堂训练
3. 以下现象与核外电子的跃迁有关的是
①霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光 ⑥燃放的焰火,在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶 ( )
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
A
选择性必修一
课堂小结
CLASS SUMMARY
选择性必修一
感谢您的观看
THANKS FOR WATCHING
能层与能级 基态与激发态 原子光谱
第1课时
Application of precipitation dissolution equilibrium
第一节 难溶电解质的溶解平衡
第一章 原子结构与性质
选择性必修一
#0070C0
#00B0F0
原子结构模型的演变
1803年,道尔顿实心球模型
原子是构成物质的最小粒子
是不可再分的实心球
1904年汤姆逊葡萄干面包模型
原子平均分布着正电荷粒子,
镶嵌电子,形成电中性原子
1911年卢瑟福原子行星模型
原子中心有带正电的核(质量几乎等于原子质量,电子围绕它沿着不同的轨道运行,就像行星围绕太阳运转一样)
1913年,玻尓原子轨道模型
对卢瑟福模型改进,称电子在原子核外空间的一定轨道上绕核作高速运动。
1926-1935年电子云模型
现代物质结构学说,电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道
-
+
+
-
+
-
+
+
-
原子结构与性质
学习目标
通过认识原子结构和电子排布理解能层和能级的关系。
通过核外电子能量不同分析、理解基态与激发态的含义。
3. 能辨识光谱与电子跃迁之间的关系。
#0070C0
#00B0F0
一、能层与能级
1920年,丹麦科学家玻尔在氢原子模型基础上,提出 ,开启了用原子结构解释 的篇章。1925年以后,玻尔的“壳层”落实为“能层”与“能级”,厘清了核外电子的可能状态,复杂的原子光谱得以诠释。1936年,德国科学家马德隆发表了以 事实为依据的完整的 。
构造原理
元素周期律
原子光谱
构造原理
#0070C0
#00B0F0
一、影响化学反应速率的因素
1. 能层
(1) 含义:根据核外电子的 不同,将核外电子分为不同的能层(电子层)。
(2) 序号及符号 :
能层序号一、二、三、四、五、六、七……分别用 、 、 、 、 、
、 ……表示,其中每层所容纳的电子数最多为 个。
(3) 能量关系 : 能层越高,电子的能量越高,能量的高低顺序为
__________________________________________________。
能量
K
L
M
N
O
P
Q
2n2
E(K)<E(L)<E(M)<
E(N)<E(O)<E(P)<E(Q)
#0070C0
#00B0F0
一、影响化学反应速率的因素
1. 能级
含义:根据多电子原子的同一能层的电子的 也可能不同,将它们分
为不同能级。
(2) 表示方法:分别用相应能层的序数和字母 等表示,如n能
层的能级按能量由低到高的排列顺序为ns、 、 、nf等。
能量
s、p、d、f
np
nd
#0070C0
#00B0F0
一、影响化学反应速率的因素
3. 能层、能级与最多容纳的电子数
....
6
5
4
3
2
1
....
PONML
K
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f 5g
......
能层能量
离核越远 能量越高
能级(s、p、d、f)能量升高
2
2+6=8
2+6+10=18
2+6+10+14=32
每层最多容纳电子数:2n2
最多容纳的电子数目
#0070C0
#00B0F0
一、影响化学反应速率的因素
能层(n) 一 二 三 四 五 六 七 ……
符号 K L M N O P Q ……
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s …… …… …… ……
最多电子数 2 2 6 2 6 10 2 6 10 14 2 …… …… …… ……
2 8 18 32 …… …… …… 2n2
由上表可知:
(1)能层序数 该能层所包含的能级数,如第三能层有 个能级。
(2)s、p、d、f 各能级可容纳的最多电子数分别为 、 、 、 的2倍。
(3)原子核外电子的每一能层最多可容纳的电子数是 (n为能层的序数)。
等于
3
1
3
5
7
2n2
#0070C0
#00B0F0
随堂检测
1. 什么是能层,有什么规律?
2. 什么是能级?能级的符号和所能容纳的电子数?
核外电子按能量不同分成能层,能层越高,电子能量越高。
在多电子原子中,同一能层的电子,还被分成不同能级。
能层 K L M N O 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p ...
最多电子数 ...
2
2
6
2
6
10
2
6
10
2
14
6
#0070C0
#00B0F0
思考与讨论
一个能层的能级与能层序数(n)间存在什么关系?一个能层最多可容纳的电子数与能层序数(n)间存在什么关系
2. 以s、p、d、f、为符号的能级分别最多可容纳多少电子?3d、4d、5d能级所
能容纳的最多电子数是否相同?
3. 第五能层最多可容纳多少电子?它们分别容纳在几个能级中?各能级最多容纳
多少个电子?(注:高于f的能级不用符号表示。)
一个能层的能级序数与能层序数(n)相等。一个能层最多可容纳的电子数=2n2
s能级最多容纳2电子,p能级最多可容纳6个电子,d能级最多可容纳10个电子,f能级最多可容纳14个电子。3d、4d、5d能级所能容纳的最多电子数相同
第五能层最多可容纳50个电子,它们分别容纳在5个能级中,5s能级最多容纳2个电子,5p能级最多容纳6个电子,5d能级最多容纳10个电子,5f能级最多容纳14个电子,还有一个能级最多容纳18个电子。
#0070C0
#00B0F0
二、基态与激发态 原子光谱
1. 基态原子与激发态原子
(1) 基态原子:处于 状态的原子。
(2) 激发态原子:基态原子 能量,它的电子会跃迁到 能级,
变成激发态原子。
最低能量
吸收
较高
#0070C0
#00B0F0
二、基态与激发态 原子光谱
1. 基态原子与激发态原子
#0070C0
#00B0F0
二、基态与激发态 原子光谱
2. 光谱
(1) 光谱的成因及分类
吸收光谱
发射光谱
#0070C0
#00B0F0
二、基态与激发态 原子光谱
2. 光谱
(2) 原子光谱与光谱分析
① 原子光谱: 不同元素的原子, 电子发生跃迁时会吸收或释放不同的光, 可以用光
谱仪摄取各种元素原子的 吸收 光谱或 发射 光谱,总称原子光谱。
② 光谱分析: 现代化学中, 常利用原子光谱上的 特征谱线 来鉴定元素, 称为光谱
分析。
提示: 激发态原子中的电子跃迁到低能级时, 多余的能量以光的形式释放出来。
【思考】
金属的焰色试验中, 一些金属元素呈现不同焰色的原因是什么
#0070C0
#00B0F0
二、基态与激发态 原子光谱
3. 基态原子、激发态原子与原子光谱的关系
基态原子
激发态原子
吸收能量
形成吸收光谱
释放能量
形成发射光谱
电子跃迁
有什么发现?
同一原子发射光谱中的亮线和吸收光谱中的暗线的位置对应相同。
有什么用?
光谱分析:每一种元素都有自己的特征谱线,就像“指纹”一样可用于辨别形成光谱的元素。
#0070C0
#00B0F0
随堂检测
1. 什么是基态原子?什么是激发态原子?
处于最低能量状态的原子叫基态原子。
基态原子吸收能量,它的电子跃迁到较高能级,变为激发态原子。
不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱,总称原子光谱。
2. 日常生活中,与原子核核外电子跃迁释放能量有关的例子?
3. 原子光谱的形成?
led灯光
焰火
激光
#0070C0
#00B0F0
课堂训练
1. 下列叙述正确的是( )
A. 能级就是电子层
B. 每个能层最多可容纳的电子数是2n2
C. 同一能层中的不同能级的能量高低相同
D. 不同能层中的s能级的能量高低相同
B
#0070C0
#00B0F0
课堂练习
解析
能层是电子层,对于同一能层里能量不同的电子,又将其分为不同的能级,故A错误;
不同能层中的s能级的能量不同,能层越大,s能级的能量越高,例如:E(1s)
同一能层里不同能级,能量按照s、p、d、f的顺序升高,故C错误;
#0070C0
#00B0F0
课堂训练
2. 某元素原子的核外有三个能层,最外能层有4个电子,该原子核内
的质子数为( )
A.14 B.15 C.16 D.17
A
原子核外共有三个能层,最内层只有1s能级,可容纳2个电子,第二层有2s、2p两个能级,可容纳1×2+3×2=8个电子,最外层有4个电子,所以该原子核外有14个电子,又因在原子中核外电子数等于核内质子数,故选A。
解析
#0070C0
#00B0F0
课堂训练
3. 以下现象与核外电子的跃迁有关的是
①霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光 ⑥燃放的焰火,在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶 ( )
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
A
选择性必修一
课堂小结
CLASS SUMMARY
选择性必修一
感谢您的观看
THANKS FOR WATCHING
