2.1《共价键》课件(共33张PPT)
文档属性
| 名称 | 2.1《共价键》课件(共33张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 00:00:00 | ||
图片预览









文档简介
(共33张PPT)
第二章 分子结构与性质
第二节 共价键
第2课时 键参数—键能、
键长与键角
选修二
原子结构与性质
核心素养
了解共价键键参数的含义,能用键能、键长、键角说明简单分子的某些性质。
通过认识共价键的键参数对物质性质的影响,探析微观结构对宏观性质的影响。
#0070C0
#00B0F0
一、键参数之键能
1. 定义
气态分子中1 mol化学键解离成气态原子所吸收的能量。
kJ·mol-1
通常是298.15K,101kPa条件下的标准值
2. 单位
#0070C0
#00B0F0
思考讨论
键能
键能是共价键强弱的一种标度
气态分子中1 mol化学键解离成气态原子所吸收的能量。
键能越大
气态分子中1mol化学键解离成气态原子所吸收的能量越多
共价键越牢固
分子越稳定
#0070C0
#00B0F0
资料卡片
键能通常是一个平均值
C-H 键键能平均值:
= 415.5 kJ·mol-1
断开CH4中的4个C-H ,所需能量并不相等,因此,CH4中C-H键的键能是平均值。
共价键
键能(kJ·mol-1)
H-CH3 → · CH3 +H· 439.3
H-CH2 → CH2 +H· 442.0
H-CH → CH +H· 442.0
·
H-C → C · + H· 338.6
·
·
·
·
·
·
·
·
·
·
·
·
·
#0070C0
#00B0F0
资料卡片
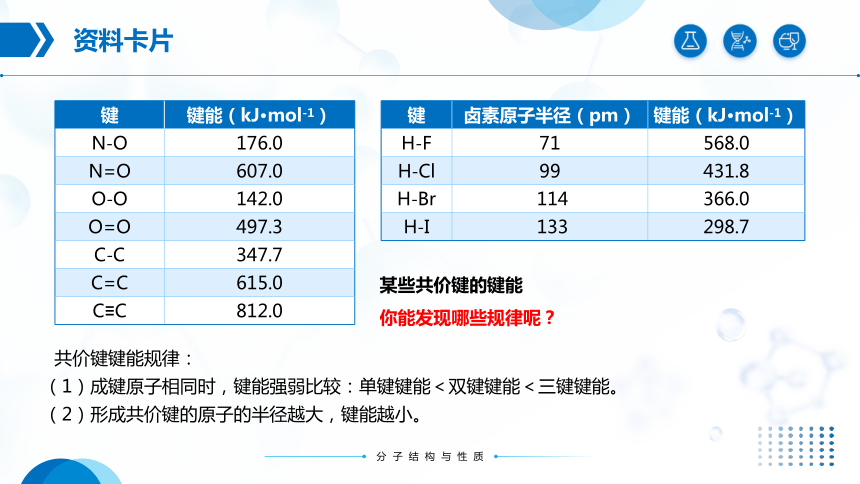
键 键能(kJ·mol-1)
N-O 176.0
N=O 607.0
O-O 142.0
O=O 497.3
C-C 347.7
C=C 615.0
C≡C 812.0
某些共价键的键能
键 卤素原子半径(pm) 键能(kJ·mol-1)
H-F 71 568.0
H-Cl 99 431.8
H-Br 114 366.0
H-I 133 298.7
你能发现哪些规律呢?
共价键键能规律:
(1)成键原子相同时,键能强弱比较:单键键能<双键键能<三键键能。
(2)形成共价键的原子的半径越大,键能越小。
#0070C0
#00B0F0
练一练
下列事实不能用键能的大小来解释的是( )
A. N元素的电负性较大,但N2的化学性质很稳定
B. 稀有气体一般难发生化学反应
C. HF、HCl、HBr、HI的热稳定性逐渐减弱
D. F2比O2更容易与H2反应
B
#0070C0
#00B0F0
二、键参数之键长
1. 定义
构成化学键的两个原子的核间距。
由于分子中的原子始终处于不断振动之中,因此,键长只能是振动着的原子处于平衡位置时的核间距。
pm(1 pm = 10-12 m)
2. 单位
#0070C0
#00B0F0
资料卡片
#0070C0
#00B0F0
资料卡片
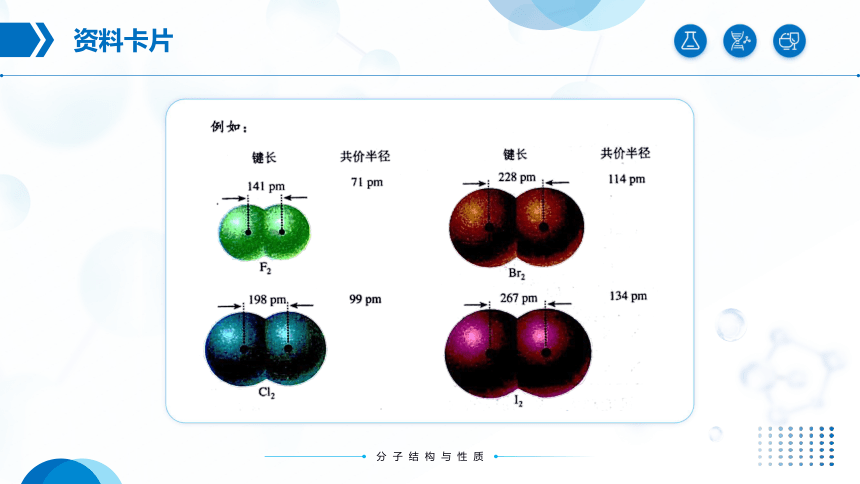
键 键长(pm)
H-F 92
H-Cl 127
H-Br 142
H-I 161
键 键长(pm)
F-F 141
Cl-Cl 198
Br-Br 228
I-I 267
你能发现哪些规律呢?
键 键长(pm)
C-C 154
C=C 133
C≡C 120
某些共价键的键长
卤素 原子半径(pm)
F 71
Cl 99
Br 114
I 133
共价键键长规律:
(1)对于同种类型的共价键,成键原子的原子半径越大,键长越大。
(2)成键原子相同的共价键的键长:单键键长>双键键长>三键键长
#0070C0
#00B0F0
资料卡片
键 键长(pm) 键能(kJ·mol-1)
H-F 92 568
H-Cl 127 431.8
H-Br 142 366
H-I 161 298.7
键 键长(pm) 键能(kJ·mol-1)
Cl-Cl 198 242.7
Br-Br 228 193.7
I-I 267 152.7
键 键长(pm) 键能(kJ·mol-1)
C-C 154 347.7
C=C 133 615
C≡C 120 812
通过观察共价键的键长和键能的数据,你能发现键长和键能之间的关系吗?
F-F不符合“键长越短,键能越大”的规律,为什么?
关系:键长越短,键能越大。
F-F
141
157.0
#0070C0
#00B0F0
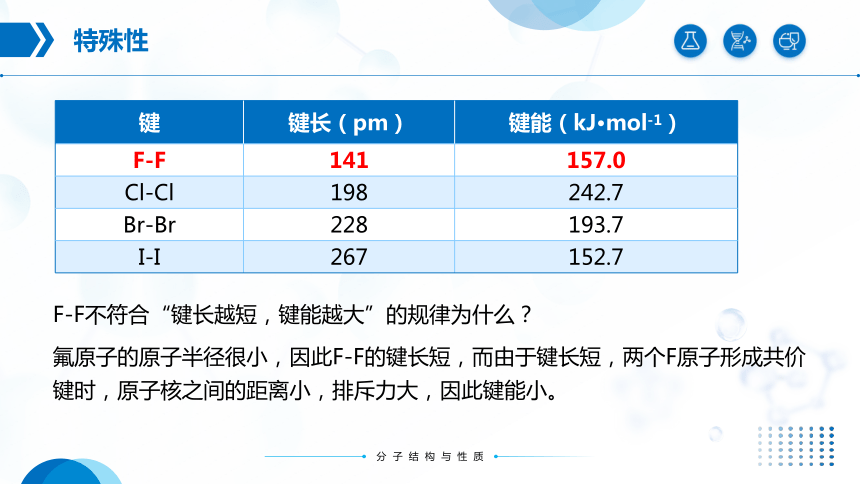
特殊性
F-F不符合“键长越短,键能越大”的规律为什么?
氟原子的原子半径很小,因此F-F的键长短,而由于键长短,两个F原子形成共价键时,原子核之间的距离小,排斥力大,因此键能小。
键 键长(pm) 键能(kJ·mol-1)
F-F 141 157.0
Cl-Cl 198 242.7
Br-Br 228 193.7
I-I 267 152.7
#0070C0
#00B0F0
练一练
下列单质分子中,键长最长,键能最小的是( )
A. H2 B. Cl2
C. Br2 D. I2
D
#0070C0
#00B0F0
思考讨论
键 键能(kJ·mol-1)
H-Cl 431.8
H-Br 366.0
H-I 298.7
键能越大,共价键越牢固,由此构成的分子越稳定。
HCl、HBr、HI稳定性差异的分析
1
H-Cl、H-Br和H-I的强度不同
键能
#0070C0
#00B0F0
思考讨论
一般地,原子半径越大,形成的共价键键长越长,键能越小,共价键越不牢固,形成的分子越不稳定。
HCl、HBr、HI稳定性差异的猜想
2
Cl、Br和I的原子半径依次增大
键长
卤素 原子半径
(pm)
Cl 99
Br 114
I 133
键 键长(pm) 键能(kJ·mol-1)
H-Cl 127 431.8
H-Br 142 366
H-I 161 298.7
#0070C0
#00B0F0
思考讨论
HCl、HBr、HI稳定性差异的分析
3
H2与Cl2、Br2和I2反应放出的热量变化
化学反应的热量变化
#0070C0
#00B0F0
思考讨论
旧化学键的断裂
旧化学键的断裂
化学反应实质
化学键断裂吸收能量
化学键形成释放能量
键能与化学反应的能量变化存在一定的关系
如何用键能计算H2与Cl2、Br2和I2反应放出的热量呢?
#0070C0
#00B0F0
动手计算
键 键能
(kJ·mol-1)
H-H 436.0
Cl-Cl 242.7
H-Cl 431.8
吸收436.0 kJ·mol-1能量
吸收242.7 kJ·mol-1能量
H
H
Cl
Cl
键断裂
键断裂
H
H
Cl
Cl
+
+
键形成
键形成
H
Cl
H
Cl
各释放431.8 kJ·mol-1能量
依据键能的数据,计算1 mol H2和1mol Cl2反应生成2 mol HCl释放的能量。
#0070C0
#00B0F0
动手计算
吸收436.0 kJ·mol-1能量
吸收242.7 kJ·mol-1能量
H
H
Cl
Cl
键断裂
键断裂
H
H
Cl
Cl
+
+
键形成
键形成
H
Cl
H
Cl
各释放431.8 kJ·mol-1能量
436.0+242.7-431.8×2=-184.9 kJ
放出184.9 kJ的热量
#0070C0
#00B0F0
动手计算
键 键能(kJ·mol-1)
H-H 436.0
Br-Br 193.7
H-Br 366.0
I-I 152.7
H-I 298.7
计算1mol H2分别与1mol Br2(蒸气)和1mol I2(蒸气)反应,生成2mol HBr 和2 mol HI,反应的热量变化。
H2+Br2
2HBr
放出热量102.3 kJ
H2+I2
2HI
放出热量8.7 kJ
#0070C0
#00B0F0
得出结论
生成1 molHX放出的热量:HCl>HBr>HI
同类型的化学反应,相同物质的量的反应物放出的热量越多,产物越稳定,故HCl最稳定,分解的百分数最小,HI最不稳定,更易发生热分解反应。
卤化氢 在1000℃分解的百分数/%
HCl 0.0014
HBr 0.5
HI 33
生成物 放出的热量(kJ)
HCl 184.9
HBr 102.3
HI 8.7
键能的应用:计算化学反应的反应热。
H=反应物键能总和 - 生成物键能总和
#0070C0
#00B0F0
小 结
键能和键长是衡量共价键强弱和分子稳定性的重要参数。
一般来说,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,分子性质越稳定。
以上两个参数定量地对分子进行了分析,而要更好的描述分子的空间构型,还必须引入共价键的第三个键参数——键角。
#0070C0
#00B0F0
三、键参数之键角
105°
H2O
V形(角形)
107°
NH3
三角锥形
180°
CO2
直线形
在多原子分子中,两个相邻共价键之间的夹角。
1. 定义
#0070C0
#00B0F0
三、键参数之键角
2. 应用
在多原子分子中键角是一定的,这表明共价键具有 性,因此键角影响着共价分子的 。
方向
空间结构
#0070C0
#00B0F0
练一练
分子的空间结构 键角 实例
正四面体形 CH4、CCl4
平面形 苯、乙烯、BF3等
三角锥形 NH3
V形(角形) H2O
直线形 CO2、CS2、CH≡CH
试根据空间结构填写下列分子的键角:
109°28′
120°
105°
180°
107°
#0070C0
#00B0F0
练一练
氨分子、水分子、甲烷分子中共价键的键角分别为a、b、c,则a、b、c的大小关系为( )
A. aC. bD
#0070C0
#00B0F0
归纳总结
键长是影响分子空间结构的因素之一。如CH4分子的空间结构是正四面体,而CH3Cl只是四面体而不是正四面体,原因是C—H和C—Cl的键长不相等。
(1)键长与分子空间结构的关系
①根据原子半径进行判断。在其他条件相同时,成键原子的半径越小,键长越短。
②根据共用电子对数判断。就相同的两原子形成的共价键而言,当两个原子形成双键或者三键时,由于原子轨道的重叠程度增大,原子之间的核间距减小,键长变短,故单键键长>双键键长>三键键长。
(2)定性判断键长的方法
#0070C0
#00B0F0
小 结
#0070C0
#00B0F0
课堂练习
1. 关于键长、键能和键角,下列说法错误的是( )
A. 键角是描述分子空间结构的重要参数
B. 键长是形成共价键的两原子间的核间距
C. 键能越大,键长越长,共价化合物越稳定
D. 键角的大小与键长、键能的大小无关
C
#0070C0
#00B0F0
课堂练习
2. 对比以下几个反应式:Cl+Cl―→Cl2 ΔH1=-247 kJ·mol-1;
O+O―→O2 ΔH2=-493 kJ·mol-1;N+N―→N2 ΔH3=-946 kJ·mol-1。
可以得出的结论是 ( )
A. 在常温下氮气比氧气和氯气稳定
B. 氮、氧和氯的单质常温下为气体
C. 氮、氧和氯都是双原子分子
D. 氮气、氧气和氯气的密度不同
A
#0070C0
#00B0F0
课堂练习
3. 如图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 ( )
A. W、R元素单质分子内都存在非极性键
B. X、Z元素都能形成双原子分子
C. 第一电离能:X>Y>W
D. 键长:X—HB
选修二
课堂小结
CLASS SUMMARY
选修二
感谢您的观看
THANKS FOR WATCHING
第二章 分子结构与性质
第二节 共价键
第2课时 键参数—键能、
键长与键角
选修二
原子结构与性质
核心素养
了解共价键键参数的含义,能用键能、键长、键角说明简单分子的某些性质。
通过认识共价键的键参数对物质性质的影响,探析微观结构对宏观性质的影响。
#0070C0
#00B0F0
一、键参数之键能
1. 定义
气态分子中1 mol化学键解离成气态原子所吸收的能量。
kJ·mol-1
通常是298.15K,101kPa条件下的标准值
2. 单位
#0070C0
#00B0F0
思考讨论
键能
键能是共价键强弱的一种标度
气态分子中1 mol化学键解离成气态原子所吸收的能量。
键能越大
气态分子中1mol化学键解离成气态原子所吸收的能量越多
共价键越牢固
分子越稳定
#0070C0
#00B0F0
资料卡片
键能通常是一个平均值
C-H 键键能平均值:
= 415.5 kJ·mol-1
断开CH4中的4个C-H ,所需能量并不相等,因此,CH4中C-H键的键能是平均值。
共价键
键能(kJ·mol-1)
H-CH3 → · CH3 +H· 439.3
H-CH2 → CH2 +H· 442.0
H-CH → CH +H· 442.0
·
H-C → C · + H· 338.6
·
·
·
·
·
·
·
·
·
·
·
·
·
#0070C0
#00B0F0
资料卡片
键 键能(kJ·mol-1)
N-O 176.0
N=O 607.0
O-O 142.0
O=O 497.3
C-C 347.7
C=C 615.0
C≡C 812.0
某些共价键的键能
键 卤素原子半径(pm) 键能(kJ·mol-1)
H-F 71 568.0
H-Cl 99 431.8
H-Br 114 366.0
H-I 133 298.7
你能发现哪些规律呢?
共价键键能规律:
(1)成键原子相同时,键能强弱比较:单键键能<双键键能<三键键能。
(2)形成共价键的原子的半径越大,键能越小。
#0070C0
#00B0F0
练一练
下列事实不能用键能的大小来解释的是( )
A. N元素的电负性较大,但N2的化学性质很稳定
B. 稀有气体一般难发生化学反应
C. HF、HCl、HBr、HI的热稳定性逐渐减弱
D. F2比O2更容易与H2反应
B
#0070C0
#00B0F0
二、键参数之键长
1. 定义
构成化学键的两个原子的核间距。
由于分子中的原子始终处于不断振动之中,因此,键长只能是振动着的原子处于平衡位置时的核间距。
pm(1 pm = 10-12 m)
2. 单位
#0070C0
#00B0F0
资料卡片
#0070C0
#00B0F0
资料卡片
键 键长(pm)
H-F 92
H-Cl 127
H-Br 142
H-I 161
键 键长(pm)
F-F 141
Cl-Cl 198
Br-Br 228
I-I 267
你能发现哪些规律呢?
键 键长(pm)
C-C 154
C=C 133
C≡C 120
某些共价键的键长
卤素 原子半径(pm)
F 71
Cl 99
Br 114
I 133
共价键键长规律:
(1)对于同种类型的共价键,成键原子的原子半径越大,键长越大。
(2)成键原子相同的共价键的键长:单键键长>双键键长>三键键长
#0070C0
#00B0F0
资料卡片
键 键长(pm) 键能(kJ·mol-1)
H-F 92 568
H-Cl 127 431.8
H-Br 142 366
H-I 161 298.7
键 键长(pm) 键能(kJ·mol-1)
Cl-Cl 198 242.7
Br-Br 228 193.7
I-I 267 152.7
键 键长(pm) 键能(kJ·mol-1)
C-C 154 347.7
C=C 133 615
C≡C 120 812
通过观察共价键的键长和键能的数据,你能发现键长和键能之间的关系吗?
F-F不符合“键长越短,键能越大”的规律,为什么?
关系:键长越短,键能越大。
F-F
141
157.0
#0070C0
#00B0F0
特殊性
F-F不符合“键长越短,键能越大”的规律为什么?
氟原子的原子半径很小,因此F-F的键长短,而由于键长短,两个F原子形成共价键时,原子核之间的距离小,排斥力大,因此键能小。
键 键长(pm) 键能(kJ·mol-1)
F-F 141 157.0
Cl-Cl 198 242.7
Br-Br 228 193.7
I-I 267 152.7
#0070C0
#00B0F0
练一练
下列单质分子中,键长最长,键能最小的是( )
A. H2 B. Cl2
C. Br2 D. I2
D
#0070C0
#00B0F0
思考讨论
键 键能(kJ·mol-1)
H-Cl 431.8
H-Br 366.0
H-I 298.7
键能越大,共价键越牢固,由此构成的分子越稳定。
HCl、HBr、HI稳定性差异的分析
1
H-Cl、H-Br和H-I的强度不同
键能
#0070C0
#00B0F0
思考讨论
一般地,原子半径越大,形成的共价键键长越长,键能越小,共价键越不牢固,形成的分子越不稳定。
HCl、HBr、HI稳定性差异的猜想
2
Cl、Br和I的原子半径依次增大
键长
卤素 原子半径
(pm)
Cl 99
Br 114
I 133
键 键长(pm) 键能(kJ·mol-1)
H-Cl 127 431.8
H-Br 142 366
H-I 161 298.7
#0070C0
#00B0F0
思考讨论
HCl、HBr、HI稳定性差异的分析
3
H2与Cl2、Br2和I2反应放出的热量变化
化学反应的热量变化
#0070C0
#00B0F0
思考讨论
旧化学键的断裂
旧化学键的断裂
化学反应实质
化学键断裂吸收能量
化学键形成释放能量
键能与化学反应的能量变化存在一定的关系
如何用键能计算H2与Cl2、Br2和I2反应放出的热量呢?
#0070C0
#00B0F0
动手计算
键 键能
(kJ·mol-1)
H-H 436.0
Cl-Cl 242.7
H-Cl 431.8
吸收436.0 kJ·mol-1能量
吸收242.7 kJ·mol-1能量
H
H
Cl
Cl
键断裂
键断裂
H
H
Cl
Cl
+
+
键形成
键形成
H
Cl
H
Cl
各释放431.8 kJ·mol-1能量
依据键能的数据,计算1 mol H2和1mol Cl2反应生成2 mol HCl释放的能量。
#0070C0
#00B0F0
动手计算
吸收436.0 kJ·mol-1能量
吸收242.7 kJ·mol-1能量
H
H
Cl
Cl
键断裂
键断裂
H
H
Cl
Cl
+
+
键形成
键形成
H
Cl
H
Cl
各释放431.8 kJ·mol-1能量
436.0+242.7-431.8×2=-184.9 kJ
放出184.9 kJ的热量
#0070C0
#00B0F0
动手计算
键 键能(kJ·mol-1)
H-H 436.0
Br-Br 193.7
H-Br 366.0
I-I 152.7
H-I 298.7
计算1mol H2分别与1mol Br2(蒸气)和1mol I2(蒸气)反应,生成2mol HBr 和2 mol HI,反应的热量变化。
H2+Br2
2HBr
放出热量102.3 kJ
H2+I2
2HI
放出热量8.7 kJ
#0070C0
#00B0F0
得出结论
生成1 molHX放出的热量:HCl>HBr>HI
同类型的化学反应,相同物质的量的反应物放出的热量越多,产物越稳定,故HCl最稳定,分解的百分数最小,HI最不稳定,更易发生热分解反应。
卤化氢 在1000℃分解的百分数/%
HCl 0.0014
HBr 0.5
HI 33
生成物 放出的热量(kJ)
HCl 184.9
HBr 102.3
HI 8.7
键能的应用:计算化学反应的反应热。
H=反应物键能总和 - 生成物键能总和
#0070C0
#00B0F0
小 结
键能和键长是衡量共价键强弱和分子稳定性的重要参数。
一般来说,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,分子性质越稳定。
以上两个参数定量地对分子进行了分析,而要更好的描述分子的空间构型,还必须引入共价键的第三个键参数——键角。
#0070C0
#00B0F0
三、键参数之键角
105°
H2O
V形(角形)
107°
NH3
三角锥形
180°
CO2
直线形
在多原子分子中,两个相邻共价键之间的夹角。
1. 定义
#0070C0
#00B0F0
三、键参数之键角
2. 应用
在多原子分子中键角是一定的,这表明共价键具有 性,因此键角影响着共价分子的 。
方向
空间结构
#0070C0
#00B0F0
练一练
分子的空间结构 键角 实例
正四面体形 CH4、CCl4
平面形 苯、乙烯、BF3等
三角锥形 NH3
V形(角形) H2O
直线形 CO2、CS2、CH≡CH
试根据空间结构填写下列分子的键角:
109°28′
120°
105°
180°
107°
#0070C0
#00B0F0
练一练
氨分子、水分子、甲烷分子中共价键的键角分别为a、b、c,则a、b、c的大小关系为( )
A. a
#0070C0
#00B0F0
归纳总结
键长是影响分子空间结构的因素之一。如CH4分子的空间结构是正四面体,而CH3Cl只是四面体而不是正四面体,原因是C—H和C—Cl的键长不相等。
(1)键长与分子空间结构的关系
①根据原子半径进行判断。在其他条件相同时,成键原子的半径越小,键长越短。
②根据共用电子对数判断。就相同的两原子形成的共价键而言,当两个原子形成双键或者三键时,由于原子轨道的重叠程度增大,原子之间的核间距减小,键长变短,故单键键长>双键键长>三键键长。
(2)定性判断键长的方法
#0070C0
#00B0F0
小 结
#0070C0
#00B0F0
课堂练习
1. 关于键长、键能和键角,下列说法错误的是( )
A. 键角是描述分子空间结构的重要参数
B. 键长是形成共价键的两原子间的核间距
C. 键能越大,键长越长,共价化合物越稳定
D. 键角的大小与键长、键能的大小无关
C
#0070C0
#00B0F0
课堂练习
2. 对比以下几个反应式:Cl+Cl―→Cl2 ΔH1=-247 kJ·mol-1;
O+O―→O2 ΔH2=-493 kJ·mol-1;N+N―→N2 ΔH3=-946 kJ·mol-1。
可以得出的结论是 ( )
A. 在常温下氮气比氧气和氯气稳定
B. 氮、氧和氯的单质常温下为气体
C. 氮、氧和氯都是双原子分子
D. 氮气、氧气和氯气的密度不同
A
#0070C0
#00B0F0
课堂练习
3. 如图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 ( )
A. W、R元素单质分子内都存在非极性键
B. X、Z元素都能形成双原子分子
C. 第一电离能:X>Y>W
D. 键长:X—H
选修二
课堂小结
CLASS SUMMARY
选修二
感谢您的观看
THANKS FOR WATCHING
