1.2《原子结构与元素的性质》(第2课时)课件(共30张PPT)
文档属性
| 名称 | 1.2《原子结构与元素的性质》(第2课时)课件(共30张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-23 00:00:00 | ||
图片预览








文档简介
(共30张PPT)
第一章 原子结构与性质
第二节 原子结构与元素的性质
第2课时 《元素周期律》
选修二
原子结构与性质
核心素养
分析原子结构中原子核对核外电子作用力的变化,理解原子半径、第一电离能和电负性的递变规律及其原因,培养宏观辨识与微观探析的核心素养
通过原子半径、第一电离能和电负性的数据和图示,掌握相关规律,培养证据推理与模型认知的核心素养
学法指导
通过实例归纳总结微粒半径大小、第一电离能强弱、电负性强弱的规律,通过练习巩固落实
掌握一般规律的同时,注意个别特殊情况的例子,落实规律判断的应用
#0070C0
#00B0F0
元素周期律
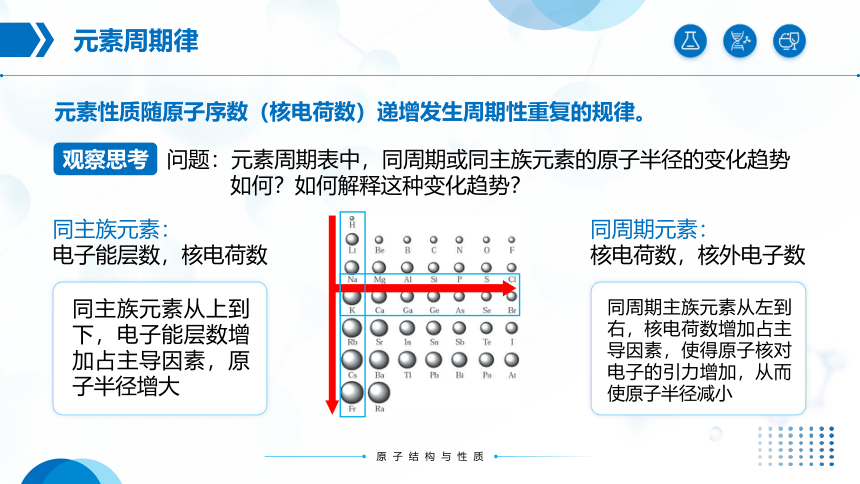
元素性质随原子序数(核电荷数)递增发生周期性重复的规律。
同主族自上到下,原子半径增大
同周期从左到右,
原子半径减小
问题:元素周期表中,同周期或同主族元素的原子半径的变化趋势
如何?如何解释这种变化趋势?
观察思考
#0070C0
#00B0F0
元素周期律
元素性质随原子序数(核电荷数)递增发生周期性重复的规律。
同主族元素从上到下,电子能层数增加占主导因素,原子半径增大
问题:元素周期表中,同周期或同主族元素的原子半径的变化趋势
如何?如何解释这种变化趋势?
观察思考
同主族元素:
电子能层数,核电荷数
同周期元素:
核电荷数,核外电子数
同周期主族元素从左到右,核电荷数增加占主导因素,使得原子核对电子的引力增加,从而使原子半径减小
#0070C0
#00B0F0
原子半径
结构
性质
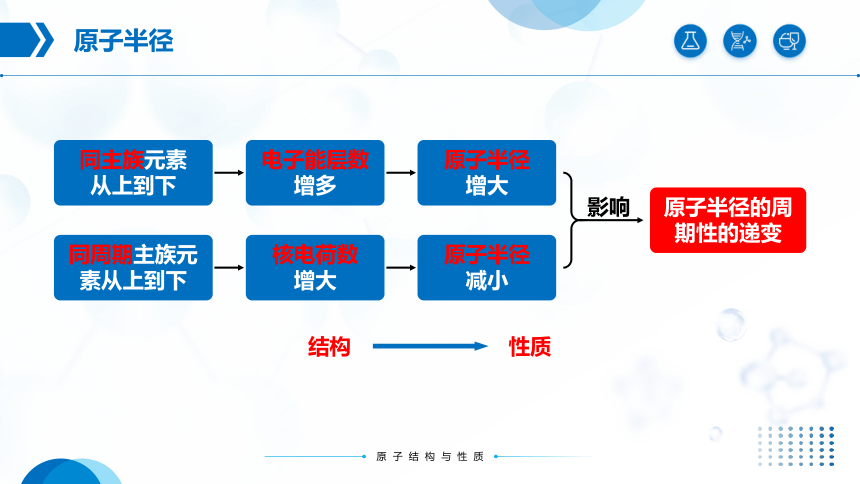
同主族元素
从上到下
电子能层数
增多
原子半径
增大
同周期主族元
素从上到下
核电荷数
增大
原子半径
减小
影响
原子半径的周
期性的递变
#0070C0
#00B0F0
电离能
气态电中性基态原子失去一个电子转化为气态基态正离子
所需要的最低能量叫做第一电离能。用符号 I1 表示,单位:kJ /mol
M(g)=M+(g)+e- I1(第一电离能)
M+(g)=M2+(g)+e- I2(第二电离能)
(1)定义
(2)表示方法
#0070C0
#00B0F0
电离能
电离能越小,气态原子(离子)越易失电子,元素的金属性越强;
电离能越大,气态原子(离子)越难失电子,元素的金属性越弱。
(3)电离能的意义
电离能的数值大小表示气态原子(或离子)失电子的难易。
#0070C0
#00B0F0
电离能的递变规律
观察思考
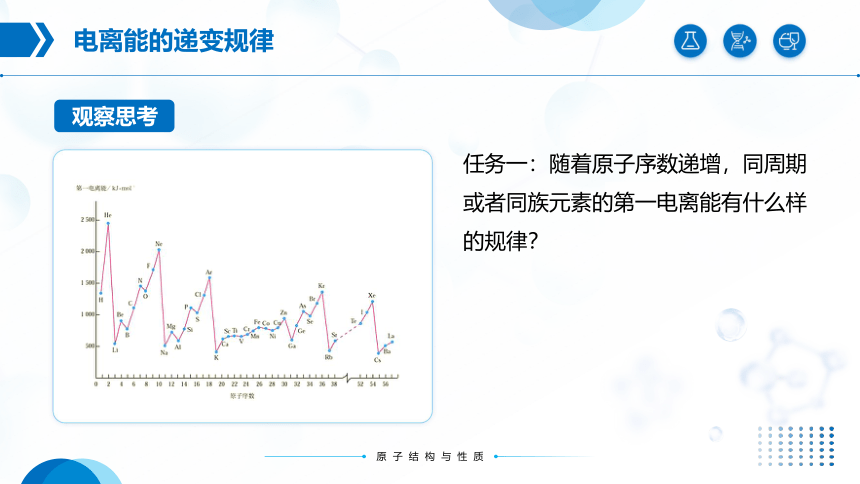
任务一:随着原子序数递增,同周期或者同族元素的第一电离能有什么样的规律?
#0070C0
#00B0F0
电离能的递变规律
观察思考
③ 每周期的第一种元素(氢和碱金属)
的第一电离能 。
④ 每周期最后一种元素(稀有气体)
的第一电离能 。
① 同主族从上到下元素的第一电离能
整体趋势 。
变小
最小
最大
② 同周期从左到右元素的第一电离能
整体趋势 。
变大
ⅡA>ⅢA ;ⅤA>ⅥA
反常:
#0070C0
#00B0F0
电离能的递变规律
观察思考
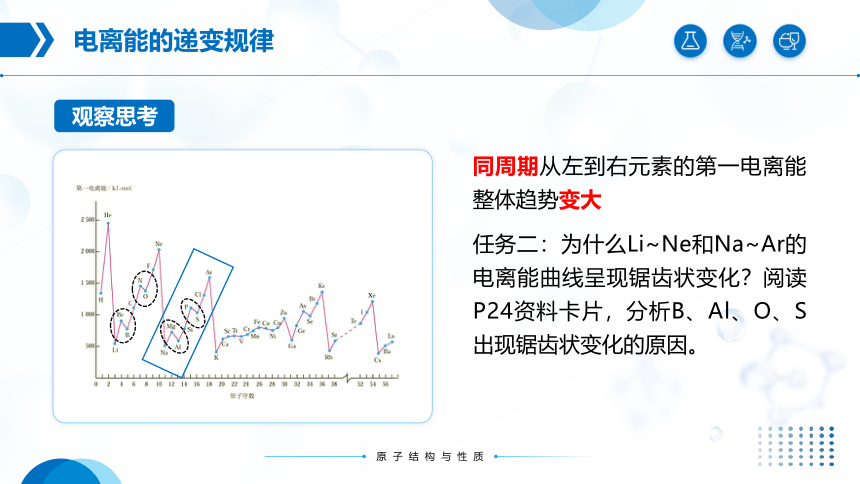
任务二:为什么Li~Ne和Na~Ar的电离能曲线呈现锯齿状变化?阅读P24资料卡片,分析B、Al、O、S出现锯齿状变化的原因。
同周期从左到右元素的第一电离能整体趋势变大
#0070C0
#00B0F0
电离能的递变规律
观察思考
任务二:为什么Li~Ne和Na~Ar的电离能曲线呈现锯齿状变化?阅读P24资料卡片,分析B、Al、O、S出现锯齿状变化的原因。
ⅡA Be:1s22s2 ⅢA B:1s22s22p1
Mg:1s22s22p63s2 Al:1s22s22p63s23p1
ⅤA N:1s22s22p3 ⅥA O:1s22s22p4
P:1s22s22p63s23p3 S:1s22s22p63s23p4
B和Al第一电离能失去的电子是np能级的,该能级的能量比左边的ns能级的能量高,则不稳定,容易失去电子,第一 电离能较低;
N和P的电子排布是半充满的,比较稳定,难失去电子,第一电离能较高。
#0070C0
#00B0F0
电离能的应用之一:判断元素的金属性强弱
思考讨论
第IA族碱金属元素的第一电离能从上到下逐渐变小,则原子越容易失电子,碱金属元素的金属性逐渐增强,碱金属的活泼性越强。
(1)第IA族碱金属的电离能与碱金属的活泼性存在什么关系?
#0070C0
#00B0F0
电离能的应用之二:判断元素的化合价
思考讨论
元素 Na Mg Al
各级电离能 (kJ·mol-1) 496 738 578
4562 1451 1817
6912 7733 2745
9543 10540 11575
13353 13630 14830
16610 17995 18376
20114 21703 23293
为什么原子的逐级电离能越来越大
1. 原子内的电子越靠近原子核,受到的吸引力越大,则要离开原子所需要的能量越大,原子的逐级电离能越来越大;
2. 随着电子的逐个失去,阳离子所带的正电荷数越来越大,再要失去一个电子需克服的电性引力也越来越大,消耗的能量也越来越多,所以原子的逐级电离能越来越大。
#0070C0
#00B0F0
电离能的应用之二:判断元素的化合价
思考讨论
元素 Na Mg Al
各级电离能 (kJ·mol-1) 496 738 578
4562 1451 1817
6912 7733 2745
9543 10540 11575
13353 13630 14830
16610 17995 18376
20114 21703 23293
4066
计算钠元素 I2-I1=
镁元素 I2-I1= I3-I2=
铝元素 I4-I3= I3-I2= I2-I1=
Na 1s2 2s22p6 3s1
Mg 1s2 2s22p6 3s2
Mg 1s2 2s22p6 3s23p1
713
1239
6282
928
8830
学生活动
#0070C0
#00B0F0
电离能的应用之二:判断元素的化合价
思考讨论
元素 Na Mg Al
各级电离能 (kJ·mol-1) 496 738 578
4562 1451 1817
6912 7733 2745
9543 10540 11575
13353 13630 14830
16610 17995 18376
20114 21703 23293
4066
713
1239
6282
928
8830
(2)逐级电离能数据与钠、镁、铝的化合
价有什么关系
Na→Na+ Mg→Mg2+ Al→Al3+
钠的第一电离能比第二电离能小很多,说明失去第一个电子比失去第二个电子容易得多,所以Na容易失去一个电子形成Na+;镁的第一电离能和第二电离能相差不多,但第二电离能比第三电离能小很多,说明Mg容易失去两个电子形成Mg2+;铝的第一电离能、第二电离能、第三电离能相差不多,但第三电离能比第四电离能小很多,说明Al容易失去三个电子形成Al3+。
#0070C0
#00B0F0
电负性
思考讨论
电负性越大的原子,对键合电子的吸引力越大
鲍林
描述不同元素的原子对键合电子吸引力的大小
键合电子
原子中用于形成化学键的电子
电负性
键合电子
#0070C0
#00B0F0
电负性
元素的电负性随原子序数的递增,同周期或者同族有什么规律?
#0070C0
#00B0F0
电负性的递变规律
第二周期
第三周期
第四周期
电负性
活动1:绘制同周期元素电负性随原子序数变化的图像
总结规律:同周期元素从左到右,元素的电负性逐渐增大
原子半径
0.05
0.1
0.15
0.2
0.25
0.3
(nm)
#0070C0
#00B0F0
电负性的递变规律
第二周期
第三周期
第四周期
总结规律:同周期元素从左到右,元素的电负性逐渐增大
电负性
第IA族
第VIA族
第VIIA族
总结规律:同族元素从上到下,元素的电负性逐渐减小
原子半径
0.05
0.1
0.15
0.2
0.25
0.3
(nm)
活动2:绘制同主族元素电负性随原子序数变化的图像
#0070C0
#00B0F0
电负性的递变规律
电负性
电负性呈现周期性递变
电负性
不同元素的原子对键合电子吸引力的大小
#0070C0
#00B0F0
电负性的应用1:判断元素的金属性与非金属性
电负性 > 1.8 非金属元素
电负性 < 1.8 金属元素
电负性 ≈ 1.8 类金属元素
Na
.
.
.
.
.
.
Cl
.
+
.
.
.
.
.
Cl
.
.
Na+
-
电负性差 2.1
H
.
.
.
.
.
.
O
+
.
.
.
.
.
O
.
H
电负性差 0.4
+
H
H
#0070C0
#00B0F0
电负性的应用2: 判断化学键的类型
成键原子之间的电负性差值可作化学键类型的判断依据
电负性的差值较大 离子键
电负性的差值较小 共价键
#0070C0
#00B0F0
电负性的应用2: 判断化学键的类型
#0070C0
#00B0F0
电负性的应用2: 判断化学键的类型
H
Cl
-1
+1
显负价
显正价
H
C
H
H
H
H
Si
H
H
H
SiH4
+4
-1
CH4
-4
+1
#0070C0
#00B0F0
元素周期律的综合应用
性质 同一周期(从左到右) 同一主族(从上到下)
核外电子 的排布 能层数
最外层电子数 1→2或8
金属性
非金属性
单质的氧化性、还原性 氧化性
还原性
1. 同周期、同主族元素性质的递变规律
相同
增加
相同
减弱
增强
增强
减弱
增强
减弱
减弱
增强
#0070C0
#00B0F0
元素周期律的综合应用
1. 同周期、同主族元素性质的递变规律
最高价氧化物对应 水化物的酸碱性 酸性
碱性
气态氢化物的稳定性
第一电离能 (但ⅡA ⅢA,ⅤA ⅥA)
电负性
增强
减弱
减弱
增强
增强
减弱
增大
>
>
减小
变大
变小
#0070C0
#00B0F0
元素周期律的综合应用
2. 电负性、第一电离能与金属性和非金属性的关系
增大
减小
#0070C0
#00B0F0
课堂总结
选修二
课堂小结
CLASS SUMMARY
选修二
感谢您的观看
THANKS FOR WATCHING
第一章 原子结构与性质
第二节 原子结构与元素的性质
第2课时 《元素周期律》
选修二
原子结构与性质
核心素养
分析原子结构中原子核对核外电子作用力的变化,理解原子半径、第一电离能和电负性的递变规律及其原因,培养宏观辨识与微观探析的核心素养
通过原子半径、第一电离能和电负性的数据和图示,掌握相关规律,培养证据推理与模型认知的核心素养
学法指导
通过实例归纳总结微粒半径大小、第一电离能强弱、电负性强弱的规律,通过练习巩固落实
掌握一般规律的同时,注意个别特殊情况的例子,落实规律判断的应用
#0070C0
#00B0F0
元素周期律
元素性质随原子序数(核电荷数)递增发生周期性重复的规律。
同主族自上到下,原子半径增大
同周期从左到右,
原子半径减小
问题:元素周期表中,同周期或同主族元素的原子半径的变化趋势
如何?如何解释这种变化趋势?
观察思考
#0070C0
#00B0F0
元素周期律
元素性质随原子序数(核电荷数)递增发生周期性重复的规律。
同主族元素从上到下,电子能层数增加占主导因素,原子半径增大
问题:元素周期表中,同周期或同主族元素的原子半径的变化趋势
如何?如何解释这种变化趋势?
观察思考
同主族元素:
电子能层数,核电荷数
同周期元素:
核电荷数,核外电子数
同周期主族元素从左到右,核电荷数增加占主导因素,使得原子核对电子的引力增加,从而使原子半径减小
#0070C0
#00B0F0
原子半径
结构
性质
同主族元素
从上到下
电子能层数
增多
原子半径
增大
同周期主族元
素从上到下
核电荷数
增大
原子半径
减小
影响
原子半径的周
期性的递变
#0070C0
#00B0F0
电离能
气态电中性基态原子失去一个电子转化为气态基态正离子
所需要的最低能量叫做第一电离能。用符号 I1 表示,单位:kJ /mol
M(g)=M+(g)+e- I1(第一电离能)
M+(g)=M2+(g)+e- I2(第二电离能)
(1)定义
(2)表示方法
#0070C0
#00B0F0
电离能
电离能越小,气态原子(离子)越易失电子,元素的金属性越强;
电离能越大,气态原子(离子)越难失电子,元素的金属性越弱。
(3)电离能的意义
电离能的数值大小表示气态原子(或离子)失电子的难易。
#0070C0
#00B0F0
电离能的递变规律
观察思考
任务一:随着原子序数递增,同周期或者同族元素的第一电离能有什么样的规律?
#0070C0
#00B0F0
电离能的递变规律
观察思考
③ 每周期的第一种元素(氢和碱金属)
的第一电离能 。
④ 每周期最后一种元素(稀有气体)
的第一电离能 。
① 同主族从上到下元素的第一电离能
整体趋势 。
变小
最小
最大
② 同周期从左到右元素的第一电离能
整体趋势 。
变大
ⅡA>ⅢA ;ⅤA>ⅥA
反常:
#0070C0
#00B0F0
电离能的递变规律
观察思考
任务二:为什么Li~Ne和Na~Ar的电离能曲线呈现锯齿状变化?阅读P24资料卡片,分析B、Al、O、S出现锯齿状变化的原因。
同周期从左到右元素的第一电离能整体趋势变大
#0070C0
#00B0F0
电离能的递变规律
观察思考
任务二:为什么Li~Ne和Na~Ar的电离能曲线呈现锯齿状变化?阅读P24资料卡片,分析B、Al、O、S出现锯齿状变化的原因。
ⅡA Be:1s22s2 ⅢA B:1s22s22p1
Mg:1s22s22p63s2 Al:1s22s22p63s23p1
ⅤA N:1s22s22p3 ⅥA O:1s22s22p4
P:1s22s22p63s23p3 S:1s22s22p63s23p4
B和Al第一电离能失去的电子是np能级的,该能级的能量比左边的ns能级的能量高,则不稳定,容易失去电子,第一 电离能较低;
N和P的电子排布是半充满的,比较稳定,难失去电子,第一电离能较高。
#0070C0
#00B0F0
电离能的应用之一:判断元素的金属性强弱
思考讨论
第IA族碱金属元素的第一电离能从上到下逐渐变小,则原子越容易失电子,碱金属元素的金属性逐渐增强,碱金属的活泼性越强。
(1)第IA族碱金属的电离能与碱金属的活泼性存在什么关系?
#0070C0
#00B0F0
电离能的应用之二:判断元素的化合价
思考讨论
元素 Na Mg Al
各级电离能 (kJ·mol-1) 496 738 578
4562 1451 1817
6912 7733 2745
9543 10540 11575
13353 13630 14830
16610 17995 18376
20114 21703 23293
为什么原子的逐级电离能越来越大
1. 原子内的电子越靠近原子核,受到的吸引力越大,则要离开原子所需要的能量越大,原子的逐级电离能越来越大;
2. 随着电子的逐个失去,阳离子所带的正电荷数越来越大,再要失去一个电子需克服的电性引力也越来越大,消耗的能量也越来越多,所以原子的逐级电离能越来越大。
#0070C0
#00B0F0
电离能的应用之二:判断元素的化合价
思考讨论
元素 Na Mg Al
各级电离能 (kJ·mol-1) 496 738 578
4562 1451 1817
6912 7733 2745
9543 10540 11575
13353 13630 14830
16610 17995 18376
20114 21703 23293
4066
计算钠元素 I2-I1=
镁元素 I2-I1= I3-I2=
铝元素 I4-I3= I3-I2= I2-I1=
Na 1s2 2s22p6 3s1
Mg 1s2 2s22p6 3s2
Mg 1s2 2s22p6 3s23p1
713
1239
6282
928
8830
学生活动
#0070C0
#00B0F0
电离能的应用之二:判断元素的化合价
思考讨论
元素 Na Mg Al
各级电离能 (kJ·mol-1) 496 738 578
4562 1451 1817
6912 7733 2745
9543 10540 11575
13353 13630 14830
16610 17995 18376
20114 21703 23293
4066
713
1239
6282
928
8830
(2)逐级电离能数据与钠、镁、铝的化合
价有什么关系
Na→Na+ Mg→Mg2+ Al→Al3+
钠的第一电离能比第二电离能小很多,说明失去第一个电子比失去第二个电子容易得多,所以Na容易失去一个电子形成Na+;镁的第一电离能和第二电离能相差不多,但第二电离能比第三电离能小很多,说明Mg容易失去两个电子形成Mg2+;铝的第一电离能、第二电离能、第三电离能相差不多,但第三电离能比第四电离能小很多,说明Al容易失去三个电子形成Al3+。
#0070C0
#00B0F0
电负性
思考讨论
电负性越大的原子,对键合电子的吸引力越大
鲍林
描述不同元素的原子对键合电子吸引力的大小
键合电子
原子中用于形成化学键的电子
电负性
键合电子
#0070C0
#00B0F0
电负性
元素的电负性随原子序数的递增,同周期或者同族有什么规律?
#0070C0
#00B0F0
电负性的递变规律
第二周期
第三周期
第四周期
电负性
活动1:绘制同周期元素电负性随原子序数变化的图像
总结规律:同周期元素从左到右,元素的电负性逐渐增大
原子半径
0.05
0.1
0.15
0.2
0.25
0.3
(nm)
#0070C0
#00B0F0
电负性的递变规律
第二周期
第三周期
第四周期
总结规律:同周期元素从左到右,元素的电负性逐渐增大
电负性
第IA族
第VIA族
第VIIA族
总结规律:同族元素从上到下,元素的电负性逐渐减小
原子半径
0.05
0.1
0.15
0.2
0.25
0.3
(nm)
活动2:绘制同主族元素电负性随原子序数变化的图像
#0070C0
#00B0F0
电负性的递变规律
电负性
电负性呈现周期性递变
电负性
不同元素的原子对键合电子吸引力的大小
#0070C0
#00B0F0
电负性的应用1:判断元素的金属性与非金属性
电负性 > 1.8 非金属元素
电负性 < 1.8 金属元素
电负性 ≈ 1.8 类金属元素
Na
.
.
.
.
.
.
Cl
.
+
.
.
.
.
.
Cl
.
.
Na+
-
电负性差 2.1
H
.
.
.
.
.
.
O
+
.
.
.
.
.
O
.
H
电负性差 0.4
+
H
H
#0070C0
#00B0F0
电负性的应用2: 判断化学键的类型
成键原子之间的电负性差值可作化学键类型的判断依据
电负性的差值较大 离子键
电负性的差值较小 共价键
#0070C0
#00B0F0
电负性的应用2: 判断化学键的类型
#0070C0
#00B0F0
电负性的应用2: 判断化学键的类型
H
Cl
-1
+1
显负价
显正价
H
C
H
H
H
H
Si
H
H
H
SiH4
+4
-1
CH4
-4
+1
#0070C0
#00B0F0
元素周期律的综合应用
性质 同一周期(从左到右) 同一主族(从上到下)
核外电子 的排布 能层数
最外层电子数 1→2或8
金属性
非金属性
单质的氧化性、还原性 氧化性
还原性
1. 同周期、同主族元素性质的递变规律
相同
增加
相同
减弱
增强
增强
减弱
增强
减弱
减弱
增强
#0070C0
#00B0F0
元素周期律的综合应用
1. 同周期、同主族元素性质的递变规律
最高价氧化物对应 水化物的酸碱性 酸性
碱性
气态氢化物的稳定性
第一电离能 (但ⅡA ⅢA,ⅤA ⅥA)
电负性
增强
减弱
减弱
增强
增强
减弱
增大
>
>
减小
变大
变小
#0070C0
#00B0F0
元素周期律的综合应用
2. 电负性、第一电离能与金属性和非金属性的关系
增大
减小
#0070C0
#00B0F0
课堂总结
选修二
课堂小结
CLASS SUMMARY
选修二
感谢您的观看
THANKS FOR WATCHING
